INTRODUCCIÓN
El síndrome de Li-Fraumeni (SLF) es una condición de predisposición al cáncer que se asocia a un espectro diverso de neoplasias malignas, tanto en la infancia como en la edad adulta 1. Fue descrito por primera vez en 1969 por Li y Fraumeni, quienes, luego de revisar retrospectivamente las historias clínicas de niños diagnosticados con rabdomiosarcoma, identificaron patrones de predisposición familiar a otro tipo de tumores que iban surgiendo en el tiempo, sugiriendo así un síndrome de cáncer familiar con transmisión autosómica dominante 2. En 1990 se llevó a cabo el estudio genético que permitió realizar la asociación entre el SLF y las mutaciones por línea germinal del gen supresor tumoral TP53, lo que se consideró su sello distintivo 3.
De acuerdo con Schneider et al. 1, en esta población se estima un riesgo de presentar algún tipo de cáncer a lo largo de la vida, mayor o igual al 90% en mujeres y mayor o igual al 70% en hombres, dentro de los que se encuentran el cáncer de mama en mujeres; los tumores del sistema nervioso central, el osteosarcoma y los sarcomas de tejidos blandos, y el carcinoma adrenocortical en ambos sexos. Por su parte, Hwang et al. 4 describieron los riesgos acumulados de presentar algún tipo de cáncer en las mujeres portadoras de la mutación, así: 18%, 49%, 77% y 93% para las edades de 20, 30, 40 y 50 años, respectivamente; y en hombres del 10%, 21%, 33% y 68%, para las mismas edades.
El cáncer de mama es el cáncer más frecuentemente descrito en las mujeres con SLF, representando entre el 23 y 31% de todas las malignidades 4,5,6. No obstante, según lo anotado por Sidransky et al. 7, se calcula que la mutación en TP53 se asocia con menos del 1% de todos los cánceres de mama hereditarios. Mai et al. 8 encontraron una incidencia acumulada de cáncer de mama de aproximadamente el 85% para la edad de 60 años, un nivel de riesgo que es comparable al de las pacientes con una mutación en BRCA. Este cáncer ocurre en esta mutación a una edad muy temprana, con una mediana de presentación entre los 27 y 33 años 9-11. En cuanto a las características histopatológicas, el subtipo histológico más común es el ductal en cerca del 90% de los casos; hasta el 84% de los tumores expresan receptores hormonales, y con mucha más frecuencia amplifican y sobreexpresan el receptor HER2 (~53-83%) 9,12,13.
El estudio BRIDGES (Breast Cancer Risk after Diagnostic Gene Sequencing), del Breast Cancer Association Consortium, informó una asociación entre el cáncer de mama y las variantes patogénicas que generan el truncamiento de la proteína que codifica el gen TP53 (la fosfoproteína p53), al agrupar los resultados de varios estudios de casos y controles mediante el uso de métodos estadísticos bayesianos 14.
Para este síndrome se ha reportado una incidencia de cáncer de mama contralateral cercana al 60%, con una tasa anual que varía entre el 4% y 7%, mucho más alta que para las mujeres con antecedente de cáncer de mama en general (~0,3-0,5%) (15-17) . Luego de 10 años de seguimiento, el riesgo de un segundo primario mamario se estima en un 33% 18, y el riesgo de cualquier segundo cáncer en un 50% 8,19. En una revisión de la literatura realizada por Fortuno et. al. 20 sobre la supervivencia libre de enfermedad según las variantes patogénicas en TP53, se encontró que el tiempo para el diagnóstico entre el primero y el segundo cáncer fue significativamente menor en portadores de translocaciones y “hotspots”, comparado con otro tipo de variantes. Por otro lado, Sheng, et al. 21 señalaron que la mutación en TP53 es un factor independiente de mal pronóstico, pues, en general, las pacientes con SLF y cáncer de mama tienen una mortalidad del 18% a 5 años, comparada con el 5% en aquellas pacientes con cáncer de mama que no son portadoras de la mutación. Esta diferencia se mantiene incluso después de 10 años de seguimiento, con supervivencias del 77% y 90%, respectivamente.
Debido al alto riesgo de un cáncer de mama contralateral o de segundos primarios mamarios 20, autores como Song et al. 22 han recomendado la mastectomía profiláctica como parte del tratamiento integral de las pacientes con SLF y cáncer de mama. No obstante, esta aproximación de manejo podría no ser siempre la adecuada. La mayoría de la información sobre el efecto de la MPC en mujeres con mutaciones en los genes de alto riesgo para el desarrollo de cáncer de mama proviene de aquellas con una mutación en BRCA 23,24. Adicionalmente, hay que balancear muy bien los riesgos vs los beneficios de la cirugía mamaria, que incluyen una mayor incidencia de complicaciones posoperatorias como hematoma, necrosis de los colgajos, celulitis, seroma y reintervención quirúrgica (mastectomía bilateral: 31% vs mastectomía unilateral: 23%) 25, además de considerar las preferencias de las pacientes.
En atención a estos elementos, el objetivo de este artículo es el de presentar el caso de una paciente con SLF y cáncer de mama, en quien se decidió un manejo no quirúrgico de la mama contralateral, con vigilancia clínica e imagenológica estricta. Asimismo, se realiza una discusión crítica sobre el beneficio en la supervivencia de la MPC para este grupo específico de pacientes.
CASO CLÍNICO
Mujer de 37 años sin antecedentes personales de importancia, remitida a una institución de salud en la ciudad de Bogotá, de carácter público y centro oncológico de referencia en Colombia, por un cuadro clínico de 1 año de evolución consistente en la aparición de un nódulo en la mama derecha, no doloroso y de crecimiento progresivo. Al examen físico se evidenció una masa de 11 x 10 cm que ocupaba todo el cuadrante supero-externo de la mama derecha, con edema de la piel, un nódulo de permeación de 2 mm y un conglomerado ganglionar móvil de 4 cm en la axila ipsilateral. La mama y la axila contralateral eran negativas. La ecografía mamaria extrainstitucional mostraba unas lesiones bilaterales compatibles con fibroadenomas (sin clasificación BIRADS). La paciente traía una gammagrafía ósea negativa para lesiones sospechosas de compromiso secundario. Sin embargo, ante la alta sospecha clínica de malignidad, la institución remisora optó por la realización de una biopsia trucut de la lesión mamaria derecha, y el reporte de patología confirmó la presencia de un carcinoma ductal infiltrante sin patrón específico.
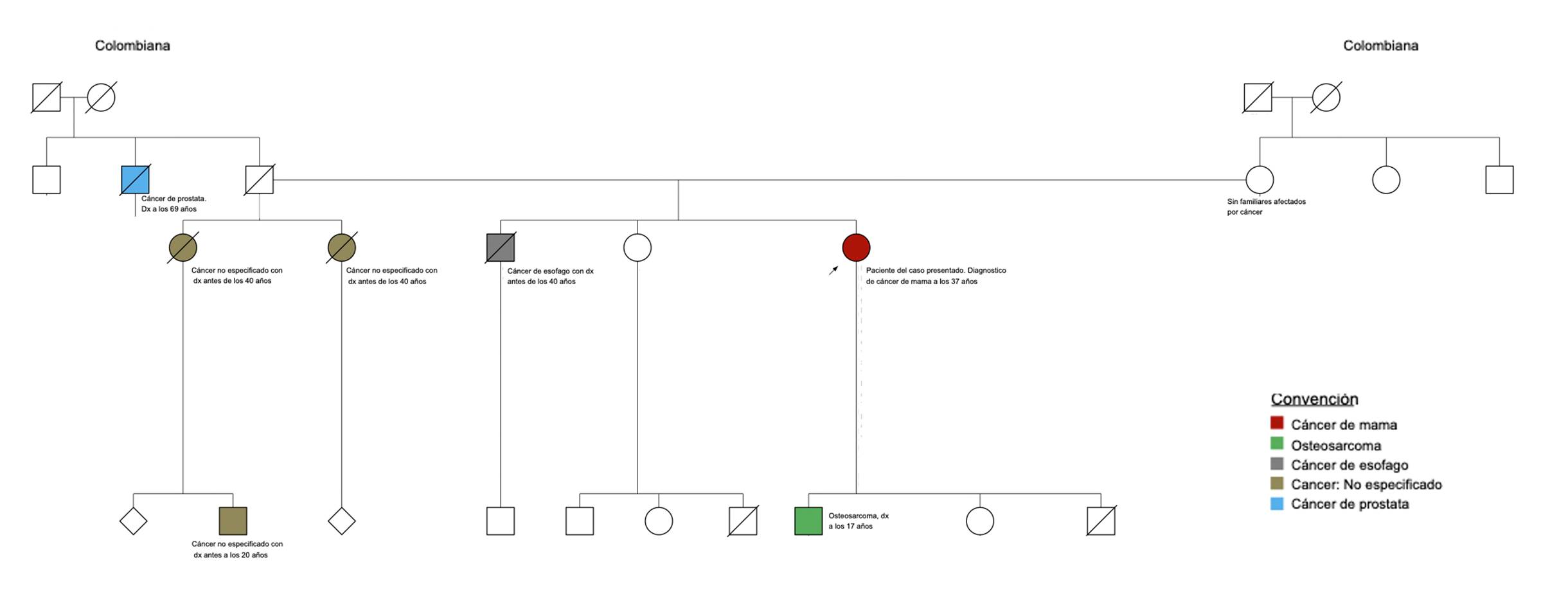
En la consulta en el centro oncológico de referencia, la paciente refirió tener varios familiares cercanos diagnosticados con cáncer, entre ellos un hijo de 17 años con un osteosarcoma de alto grado en la pelvis (Figura 1), por lo que fue remitida al servicio de genética, quienes solicitaron un panel multigén para evaluar la presencia de mutaciones en genes de riesgo bajo, moderado o alto para el desarrollo de cáncer de mama. La revisión institucional de las placas de patología confirmó la presencia de un carcinoma ductal infiltrante, grado 3, con receptores de estrógeno y progestágeno positivos (90% y 60%, respectivamente), receptor HER2 negativo y Ki67 del 55%. La mamografía y la ecografía de la mama contralateral descartaron lesiones sospechosas de malignidad a ese nivel. Las tomografías de tórax y abdomen descartaron enfermedad a distancia. La paciente se estadificó con un cáncer de mama estadio IIIB (T4bN2aM0), luminal B, HER2 negativo, y se decidió iniciar quimioterapia neoadyuvante basada en antraciclinas y taxanos. Un mes después de finalizada la terapia sistémica, se realizó una mastectomía radical modificada (derecha). El reporte final de la patología quirúrgica evidenció un tumor residual de 3 x 2 x 1 cm, con bordes de resección libres de tumor y 1/20 ganglios con compromiso macrometástasico (3 mm). En la adyuvancia la paciente recibió radioterapia a una dosis de 50Gy en 25 fracciones, sobre la reja costal y la axilo-fosa supraclavicular derecha, utilizando una técnica de intensidad modulada (IMRT). Posteriormente, se inició manejo endocrino con tamoxifeno, el cual continúa tomando hasta la fecha.
Dado que el reporte del estudio genético mostró una mutación en el gen TP53 [c.473G>T (p.Arg158Leu)] (Figura 2), la paciente fue presentada en la Junta Multidisciplinaria del Servicio de Mama, con el fin de discutir el beneficio de la MPC. Luego de revisar la literatura y de no encontrar un beneficio en la supervivencia global con la realización de la MPC, en pacientes con SLF y antecedente de cáncer de mama, la Junta definió realizar el seguimiento clínico e imagenológico estricto, con examen físico cada 6 meses e imágenes mamarias cada año (resonancia magnética contrastada, ecografía y mamografía izquierda), como una alternativa al manejo quirúrgico.
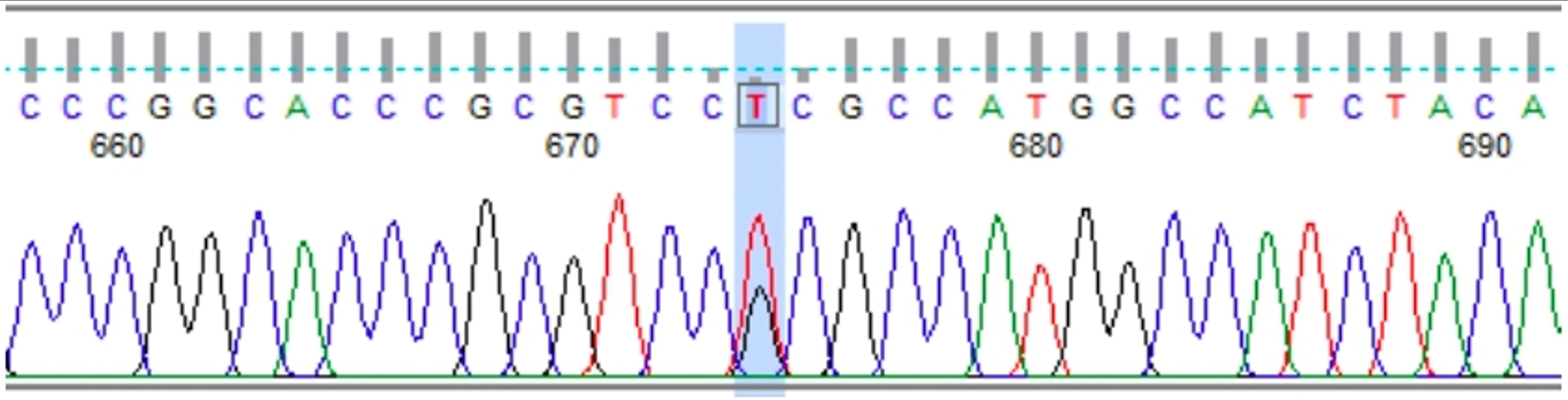
Análisis molecular del gen TP53 [(Mutación puntual: c.473G>T (p.Arg158Leu)]** Se realizó el análisis de la variante c.473G>T (p.Arg158Leu) en el gen TP53. Resultado: POSITIVO. Metodología. A partir de la muestra de ADN obtenida y debidamente identificada, se amplificaron por PCR los exones 5 y 6 del gen TP53 (ENST00000269305.8). El amplicón, que incluye ambos exones, fue purificado por medio de fosfatasa alcalina y exonucleasa I, y secuenciado directamente en la totalidad de su longitud. La secuencia del paciente fue comparada con la secuencia de referencia. La numeración de los nucleótidos se inicia con respecto a la primera adenina (A) del codón de inicio ATG en la posición 1. **En la paciente que se presenta se detectó la mutación deletérea c.473G>T (p.Arg158Leu), en el exón 5 del gen TP53. Este cambio de guanina por timina en la posición 473, genera el reemplazo de arginina por leucina en el codón 158 de la proteína p53. El trabajo publicado en 1999 por Gentile et al. 26 reportó por primera vez esta mutación puntual en cáncer de mama, en una de 123 mujeres menores de 37 años con carcinoma mamario. De acuerdo con la base de datos del médico francés Thierry Soussi, que incluye el estado de TP53 en más de 80.000 tumores (en individuos con mutaciones por línea germinal y somática), en cáncer de mama este sería el quinto reporte de la mutación c.473G>T (p.Arg158Leu) 27. Por otro lado, en 2016 Ossa et al. (28) describieron para Colombia la que sería la primera mutación del gen TP53 [c.527G>T (p.Cys176Phe)] con diagnóstico molecular confirmado, en una mujer de 31 años con dos tumores sincrónicos: un sarcoma de tejidos blandos en antebrazo derecho y un tumor filodes de la mama derecha.
Figura 2. Electroferograma de la paciente del caso.
La decisión de la Junta se basó en los argumentos que se exponen en la discusión, y que se resumen en la Tabla 1. La paciente estuvo de acuerdo con la conducta conservadora de la mama contralateral, y en ningún momento solicitó la MPC. Adicionalmente, se comprometió a adherirse a la vigilancia médica estricta. Después de 30 meses de seguimiento la paciente se encuentra sin evidencia clínica ni radiológica de recaída locorregional, o de enfermedad en la mama contralateral.
Tabla 1 Argumentos de la junta para no realizar la MPC a la paciente del caso.
Aspectos éticos. Se solicitó autorización de la paciente mediante la firma de un consentimiento informado escrito, para la publicación del caso clínico y del material fotográfico, los cuales fueron copiados de su historia clínica por dos de los autores (CBM y RASR). Según el Manual Operativo del Comité de Ética e Investigaciones del Centro Oncológico de referencia, los reportes de casos y las series de casos clínicos están exentos de aprobación por parte del Comité de Ética. No obstante, el proceso de publicación de este documento se desarrolló en el marco de las buenas prácticas clínicas, asegurando que los datos obtenidos son veraces y precisos, y protegiendo los derechos, la integridad y la confidencialidad de la paciente.
DISCUSIÓN
La guía de la National Comprehensive Cancer Network (NCCN) sobre la Evaluación Genética/Familiar en Pacientes con Alto Riesgo de Cáncer de Mama, Ovario y Páncreas señala que no hay información sobre la cirugía reductora de riesgo en pacientes con SLF, y que la decisión de realizar la MP debería incluir una discusión, individual, caso por caso, considerando siempre: 1) el alcance de la reducción/protección del riesgo de cáncer de mama; 2) los riesgos competitivos de otros cánceres; 3) la esperanza de vida; 4) las posibles complicaciones relacionadas con la cirugía 29; entre otros. A continuación, se desglosan estas cuatro consideraciones que soportan la conducta adoptada por la Junta, y se realiza un análisis crítico sobre la pertinencia de no realizar la MPC en este escenario.
Alcance de la reducción/protección del riesgo de cáncer de mama. En pacientes con SLF y cáncer de mama, la MPC debe ser considerada debido al alto riesgo de cáncer de mama contralateral 30. Mientras algunas guías internacionales sugieren discutir esta opción con las pacientes 29, otras recomiendan tener en cuenta factores adicionales como la edad al momento del diagnóstico del cáncer de mama y los antecedentes familiares, no únicamente la mutación de TP53 31. No existe información sobre el impacto en la supervivencia de la MPC en las pacientes con SLF y antecedente de cáncer de mama. Históricamente, la decisión de realizar este procedimiento se ha extrapolado de la evidencia indirecta de las pacientes con una mutación en BRCA 32,33. No obstante, en las mujeres con una mutación en BRCA la información proveniente de los estudios primarios es contradictoria (Tabla 2) 34-38.
Tabla 2 Principales estudios que han evaluado el papel de la MPC en pacientes con mutación en los genes BRCA 34-38.
| Autor / Año / Tipo de estudio | Población | Comparación | Resultados |
|---|---|---|---|
| Van Sprundel et al. 34 2005 Cohorte, prospectivo | 148 pacientes con cáncer de mama en estadios I-IIIA y mutación en BRCA1 (115) o BRCA2 (33). | MPC (79) vs Vigilancia (69) | - CMC: HR 0,09; (IC95%: 0,01-0,78) - SG: HR 0,26; (IC95%: 0,07-0,94) (análisis univariado). - SG ajustada por SOBP: HR 0,35; (IC95%: 0,09-1,39) (análisis multivariado). |
| Evans et al. 35 2013 Cohorte, prospectivo | 698 pacientes con cáncer de mama y mutación en BRCA1/2. | MPC (105) vs Vigilancia (593) 120 pacientes del grupo de vigilancia fueron llevadas a SOBP. | - CMC: HR 0,18; (IC95%: 0,07-0,45) - SG en pacientes llevadas únicamente a MPC: HR 0,48; (IC95%: 0,19-1,14) - SG en pacientes llevadas a MPC + SOBP: HR 0,16; (IC95%: 0,06-0,44) |
| Metcalfe et al. 36 2014 Cohorte, retrospectivo | 482 pacientes con cáncer de mama unilateral en estadios I-II y mutación en BRCA1 (327), BRCA2 (152) o ambas (12). | MPC (146) vs Vigilancia (336) | - CMC: RR 0,02; (IC95%: 0,00-0,18) - SG: HR 0,52; (IC95%: 0,29-0,93) - SG*: HR 0,60; (IC95%: 0,34-1,06) (*puntaje de propensión ajustado con el análisis de 79 controles (MPC vs no MPC)). |
| Heemskerk-Gerritsen et al. 37 2015 Cohorte, prospectivo | 583 pacientes con cáncer de mama unilateral y mutación en BRCA1/2. | MPC (242) vs Vigilancia (341) | - CMC: MPC 2% vs Vigilancia 19% - SG: HR 0,49; (IC95% 0,29-0,82) (análisis multivariado ajustado por SOBP). |
| Copson et al. 38 2018 Cohorte, prospectivo | 338 pacientes <40 años, con cáncer de mama y mutación en BRCA1 (201) y BRCA2 (137) | MPC vs Vigilancia | - SG en pacientes con tumores triple negativo: HR 0,98; (IC95%: 0,58-1,65) |
MPC: Mastectomía Profiláctica Contralateral. CMC: Cáncer de Mama Contralateral. SG: Supervivencia Global. SOBP: Salpingooforectomía Bilateral Profiláctica.
En el estudio de Van Sprundel et al. 34, la MPC sola no ofreció ninguna ventaja en la supervivencia específica por cáncer de mama (p=0,11). Adicionalmente, después de ajustar el efecto de la MPC por la realización adicional de la salpingooforectomía bilateral profiláctica (SOBP), el efecto de la MPC sobre la mortalidad por todas las causas no fue siempre protector (HR 0,35; IC95%: 0,09-1,39). Por otra parte, Evans et al. 35 informan que no hubo mejoría en supervivencia en aquellas pacientes tratadas con MPC sola (HR 0,48; IC95%: 0,19-1,14), aunque sí encontraron beneficio en aquellas que habían sido llevadas a MPC y SOBP (HR 0,16; IC95%: 0,06-0,44). De otro lado, Metcalfe et al. 36) informaron que la MPC se asoció a una disminución significativa en la mortalidad por todas las causas durante el estudio (HR 0,58; IC95%: 0,34-0,97), y a un descenso en la mortalidad específica por cáncer de mama a 20 años de seguimiento (HR 0,52; IC95%: 0,29-0,93). Sin embargo, el puntaje de propensión ajustado con el análisis de 79 controles (MPC vs no MPC), no confirmó este efecto protector de manera inequívoca (HR 0,60; IC95%: 0,34-1,06). Heemskerk-Gerritsen et al. 37 sí informan una disminución significativa en la mortalidad por todas las causas en aquellas pacientes llevadas a una MPC (HR 0,49; IC95%: 0,29-0,82). El beneficio en la supervivencia se observó especialmente en pacientes jóvenes (<40 años) con tumores grado 1/2, tumores no triple negativo y que no recibieron quimioterapia adyuvante. En último lugar, el estudio de Copson et al. 38, que buscó determinar el efecto de una mutación germinal en BRCA sobre los desenlaces oncológicos de pacientes con diagnóstico de cáncer de mama de temprana aparición (<40 años), no encontró que la MPC mejorara la supervivencia a 5 años (HR 0,98; IC95%: 0,58-1,65), aunque este análisis post-hoc fue específico para aquellas mujeres con tumores triple negativo.
Revisiones de la literatura como las de Levine y Gemignani 39, Biglia et al. 40 y Ludwig et al. 41, tampoco encontraron que la MPC impactara en la supervivencia de las pacientes con una mutación en BRCA. Las revisiones de la literatura de Cochrane de Lostumbo et al. 24, publicada en 2010, y de Carbine et al. 23 en 2018, concluyeron que la información al respecto continua siendo limitada.
En último lugar, varios metaanálisis han intentado agrupar la información sobre el efecto de la MPC en pacientes con mutación en BRCA, tratando de proveer conclusiones más robustas 42-44. Los resultados, nuevamente, son contradictorios. En su metaanálisis, Fayanju et al. 42 reportaron que entre las pacientes con un riesgo familiar o genético elevado (ej. mutación en BRCA), la incidencia de cáncer de mama contralateral metacrónico disminuyó (RR 0,04; IC95%: 0,02-0,09), pero no hubo mejoría en la SG. Del mismo modo, el metaanálisis de Valachis et al. 43 no demostró diferencias en la supervivencia específica por cáncer de mama entre las portadoras de una mutación en BRCA que se sometieron a una MPC vs las que no (HR 0,78; IC95%: 0,44-1,39). En contraposición, Li et al. 44) reportaron un efecto protector en las mujeres en quienes se practicó la MPC en cuanto a la mortalidad por todas las causas (HR 0,51; IC95%: 0,36-0,71).
En general, es decir, en todas las pacientes con mutaciones en los genes de alto riesgo para el desarrollo de cáncer de mama, se necesitan otros estudios que controlen los factores de confusión y otras posibles fuentes de sesgos, ya que en las publicaciones antes presentadas, específicas de pacientes con mutaciones en BRCA, hay diferencias en las características basales de los grupos de comparación (MPC vs vigilancia): edad, tipo de cirugía de la mama recibida, administración de quimioterapia/radioterapia y realización de SOBP 37, en las fechas del diagnóstico y la manera como se definió el cáncer de mama contralateral 36, y en el número de pacientes incluidas en cada uno de los brazos comparativos 34,36. Ligeras discrepancias en cualquiera de estos números podrían tener un impacto importante en los resultados a largo plazo, puesto que el denominador en que se basan los resultados es pequeño 23.
Riesgos competitivos de otros cánceres y esperanza de vida. Según el estudio de Mai et al. 8, el riesgo de desarrollar un segundo cáncer (cualquier localización) en pacientes con una mutación en TP53, después del diagnóstico del caso índice, es del 50% a 10 años de seguimiento. Este riesgo persiste hasta por 49 años. Estos investigadores también encontraron que luego del cáncer de mama, los sarcomas de tejidos blandos, el cáncer cerebral y de pulmón, son las tres malignidades más incidentes, y su frecuencia como segundos primarios se estima en 14,5%, 8% y 8%, respectivamente. En general, estos tumores acarrean un peor pronóstico que el cáncer de mama. Según las estadísticas del SEER (Surveillance, epidemiology, and End Results) la supervivencia a 5 años de los pacientes con sarcomas de tejidos blandos es del 81%, 56% y 15%, para aquellos con enfermedad localizada, localmente avanzada y en estadio metastásico, respectivamente 45. Por su parte, en el estudio de Davis et al. 46 la tasa de supervivencia relativa estimada a 5 años para los pacientes con tumores cerebrales malignos y otros tumores del sistema nervioso central fue del 27,6%, con variaciones según la histología y la edad al momento del diagnóstico. Para el cáncer de pulmón las estadísticas son aún más desalentadoras, puesto que para todos los estadios clínicos la supervivencia a 5 años está calculada en un 18,6%. En este último escenario menos del 16% de los tumores se diagnostican en estadios tempranos 47. No obstante, en el caso del cáncer de mama la supervivencia está determinada por el subtipo biológico y el estadio clínico al momento del diagnóstico 48, lo que de forma global le confiere tasas de supervivencia a 5 y 10 años cercanas al 90% y 84%, respectivamente 49.
Es necesario considerar que, por un lado, aún en las pacientes con mutaciones en los genes de alto riesgo para el desarrollo de cáncer de mama, o con historia familiar de cáncer de mama, los segundos primarios mamarios suelen diagnosticarse en estadios más tempranos y con positividad para los receptores hormonales 50. Y por otro lado, que el pronóstico global de las pacientes con SLF y cáncer de mama lo determina la mutación per se de TP53 y el caso índice, es decir, las características genéticas y clínico-patológicas de las pacientes y el primer tumor mamario 21,34. Para la paciente presentada en este artículo, no solo el estado mutacional de TP53 21, sino también el estadio clínico (IIIB), el subtipo biológico (luminal B, HER2 negativo) y la ausencia de respuesta patológica completa luego de la quimioterapia neoadyuvante, son variables que ya le están confiriendo un mal pronóstico, teniendo un riesgo de recurrencia y muerte por la enfermedad que se estiman en un 30,4% y 15,8% a 5 años, respectivamente 51.
Por último, es poco probable que en esta paciente la supervivencia se modifique con la MPC, pues resecar la mama sana no ha demostrado ser capaz de generar un cambio en la historia natural del cáncer de mama índice, instaurada desde su presentación inicial 34-38.
Complicaciones relacionadas con la cirugía. Es importante mencionar que varios estudios han mostrado que la MPC incrementa el riesgo de sufrir complicaciones quirúrgicas, llegando incluso a duplicarlo (en comparación con la mastectomía unilateral) 52-54, con tasas que oscilan entre el 5% y el 35%. Incluso, hasta un 13% de las pacientes pueden presentar complicaciones posoperatorias únicamente en la mama sana que ha sido operada de forma preventiva 25. Como se espera, las tasas de reintervención son más altas en aquellas pacientes llevadas a reconstrucción mamaria bilateral 55. La mastectomía bilateral aumenta la estancia hospitalaria y el requerimiento transfusional 17. Por último, las pacientes con cirugías profilácticas (mastectomía bilateral o contralateral) pueden experimentar cambios en la imagen corporal, el autoestima, la percepción de la feminidad, la libido y la función sexual 17; hasta un 33% de las pacientes pueden sentir insatisfacción con su apariencia corporal en particular 56. Autores como Yao 57 consideran necesario continuar investigando a este respecto, ya que el valor que las mujeres contemporáneas le dan a su imagen corporal, y cómo esto impacta en su calidad de vida, puede haber cambiado desde la publicación de los estudios más antiguos.
Limitaciones y fortalezas. Este manuscrito tiene limitaciones porque basa su discusión en las investigaciones realizadas en pacientes con una mutación en BRCA, y no en estudios diseñados con el objetivo de evaluar la supervivencia de las pacientes con SLF y cáncer de mama, llevadas a una MPC (evidencia indirecta). Existen vacíos en el conocimiento en torno al papel de la MPC en pacientes con mutaciones heredo-familiares que predisponen al desarrollo de cáncer de mama, diferentes de BRCA.
Es importante mencionar que, hasta donde los autores tienen conocimiento, este es el primer reporte de caso que menciona una estrategia de tratamiento conservador de la mama contralateral en una paciente con SLF y cáncer de mama (se realizó una búsqueda de la literatura publicada entre enero de 2000 y diciembre de 2020, en las bases de datos electrónicas: MEDLINE/PubMed, GoogleScholar, LILACS y SciELO, con los términos [MeSH/DeCS]: “TP53 mutation-genes p53/mutación TP53-genes p53”, “Li-Fraumeni syndrome/síndrome de Li-Fraumeni”, “breast neoplasms/cáncer de mama” y “prophylactic mastectomy/mastectomía profiláctica”).
CONCLUSIONES
No existe evidencia que analice, de forma particular, el impacto de la MPC en la supervivencia de las pacientes con SLF y cáncer de mama. Sin embargo, a la luz del conocimiento actual no es posible generalizar la conducta de omitir la cirugía profiláctica. Es importante reportar los casos en los que se decida realizar u omitir este procedimiento con el fin de incrementar el cuerpo de la evidencia, dado que existen limitaciones para construir grandes cohortes o estudios experimentales exclusivos para esta alteración genética (mutación en TP53).