INTRODUCCIÓN
La definición de restricción de crecimiento fetal (RCF) corresponde a una tasa de crecimiento fetal inferior a lo normal para el potencial de crecimiento biológico 1. Se clasifica en temprano y tardío, según si se presenta hasta la semana 32 de gestación o posterior a esta 2. La incidencia de la enfermedad varía desde el 5 % al 20 % 3,4. El diagnóstico antenatal se hace por medio de percentil de peso estimado fetal, Doppler de circulación feto placentaria y velocidad de crecimiento 5. Actualmente no se cuenta con tratamiento efectivo para la enfermedad 5. La mortalidad de fetos con percentil menor al 5 incrementa 2,7 % comparada con fetos normales 6. La RCF se asocia con morbilidad a corto y largo plazo 7, enfermedades crónicas no transmisibles y síndrome metabólico 8.
Es necesario diferenciar la terminología de RCF y de feto pequeño para la edad gestacional (PEG), el primero hace alusión a un feto que no alcanza su potencial genético por patología, principalmente placentaria, y está asociado a resultados adversos perinatales; mientras que PEG se refiere a un feto o neonato con peso estimado fetal (PEF), o peso al nacer menor al percentil 10; definición que incluye fetos constitucionalmente pequeños pero sanos.
Los criterios diagnósticos de RCF son variables y la terminología es inconsistente 9. Actualmente existen tres consensos internacionales que definen los criterios diagnósticos de RCF: el de la Sociedad de Medicina Materno Fetal y Colegio Americano de Ginecología y Obstetricia (SMMF/ACOG) 9,10, el de Medicina Fetal Barcelona (MFB) 11 y según el consenso Delphi 2, realizado en 2016 con 45 expertos de todo el mundo acogido por sociedades como la Sociedad Internacional de Ultrasonido en Obstetricia y Ginecología (ISUOG) 7 y la Federación Internacional de Ginecología y Obstetricia (FIGO) 5. Hoy no se dispone de un patrón de oro para confirmar el diagnóstico de RCF 5.
Estas herramientas se utilizan para identificar fetos con alto riesgo de resultados adversos perinatales, a quienes se les debe hacer un seguimiento más estricto y definir si hay indicación para finalizar el embarazo a edad gestacional más temprana. Para evaluar la predicción de resultados adversos se utilizan la sensibilidad, especificidad y área bajo la curva del punto de corte que dan los criterios diagnósticos antes mencionados, comparándolos con los fetos sin diagnóstico ecográfico de RCF. Para la evaluación del pronóstico en términos de riesgo de malos resultados se utiliza el estimador de riesgo relativo (RR).
Se ha informado que el diagnóstico de PEG (PEF menor de percentil 10) predice neonato con peso menor al percentil 10 con un área bajo la curva (AUC) de 0,69 (IC 95 %: 0,65-0,73); sin embargo, no presenta asociación significativa con resultado neonatal adverso compuesto RR: 1,1 (IC 95 %: 0,6-1,8). No obstante, en la validación del consenso Delphi si bien presenta una menor discriminación en la predicción de neonato con peso menor al percentil 10, AUC: 0,64 (IC 95 %: 0,60-0,67), y presenta asociación significativa con resultado neonatal adverso compuesto RR: 2,0 (IC 95 %: 1,2-3,3) 12.
Es conocido que el desempeño predictivo de una prueba diagnóstica varía de acuerdo con la población base de estudio 13, y que en Latinoamérica podríamos tener una prevalencia y un pronóstico diferente de malos resultados perinatales con respecto a la población de los países desarrollados. Por lo tanto, se hace necesario determinar el desempeño operativo de los criterios diagnósticos de RCF y el valor pronóstico de estos criterios para resultados adversos perinatales en nuestra población, y así, realizar una adecuada discriminación antenatal entre RCF y fetos constitucionalmente pequeños pero sanos, que permita realizar monitoria más estrecha en los primeros y no aumente intervenciones innecesarias en los segundos.
El objetivo principal del presente estudio es determinar el desempeño predictivo de la definición de ultrasonografía de SMMF/ACOG, consenso Delphi y MFB, respecto a resultados adversos perinatales en cada una. Como objetivo secundario, identificar si hay asociación entre diagnóstico de RCF y resultados adversos perinatales.
MATERIALES Y MÉTODOS
Diseño: estudio de cohorte retrospectivo en el que se incluyeron gestantes con embarazo único, entre 24 y 36 semanas con 6 días, con edad gestacional calculada por longitud cefalocaudal en ecografía de primer trimestre, atendidas en la unidad de medicina materno fetal del Hospital San José de la ciudad de Popayán, Cauca, Colombia, entre agosto de 2019 y enero de 2020, en quienes se realizó al menos una ecografía obstétrica, y Doppler de circulación feto placentaria, cuyo parto o cesárea fueron atendidas en esta institución. Este es el único hospital público de alta complejidad en el departamento del Cauca, centro de remisión para población perteneciente al régimen contributivo de los trabajadores y subsidiado por el Estado en la región sur occidental del país, que atiende entre 1.800 y 2.000 partos anuales. Se excluyeron embarazos con hallazgos ecográficos de anomalías congénitas.
Para el tamaño de la muestra se tomó como estimador más importante la sensibilidad mínima del 80 % con un margen de error del 5 % y un nivel de confianza del 95 %. Obteniendo un tamaño muestral final de 220 embarazos. El muestreo fue no probabilístico consecutivo.
Procedimiento: las gestantes candidatas a ingresar fueron identificadas a partir de los códigos únicos de procedimientos (CUPS) que corresponden a ecografía obstétrica transabdominal CUPS 881431 y Doppler de circulación feto placentaria CUPS 881435. Se solicitaron historias clínicas y se verificó que las gestantes cumplieran con los criterios de inclusión y exclusión por parte de los investigadores.
Las ecografías fueron realizadas por especialistas en perinatología que han estandarizado los procedimeintos con ecógrafo Voluson E6. El cálculo de PEF se realizó mediante la fórmula de Hadlock 4, usando perímetro cefálico, diámetro biparietal, perímetro abdominal (PA) y longitud del fémur 14. El percentil de crecimiento fue calculado mediante tabla de Hadlock 14. El diagnóstico de RCF se hizo en caso de que alguno de los tres criterios diera una medición anormal. En caso de tener múltiples evaluaciones ecográficas se tomó para el análisis la ecografía más cercana al término. Para el estudio Doppler de circulación feto placentaria se midieron los índices de pulsatilidad (IP) de la arteria umbilical (AU), arteria cerebral media (ACM), arterias uterinas (AUT) y ductus venoso (DV) y las características morfológicas de la onda de flujo en diástole (presente, ausente y reversa) para AU y DV. La medición de dichos parámetros fue realizada siguiendo los especificados en la guía de ISUOG 15. Se consideró Doppler alterado como IP de AU, AUT o DV mayor al percentil 95 para la edad gestacional, IP de ACM o relación cerebro placentaria (RCP) menor al percentil 5 u onda de flujo en diástole ausente o reversa en AU o DV.
Según MFB como feto con PEF/PA menor al percentil 3, o también como PEF/PA con percentil menor al percentil 10 con cualquier alteración en Doppler de circulación feto placentaria ya descrita, tomando como temprano y tardío el punto de corte de 32 semanas 11. Por último, se consideró RCF según consenso Delphi como RCF temprana un feto menor de 32 semanas con PEF/PA menor al percentil 3 o flujo ausente en diástole en AU, o PEF/PA menor al percentil 10 combinado con IP de AUT mayor al percentil 95 y/o IP de AU mayor al percentil 95. Además, como RCF tardío con feto mayor a 32 semanas con PEF/PA menor al percentil 3 o presencia de 2 de 3 de los siguientes hallazgos: PEF/PA menor al percentil 10, descenso de 2 cuartiles en crecimiento de PEF/PA, RCP o IP ACM menor al percentil 5 o IP AU mayor al percentil 95 para la edad gestacional 2 (Tabla suplementaria 1).
Se realizó la revisión de las historias clínicas neonatales (en los primeros 28 días de vida) por parte de los investigadores y se evaluaron los resultados perinatales. Los datos fueron recolectados por parte de los investigadores por medio de formularios de Google, posteriormente organizados en Excel.
Variables medidas: edad materna, etnia, paridad, complicaciones maternas, trastorno hipertensivo del embarazo, parto pretérmino, ruptura prematura de membranas, diabetes gestacional y corioamnionitis. Se evaluó la definición de RCF según los criterios de SMMF/ACOG, consenso Delphi, y los criterios diagnósticos de MFB. Se evaluó el resultado adverso neonatal compuesto (RANC), basado en los resultados evaluados en el estudio de Molina et al. 12. Se definió RANC como uno o más de los siguientes resultados positivo: puntuación de apgar < 7 a los 5 minutos, requerimiento de unidad de cuidado intensivo neonatal, síndrome de dificultad respiratoria aguda (SDRA), asfixia perinatal (APN), enterocolitis necrotizante, encefalopatía hipóxico-isquémica, uso de inotrópicos y muerte fetal o neonatal. No sé incluyó pH de cordón menor de 7,1 debido a que no se contó con la disponibilidad de pH de cordón por el servicio de neonatología de la institución.
Análisis estadístico: se realizó estadística descriptiva para resumir la información de las variables con medidas de tendencia central y dispersión para variables continuas y proporciones para variables categóricas. Se hace la estimación de la prevalencia de RCF por las 3 definiciones descritas. Las variables fueron analizadas de modo individual, de manera exploratoria. Se realizaron tablas de 2 X 2 para calcular sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN), área bajo la curva (AUC) de ROC, likelihood ratio positivo (LR+) y likelihood ratio negativo (LR-) al comparar el diagnóstico de RCF por cada método con la presencia de RANC. Además, se estudió la asociación entre el diagnóstico por las 3 definiciones y RANC mediante el cálculo de RR con el respectivo IC del 95 %.
Aspectos éticos: para la realización del estudio se contó con el aval del comité de ética del Hospital San José de Popayán, lugar en donde fue realizado. Se garantiza la confidencialidad de la información.
RESULTADOS
De un total de 663 pacientes que asistieron a ecografía obstétrica transabdominal por parte del grupo de perinatología en el periodo descrito, 264 no tenían los criterios de inclusión y 18 fueron excluidas por tener malformaciones congénitas, de las 381 candidatas a ingresar, en 153 (40 %) no se dispuso de la información requerida para establecer el desempeño predictivo. Un total de 228 participantes fueron incluidos en el análisis (Figura 1).
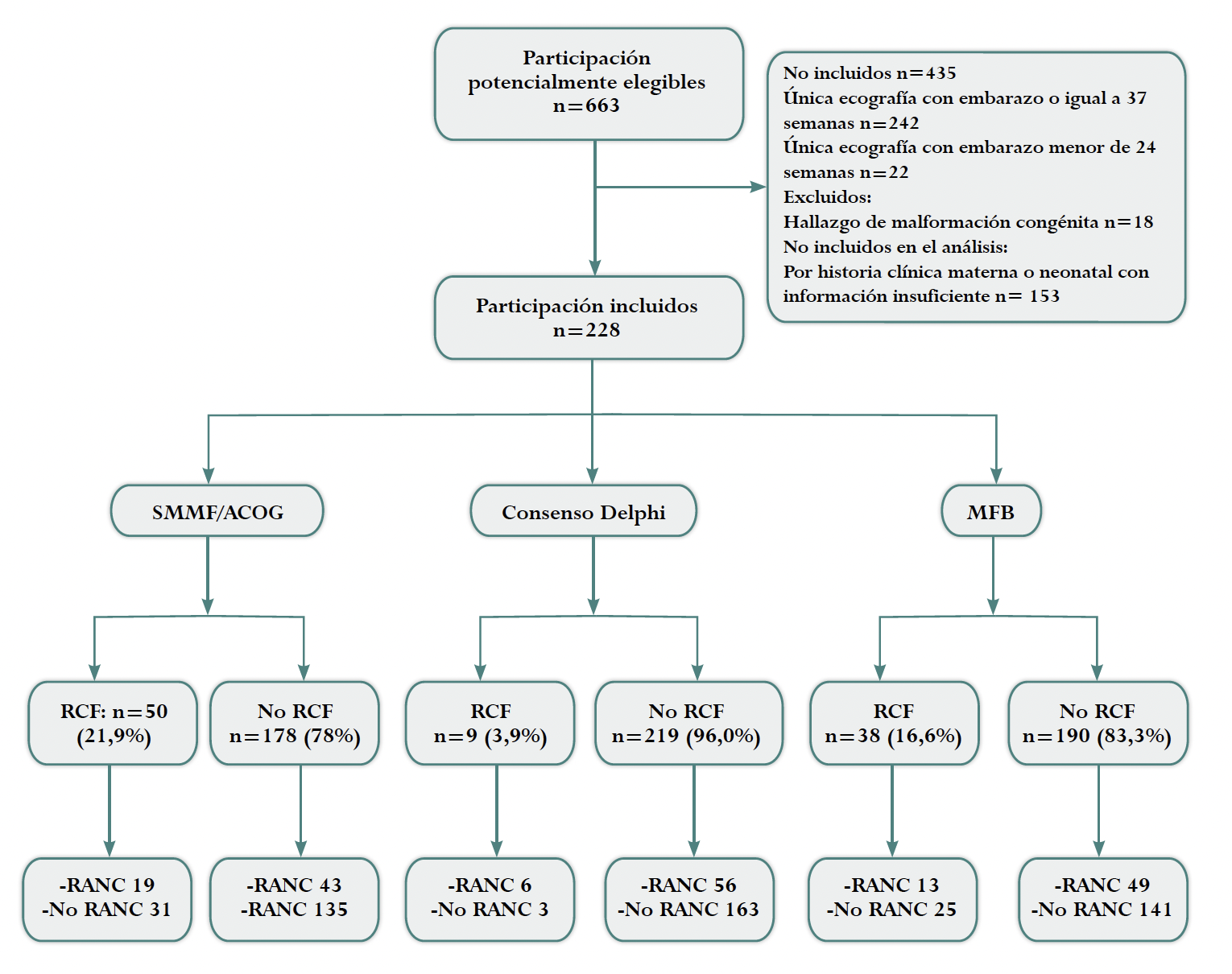
SMMF/ACOG: Sociedad de Medicina Materno Fetal/ Colegio Americano de Ginecología Y Obstetricia. MFB: Medicina Fetal Barcelona. RCF: restricción de crecimiento fetal. PEG: pequeño para la edad gestacional. RANC: resultado adverso neonatal compuesto. Fuente: elaboración propia.
Figura 1 Diagrama STARD para evaluación predictiva de los criterios diagnósticos.
Entre las características demográficas, la edad materna media fue de 26,8 años (rango: 23,2-29,4). El 67,5 % de las participantes fueron de etnia mestiza, seguida de indígena (30,2 %) y afrodescendiente (2,1 %). Entre las comorbilidades maternas presentadas, la más común fue trastornos hipertensivos del embarazo (17,5 %), parto pretérmino (13,6 %) y diabetes gestacional (8,3 %). La edad gestacional media de finalización del embarazo fue 38 semanas y 1 día (rango: 36,6-40,1), las características poblacionales se resumen en la Tabla 1.
Tabla 1 Características poblacionales y clínicas de gestantes estudiadas en el Hospital San José de la ciudad de Popayán, Cauca, Colombia, 2019-2020.
Fuente: elaboración propia.
La prevalencia de RCF según consenso Delphi fue de 3,9 %, seguida de MFB con 16,6 % y SMMF/ACOG con 21,9 % (Tabla suplementaria 2). Un total de 62 (27,19 %) de los neonatos presentaron resultado neonatal adverso compuesto y 7 (3,07 %) muerte fetal - neonatal (Tabla 2).
Tabla 2 Incidencia de resultados adversos neonatales y resultado neonatal adverso compuesto, Hospital San José de la ciudad de Popayán, Cauca, Colombia, 2019-2020.
Fuente: elaboración propia.
En cuanto a la capacidad predictiva, la sensibilidad para RANC varió entre 9,6 % para consenso Delphi hasta 30,6 % para SMMF/ACOG. La especificidad para RANC varió entre 81,3 % para SMMF/ACOG hasta 98,1 % para consenso Delphi. Respecto a LR (+), el mayor fue por consenso Delphi con 5,3, seguido de SMMF/ACOG con 1,6, la menor fue por MFB 1,3. Ningún criterio diagnóstico presentó un adecuado LR (-). Respecto al área bajo la curva, se calculó en 0,55 para SMMF/ACOG, seguido de AUC de 0,54 para consenso Delphi y 0,53 con MFB (Tabla 3).
Tabla 3 Rendimiento predictivo de los criterios diagnósticos ecográficos CFR para predicción de resultado neonatal adverso compuesto, Hospital San José de la ciudad de Popayán, Cauca, Colombia, 2019-2020.
| Criterio | AUC § | IC 95 % £ | SENS. | IC 95 % | ESP | IC 95 % | LR + | IC 95 % | LR - | IC 95 % |
|---|---|---|---|---|---|---|---|---|---|---|
| SMMF* | 0,55 | 0,49-0,62 | 30,6 | 18,3-42,9 | 81,3 | 75,1-87,5 | 1,64 | 1,00-2,68 | 0,85 | 0,71-1,02 |
| Delphi** | 0,54 | 0,50-0,58 | 9,6 | 1,5-17,8 | 98,1 | 95,8-100 | 5,35 | 1,38-20,76 | 0,92 | 0,85-1,0 |
| MFB*** | 0,53 | 0,47-0,59 | 20,9 | 10,0-31,9 | 84,9 | 79,2-90,6 | 1,3 | 0,7-2,5 | 0,93 | 0,8-1,0 |
CFR: Crecimiento fetal retardado.
* The Society for Maternal Fetal Medicine (SMMF).
** Sociedad de Perinatología de Barcelona (SPB).
*** Criterio del consensoDelphi.
§ área bajo la curva (AUC).
£ intervalo de confianza (IC) 95 %.
Sensibilidad (SEN), especificidad (ESP), likelihood ratio positivo (LR+), likelihood ratio negativo (LR-).
Fuente: elaboración propia.
Respecto a la asociación entre diagnóstico de RCF y resultados perinatales adversos por criterios SMFF/ ACOG, se encontró un RR: 1,57 (IC 95 %:1,01-2,44), por consenso Delphi RR: 2,6 (IC 95 %: 1,5-4,3) y por MFB RR: 1,32 (IC 95 %: 0,8-2,1) (Tabla 4).
Tabla 4 Riesgo relativo de criterios diagnósticos de CRF con resultado adverso perinatal compuesto, Hospital San José de la ciudad de Popayán, Cauca, Colombia, 2019-2020.
| RANC | No RANC | RR (IC 95 %) | |
|---|---|---|---|
| RCF por SMMF/ACOG | 19 | 31 | 1,57 (1,01-2,44) |
| No RCF | 43 | 135 | |
| RCF por Delphi | 6 | 3 | 2,6 (1,5- 4,3) |
| No RCF | 56 | 163 | |
| RCF por MFB | 13 | 25 | 1,32 (0,8-2,1) |
| No RCF | 49 | 141 | |
CFR: Crecimiento fetal retardado.
Fuente: elaboración propia.
DISCUSIÓN
Nuestros resultados muestran una mayor prevalencia del diagnóstico de RCF con los criterios de SMMF/ACOG con 21,9 %, seguida de MFB con 16,6 % y Delphi con 3,9 %. Ningún criterio logró desempeño adecuado para la predicción de RANC. ABC de 0,55 para SMMF/ACOG, de 0,54 para consenso Delphi y 0,53 para MFB, aunque los criterios del consenso Delphi presentan mayor especificidad y LR (+) para RANC. Además, los criterios diagnósticos de consenso Delphi y SMMF/ACOG presentaron una asociación con RANC con RR de 2,6 (IC 95 %: 1,5-4,3) y 1,57 (IC 95 %: 1,01-2,44), respectivamente; mientras que los criterios de MFB no mostraron asociación con los resultados perinatales adversos. Los tres criterios tienen una tasa alta de falsos negativos, aunque el método Delphi sería el que mejor predice un resultado fetal adverso cuando se encuentra un resultado positivo. Esta observación va en el mismo sentido de la posible asociación entre el diagnóstico de RCF y el resultado adverso perinatal.
Los resultados presentados en cuanto a la capacidad predictiva son similares a la publicación de Molina et al. 12, quienes en un análisis secundario de un estudio prospectivo realizaron una validación de los criterios del consenso Delphi comparándolo con la definición de RCF de SMMF/ACOG, encontrando que ninguno de los dos criterios aporta un AUC aceptable para predicción de RANC: 0,50 (IC 95 %: 0,48-0,53) y 0,53 (IC 95 %: 0,50-0,55) para SMMF/ACOG y consenso Delphi. Resultados, a su vez, consistentes con los encontrados por Liauw et al. 16; AUC: 0,54 para predicción de RANC con fetos menores al percentil 10 de crecimiento. Por otra parte, los hallazgos de baja sensibilidad para predicción de RANC encontrados en el presente estudio son similares a los informados por Roeckner et al. 17, con una sensibilidad de 15,1 % y de 10,1 % para SMMF/ACOG y consenso Delphi, respectivamente.
Entre nuestras limitaciones se encuentra el diseño retrospectivo del presente estudio, el análisis de los resultados de PEF de la ecografía diagnóstica de RCF, o la más cercana a las 37 semanas, en caso de que presentara múltiples evaluaciones de crecimiento fetal, lo que no permitió un análisis de la velocidad de crecimiento; no se realizó discriminación entre RCF temprana o tardía y la pérdida del 40 % de los participantes por información incompleta. Entre las principales fortalezas se encuentra la heterogeneidad de los criterios diagnósticos estudiados y la realización de las evaluaciones ecográficas por equipo entrenado y con experiencia en medicina materno fetal.
CONCLUSIONES
Ante un resultado positivo para RCF, el método Delphi se asocia de manera más importante a los resultados perinatales adversos, por lo que sería el método que más aportaría para tomar decisión terapéutica en una gestación con este diagnóstico. Los tres métodos tienen una muy alta proporción de falsos negativos en la predicción de mal resultado perinatal, es decir un resultado negativo no excluye este desenlace. Se requieren estudios prospectivos que reduzcan los sesgos de medición y datos ausentes.
Material suplementario
Tabla suplementaria 1 Criterios diagnósticos de RCF. The Society for maternal-Fetal Medicine (SMMF), american college of obstetricians and gynecologists (ACOG), Sociedad de perinatología de Barcelona (SPB), peso estimado fetal (PEF), perímetro abdominal (PA), arteria cerebral media (ACM), relación cerebro placentaria (RCP), flujo ausente en diástole de arteria umbilical (FADAU), flujo reverso en diástole de arteria umbilical (FRDAU), ductus venoso (DV).














