INTRODUCCIÓN
Los linfomas representan un grupo amplio y heterogéneo de neoplasias malignas linfocíticas. Estos se pueden originar a partir de linfocitos B, linfocitos T o linfocitos T natural killer (NK) detenidos en diferentes etapas de maduración 1.
El linfoma primario de mama (LPM) fue primeramente definido por Wiseman y Liao en 1972 y no ha habido cambios desde entonces. En su definición, los LPM se caracterizan por 1) la presencia de tejido mamario e infiltrado linfomatoso en estrecha relación, 2) adecuada muestra histopatológica, 3) no evidencia de la diseminación del linfoma al momento del diagnóstico y 4) sin existencia de linfoma extramamario al momento del diagnóstico, aunque puede haber compromiso ganglionar ipsilateral al momento del diagnóstico 2.
En cuanto a la frecuencia, los linfomas constituyen el quinto cáncer más común a nivel mundial 3. Los linfomas no Hodgkin primarios de la glándula mamaria corresponden a una entidad rara que conforma el 0,04 al 0,5 % de los tumores malignos mamarios, del 1,7 al 2,2 % de los linfomas extranodales y del 0,38-0,7 % de todos los linfomas 4,5.
Los LPM suelen ser no Hodgkin de tipo células B, siendo más comunes que los de células T, que alcanzan un 7 % 6. El subtipo más predominante, que representa a la mitad de los LPM, es el difuso de células B grandes (LDCBG) 7. Otros subtipos menos frecuentes son los linfomas foliculares (15 %) asociados a mucosas (tejido linfoide asociado a la mucosa - MALT) (12 %), Burkitt (10 %) y el 6 % restante está conformado por los extranodales de la zona marginal, linfocítico de células B pequeñas, linfoplasmocítico, de células del manto y anaplásico 8,9. Este último se ha visto implicado a implantes mamarios 10. Es importante diferenciar el subtipo, dado que las tasas de recurrencia y mortalidad son inherentes a este, siendo el linfoma difuso de células B grandes (LDCBG) el que peores cifras presenta 11.
No existe una asociación o factor de riesgo propio para los LPM. Dado que existe un predominio en mujeres, se ha desarrollado la teoría de que los estrógenos juegan un papel importante en la fisiopatogenia de los LPM, ya que se ha observado mayor incidencia en mujeres con terapia hormonal de reemplazo con estrógenos sin oposición. Al igual que otros linfomas, la inmunodeficiencia o inmunosupresión, la cual se ha visto inducida por la infección por virus del Epstein-Barr, puede representar uno de los factores de riesgo más importantes 11.
Clínicamente se presentan como un nódulo solitario, palpable, móvil, indoloro, de rápido crecimiento, que puede estar o no acompañado de linfadenopatía axilar. Otras formas de presentación infrecuente incluyen al eritema, retracción o edema cutáneo. Suele presentarse en mujeres entre la quinta y sexta década de la vida. La glándula mamaria derecha se ha visto mayormente implicada, sin embargo, se ha reportado 10 % de bilateralidad, siendo este un factor de mal pronóstico 6,7. Los síntomas B, que usualmente suelen asociarse con los linfomas, como pérdida de peso, fiebre y sudoraciones nocturnas, no suelen ser tan frecuentes en los LPM 6.
La presentación clínica radiológica es similar a otros tumores de la glándula mamaria. En la mastografía puede identificarse al nódulo solitario como la lesión más característica (69-76 %). Por otra parte, al ultrasonido no se evidencian características específicas, puede observarse un nódulo oval o irregular, con márgenes indistintos, con reforzamiento posterior. Los linfomas suelen presentar hipervascularidad a la modalidad Doppler en la ecografía (55-64 %). En la resonancia magnética no se advierten características específicas, sin embargo, se pueden observar masas ovaladas con hipointensidad en T1 e hiperintensidad en T2. En la tomografía por emisión de positrones (PET-CT), los linfomas muestran una captación alta de 18 FDG (fluorodeoxiglucosa), indistinguible de cualquier carcinoma mamario. Esta última modalidad por imagen es muy sensible y específica en la evaluación de respuesta al tratamiento 10.
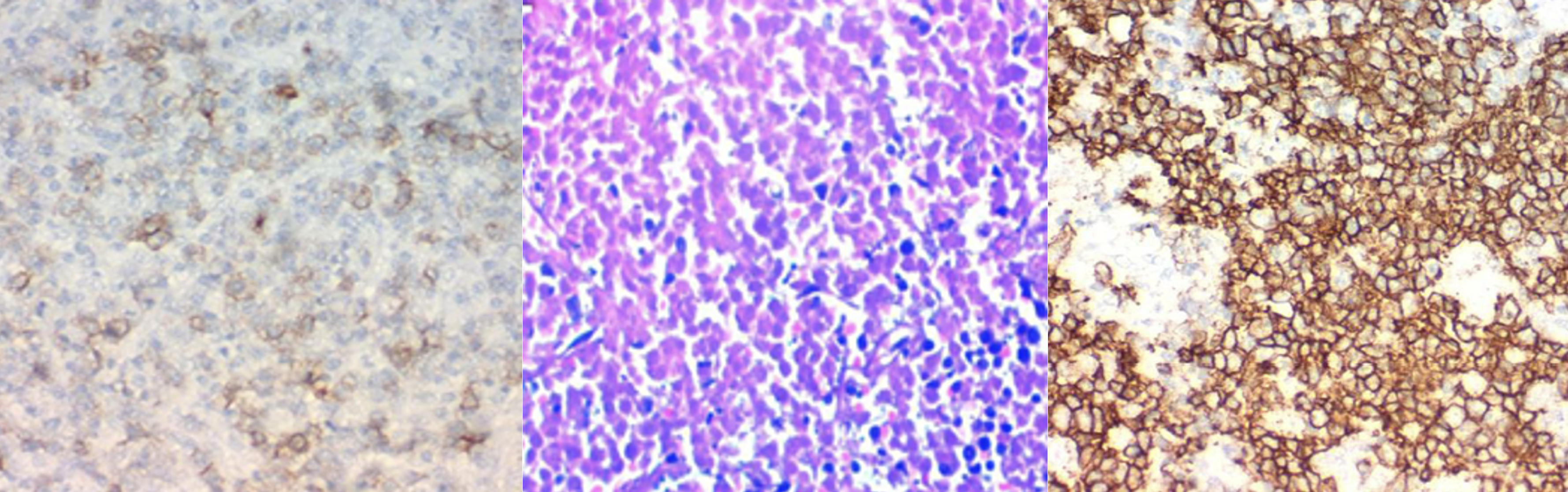
Para poder integrar el diagnóstico es necesaria la toma de biopsia, la cual puede ser escisional o por aguja de corte, esta última se prefiere por su naturaleza menos invasiva. No se recomienda la aspiración con aguja fina, ya que con esta no se pueden visualizar datos histopatológicos imprescindibles para la correcta subclasificación de los linfomas 6. Se debe complementar su estudio por medio de inmunohistoquímica con CD15 (antígeno de diferenciación), CD30, CD3, CD45, CD20, CD79a, BCL6 (proteína 6 del linfoma de células B), PAX-5 (paired box) 1.
Es posible diferenciar los LPM y el carcinoma ductal por medio de sus características citológicas. Los LPM muestran proliferaciones de células linfoides caracterizadas por células redondas no cohesivas de tamaños variables, mientras que el carcinoma ductal de mama muestra grupos tridimensionales cohesivos de células tumorales que contienen vacuolas de mucina, un hallazgo característico del adenocarcinoma 10.
El tratamiento incluye cirugía, radioterapia (RT), quimioterapia (QT) e inmunoterapia, ya sea solos o en combinación 8. Es importante mencionar que no hay guías de tratamiento establecidas y este es aún controversial 9. Actualmente, la mayoría de las pacientes reciben quimioterapia y radioterapia, y un número cada vez menor de pacientes se someten a cirugía, ya que esta última no ha reportado un impacto en la sobrevida. Se cuestiona si la terapia dirigida coadyuvante y la quimioterapia deben ser parte del manejo actual, por ello vale la pena revisar la experiencia del tratamiento de estos tumores 11-13. Se ha descrito que el pronóstico depende del tiempo de inicio de tratamiento y de la estirpe histológica, los cuales son determinantes en la supervivencia 14.
Dado que es importante que el ginecólogo conozca estos tumores para poder tener un tratamiento oportuno y adecuado, y que hay controversia sobre la efectividad de las diferentes alternativas terapéuticas, se presenta este caso de LPM con el objetivo realizar una revisión de la literatura centrada en el diagnóstico y tratamiento de esta condición y sus resultados.
PRESENTACIÓN DEL CASO
Paciente de 80 años sin antecedentes personales ni familiares relevantes para cáncer de mama. Acudió al servicio de ginecología del Hospital Ángeles Lomas (México), centro de referencia en patología mamaria a nivel privado, por autodetección de un tumor de reciente aparición, indoloro, que se extendía de la región retroareolar hacia el cuadrante superior externo de la mama derecha, acompañado de un ganglio palpable en axila ipsilateral. Negaba síntomas constitucionales y antecedente de traumatismos a nivel del tórax.
A la exploración clínica, durante la inspección se apreciaban mamas péndulas, simétricas, sin hundimientos, sin cambios en la coloración de la piel y red venosa, con adecuada relación areola-pezón, sin presencia de telorrea. A la palpación digital manual se identificó un tumor sólido en glándula mamaria derecha, retroareolar, en el radio de la 1, que se extendía hacia el cuadrante superior externo, de aproximadamente 2 x 1 cm, móvil, no doloroso, de bordes bien delimitados en el plano superficial. En la axila ipsilateral se palpó un ganglio ovalado, bien delimitado, de 3 x 2 cm, móvil, no doloroso. Se descartaron otros ganglios a nivel de la región supraclavicular. El resto de la exploración fue normal.
En la mamografía por tomosíntesis (Figura 1) se reportó tejido heterogéneamente denso en ambas glándulas mamarias. En la glándula mamaria derecha, en el cuadrante superior externo, se reportó engrosamiento difuso de la piel, con un patrón denso que sustituía la mayor parte de la glándula mamaria y se extendía de forma irregular, así como un nódulo ovalado, con márgenes indistintos y microlobulados de aproximadamente 1,5 cm en su eje mayor. Contaba con calcificaciones puntiformes, en anillo y distróficas, típicamente benignas, en ambas glándulas mamarias. En las axilas se reportaron ganglios de tamaño y forma adecuada.
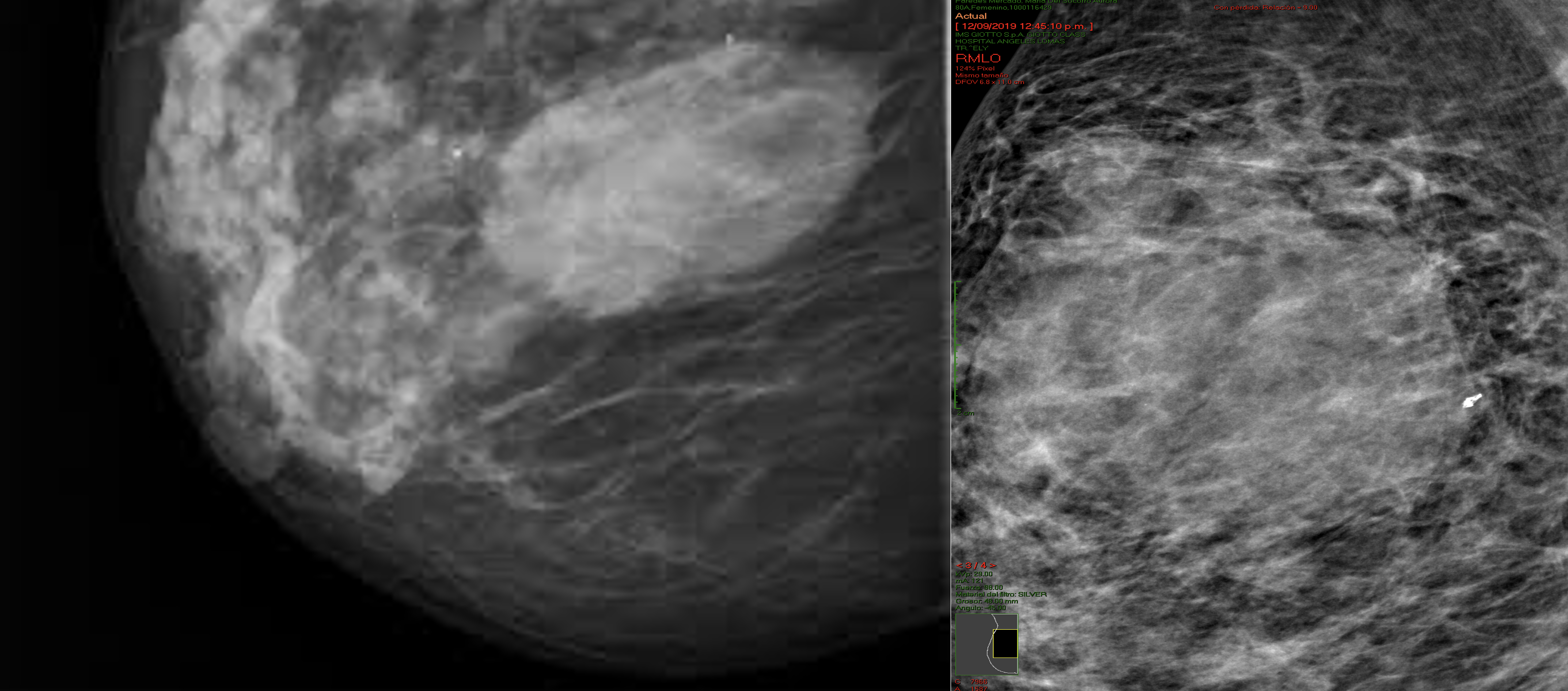
Fuente: archivo del estudio.
Figura 1 Mamografía. Lo más característico que se aprecia son nódulos solitarios (69-76 %), que generalmente tienen una forma redonda u ovalada, con márgenes bien circunscritos o indistintos, similar a lo presentado por la paciente. Los márgenes espiculados son raros. La apariencia hiperdensa suele ser la característica más representativa en los linfomas.
El estudio se complementó con ecografía mamaria (Figura 2), la cual reportó tejido mamario fibroglandular y heterogéneo, con distorsión de la arquitectura, con un tumor en glándula mamaria derecha en el radio de la 1, bordes microlobulados y heterogéneos debido a zonas de mayor y menor ecogenicidad en el interior, sin reforzamiento posterior, con vascularidad interna incrementada a la aplicación de Doppler color. Los complejos areola-pezón con ductos de calibre y distribución adecuados. A nivel cutáneo se apreció engrosamiento de la piel. En las axilas se reportaron ganglios de tamaño y forma adecuadas, que conservaban su centro graso.
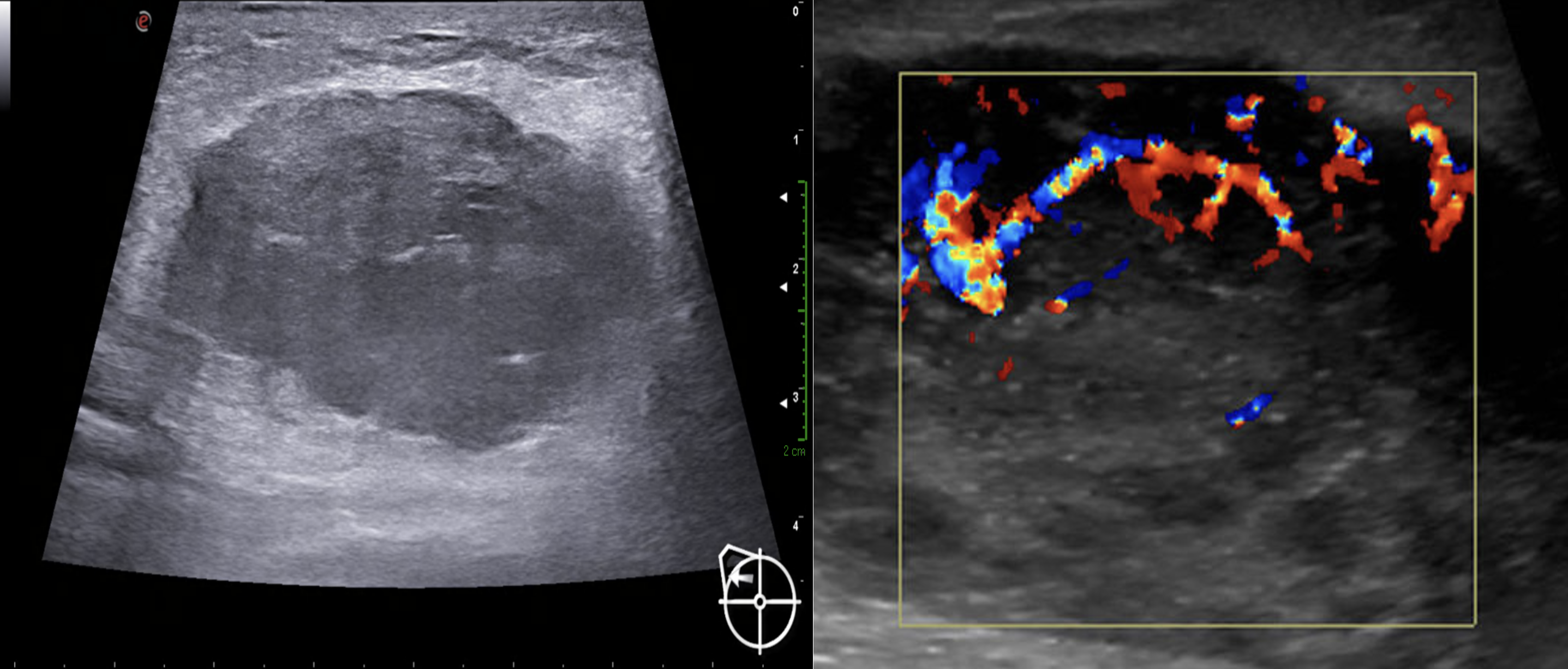
Fuente: archivo del estudio.
Figura 2 Tumor mamario irregular, sin reforzamiento posterior, con distorsión en arquitectura. Se observa vascularidad aumentada al Doppler color.
Una vez integrados los estudios de imagen se otorgó una categoría Breast Imaging Reporting and Data System (BI-RADS) 5, según el sistema del American College of Radiology, por lo que se prosiguió a realizar biopsia con aguja gruesa guiada por ultrasonido para su estudio histopatológico.
Se realizó tomografía computarizada como estudio de extensión, con cortes axiales, en fase simple, el cual reportó estructuras de la base del cuello sin alteraciones, calcificación en válvula aórtica, con morfología y tamaño normales, glándulas mamarias asimétricas, sin evidencia de adenomegalias mediastinales, cambios degenerativos en estructuras óseas. Se reportó una lesión hepática (Figura 3), la cual se protocolizó, se realizó biopsia y al resultado histopatológico se encontró un segundo tumor primario, el cual resultó un melanoma hepático. Se descartó la presencia de linfomas en otras localizaciones.
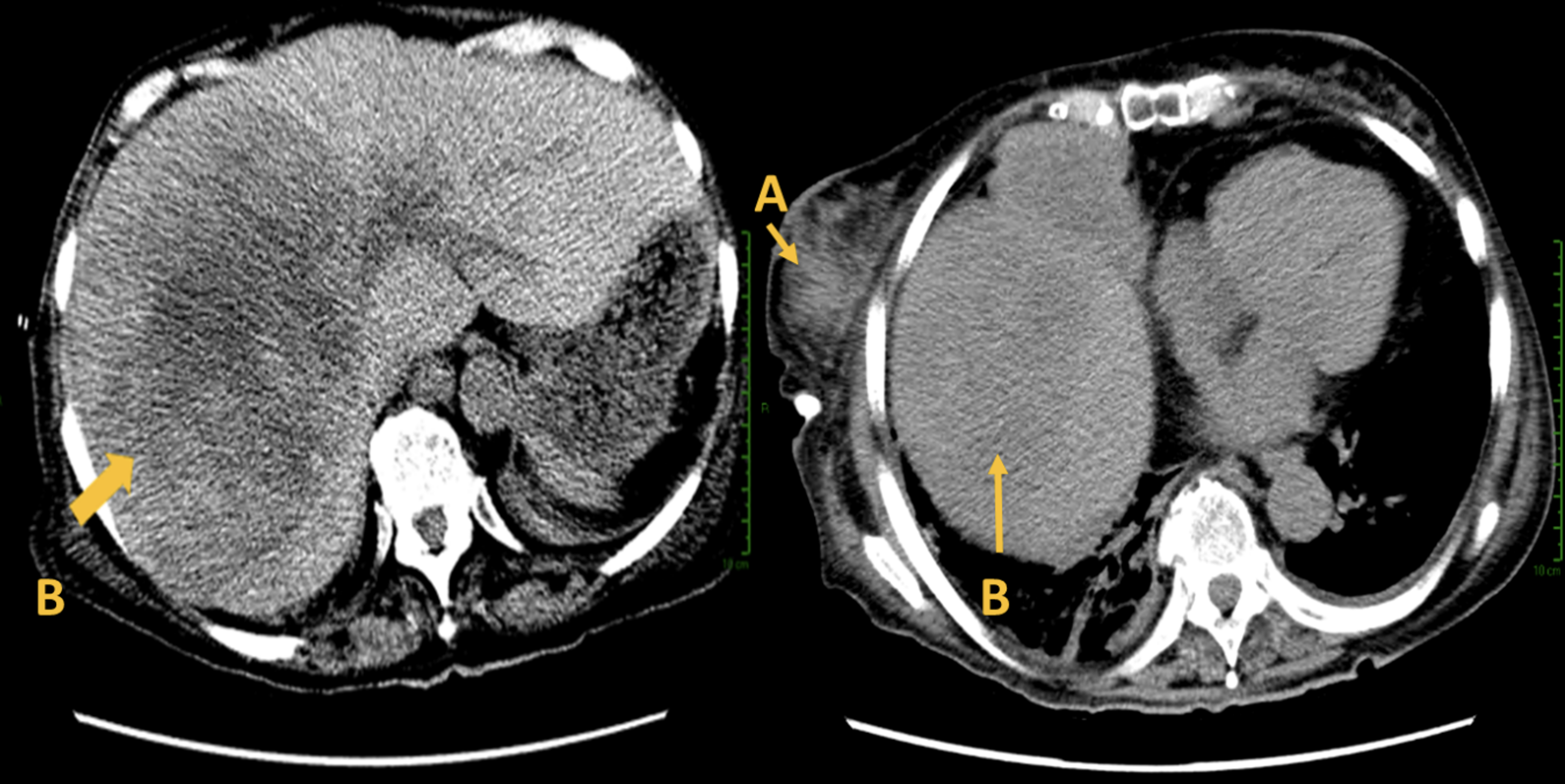
Fuente: archivo del estudio.
Figura 3 Tomografía por emisión de positrones que muestra tumor secundario: A) LNH primario de la mama y B) Lesión hepática
Posteriormente, se realizó perfil inmunohistoquímico (Figura 4) que reportó: CD5 positivo, CD10 positivo, CD20 positivo, BCL-2 positivo, MUM-1 negativo, Ki-67 100 %. Se realizó el diagnóstico de un linfoma no Hodgkin (LNH) inmunofenotipo B de células gigantes, con un índice de proliferación del 100 %. Se estadificó como etapa clínica I en la clasificación de Lugano de LNH (Tabla 1) 15,16 dado que cumplía con la definición de LPM, con involucramiento local de glándula mamaria con infiltración a un ganglio axilar ipsilateral, corroborado por biopsia por aspiración con aguja fina guiada por ecografía.
Tabla 1 Sistema de clasificación para linfomas no Hodgkin de Lugano 15,16.
Fuente: elaboración propia.
Una vez integrado el diagnóstico, se inició inmediatamente con ciclos de quimioterapia de inducción con esquema R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona) por seis ciclos, un ciclo cada tres semanas. Las dosis y vías de administración fueron conforme a lo más aceptado en la bibliografía médica, por una duración de 18 semanas (Tabla 2) 17.
Tabla 2 Esquema de quimioterapia de primera línea para linfomas no Hodgkin R-CHOP 17.
| Día | Dosis |
|---|---|
| Día 1 | Rituximab 375 mg/m2, intravenosos día 1 previo al inicio del régimen CHOP |
| Día 1 | Ciclofosfamida 750 mg/m2, intravenosos + doxorrubicina 50 mg/m2, intravenosos en media hora + vincristina 1,4 mg/m2, intravenosos en bolo (dosis máxima 2 mg) |
| Días 1-5 | Prednisona 100mg vía oral |
| Días 1-5 | G-CSF 5 /Xg/kg subcutáneos por 3-5 días. Repetir ciclo cada 3 semanas por 6-8 ciclos |
| Consideración de radioterapia en caso necesario. Comenzará 3 semanas después del último ciclo de R-CHOP |
Fuente: elaboración propia.
Se decidió optar por manejo quirúrgico complementario debido al volumen del tumor, por lo que se realizó cuadrantectomía y resección de cadenas ganglionares. Posteriormente, recibió quimioterapia adyuvante con esquema R-CHOP por un ciclo cada ocho semanas durante un año y posteriormente recibió radioterapia adyuvante en campos tangenciales con 50 Gy en 20 fracciones. Se decidió realizar una biopsia por aguja fina de control en mama derecha, que demostró respuesta clínica y patológica completa.
A pesar de la respuesta adecuada y el control del LNH, un año y medio después presenta progresión del segundo tumor primario, el cual comprometió el pronóstico. Se realizó una tomografía axial computarizada, en donde se apreció derrame pleural del 60 % (Figura 3), por lo que se realizó pleurodesis, la cual drenó 600 cc de líquido serohemático, por lo que se colocó un catéter tunelizado.
La paciente presentó un mal pronóstico condicionado por el segundo tumor primario debido a su progresión, a pesar de que el LNH se encontraba controlado. En los últimos cuatro meses, la paciente permaneció con cuidados paliativos.
MATERIALES Y MÉTODOS
Con base en la pregunta: ¿cómo se hace el diagnóstico de los linfomas no Hodgkin primarios de mama y cuál es el efecto de los diferentes tratamientos en términos de la sobrevida global?, se realizó la búsqueda sistemática de la literatura médica en las bases de datos PubMed, LILACS y Google Scholar usando los términos MeSH: "linfoma de mama", "tumor primario", "non-hodgkin lymphoma", "breast", "B-cell lymphoma", "breast carcinoma", "treatment", "chemotherapy", "mastectomy", "surgery". La búsqueda se amplió a otras fuentes de información a partir de la estrategia de búsqueda "bola de nieve", con base en los estudios recuperados. Se seleccionaron reportes, series de casos y cohortes de pacientes con diagnóstico histopatológico de linfoma no Hodgkin primario de mama, que abordaran esquemas o modos de tratamientos en términos de los efectos en la sobrevida global y sobrevida libre de enfermedad entre los años 20002020, en inglés y español. Se decidió establecer esta temporalidad dado que, a partir del año 2000, se presentó el mayor avance en tratamientos quimioterapéuticos dirigidos hacia esta entidad.
Los autores revisaron los títulos y resúmenes de forma independiente y se seleccionaron aquellos que cumplieron con los criterios de selección. De cada estudio se buscó información sobre país, número de casos, institución, diagnóstico clínico, imágenes diagnósticas e inmunohistoquímica, estadio clínico, tipo de tratamiento, tiempo de seguimiento, sobrevida global a cinco años, sobrevida libre de enfermedad, efectos adversos. La información se organizó mediante un instrumento de recolección de datos (Excel). Se realizó un resumen narrativo de los hallazgos con los resultados de búsqueda, los tipos de estudios incluidos y los resultados.
Aspectos éticos. Para la publicación del presente caso se informó a la paciente del diagnóstico, se firmó el consentimiento informado en cada procedimiento realizado, así como el consentimiento expreso para poder publicar su caso. Se tomaron las precauciones pertinentes para garantizar la confidencialidad de la información, así como el anonimato de la paciente.
RESULTADOS
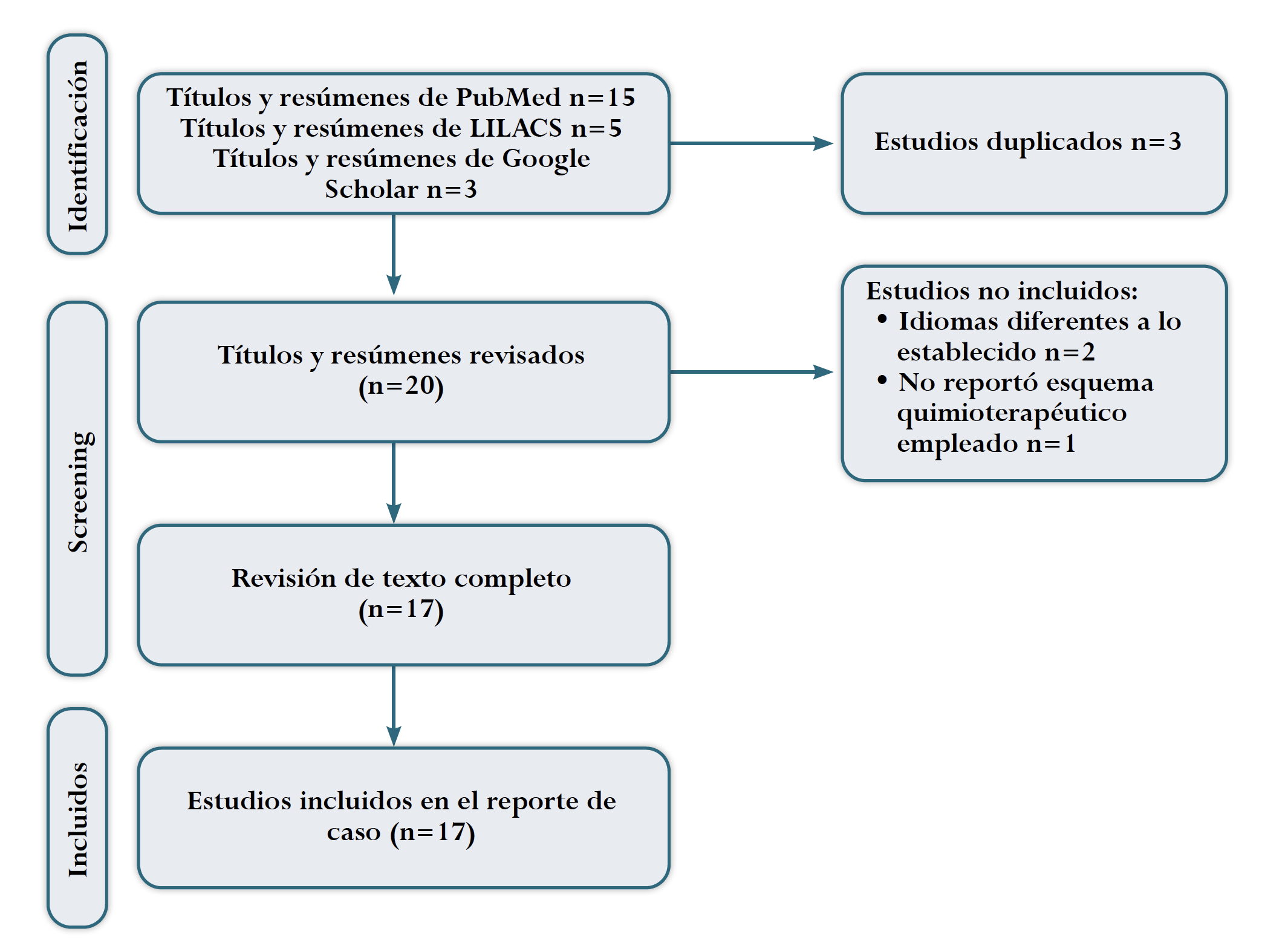
Se identificaron 23 títulos publicados, de estos, tres se encontraban duplicados, por lo que se revisaron 20 títulos. Al revisar los resúmenes se identificó que tres estudios no cumplían los criterios de inclusión debido a que dos se encontraban en idiomas diferentes al inglés y español (uno en turco y uno en alemán), y otro no reportó el tratamiento empleado (Figura 5). Se analizaron, entonces, 17 estudios (Tabla 3), de los cuales 12 correspondían a reportes de caso 20,21,23-31,34, y 5 series de casos 18,19,22,32,33, que sumaron un total de 92 casos. Los países de origen fueron: Bolivia 20, México 21,30,31, Estados Unidos 23, Marruecos 24, Japón 25,26, Egipto 27, Venezuela 28, India 29, Portugal 34. Las series de casos fueron publicadas en Colombia 19, Singapur 18, Francia 22 y Estados Unidos 32,33.
Tabla 3 Resumen de las características de los estudios de caso de pacientes con LNH primario de glándula mamaria.
| # | Autor | Diseño | Año | País | Número de casos | Institución | Tiempo de seguimiento | Estadio clínico | Inmuno-histoquímica | Tratamientos | Sobre-vida global a 5 años | Sobrevida libre de enfermedad | Eventos adversos |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Foo et al. 18 | Serie de casos | 2019 | Singapur | 7 | Changi General Hospital | 36 meses | Estadios IE (1) IIE (3), IIIE (1) e IVE (2) | No reportado | QT: R-CHOP por 6 ciclos vincristina/ ciclofosfamida/ prendnisona (1 paciente) | 64,3 % | 64 % de las pacientes a 3 años | No reportado |
| 2 | Rodríguez et al. 19 | Serie de casos | 2004 | Colombia | 25 | Instituto Nacional de Can-cerología | 57 meses | Estadio I-II | No reportado | RT (2,400-6000cGy) con/ sin QT con regímenes CHOP o COP | 91 % | No reportado | Recaída en sistema nervioso central (20 %), pulmón, hígado y mamas. 1 peritonitis posterior a la QT con antraciclinas |
| 3 | León-Pacari et al. 20 | Reporte de caso | 2015 | Bolivia | 1 | Instituto Nacional del Tórax | 3 meses | Estadio IV | No reportado | Soporte ventilatorio | 0 %. | 0 meses. | Paro respiratorio-muerte. |
| 4 | Zamudio et al. 21 | Reporte de caso | 2019 | México | 1 | Instituto Mexicano del Seguro Social | 20 meses | IIE | CD20, CD10, Bcl-2 positivos, Ki67: 100 % CD5, ciclinas y MUM-1 negativos | QT con esquema R-CHOP 8 ciclos (1 cada 3 semanas) + mastectomía radical modificada + rituximab de mantenimiento 1 ciclo cada 8 semanas por 12 meses + RT con campos tangenciales y axilo-supraclavicular 50,4Gy en 25 fracciones | 100 % | 20 meses | Ninguno |
| 5 | Vignot et al. 22 | Serie de casos | 2005 | Francia | 19 | Centre de Lutte Contre le Cancer René Huguenin | 36 meses | Estadios IE (5), IIE (9), IIIE (2) y IV (3) | No reportado | Cirugía (tumorectomía o mastectomía) en 11 pacientes. 14 QT/RT adyuvante (13 antaciclinas y 1 fludarabina) | 29 % | 8.3 meses | No reportado |
| 6 | Paras-har et al. 23 | Reporte de caso | 2021 | Estados Unidos | 1 | Vincent's Medical Center | 12 meses | Estadio I | mencionan marcadores de inmunohistoquí-mica (no se especifican) | RT local 3060cGy en fracciones diarias de 180cGy | No reportado | 12 meses | Urosepsis |
| 7 | Meklaa et al. (24 | Reporte de caso | 2017 | Marruecos | 1 | Hôpital Militaire d'Instructions | 12 meses | Estadio I | CD20 positivo | QT (Vincris-tina/ Ciclo-fosfamida/ Prednisona) + Inmunoterapia | 100 % | No reportado | Ninguna |
| 8 | Yone-yama et al. 25 | Reporte de caso | 2021 | Japón | 1 | Hiratsuka City Hospital | No reportado | Estadio I | CD20, CD79a y Bcl-2 positivos CD3, CD10, S100, citoqueratina negativos | Cirugía (Mas-tectomía parcial + ganglio centinela) + QT (R-CHOP) + Metotrexato intratecal | 100 % | 4 años | Ninguna |
| 9 | Uesato et al. 26 | Reporte de caso | 2005 | Japón | 1 | Universidad de Chiba | 7 años | Estadio IIE | No se realizó | Cirugía + QT (CHOP) | 100 % | 7 años | Ninguna |
| 10 | Harb et al. 27 | Reporte de caso | 2019 | Egipto | 1 | Universidad Zagazig | 7 meses | Estadio I | CD5, CD20, CD45, positivos CD3, CD15, CD30, pan-queratina negativos | QT: R-CO-DOX/IVAC x 4 | 100 % | 7 meses | Ninguna |
| 11 | Quintero et al. 28 | Reporte de caso | 2017 | Venezuela | 1 | Hospital Gutiérrez Ortega de Valdepeñas | No reportado | Estadio I | CD3, CD19, CD20 positivos | QT: Régimen R-CHOP + Vincristina | 100 % | No reportado | Ninguna |
| 12 | Gupta et al. 29 | Reporte de caso | 2017 | India | 1 | Premier Govt Medical Institute of India | 7 meses | Estadio I | CD5, CD20, CK positivos | QT: régimen no especificado | 100 % | No reportado | No reportado |
| 13 | Ferbeyreet 30 | Reporte de caso | 2013 | México | 1 | Hospital General Regional N° 17, Instituto Mexicano del Seguro Social (IMSS) | 12 meses | Estadio IE | CD20, Ki67, Bcl-2 positivos CD3 negativo | QT: R-CHOP por 6 ciclos | 100 % | 12 meses | Ninguna |
| 14 | Rivas-Verá et al. 31 | Reporte de caso | 2014 | México | 1 | Instituto Nacional de Cancerología | 5 años | Estadio IE | CD3, Ficl-2, écl-3, MUM-1 positivos | QT: CHOP por 4 ciclos + RT a dosis 46Gy en 23 fracciones | 100 % | 5 años | Ninguno |
| 15 | Wadhwa et al. 32 | Serie de casos | 2018 | Estados Unidos | 3 | Hospital Froedtert | 3-4 años | Estadio I | No reportado | 1: R-CHOP X6 ciclos + RT a dosis 48Gy x 24 fracciones 1: R-CHOP x 2 ciclos + RT a 50 Gy x 25 fracciones 1: Rituximab como agente único | 100 % | 5 años | Ninguno |
| 16 | Wong et. al. 33 | Serie de casos | 2002 | Estados Unidos | 26 | Mayo Clinic Rochester y Scottdale | Estadio I (21) Estadio II (5) | No reportado | Excisión 23 pacientes y 3 mastectomía 15 RT, 6 QT, 5 RT + QT RT: 20-50.4 Gy CHOP: 3 (ciclofosfami-da, vincristina, doxorrubicina, prednisona) COPP: 1 1: ciclofosfami-da, etopósido, procarbazina y prednisona 1: ciclofosfa-mida, vincristi-na, prednisona, metotrexato | Estadio I 83 % Estadio II 20 % Global: 70 % | Global: 42 % a 5 años Pacientes que recibieron QT: 65 % a 5 años No recibieron QT: 52 % a 5 años | 14 presentaron diseminación de la enfermedad, 3 pacientes afectación a nivel de sistema nervioso central. 1 recidiva tras escisión quirúrgica sin márgenes libres. 8 sin eventos adversos | |
| 17 | Melo et al. 34 | Reporte de caso | 2018 | Portugal | 1 | Centro Hospi-talaar Tras-os-Montes | 24 meses | Estadio I | No reportado | R-CHOP x8 | No reportado | 2 años | Ninguno |
Fuente: elaboración propia.
Al momento del diagnóstico, la población incluida presentaba una edad media de 55,5 años (rango 17-86 años), la mayoría eran mayores de 60 años. La paciente mayor tenía 86 años 22.
El síntoma principal al momento de la primera consulta fue el nódulo palpable en la mayoría de las pacientes, presentándose en 87 de ellas (94,5 %) 18,19,21,22-33, otra sintomatología reportada fue dolor en dos pacientes (2,1 %) 20,34, cambios cutáneos en 5 pacientes (5,4 %) 22,24,34, disnea en 2 pacientes (2,1 %) 20,23 y retracción del pezón solamente en una paciente (1,08 %) 24.
En cuanto a las imágenes diagnósticas, la empleada fue la mastografía tomada en todas las pacientes excepto en dos 20,22 debido a las condiciones físicas de estas: en la primera por el deterioro, pues acude con disnea, astenia, dolor, adinamia y síntomas B 20, en el segundo caso por la gran presencia de edema, por lo que se prefirió realizar ultrasonido 22. En la mayoría de las mastografías se reportaron como hallazgos asimetrías, microcalcificaciones y nódulos irregulares. El estudio complementario más utilizado fue la ultrasonografía (70,6 %). Otras modalidades de imagen utilizadas para evaluación del tumor fueron la tomografía en 12 pacientes (13 %) 18,23,32,34 y la resonancia magnética en dos pacientes (2,1 %) 25,26.
El diagnóstico se realizó por biopsia en 5 estudios 19,26-28,34. En cuanto al uso de inmunohistoquímica, se reportaron positivos en su mayor parte CD20 21,24,25,27-31 y CD3 28,31 y este último negativo en tres estudios 25,27,30. El índice de proliferación Ki 67 fue del 100 % según lo reportado por Zamudio et al. 21, mientras que Ferbeyre et al. 30 lo reportan únicamente como positivo.
Una vez realizada la estadificación, 54 pacientes (58,6 %) se encontraban en estadio I, 8 pacientes (8,6 %) en estadio IE, 7 pacientes (7,6 %) en estadio II, 14 pacientes (15,2 %) en estadio IIE, 3 pacientes (3,2 %) en estadio IIIE, 4 pacientes (4,3 %) en estadio IV y 2 pacientes (2,1 %) en estadio IVE. El tiempo de seguimiento fue ≤ 1 año en 6 pacientes 20,23,24,27,29,30, de 2 a 4 años en 56 pacientes 18,19,21,22,32,34 y ≥ 5 años en 28 pacientes 26,31,33, mientras que en dos de ellas no se especificó el tiempo de seguimiento 25,28.
En cuanto al tratamiento, la mayoría de las pacientes recibió quimioterapia. El esquema más empleado fue el CHOP, con o sin rituximab (R-CHOP). En siete estudios 18,21,25,28,30,32,34 se empleó el esquema R-CHOP, en donde se obtuvo una sobrevida global a 5 años del 94,05 % y una sobrevida libre de enfermedad de 40 meses mientras que dos pacientes en dos estudios 26,31 que emplearon el esquema CHOP reportaron una sobrevida global a 5 años del 100 % y sobrevida libre de enfermedad de 6 años respectivamente. Cheah et al. 13 sugieren contemplar el uso de anticuerpos monoclonales como el rituximab, teniendo en cuenta de la profilaxis al sistema nervioso central (SNC), sitio que presenta mayores recaídas. Mencionan que las pacientes en estadio 0-I, sin otros factores de riesgo, se pueden beneficiar de 4-6 ciclos de esquema R-CHOP y las pacientes con alto riesgo, en estadio II-IV, de 6 ciclos 13. Otros esquemas utilizados fueron el empleo de vincristina, ciclofosfamida y prednisona 18,24, COPP (ciclofosfamida, etopósido, procarbazina y prednisona) 33. En una paciente 32 reportada por Wadhwa et al. se empleó rituximab en monoterapia, presentando buena respuesta al tratamiento; a los 16 meses de seguimiento la paciente permaneció libre de enfermedad, sin involucro a otros órganos o linfadenopatías.
En cuanto a la radioterapia, esta se utilizó en conjunto con la quimioterapia en la mayoría de los casos 19,21-23,27,31-34 en 68 pacientes (73,9 %). En cuanto a los eventos adversos, se reportó recaída a sistema nervioso central en 8 pacientes (8,6 %), el cual fue el sitio más común 18,32. De estas pacientes, además una presentó recaída en pulmón y otra en mama contralateral 19, urosepsis en una paciente (1,08 %) 23, 14 pacientes presentaron diseminación de la enfermedad (15,2 %) 33, una paciente paro cardiorrespiratorio (1,08 %) 20, una paciente presentó recidiva tras cirugía sin márgenes libres (1,08 %) 33. No se presentaron eventos adversos en 40 pacientes (43,4 %) 19,21,24-34, mientras que dichos eventos no se reportaron eventos adversos en 27 pacientes (29,3 %) 18,22,29.
La sobrevida global a 5 años fue de 83,62 % (18-22, 24-33), sin embargo, ésta no se reportó en dos estudios 23,34. La sobrevida libre de enfermedad fue de 30,9 meses, en cuatro estudios no se reportó dicha información 19,24,28,29.
CONCLUSIÓN
En la actualidad el esquema CHOP, con o sin rituximab, es el más empleado y el único que ha mostrado tener un impacto positivo en la supervivencia, este suele acompañarse de radioterapia. Se requieren más estudios clínicos aleatorizados para establecer de manera más adecuada la efectividad y seguridad de estos tratamientos.