Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.28 no.2 Bogotá Apr./June 1999
* Médico, especialista en Neurología, Universidad del Rosario. Anclen Assistant Étranger de la Faculté de Médecine de Paris V "Rene Descartes". Jefe de Educación Médica y Profesor Asociado de Neurología Universidad Colegio Mayor de Nuestra Señora del Rosario. Jefe Servicio de Neurología, Clínica Reina Sofía.
RESUMEN
El autor hace una revisión actualizada de la epilepsia, clarifica el concepto de crisis epiléptica y convulsiva, describe su clasificación (Clasificación internacional de crisis epiléptica y clasificación internacional de las epilepsias y síndromes epilépticos) fisiopatología, tratamiento y algunos factores pronósticos.
Palabras clave: Epilepsia, Niños, Adolescentes.
ABSTRACT
The author presents an updater review of epilepsy, explaining the concepts of epileptic and convulsive crises. International classification of epileptic crises, epilepsies and epileptic syndromes are described. Patrophysiology, treatment and prognosis are studies.
Key Words: Epilepsy, Children, Adolescents.
INTRODUCCIÓN
La epilepsia se define como un trastorno caracterizado por la recurrencia de crisis epilépticas. Estas, a su vez, son el resultado de descargas excesivas y desordenadas de neuronas cerebrales. Las crisis epilépticas pueden ser convulsivas y no convulsivas. Las primeras son aquellas en las cuales hay movimiento (ej. Crisis parciales motoras, o crisis tónico clónicas generalizadas). En las no convulsivas, no hay movimiento, pero se presentan igualmente descargas anormales, responsables del fenómeno observado. Ejemplo de lo anterior constituyen las ausencias, las crisis parciales, sensitivas o las crisis parciales con componente psíquico.
Tipos de crisis:
Crisis parcial: son aquellas que se generan en un área específica del cerebro (Ej. lóbulo frontal izquierdo).
Crisis Generalizada: son aquellas en las cuales hay compromiso simultáneo de ambos hemisferios cerebrales.
Síndrome epiléptico: se define por la asociación de diferentes crisis epilépticas, el estado neurológico intercrítico del paciente y las características electroencefalográficas ictales e interictales.
PREVALENCIA E INCIDENCIA:
Es una de las entidades neurológicas más frecuentes. A su vez su incidencia varía de acuerdo a diferentes latitudes, siendo más frecuente en países en vía de desarrollo que en países industrializados. En nuestro medio, su prevalencia es cercana al 15 por mil, mientras que por ejemplo en los Estado Unidos de Norteamérica se acerca al 3 por mil. Es una entidad que en la mayoría de los casos se inicia en la infancia. Loiseau y Jallon señalan como 50 % de las crisis aparecen antes de los 10 años de edad, 44 % antes de los 5 años, 30 % entre los 10 y los 29 años y 75 % antes de los 20 años.
CLASIFICACIONES
Hay dos grandes Clasificaciones que utilizamos en la actualidad en epilepsia: La Clasificación de las Crisis Epilépticas y la de las Epilepsias y Síndromes Epilépticos.
Clasificación Internacional de las crisis epilépticas:
También conocida como Clasificación de Kyoto, ya que en esa ciudad Japonesa se reunió el Comité de Clasificación y Terminología proponiendo esta clasificación en 1981. En ella se tienen en cuenta los criterios clínicos (crisis epilépticas) y electrofisiológicos (Electroencefalograma).
Ha sido de gran utilidad, marcó una pauta en el mundo entero y es universalmente aceptada y empleada por quienes trabajan en epilepsia.
Ha permitido, entre otras cosas, disponer de un vocabulario específico y de una terminología unificada que permiten llevar a cabo estudios epidemiológicos más uniformes. (labial).
Al clasificar de manera correcta a un paciente, se puede elegir el (o los) fármaco (s) más adecuado (s) para su manejo, informarlo a él o a sus padres, si se trata de un menor, sobre el tiempo aproximado que debe recibir tratamiento y sobre el pronóstico de la entidad.
Previamente a la utilización de esta clasificación, empleábamos con frecuencia el término "paciente con síndrome convulsivo", lo cual era cuando menos difuso, ya que para empezar, no todas las crisis epilépticas son convulsivas y, en segundo término, el sólo tipo de crisis que presenta un paciente no es criterio suficiente para clasificarlo.
Ejemplo de lo anterior puede constituir un niño que inicie un cuadro clínico caracterizado por crisis mioclónicas pluricotidianas. varias veces al día el paciente podría tener desde una epilepsia mioclónica benigna del lactante, de excelente pronóstico, hasta una entidad del grupo de las epilepsias mioclónicas progresivas, generalmente de mal pronóstico y algunas de ellas potencialmente fatales.
Clasificación Internacional de las Epilepsias y Síndromes epilépticos:
Factores importantes como etiología, aspectos terapéuticos más precisos y pronóstico, no están contemplados en la clasificación de Kyoto.
Conscientes de esto y con valiosos aportes de expertos de muchas partes del mundo, se llegó a la Clasificación de la Epilepsias y Síndromes Epilépticos en 1985, conocida también como Clasificación de Hamburgo. Esta Clasificación tuvo modificaciones en 1989.
En esta clasificación se emplea, como uno de los puntos esenciales, la crisis como expresión Clínica de la Epilepsia. Tiene además en cuenta, la etiología de la epilepsia y las divide en Primarias o Idiopáticas y Secundarias o Sintomáticas.
En las epilepsias idiopáticas la única etiología presumible es hereditaria. La palabra proviene del término griego "¡dios", que quiere decir propio, personal. Las epilepsias idiopáticas se diagnostican de acuerdo a la edad de aparición, al tipo de crisis, a los hallazgos electroencefalográficos y se presumen de etiología genética.
Las epilepsias sintomáticas son aquellas en las cuales las crisis epilépticas son el resultado de una patología cerebral. Esta puede estar claramente definida (Ej.: encefalopatía hipóxico-isquémica, secuelas de neurointección etc. ..) o eventualmente puede haber una sospecha clínica, pero no ha podido demostrarse la patología con los exámenes paraclínicos realizados. En este tipo de casos, se emplea el término epilepsia criptogénica.
Su otro gran eje las divide en epilepsias o síndromes epilépticos generalizados: tienen crisis en las que el inicio indica compromiso simultáneo de ambos hemisferios, y epilepsias o síndromes epilépticos parciales (focales o locales): el tipo de crisis y los hallazgos paraclínicos indican un origen focal de las crisis.
La tabla 2 resume los principales aspectos de esta Clasificación:
La utilización correcta de esas dos clasificaciones (Kyoto y Hamburgo) es definitiva en la práctica diaria de la epileptología, para efectos de comunicarse en un mismo idioma, con la posibilidad de unificar criterios para proyectos de investigación multicéntricos e internacionales.
FISIOPATOLOGÍA
Se han planteado diferentes hipótesis para explicar la génesis de las crisis epilépticas:
1) Alteraciones neuronales
2) Alteraciones en los neurotransmisores
3) Kindling
1) Alteraciones neuronales:
Las neuronas que generan descargas epilépticas tienen la particularidad de producir potenciales de acción de mayor voltaje que las demás neuronas. Ante un estímulo determinado pueden generar "potenciales de acción gigantes", cuya expresión clínica puede ser una crisis epiléptica.
Por otra parte, es bien conocido que las neuronas están genéticamente codificadas para generar potenciales de acción ante diferentes estímulos. Sin embargo si estos no son lo suficientemente intensos, no se logrará generar el potencial. El punto al cual debe llegar el estímulo para generar el potencial de acción se denomina" umbral de la neurona." Entre más alto sea este, más intenso tendrá que ser el estímulo para generar la descarga. Se ha planteado entonces que las neuronas que generan crisis epilépticas tienen un umbral muy bajo y esto facilita la aparición de crisis.
Parte de las estrategias farmacológicas, para controlar esta entidad, es administrar fármacos que incrementan el umbral de las neuronas, u otros que bloquean los canales del calcio, disminuyendo en esta forma la amplitud del potencial de acción.
Alteraciones en los neurotransmisores:
En el cerebro hay neurotransmisores inhibidores y excitadores. El principal neurotransmisor inhibidor en el sistema nervioso es el ácido gama-aminobutírico, denominado GABA. A su vez, los principales aminoácidos excitatorios son el ácido glutámico y el aspartato.
Se ha planteado que en la epilepsia podría haber un desequilibrio entre estos neurotransmisores, existiendo un déficit de GABA o un exceso de aminoácidos excitatorios. De hecho, algunos fármacos antiepilépticos actúan incrementando los niveles de GABA y se conocen como medicamentos "gabaérgicos". Otros medicamentos bloquean la acción de los neurotransmisores excitatorios.
Kindling:
Este fenómeno logra producir crisis epilépticas en forma experimental. Consiste en aplicar a un grupo neuronal, durante breves períodos de tiempo (no más de un segundo), estímulos eléctricos repetitivos, de baja intensidad. Los estímulos se usan con diferentes intervalos de tiempo (2 a 24 horas). Inicialmente esto lleva a generar en dichas neuronas descargas que se visualizan en el electroencefalograma (EEG) pero sin ninguna manifestación clínica.
Posteriormente, la aplicación de estos mismos estímulos, generará descargas de mayor voltaje en el EEGs y producirá diferentes manifestaciones clínicas en el sujeto de experimentación, hasta llegar incluso a producir una convulsión.
Si se deja de estimular en ese momento, el sujeto podrá llevar una vida normal, pero si se vuelve a estimular incluso mucho tiempo después, (en estudios hasta tres años después) se volverán a generar descargas acompañadas de manifestaciones clínicas.
Si al llegar al punto en el que el estímulo genera manifestaciones clínicas se sigue estimulando el tejido nervioso, este descargará luego espontáneamente, sin necesidad de ningún tipo de epilepsia. Se genera en esta forma, tejido epileptogénico.
Es probable que el kindling intervenga en la génesis de epilepsia en el ser humano.
TRATAMIENTO
El tratamiento de los pacientes con epilepsia involucra diferentes aspectos:
Tratamiento farmacológico, con el cual se logra en la actualidad un control satisfactorio en el 80 % de los casos, aproximadamente.
-
El tratamiento quirúrgico que en la actualidad ofrece resultados muy satisfactorios a pacientes debidamente seleccionados, advirtiendo que requiere de recursos de alta tecnología y muy costosos. El porcentaje de éxito varía de acuerdo a diferentes autores, entre el 90 al 95 %.
-
El manejo integral del paciente, de la familia, del ambiente escolar, laboral y social en el que debe enfrentar diferentes problemas y decisiones que pueden interferir con su vida.
Las presentes líneas está dedicadas al primero de estos aspectos: el manejo farmacológico.
Conceptos generales
Al administrar una droga antiepiléptica, hay una serie de pasos que recorrer.
Absorción
Es el paso de un fármaco desde el sitio de administración hasta la circulación general. Hay dos parámetros que se deben considerar: La cantidad de medicamento administrado que llega a la sangre, y la velocidad a la cual el producto lo hace.
Estos dos parámetros definen la biodisponibilidad, que es del 100% al administrar el producto por vía intravenosa.
Distribución
En la sangre, el antiepiléptico se liga a las proteínas plasmáticas (esencialmente a la albúmina y ocasionalmente a las globulinas en proporciones variables).
Así, se divide en una fracción ligada a las proteínas y una fracción libre. Sólo la fracción libre es activa, ya que difunde a los tejidos. El complejo medicamento-proteínas tiene un peso molecular muy alto y no puede pasar las barreras biológicas.
La importancia de estos datos consiste en que las variaciones en la unión del fármaco a las proteínas plasmáticas pueden aumentar la fracción libre y producir sobredosificación. Hay también asociaciones medicamentosas que pueden tener este efecto, y casos en los cuales la albúmina plasmática está baja (lactantes, ancianos, insuficiencia hepática o renal).
Posteriormente el producto pasa a los tejidos. Esta fase de distribución asegura el acceso del fármaco a los tejidos blanco, y finalmente a los receptores.
En el caso de los antiepilépticos, el producto debe pasar a través de la barrera hematoencefálica, y esto depende esencialmente de la liposolubilidad.
Una vez en el tejido cerebral, el producto se distribuye de manera heterogénea, pero las concentraciones más altas se encuentran en la sustancia gris.
Niveles séricos
Con una muestra de sangre es posible conocer la concentración del antiepiléptico en la sangre.
Pueden medirse el nivel sérico total y la fracción libre. Sin embargo, los equipos disponibles en nuestro medio no permiten estimar la fracción libre, y por lo tanto se manejan cifras de niveles séricos totales.
El ideal es que el paciente mantenga unos niveles dentro del denominado "rango terapéutico". Cuando el laboratorio informa el valor de unos niveles séricos, se debe observarlos siempre en función del estado clínico del paciente; el valor del nivel sérico da una guía sobre la acción del fármaco.
Al igual que cualquier dato de laboratorio, debe dársele el valor que merece y no tomarlo como la única pauta para aumentar o reducir la dosis de un fármaco.
El estado clínico del paciente, la frecuencia ictal, los efectos colaterales del producto, etc... son los elementos que en un determinado momento llevan a estas decisiones.
Metabolismo
La mayoría de los fármacos son transformados en sustancias hidrosolubles, más fáciles de excretar por el organismo. Estos metabolitos se forman en particular en el hígado, gracias a enzimas microsomales. La biotransformación representa la principal vía de eliminación de los anti-convulsivantes.
Es importante conocer que la actividad de las enzimas hepáticas puede ser modificada por diferentes medicamentos. Si la actividad de las enzimas aumenta, se habla de inductores enzimáticos, si esta disminuye, se emplea el término inhibidores enzimáticos, y si no la modifican, se consideran neutros.
La tabla 3 ilustra el grupo al cual pertenecen los principales antiepilépticos:
Autoinducción enzimática
Es una condición de gran importancia clínica. En ella, un antiepiléptico que además tenga la propiedad de ser un inductor enzimático, induce su propio metabolismo.
Aunque puede presentarse con varios fármacos, es relativamente frecuente con la carbamazepina. En la literatura anglosajona está descrito hacia la cuarta o quinta semana de tratamiento, per se ha tenido la oportunidad de observarlo en pacientes alrededor del segundo a tercer mes de iniciado el fármaco. Es por lo tanto prudente solicitar niveles séricos durante este período y estar vigilante, para evitar una caída de ellos o una posible recurrencia de las crisis.
La autoinducción enzimática se maneja aumentando lentamente la dosis de carbamazepina, con estrecha vigilancia clínica y paraclínica.
Excreción
La mayoría de los antiepilépticos son eliminados por vía renal y en menor grado hepática.
Vida media
Es el tiempo necesario para que la concentración de un fármaco se reduzca a la mitad de la concentración inicial.
Estado de equilibrio
También llamado estado estable, es la situación en la cual el aporte del fármaco es igual a la cantidad de producto eliminado. Es la condición en la cual se puede evaluar la acción terapéutica o los efectos indeseables del antiepiléptico.
A las dosis recomendadas por vía oral, se acepta que el estado de equilibrio se logra aproximadamente en cinco vidas medias del producto. Por ejemplo para la fenitoina, que tiene una vida media de 24 a 36 hrs. al administrar el fármaco a las dosis habituales, el estado de equilibrio se obtendrá 5 a 7 dúas después de estarlo administrando.
Desde el punto de vista de la cinética, hay que saber que todos los antiepilépticos, excepto la fenitoina, tienen una cinética lineal de orden "1". Esto quiere decir que se puede prever que un aumento de la dosis lleve a un incremento similar en los niveles séricos.
La fenitoina tiene una cinética no lineal o de orden "O" y esto hace que, en un momento dado, un pequeño aumento de la dosis puede llevar a una sobredosificación. Esto sucede por la saturación de los mecanismos que a nivel hepático metabolizan este producto.
Efectos secundarios
Hay dos tipos: idiosincráticos y por sobredosificación
Los efectos idiosincráticos se presentan en raras ocasiones, en que un individuo presenta una reacción adversa con un antiepiléptico que generalmente es muy bien tolerado. Pueden tener gravedad variable, de leve a severa, y en la práctica se presentan muy ocasionalmente.
La sobredosificación se observa en particular al formular dosis muy altas de un producto, o al indicar politerapia. Cuando estos efectos se presentan en forma aguda o subaguda, son generalmente detectados rápidamente y pueden corregirse ajustando la dosis.
Es complicado cuando estos efectos se presentan crónicamente, pasan inadvertidos, y hacen que el paciente tolere mal el tratamiento.
FÁRMACOS ANTIEPILÉPTICOS:
Se dividen en dos grandes grupos, fármacos de primera generación y fármacos antiepilépticos de última generación.
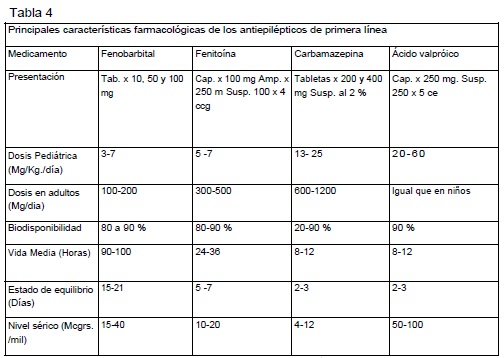
Al primer grupo pertenecen: Fenobarbital, Fenitoína, Carbamazepina, Acido Valproico, Primidona, Etosuccimida, Diazepam, y Clobazam.
En los últimos diez años se han sintetizado otras moléculas muy eficaces para el tratamiento de esta entidad. Actualmente se encuentran comercializados: Vigabatrin, Oxcarbazepina, Gabapentin. Topiramatey Tiagabin. En casos excepcionales, en los que ninguna otra molécula ofrezca resultados satisfactorios, y con el consentimiento informado del paciente, puede utilizarse Felbamato. Se requiere un estudio previo de la función hepática y de sangre del paciente, al inicio y durante el tratamiento, ya que este medicamento tiene el riesgo potencial de producir hepatitis tóxica fulminante o anemia aplásica.
PRONÓSTICO
En general, las epilepsias idiopáticas son de mejor pronóstico que las sintomáticas. En algunas de ellas, el tipo de epilepsia está precedido de la palabra "benigna", indicando que no hay deterioro neurológico, que hay una buena respuesta terapéutica, y que en algunas de ellas, hay curación. En el contexto de la clasificación a la que nos hemos venido refiriendo, las de mejor pronóstico son:
La epilepsia benigna de la infancia con puntas centrotemporales, la epilepsia benigna de la infancia con puntas occipitales, la epilepsia primaria de la lectura, la epilepsia mioclónica benigna del lactante, la epilepsia infantil con ausencias, la epilepsia mioclónica juvenil benigna, la epilepsia con crisis tónico-clónicas del despertar.
A su vez, hay algunas con mal pronóstico, siendo las más importantes: epilepsia parcial continua crónica de la infancia (síndrome de Kojewnikow), epilepsias sintomáticas parciales o generalizadas sintomáticas de lesiones graves del sistema nervioso (ej. anoxias perinatales, secuelas de neuroinfección, de trauma, de lesiones tumorales diversas, etc....), síndrome de West, síndrome de Aicardi, síndrome de Lennox-Gastaut, epilepsia mioclónica severa, encefalopatía mioclónica temprana, encefalopatía epiléptica temprana.
REFERENCIAS
1. Beaussart M. Benign epilepsy of children with with rolandic (centro-temporal) paroxysmal foci. Epilepsia, 1972; 13: 795-811. [ Links ]
2. Chadwickd: Epilepsy. Journal of Neurology, Neurosurgery and Psychiatry 1994;57:264-277. [ Links ]
3. Comission on Classification and terminology of the International League against Epilepsy: proposal for revised and electroencephalographic Classification of epileptic seizures. Epilepsia 1981; 22:489:501. [ Links ]
4. Comission on Classification and terminology of the International League against Epilepsy: proposal for Classification of Epilepsies and epileptic Syndromes. Epilepsia 1985; 26. 268-278. [ Links ]
5. Comission on Classification and terminology of the International League against Epilepsy: proposal for revised Classification of Epilepsies and epileptic ifuss F.: Pediatric Epileptology. Jhon Wright, Littleton; Massachusets, 1983. [ Links ]
7. Engel J. Perspectives. In Engel J. Seizures and Epilepsy: F.A. Davis Company, Philadelhia, 1989: 22-37. [ Links ]
8. Espinosa E., Dunoyer C., Nuñez L.C., Solano M., Casabuenas O.L. Síndrome Convulsivo en niños; Guías de Práctica Médica Basadas en la Evidencia. ISS-ASCOFAME. Editorial Maído nado, Santafé de Bogotá, 1997. [ Links ]
9. Gastauth H., y Cois. Diccionario de la Epilepsia. O.M.S. Ginebra, 1973. [ Links ]
10. Gastauth: Clinical and electroencephalographical Classification of epileptic seizures. Epilepsia 1970; 11:103-113. [ Links ]
11. Loiseau P., Duche B., Antiépileptiques nouveaux et futurs. Epilepsies 1989; 1: 244-257. [ Links ]
12. Palacios L., Palacios E.: Epilepsia, pasado y presente. Editorial Land de Colombia, Santafé de Bogotá, 1992. [ Links ]
13. Palacios L., Palacios E.: La Epilepsia a través de la Historia. Editorial Horizonte, Santafé de Bogotá, 1999. [ Links ]
14. Olaya A. I. Fármacos antiepilépticos. En Palacios L., Palacios E.: La Epilepsia a través de la Historia. Editorial Horizonte, Santafé de Bogotá, 1999, p. 55-83. [ Links ]