Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.31 no.3 Bogotá July/Sept. 2002
Artículo de Revisión
Medicación antigotosa para agresión refractaria en pacientes autistas
Juan Felipe Ortiz Tobón1
1 Residente de Psiquiatría de la Pontificia Universidad Javeriana. Dirección electrónica: juanfot@hotmail.com
Resumen
Las conductas hetero y autoagresivas en pacientes con autismo pueden ser refractarias a los medicamentos comúnmente empleados; sin embargo, la adenosina, purina neuromoduladora, ha demostrado ser una sustancia con propiedades antiagresivas dentro de modelos animales. Las vías de purinas se encuentran modificadas en ciertas patologías que presentan automutilaciones. El alopurinol aumentaría de forma indirecta las concentraciones de adenosina, por lo cual sería efectiva en el manejo de la agresión. En consecuencia, la población de pacientes autistas con dichos comportamientos lesivos podría tener mejoría con este medicamento antigotoso.
Palabras clave: agresión, alopurinol, trastorno autista, terapéutica, adenosina.
Abstract
Aggressive behavior seen in autism, could be refractary to carrera therapies. Adenosine, a neuromodulator purine, has proven to be an antiaggressive substance in animal modéls. The purine pathways are defective in some diseases that show automutilation. Allopurinol could increase adenosine levéis by an indirect mechanism and thus be effective as an antiaggression drug. Autistic patiets with these behaviors could improve with this drug.
Key words aggression, allopurinol, autistic disorders, therapeutic, adenosine.
La necesidad de ampliar el arsenal terapéutico en pacientes autistas con conductas agresivas, diferentes a fármacos como litio, anticonvulsivantes, Bbloqueadores, benzodiacepinas, neurolépticos e inhibidores selectivos de la recaptación de serotonina, plantea un reto, debido a que todas las anteriores presentan respuestas parciales, inicio lento y efectos colaterales indeseables. Sin embargo, el uso de medicamentos como el alopurinol (análogo estructural de hipoxantina, que inhibe fuertemente a la xantina oxidasa), comúnmente empleado en el tratamiento de hiperuricemia, en pacientes no autistas, con agresividad refractaria, ha mostrado una disminución de este tipo de conductas; pues, además, mejora la ansiedad e incrementa tanto el sueño como la sociabilidad (1).
Dentro de las teorías biológicas para explicar la agresión, se incluye el sistema de adenosina y adenosina trifosfato (ATP), a través de sus receptores P1 y P2, respectivamente (2), sustentado en ciertas manifestaciones conductuales como automutilación (se presenta en errores innatos del metabolismo de las purinas, por ejemplo, el síndrome de LeschNyhan) y el aumento de la agresividad en ratones knockout, carentes de receptores A2A de adenosina (3),(4). Esta purina es un neuromodulador inhibitorio que regula la liberación de norepinefrina, serotonina, dopamina, acetilcolina, glutamato, entre otros (2)(5). También posee efectos anticonvulsivantes, ansiolíticos, sedantes y propiedades inhibitorias de conductas agresivas en modelos animales (6).
Dentro de las posibles estrategias para interferir con la degradación de purinas y, por consiguiente, aumentar las concentraciones de adenosina, aprovechando las propiedades descritas, estaría el empleo del alopurinol. Este medicamento inhibe a la xantina oxidasa, enzima limitante de la conversión de hipoxantina y de xantina a ácido úrico, producto final del metabolismo de las purinas (véase Figura 1). De igual forma, incrementaría las cantidades de hipoxantina y xantina, los cuales pueden ser reutilizadas en la síntesis de inosina 5monofosfato y posiblemente en nucleótidos de adenosina e inosina.
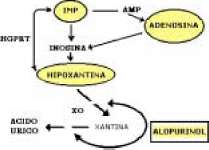
Figura 1. Vías del metabolismo de las purinas y mecanismo propuesto para la acción del alopurinol
Como se ve en la figura, el alopurinol inhibe la xantina oxidasa (XO) y acumula xantina e hipoxantina; esta última puede ser 'salvada' por la HGPRT (hipoxantina guaninafosforibosiltransferasa), eventualmente, si se aumentan las concentraciones de IMP (inosina 5monofosfato) y posiblemente de los nucleósidos de adenosina e inosina. El ovalo que encierra a las sustancias, indica que su concentración está aumentada.
Existen reportes de casos que muestran conductas agresivas y de autolesiones, como los dos pacientes descritos por LaraBelmonte de Abreu y Souza (1). Al primero, una paciente de treinta años, caucásica, con síntomas previos de ansiedad, a quien en 1993 se le diagnosticó un astrocitoma parietal izquierdo y se le realizó un drenaje quirúrgico por un absceso local. Un mes más tarde, presentó aumento en la impulsividad, disforia e ideas de rechazo social, que progresaron hasta una fobia social, con dos intentos de suicidio dos meses después (el último al cortarse la muñeca). En 1995, la paciente inició conductas de autolesión (cortarse la piel con cuchillas, botellas y espejos rotos), desencadenadas por frustraciones triviales con sus relaciones familiares. Desde 1993 a 1999 fue tratada de forma consecutiva con fluoxetina, hasta 60 mg/día (por 16 meses), clonacepam 1 mg/día (por dos meses), fenelcina 45 mg/día (por seis meses), sertralina 50 mg/día (por un año), oxcarbamacepina 750 mg (por dos meses), vigabatrin hasta 4 g (por .cinco meses), citalopram 20 mg (por un mes), propranolol 60 mg (por dos meses), venlafaxina 75 mg (un mes), mirtazapina 45 mg (un mes), amoxapina 150 mg (dos semanas), ácido valproico 750 mg (un mes) y clozapina 100 mg (por seis meses), sin control sintomático significativo. Todos los tratamientos fueron suspendidos debido a falta de respuesta o por efectos secundarios significativos. Ella se mantuvo con dosis diarias de fenitoína de 300 mg desde 1993, fenobarbital 150 mg desde 1994, paroxetina 20 mg desde 1997, olanzapina desde 1998 y nefazodona 300 mg desde 1998, con persistencia de conductas de autolesión desde 1995. A partir de 1998, se inició alopurinol, 300 mg/día, vía oral. Luego de dos días de tratamiento la paciente y sus familiares reportaron una marcada mejoría en el control de sus síntomas, principalmente, conductas autolesivas, ansiedad, agitación y sueño, sin efectos secundarios. Antes de emplear alopurinol, el puntaje promedio en las escalas de agresividad (Modified Overt Aggression Scale OASM) fue de 219 (72 contra ella misma). La paciente mantuvo su conducta estable durante siete meses, a pesar de presentar hemiparesia a causa de la progresión del tumor, con puntajes semanales de OASM de 50 (3 contra ella misma y 32 en agresión verbal).
El segundo paciente descrito es un hombre caucásico de 27 años, con retardo mental grave y ceguera se cundaria a meningitis, un mes luego de su nacimiento. Había presentado conductas agresivas desde la pubertad, sin mejoría significativa, a pesar de dosis hasta 800 mg de carbamacepina (por tres años), clorpromazina hasta 800 mg/día (por dos años), haloperidol 25 mg/día (por dos años) y fenobarbital 150 mg/día (por seis años). Antes de iniciar alopurinol 300 mg/día, vía oral, estaba medicado con haloperidol 15 mg/día, clorpromacina 200 mg y fenobarbital 150 mg, con puntajes promedios con la escala de agresividad OASM de 147, durante al menos cuatro semanas, con agresividad hacia su padre y objetos de su hogar. El paciente no presentó conductas agresivas durante cinco meses (OAS de 0) desde que se le inició alopurinol. Sus padres reportaron marcada mejoría en ansiedad, sociabilidad y sueño, sin efectos secundarios.
Los indicios más importantes sobre el papel de las purinas en conductas autolesivas en humanos, proviene de pacientes con síndrome de LeschNyhan causado por deficiencia en la enzima hipoxantinaguaninafosforibosiltransferasa (HGPRT), la principal enzima en las vías de salvamento de las purinas y que puede presentarse por una deficiencia completa o parcial. Aquellos con actividad enzimática mayor de 10% con relación a lo normal, no presentan manifestaciones neurológicas, aunque grados leves de ésta, pueden resultar en cifras preocupantes de hiperuricemia. Las características más sobresalientes son: retardo mental, coreoatetosis e hiperuricemia. Téngase en cuenta que el alopurinol es efectivo sólo para el manejo de los efectos secundarios de la hiperuricemia, como nefrolitiasis y gota, ya que las vías de salvamento de las purinas permanecen bloqueadas, debido a ausencia de la enzima (HGPRT); pues se muestra inefectivo en las manifestaciones neurológicas y conductuales de la enfermedad (10).
En pacientes sin dicha deficiencia (como el descrito inicialmente), el alopurinol puede producir acumulación de otras purinas (por ejemplo, adenosina) y mejorar conductas autolesivas (1).
Dentro de los autistas existe un subgrupo que presenta un aumento en la excreción de ácido úrico por encima de lo normal (definido como una excreción por encima de dos desviaciones estándar sobre el promedio). Estos individuos hipericosúricos podrían incluir a un 20% del total de la población de autistas. Dicha patología, llamada autismo por purinas (purine autism), fue caracterizada en la década de los setenta por un investigador, quien notó concentraciones elevadas de ácido úrico en la orina de ciertos pacientes. Aunque no se han identificado deficiencias enzimáticas específicas, hay pruebas de valores anormalmente elevados en la síntesis de purinas intracelulares, como muestra la proporción anormal entre adenina:guanina, que sugiere un defecto en la interconversión de nucleótidos de purina (7).
Page y Moseley (8) describieron un sujeto con autismo hipericosúrico, quien fue tratado durante dos años con dosis de uridina oral, con aumentos de 50 a 500 mg/kg/día. Este paciente mostró mejorías sociales, cognoscitivas, motoras y del lenguaje, que disminuyeron 72 horas después de suspender la uridina, pero reaparecieron cuando el suplemento se reinició. Los autores sugieren que pacientes con autismo hipericosúrico se pueden beneficiar con terapia metabólica con uridina oral, de manera similar a otras patologías del metabolismo de las purinas con síntomas autistas.
En consecuencia, la uridina es un precursor esencial para la síntesis de ARN y también de ADN para otras funciones celulares. La mitocondria es la única fuente humana conocida para su producción; por ello se emplea en la terapia de varias patologías mitocondriales (11).
Dentro de las regiones cromosómicas más interesantes, en cuanto a posible etiología del autismo se han localizado los cromosomas 7, 15 y 16; además, el cromosoma 22q13.1 se sugiere como portador de un posible candidato, por un punto de mutación en el gen de la adenilo succinato liasa (ADSL), enzima esencial para la síntesis de novo de purinas (12).
Lo anterior muestra un potencial beneficio terapéutico en la población autista, o al menos en un subgrupo de pacientes con hiperuricemia, cuando se modifican las vías metabólicas de las purinas. No existen estudios que muestren si el tratamiento con alopurinol en pacientes autistas con conductas agresivas sea benéfico. Tampoco se sabe si quienes presentan hiperuricemia responderán de forma más o menos adecuada; se parte del supuesto de que un metabolismo anómalo de las purinas, con expresión en forma de hiperuricemia, pueda ser de los más beneficiados con el tratamiento.
Dentro de la práctica clínica no se dispone de agonistas directos de adenosina. Por consiguiente, la inhibición de la degradación de purinas, por medio del alopurinol, parecería ser una posibilidad terapéutica en este grupo de pacientes, con las ventajas de ser bien tolerado, fácil de dosificar y con rápido inicio de acción. Teniendo en cuenta el modelo purinérgico de la esquizofrenia, se ha observado una mejoría similar en los índices de hostilidad y agresión en pacientes esquizofrénicos refractarios a antipsicóticos típicos, mediante el empleo de alopurinol (1). Las dosis utilizadas de este medicamento no difieren de las terapéuticas para la hiperuricemia, es decir, 300 mg/día vía oral.
En conclusión, deberían realizarse estudios controlados para determinar la utilidad clínica del alopurinol en el subgrupo de pacientes autistas con conductas agresivas y hostiles, refractarios a terapias convencionales; ampliar el conocimiento de los defectos o mecanismos bioquímicos implicados en ciertas manifestaciones conductuales en la población con autismo; dar luces sobre si realmente este subgrupo de pacientes representa formas de autismo 'secundario', no extrapolable al resto de los pacientes con autismo, y aclarar si la hiperuricemia constituye el fenotipo de un(os) defecto(s) genético(s), dentro de los descritos (12), como las regiones cromosómicas 7q3135, 15q1113 y 16p13.3 en el autismo.
Bibliografía
1. Lara DR, BelmontedeAbreu P, Souza DO. Allopurinol for refractory aggression and selfinflicted behaviour. Jou of Psych 2000; 14(1): 813. [ Links ]
2. Ralevic V, Burnstock G. Receptors for purines and pyrimidines. Pharmac Rev 1998; 50: 41392. [ Links ]
3. Ginsberg DL. Column Psychopharmacology Jou Watch Prim Psych 2000; 7(5): 137. [ Links ]
4. Ledent C, Vaugeois JM, Schiffmann SN et al. Aggressiveness, hypoalgesia and high blood pressure in mice lacking the adenosine A2A receptor. Nature 1997; 388: 6748. [ Links ]
5. Brundege JM, Dunwiddie TV. Role of adenosine as modulator of synaptic activity in the central nervous system. Adv Pharmac1997; 39: 391. [ Links ]
6. Ushijima I, Katsuragi T, Furukawa T. Involvement of adenosine receptor activities in aggressive responses produced by clonidine in mice. Psychopharmacology 1984; 83: 3359. [ Links ]
7. Page T, Coleman M. Purine metabolism abnormalities in a hypericosuric subclass of autism. Biochi et Biophy Acta Molec Basis of Dis 2000; 1500(3): 2916. [ Links ]
8. Page T, Moseley C. Metabolic Treatment of hypericosuric autism. Prog in Neuro Psychophar Bio Psy 2002; 26(2): 397400. [ Links ]
9. Wilcox, W. D. Abnormal serum uric acid levéis in children. The Jou of Pediat 1996; 28: 73141. [ Links ]
10. Nyhan WL, Wong DF. New approaches to understanding LeschNyhan disease. The New Eng Jou of Med 1996; 334(24):16024. [ Links ]
11. Repligen Licenses Patent Rights for Treatment of Mitochondrial Disorders And Purine Autism from University of California, San Diego. PR Newswire; New York; Dec 14, 2000. [ Links ]
12. Lauritsen MB, Ewald H. The genetics of autism (review article). Acta Psychiatr Scand 2001; 103: 41127. [ Links ]














