Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Psiquiatría
versão impressa ISSN 0034-7450
rev.colomb.psiquiatr. v.32 n.3 Bogotá jul./set.. 2003
Artículo original
El uso de endofenotipos en el estudio del componente genético de la esquizofrenia
THE USE OF ENDOPHENOTYPES IN THE STUDY OF THE GENETIC COMPONENT IN SQUIZOPHRENIA
Ana Lucía Miranda1, Carlos López Jaramillo2, Jenny García Valencia3, Jorge Ospina Duque4
1 M. D. Profesora de la Facultad de Medicina, Universidad de Antioquia.
2 M. D. Psiquiatra, docente de la Facultad de Medicina, Universidad de Antioquia.
3 M. D. Psiquiatra, docente de la Facultad de Medicina, Universidad de Antioquia.
4 M. D. Psiquiatra, docente de la Facultad de Medicina, Universidad de Antioquia.
Programa de Investigación en Psiquiatría Genética, Departamento de Psiquiatría y Laboratorio de Genética Molecular.
Resumen
Se revisa el concepto de endofenotipo, desde su origen histórico hasta su concepción actual. Además, se hace una aproximación a la metodología utilizada para la detección y validación de un endofenotipo, y se analizan las ventajas que ofrecen éstos en el estudio del componente genético de las enfermedades psiquiátricas, específicamente en la esquizofrenia.
Palabras clave: endofenotipo, genética, esquizofrenia.
Abstract
A review of the concept endophenotype from its historical origins to its actual conception is made. Besides, an approximation to the methodology used for detecting and validating an endophenotype and its advantages for studying the genetic component of psychiatric diseases, specifically schizophrenia, is performed.
Key words: Endophenotype, genetics, schizophrenia.
Introducción
Se ha demostrado, por un siglo de investigaciones en epidemiología genética, que los genes desempeñan un papel importante en la etiología de la esquizofrenia; sin embargo, no ha sido posible determinar específicamente cuáles son lo que participan en la fisiopatología de este síndrome debido a sus características clínicas, neurobiológicas y genéticas (1),(2).
Es bien conocida la gran variedad de manifestaciones clínicas de la esquizofrenia, que es el reflejo de complejos mecanismos neurobiológicos, resultado de la expresión de múltiples genes y de la interacción entre ellos y de éstos con el ambiente (1),(3). Debido a esta complejidad, ha sido necesario desarrollar diversas tecnologías y metodologías de análisis en varios ámbitos, que comprenden desde estrategias para refinar el fenotipo hasta aquellas que involucran análisis de la expresión génica en cerebros de pacientes (4),(5).
En los estudios de búsqueda de genes de enfermedades complejas, como la esquizofrenia, un paso fundamental es la depuración del fenotipo, lo cual implica delimitar uno específico para evaluarlo con la mayor objetividad y precisión (6). Para garantizar que esto se cumpla existen los criterios diagnósticos mundialmente aceptados DSM y CID y las diferentes estrategias para garantizar su adecuado uso (4). Así, de la eficaz depuración del fenotipo depende en gran parte el éxito del mapeo de genes.
Estos esfuerzos han contribuido a una mejor comprensión de los aspectos epidemiológicos y clínicos de la esquizofrenia, pero no han permitido establecer con claridad ninguna asociación genética que utilice como fenotipo el síndrome completo esquizofrenia, según los criterios diagnósticos estándar (7).
Por estas dificultades en la definición del fenotipo más apropiado para los estudios de genética, los expertos se reunieron en la Universidad de Rockefeller, en el 2000, para realizar un taller de trabajo titulado Phenotypes and Genetic Analysis of Psychiatric and Neuropsychiatric Traits, con el objetivo de examinar la definición de fenotipo de los caracteres complejos, especialmente de los rasgos psiquiátricos y neuropsiquiátricos. En esta reunión hubo un particular interés en el uso de fenotipos alternativos o endofenotipos en el estudio de las enfermedades psiquiátricas (8).
Dado que son muchas las investigaciones que los han utilizado y que muestran resultados promisorios, en este artículo se hará una revisión del uso de endofenotipos en el estudio del componente genético de la esquizofrenia.
El concepto de endofenotipo El concepto de endofenotipo es el resultado de una serie de sucesos Endofenotipos en esquizofrenia históricos que inician en el siglo XIX cuando Morel, en 1957, introduce el concepto de vulnerabilidad, quien la describe como un “terreno frágil” que era transmitido en forma hereditaria y que junto con el grado de ‘degeneración’ presente en un individuo conducía a la aparición de las enfermedades mentales (9).
En 1919, Dupré afirma que la variación en la presentación clínica de la psicosis se debía a factores hereditarios; entonces las diferentes constituciones hereditarias eran factores decisivos para el tipo de enfermedad que aparecía (9).
Después, Rado, en 1956, habla de que la interacción de un genotipo específico con el ambiente originaba un tipo de personalidad que podía ser considerada esquizotipia y que influía en el inicio de la esquizofrenia (9).
En 1962, Meehl introdujo el término esquizotaxia para denominar la predisposición genética a la esquizofrenia, conceptualizada como defectos integrativos neurales no expresados. Este investigador sugirió que la esquizotaxia podía llevar en la mayoría de los casos a esquizotipia o esquizofrenia o no desencadenar en ninguna de ellas, dependiendo de los factores ambientales a que se viera expuesto el individuo.
El punto de vista de esquizotipia de Meelh entró a al nomenclatura psiquiátrica como trastorno de personalidad esquizotípico, pero el concepto de esquizotaxia no (10).
Esta hipótesis ha sido respaldada por la investigación en genética, que indica que el “genotipo de esquizofrenia” puede permanecer sin expresarse, pero puede ser transmitido y expresarse como tal en la siguiente generación.
Rosenthal, basado en esta observación, en 1970 elabora su modelo diátesis-estrés, que indica que una predisposición constitucional inherente se manifiesta sólo bajo el impacto del estrés ambiental (9).
Zubin y Spring, en 1977, retomaron el término vulnerabilidad en su modelo estrés-vulnerabilidad, en el cual afirmaron que una predisposición particular continua permitía la manifestación de episodios psicóticos, pero que esa predisposición no era necesariamente genética (9).
En 1985 apareció el modelo interaccionista, de Warner, quien establece la diferencia entre vulnerabilidad y predisposición. Él se refiere a la primera como un riesgo aumentado de manifestar la enfermedad, lo cual es determinado por la influencia de eventos que ocurren después del período prenatal y perinatal en individuos con predisposición (9). Para Warner, la predisposición se refiere a la disfunción fundamental de la enfermedad y por eso alude a los factores genéticos.
Entonces, la vulnerabilidad se refiere al riesgo aumentado de sufrir la enfermedad como resultado de la interacción de los factores genéticos propios del individuo y su exposición a estresores ambientales. Además, ésta puede expresarse en diferentes funciones: bioquímica, neurofisiológica, neuroanatómica o neuropsicológica.
Todas estas formas de expresión se consideran indicadores o marcadores de vulnerabilidad, los cuales han recibido varias clasificaciones. Nuechterlein distingue tres tipos de indicadores de vulnerabilidad (9):
- Estables: son anormalidades presentes antes, durante y después de episodios psicóticos.
- Mediadores: son permanentes, pero covarían con el grado de sintomatología presente.
- Episódicos: que sólo se perciben durante los episodios psicóticos.
Sfarti y Harcy Baylé proponen que existen dos formas de comprender los marcadores de vulnerabilidad desde un punto de vista amplio y desde un punto de vista estrecho (11). En el primer sentido es cualquier manifestación que indique aumento de la probabilidad de sufrir una enfermedad; esto involucra entonces gran cantidad de manifestaciones, que en el caso de la esquizofrenia puede incluir adicción a drogas, aislamiento social, deterioro en el desempeño académico, etc. En consecuencia, los marcadores de vulnerabilidad en sentido amplio no son específicos y son determinados por múltiples factores; por lo tanto, su asociación con la enfermedad es sólo generalmente estadística.
Desde un punto de vista restringido, un marcador de vulnerabilidad tiene que cumplir ciertas condiciones para ser considerado como tal: ser específico, heredable, estable y replicable.
Los marcadores de vulnerabilidad estables propuestos por Neuchterlein y los indicadores de vulnerabilidad tomados en sentido restringido, propuestos por Sfarti y Harcy Baylé, son los llamados actualmente endofenotipos (12), (13),(14).
Los endofenotipos corresponden a las alteraciones en las funciones bioquímicas, neurofisiológicas, neuroanatómicas o cognitivas, que están determinadas por factores genéticos y ambientales y que en conjunto muestran los procesos fisiopatológicos subyacentes a la enfermedad, y son la expresión de la vulnerabilidad. Por lo tanto, su presencia indica un riesgo aumentado de manifestar la enfermedad (15).
Cómo se identifica y se evalúa un endofenotipo
Basados en la revisión hecha hasta el momento, un endofenotipo válido implica un mecanismo bioquímico, neurofisiológico, neuroanatómico o neuropsicológico que cumpla con los criterios de heredabilidad, estabilidad, especificidad y replicabilidad. Así, para comprender cómo se evalúa la heredabilidad debemos empezar por entender cómo se comportan los factores genéticos en la esquizofrenia, es decir, cuál es su patrón de herencia.
De acuerdo con los estudios de concordancia gemelar y de adopción, tanto en los cálculos de riesgo relativo y de heredabilidad como en los análisis de segregación, la esquizofrenia sigue un patrón de herencia multifactorial (16).
El patrón de herencia multifactorial es el que presentan aquellos fenotipos cuantitativos, resultado de la expresión de varios genes que aportan cada uno un pequeño efecto y que interactúan entre sí (epistasia) y con el ambiente. La mayoría de los rasgos normales (por ejemplo: peso, talla, IQ, etc.) y las enfermedades más comunes (por ejemplo: hipertensión, asma, trastornos del comportamiento) siguen este patrón (16).
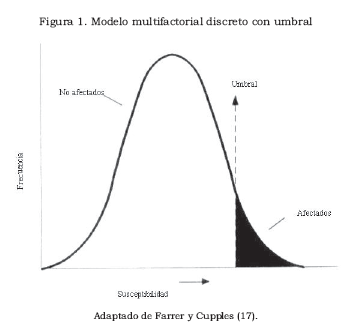
Existen varios modelos para explicar las relaciones entre los múltiples genes y los factores ambientales que originan la manifestación de los fenotipos multifactoriales. Uno de ellos es el modelo discreto con umbral, que parece ser el que mejor explica al fenotipo esquizofrenia. Está representado por una curva continua donde se distribuye la susceptibilidad genética al fenotipo en la población general —la menor susceptibilidad está en el extremo izquierdo y la mayor susceptibilidad, en el extremo derecho—. El punto en que la combinación de los factores genéticos y ambientales da lugar a la aparición del fenotipo se considera un umbral. Los individuos afectados aparecen después del umbral en el extremo derecho, al final de la curva de distribución, tal como se puede ver en la Figura 1 —donde la susceptibilidad a la enfermedad esta distribuida normalmente, con un umbral que divide la población en un grupo afectado y otro no afectado— (17),(18).
El comportamiento de la susceptibilidad genética con este modelo permite hacer varias predicciones acerca de la probabilidad de que un individuo presente la enfermedad (17),(18):
- Cuantos más genes se compartan con un individuo afectado, es decir, mientras más cercano sea el parentesco, mayor probabilidad de presentar la enfermedad.
- Cuanto más grave sea la enfermedad, más riesgo tienen los individuos de la misma familia de manifestar la enfermedad.
- Cuanto más individuos afectados haya en las familias, los individuos no afectados tienen más riesgos de sufrirla.
La determinación exacta de qué tanto aporta el componente genético y qué tanto el componente ambiental en la expresión de los fenotipos multifactoriales parece imposible, pero existen aproximaciones, como lo es el cálculo de la heredabilidad.
Dado que la varianza total de un fenotipo multifactorial (s2T) está compuesta por un componente genético (s2G) y por otro no genético (s2E), se puede hacer una proporción entre el primer componente y la varianza total del fenotipo para determinar su aporte. Esta proporción corresponde a la heredabilidad h2=s2G/s2T y se expresa en porcentaje.
Por lo tanto, cuanto mayor sea el valor de h2, mayor es la contribución genética a la etiología, de aquí que los fenotipos monogénicos o mendelianos tengan heredabilidades mayores o iguales a 0,1 o 100% y los fenotipos multifactoriales presenten heredabilidades menores de 0,1 (19).
La heredabilidad también puede ser vista como el grado de semejanza entre familiares, y esto se puede calcular utilizando una correlación entre parientes. Para evitar los sesgos por ambiente compartido es recomendable hacer los cálculos de heredabilidad entre individuos de diferente parentesco (por ejemplo, padre-hijo, madre-hijo, ambos padres- hijo, nieto-abuelo, tío-sobrino). Cuanto mayor sea la correlación, mayor es la heredabilidad (20).
Por lo tanto, para calcular la heredabilidad de un endofenotipo deben recolectarse individuos afectados y a sus familias. Las que son informativas para los estudios de los endofenotipos son grandes familias extendidas que no son recolectadas a partir de individuos afectados, es decir, las mejores familias pueden ser aquellas que tienen uno o dos afectados, pero muchos individuos no afectados. Esto debido a que, primero, es muy difícil en términos de tiempo y costos recolectar familias con múltiples individuos afectados y, segundo, para los endofenotipos tanto los individuos esquizofrénicos como no esquizofrénicos son informativos para el análisis, porque ambos presentan el endofenotipo (12).
Cuando en la literatura médica se refieren a la heredabilidad como un criterio para la validación de un endofenotipo, parece en realidad que están aludiendo a que éste debe tener un componente genético que se transmita y no tanto a la heredabilidad en sentido estricto; ya que esta medida no es estática o única para un determinado rasgo, porque está influida por un factor variable, que es el ambiente, y por lo tanto cuando se calcula su valor, éste es válido sólo para la población, el entorno y el momento en que se hizo (20).
La presencia de un componente genético cuantitativo en el endofenotipo se puede sospechar si éste cumple con las predicciones del modelo discreto con umbral, como las que aparecen a continuación y que se vienen evaluando en los diferentes estudios que buscan demostrar la utilidad de endofenotipos específicos:
- El endofenotipo debe estar presente en los familiares de alto riesgo genético, es decir, los familiares de primer grado de un individuo esquizofrénico. Mientras más lejano sea el parentesco, menor la probabilidad de que posean el endofenotipo (7).
- Si la disfunción neuropatológica es un verdadero endofenotipo, debe ser un buen predictor de la aparición de la enfermedad, lo cual se viene evaluando en los estudios a largo plazo de Edimburgo y Nueva York (21), (22).
- Mientras más esquizofrénicos haya en las familias, más susceptibilidad genética hay y por lo tanto el endofenotipo se expresa de forma más grave en los individuos no afectados. Para evaluar la estabilidad de un marcador de vulnerabilidad se requieren estudios longitudinales que permitan verificar que el endofenotipo esté presente antes, durante y después del desarrollo de los episodios agudos de la enfermedad. Además, deben realizarse estudios para evaluar el efecto de la medicación en el endofenotipo, el cual no debe desaparecer (21),(22).
La especificidad se evalúa buscando la presencia del endofenotipo en los individuos esquizofrénicos, en individuos controles y en individuos con otras patologías psiquiátricas, aunque si el marcador de vulnerabilidad es un endofenotipo, debe ser específico de los pacientes esquizofrénicos (23),(24).
La replicabilidad se logra en la medida en que los endofenotipos sean fácilmente medibles y que existan estrategias estándar para su evaluación (2).
Una vez sea determinada la validez del endofenotipo y su relación con el fenotipo sea bien establecida, el siguiente paso es localizar los genes que influyen en el endofenotipo e identificar las partes biológicas en las que están involucrados, para lo cual resultan muy útiles los modelos murinos; es más, el reto actual en el análisis de fenotipos de roedores es identificar aquellas características que correspondan a endofenotipos en humanos (12),(25).
Ventajas del uso de los endofenotipos en los estudios de mapeo de genes susceptibilidad
Debido a la complejidad cerebral y a las dificultades para el acceso directo a las vías neuronales, es difícil el estudio de los aspectos biológicos de las enfermedades psiquiátricas.
Los modelos animales pueden ayudar a sugerir ciertos mecanismos candidato de enfermedades psiquiátricas, pero su validación en los estudios humanos continúa siendo un problema (26).
El análisis de ligamiento genético ha permitido el descubrimiento de genes relacionados con enfermedades sin tener una clave biológica de su función y simplemente por la identificación de áreas del genoma humano que contengan genes que participen en la enfermedad (26).
Estas estrategias han mostrado ser muy útiles para el estudio de enfermedades causadas por el efecto de un gen mayor, idea que ya ha sido refutada para la esquizofrenia, en la cual es más probable que existan muchos genes implicados cada uno con un efecto pequeño (2).
Por lo tanto, la más urgente necesidad para los estudios de mapeo de genes de susceptibilidad a esquizofrenia es implementar métodos que mejoren el poder de detección de genes de pequeño efecto. El poder estadístico, es decir, la probabilidad de detectar la asociación genética de estos estudios, depende sobre todo del tamaño de la muestra y de la definición adecuada del fenotipo que va a ser estudiado. Ambos aspectos pueden ser mejorados utilizando los endofenotipos en los estudios de genética, y esto constituye la principal justificación de su uso (2).
El uso de endofenotipos disminuye el tamaño de la muestra requerido porque aumenta el número de individuos útiles para el estudio
El poder para los análisis genéticos de ligamiento se incrementa enormemente cuando pueden utilizarse todos los individuos de la familia, porque se tiene certeza de su estado de afección, es decir, porque se sabe con claridad quiénes están afectados y quiénes no. Lo anterior no es lo más frecuente en los estudios de genética de la esquizofrenia, ya que para esta enfermedad se pueden utilizar esquemas diagnósticos para determinar si un individuo está afectado y, por lo tanto, si porta un gen de susceptibilidad; pero no es posible determinar si un individuo no afectado tiene un genotipo normal o anormal.
Se ha estimado que debido a este inconveniente se necesitan cientos de familias para lograr que un estudio de análisis genético tenga suficiente poder para detectar genes relacionados con la esquizofrenia, cuando se considera ésta como fenotipo.
En caso contrario, cuando se utiliza un endofenotipo, es posible determinar cuáles individuos no afectados pueden portar un genotipo anormal, ya que la presencia del endofenotipo indica susceptibilidad genética y esto permite utilizar más individuos de la familia con certeza de su estado de afección, hecho que aumenta el poder del estudio porque disminuye el número de familias requeridos (26).
Los endofenotipos permiten una mejor definición del fenotipo por tres razones
En primer lugar, reflejan mejor el efecto de los genes implicados que el fenotipo esquizofrenia. Uno de los obstáculos para la comprensión de la etiología de la esquizofrenia puede ser la conceptualización de la enfermedad utilizando criterios diagnósticos. El DSM y otras nosologías proporcionan fundamentación para diagnósticos clínicos, pero varios investigadores han afirmado que hay pocas bases para afirmar que las definiciones operacionales del DSM corresponden a una verdadera noción de la esquizofrenia. Las limitaciones de los criterios actuales comprenden (10):
- La consideración de la esquizofrenia como un carácter discreto: aquel individuo que no cumpla con los criterios diagnósticos no se considera enfermo y lo contrario para el que sí los cumpla. Esto está en desacuerdo con lo que muestran las investigaciones en genética, en las cuales la esquizofrenia es una entidad multifactorial, donde mutaciones en múltiples genes, que combinan su efecto uno con otro y con los factores ambientales, originan la presentación de la enfermedad. Desde este punto de vista se explica que existen personas con baja, moderada o alta dosis de susceptibilidad genética para esquizofrenia y, por lo tanto, se observa un espectro de manifestaciones de tal forma que puede decirse que aquellos que tengan alta susceptibilidad genética presentan esquizofrenia; los que tienen dosis moderada, algún trastorno de personalidad del espectro esquizofrénico, y los de baja dosis, algún deterioro neuropsicológico, que sería un endofenotipo.
- El hacer hincapié en la psicosis como elemento central del diagnóstico: varias pruebas muestras que la psicosis es la “fiebre de las enfermedades mentales”, es decir, un indicador serio pero inespecífico y que ésta es un estado final del conjunto de alteraciones presentes en la enfermedad. Además, se ha observado que en los familiares no afectados de primer grado de individuos esquizofrénicos son muy pocos frecuentes los síntomas positivos, es decir, que si aquellos individuos con alto riesgo no presentan psicosis o anormalidades relacionadas con ella, ésta no es un buen indicador de susceptibilidad genética (27).
- El uso de características descriptivas más que empíricas: el DSM no está basado en hallazgos empíricos relacionados con la etiología, sino en la descripción de síntomas.
Como consecuencia de estas limitaciones, los criterios diagnósticos no proporcionan información acerca de la etiología o fisiopatología de la enfermedad y, por lo tanto, están lejos de permitir la comprensión los mecanismos genéticos subyacentes (10).
Por el contrario, los endofenotipos son cuantitativos, están basados en observaciones experimentales y reflejan mejor el efecto de los genes implicados, debido a que son la manifestación más próxima de la vulnerabilidad (15).
En segundo lugar, los endofenotipos son medidas cuantitativas más que cualitativas. Si el modelo de transmisión de la esquizofrenia más probable es un modelo multifactorial —el cual explica la trasmisión de caracteres cuantitativos—, es necesario cuantificar el fenotipo esquizofrenia para tener más probabilidad de comprender los factores genéticos subyacentes. Dado que los criterios diagnósticos muestran a la esquizofrenia como una variable discreta, ese fenotipo no es el más adecuado para los estudios genéticos. Los endofenotipos muestran la posibilidad de contribuir a la solución de este inconveniente, ya que son anormalidades neurobiológicas que sí pueden ser medibles como las alteraciones anatómicas, bioquímicas, neurofisiológicas y neuropsicológicas (15). De este modo, si cada una de éstas nos habla de una parte del déficit en la enfermedad, entonces debemos enfocarnos en el estudio de su componente genético por separado y luego de la suma del afecto de cada uno de los genes, que podría permitir explicar la fisiopatología general (26). O, al contrario, la comprensión de los mecanismos moleculares de las anormalidades Endofenotipos en esquizofrenia neurobiológicas permitiría comprender la participación de los factores genéticos en la esquizofrenia.
En tercer lugar, los endofenotipos pueden tener mecanismos genéticos más simples
Algunos autores consideran que éstos pueden explicarse por el efecto de genes únicos, lo que permite una más fácil detección de sus factores genéticos subyacentes. Esto ha sido respaldado por algunos hallazgos empíricos, como lo que sucede con las alteraciones del umbral P50, uno de los endofenotipos más estudiados en esquizofrenia. Se ha observado que los individuos esquizofrénicos presentan dificultades en la inhibición de estímulos auditivos (uno de ellos es la anormalidad P50) y este proceso inhibitorio tiene lugar en el lóbulo temporal y es potenciado por mecanismos colinérgicos (1). La anormalidad P50 ha sido propuesta como un endofenotipo y según los estudios de análisis de ligamiento y los ratones knockout, el gen del receptor alfa 7 nicotínico parece ser el principal responsable de esta alteración (28). Adicionalmente, se han desarrollado varios modelos murinos que reproducen alteraciones del comportamiento por mutaciones en genes únicos (25).
Sin embargo, otros investigadores consideran que debido a la complejidad de los mecanismos cerebrales es poco probable que una alteración neurobiológica represente el efecto de un gen único. Ellos argumentan que lo que realmente sucede en los modelos murinos que reproducen alteraciones cognitivas por defectos en genes únicos es que la mutación en un gen causa un déficit porque origina una acción en cadena determinada por la expresión de muchos genes (29).
En resumen, debido a las dificultades en el estudio del componente genético de la esquizofrenia causada por su complejidad clínica y neurobiológica, han surgido nuevas estrategias de aproximación que buscan simplificar el panorama y así lograr resultados contundentes.
Una de tales aproximaciones es el uso de endofenotipos, los cuales son la manifestación de la vulnerabilidad a la enfermedad a en varios aspectos dentro del perfil fisiopatológico de la enfermedad y que, por lo tanto, permiten una mejor aproximación a la comprensión de los mecanismos genéticos subyacentes. La validación de un endofenotipo requiere gran trabajo, pero su aporte al aumento de poder de los estudios en genética justifica su exploración.
Bibliografía
1. Pearlson G. Neurobiology of schizophrenia. Ann Neurol 2000;48:556-66. [ Links ]
2. Tsuang M, Faraone S. The frustrating search for schizophrenia genes. Am J Med Gen 2000;97:1-3. [ Links ]
3. Sadock B, Sadock V. Schizoprenia. Comprenhensive textbook of psychiatry. New York: Lippincott Williams Wilkins; 2000. [ Links ] 4. Lenzenwerger M. Schizophrenia: refining the phenotype, resolving endophenotypes. Behavioral Research and Therapy 1999;37:281-95. [ Links ]
5. Hakak Y, Walker J, Li C, Wong WH, Davis KL, Buxbaum JD, et al. Genome-wide expression analysis reveals dysregulation of myelination-related genes in chronic schizophrenia. Proc Natl Acad Sci 2001;98(8):4746-51. [ Links ]
6. Hannies J, Pericak-Vance M. Overview of mapping common and genetically complex human disease traits. In: Haines J, Pericak-Vance M, editors. Approaches to gene mapping in complex human disease. New York: Jonh Wiley & Sons; 1998. p. 1-16. [ Links ]
7. Faraone S, Seidman L, Kremen W, Toomey R, Pepple JR, Tsuang MT. Neuropsychologic functioning among the nonpsychotic relatives of schizophrenia patients: the effect of genetic loading. Biol Psychiatry 2000;48:120-6. [ Links ]
8. Leal S. Phenotypes and genetic analysis of psychiatric and neuropsychiatric traits. Am J Med Genet 2001;105:4-7. [ Links ]
9. Berner P. Conceptualization of vulnerability models for schizophrenia: historical aspects. Am J Med Genet 2002;114: 938-42. [ Links ]
10. Tsuang M, Stone W, Faraone S. Toward reformulating the diagnosis of schizophrenia. Am J Psychiatry 2000;157(7): 1041-50. [ Links ]
11. Sarfati Y, Hardy-Baylé M. Could cognitive vulnerability identify high-risk subjetcs for schizophrenia? Am J Med Genet 2002; 114:893-7. [ Links ]
12. Almasy L, Blangero J. Endophenotypes as quantitative risk factors for psychiatric disease: rationale and study desing. Am J Med Genet 2001;105:42-4. [ Links ]
13. Lenox R, Gould T, Manji H. Endophenotypes in bipolar disorder. Am J Med Genet 2002;114:391-406. [ Links ]
14. Skuse D. Endophenotypes and child psychiatry. Br J Psychiatry 2001;178: 395-6. [ Links ]
15. Cannon T, Gasperoni T, Van Erp T, Rosso IM. Quantitative neural indicators of liability to schizophrenia: implication for molecular genetics studies. Am J Med Genet 2001;105:16-9. [ Links ]
16. Stratchan T, Read A. Complex diseases: theory and results. In: Stratchan T, Read A, editors. Human Molecular Genetics. New York: Wiley-Liss; 1999. p. 445-64. [ Links ]
17. Farrer L, Cupples A. Determining the genetic component of a disease. In: Haines J, Pericak-Vance M, editors. Approaches to gene mapping in complex human diseases. New York: John Wiley & Sons; 1998: 93-130. [ Links ]
18. Sack H. Aspectos genéticos de las enfermedades comunes. In: Sack G, editor. Genética médica. México: McGraw-Hill; 1999. p. 195-210. [ Links ]
19. Zabala C. Interacción genético ambiental de las enfermedades hereditarias. In: Guízar-Vázquez J, editor. Genética clínica. Diagnóstico y manejo de las enfermedades hereditarias. México: Manual Moderno; 2001. p. 251-8. [ Links ]
20. Falconer D, Mackay T. Heritability. In: Falconer D, Mackay T, editors. Introduction to quantitative genetics. Malaysia: Prentice Hall; 1996. p. 160-83. [ Links ]
21. Johnstone E, Lawrie S, Cosway R. What does the Edinburgh high-risk study tell us about schizophrenia. Am J Med Genet 2002;114:906-12. [ Links ]
22. Ott S, Allen J, Erlenmeyer-Kimling L. The New York High-Risk Proyect: observations on the rating of early manifestations of schizophrenia. Am J Med Genet 2001; 105: 25-7. [ Links ]
23. Egan M, Goldberg T, Gscheidle T, Weirich M, Rawlings T, Hyde TM. Relative risk for cognitive impairments in siblings of patients with schizophrenia. Biol Psychiatry 2001;50:98-107. [ Links ]
24. Ross R, Olincy A, Harris J, Sullivan B, Radant A. Smooth pursuit eye movements in schizophrenia and attention dysfunction: adults with schizophrenia, ADHD, and a normal comparison group. Biol psychiatry 2000;48:197-203. [ Links ]
25. Tarantino L, Bucan M. Dissection of behavior and psychiatry disorders using the mouse as a model. Hum Mol Genet 2000;9(6):953-65. [ Links ]
26. Freedman R, Adler L, Leonard S. Alternative phenotypes for the complex genetics of schizophrenia. Biol Psych 1999;45:551-8. [ Links ]
27. Tsuang M, Stone W, Tarbox S. Treatment of nonpsychotic relatives of patients with schizophrenia: six case studies. Am J Med Gen 2002;114:943-8. [ Links ]
28. Freedman R, Coon H, Myles-Worsley M, Orr-Urteger A, Olincy A, Davis A, et al. Linkage of a neurophysiological deficit in shiczophrenia to a chromosome 15 locus. Proc Natl Acad Sci 1997;94: 587-92. [ Links ]
29. Karmiloff-Smith A, Scerif G, Thomas M. Different approaches to relating genotype to phenotype in developmental disorders. Devel Psychobiology 2002; 40:311-22. [ Links ]