Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.33 no.1 Bogotá Jan./Mar. 2004
Artículo de revisión / actualización
Evaluación clínica del hipersomnio
Clinical Evaluation of Hypersomnia
Heydy Luz Chica Urzola1, Franklin Escobar Córdoba2, Jorge Echeverry Chabur3
1 Residente de primer año del Departamento de Psiquiatría, Facultad de Medicina, Universidad Nacional de Colombia. 2 Profesor asociado de Psiquiatría, Facultad de Medicina, Universidad Nacional de Colombia. 3 Profesor asociado, director del Departamento de Psiquiatría de la Facultad de Ciencias de la Salud, Programa de Medicina, Universidad Tecnológica de Pereira. Laboratorio de Sueño del Hospital Universitario San Jorge, Pereira, Colombia.
Resumen
En la actualidad está esclarecida parcialmente la fisiología del sueño y su sustrato neuroanatómico. Se conocen las modificaciones que sufre, pero no su función; por ello se postula que sus dos principales papeles son reparar y regular el sistema nervioso central y otras estructuras del cuerpo. El hipersomnio representa un problema frecuente, con una prevalencia global alrededor del 16%. Es un síntoma importante tanto para el paciente como para su acompañante, y la aproximación al diagnóstico incluye auto y heteroanamnesis completa. Además, existen métodos subjetivos y objetivos que facilitan el diagnóstico y permiten aclarar su etiología. Se acude a exámenes somáticos, psicológicos (escala de Epworth, índice de somnolencia de Stanford), polisomnografía, así como a pruebas de latencia múltiple del sueño y de mantenimiento de la vigilia. Como causas frecuentes se destacan el síndrome de insuficiencia crónica de sueño, el hipersomnio asociado a alteraciones respiratorias o apnea del sueño, los trastornos motores durante el sueño, la narcolepsia, el hipersomnio idiopático, entre otras. Una adecuada intervención exige el diagnóstico cuidadoso y tratamiento etiológico.
Palabras clave: trastornos de somnolencia excesiva, evaluación, diagnóstico, trastornos del sueño.
Abstract
Sleep physiology and its neuroanatomic basis is currently only partially clarified. We know the modifications sleep can suffer but not its function, so it is postulated that its principal role is to repair and regulate the central nervous system and other structures of the body. Hypersomnia represents a frequent problem with a global prevalence of around 16%. It is an important symptom for both the patient and his companion, and the approach to the diagnosis includes complete auto and heteroanamnesis. Also, subjective and objective methods exist that facilitate the diagnosis and allow the etiology to be clarified. Somatic, psychological exams (Epworth Sleepiness Scale, Stanford Sleepiness Scale), polysomnography, as well as multiple sleep latency tests and maintenance of wakefulness tests are used. Chronic sleep deprivation syndrome, hypersomnia associated with sleep-disordered breathing or sleep apnea, motor dysfunctions during sleep, narcolepsy and idiopathic hypersomnia, among others, are frequent causes of hypersomnia. An appropriate intervention demands careful diagnosis and an etiological treatment.
Key words: disorders of excessive somnolence, evaluation, diagnosis, sleep disorders.
Introducción
Se conoce que durante el pregrado la gran mayoría de los médicos recibe escasamente entre una y dos horas de clases formales o conferencias magistrales sobre trastornos del sueño, lo cual, desde cualquier punto de vista, es insuficiente (1). Por lo anterior, es importante iniciar este artículo con las bases fisiológicas del ciclo sueño-vigilia.
Cada vez se conocen mejor los mecanismos normales y fisiopatológicos relacionados con el dormir, para que una persona concilie el sueño o se mantenga en estado de vigilia (2). En la actualidad se piensa que existen sustancias cerebrales inductoras del sueño y otras que ayudan a mantener la vigilia.
Existen dos sistemas neuroanatómicos que sirven de sustrato al ciclo vigilia-sueño en los humanos: el sistema inductor del dormir y el sistema inductor de la vigilia. Este último mantiene los estados de alerta y garantiza la capacidad de concentración. Por otro lado, el sistema que induce el dormir produce la aparición de los diferentes estadios o fases de sueño. Ambos sistemas están perfectamente sincronizados y para lograr un funcionamiento adecuado requieren la maduración del sistema nervioso central (SNC) durante los primeros años de vida (3).
Los mecanismos neurofisiológicos que inducen los estados de vigilia tienen su sustrato anatómico en el sistema reticular activador ascendente (SRAA). Allí se encuentra el locus cerúleos, localizado en el piso del cuarto ventrículo, cuyas células se interconectan, hacia arriba, con la mayor parte de la corteza cerebral y, hacia abajo, en forma difusa con el tronco cerebral. Este pequeño núcleo gris central funciona como una lámpara, que la hace encender y apagar según la presencia de oscilaciones circadianas, con ciclos infradianos de aproximadamente dos horas de duración (4),(5). El locus cerúleos tiene un ritmo circadiano, el cual se correlaciona bastante bien con la curva de temperatura corporal central (CTCC) (6), (7). Es decir, cuando aumenta la temperatura, el locus cerúleos aumenta su actividad metabólica para producir mayor cantidad de catecolaminas y lo contrario. Lo anterior ayuda a inducir estados de menor o mayor alerta.
Por otra parte, el sistema inductor del dormir tiene su asiento en los núcleos grises posteriores del tronco cerebral. Estos núcleos se conectan con gran parte de la corteza cerebral y con el haz medial frontal. Por medio de este sustrato neuroanatómico se induce el dormir (8),(9). Aquí tienen papel central los núcleos grises del rafé dorsal secretores de serotonina y el núcleo giganto-celular de la formación reticular productor de acetilcolina (10),(11), tal como se puede ver en la Figura 1.
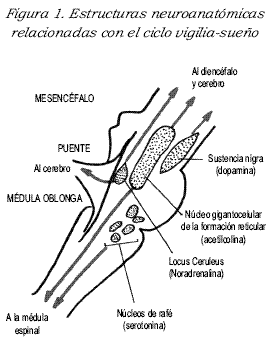
Existen factores internos y externos que influyen directamente en el ciclo vigilia-sueño, como el ciclo luz-oscuridad y las diferentes claves sociales, por ejemplo, el horario de las comidas o los horarios laborales y escolares (12). Igualmente, los ritmos circadianos de sustancias hormonales, como la hormona del crecimiento (GH), el cortisol, la melatonina (MLT) y la prolactina (PRL), inducidos en gran parte por los zeitgebers o relojes internos (13).
En la primera mitad del siglo pasado cobró importancia la teoría de la recuperación y reparación metabólica. En la segunda mitad cambió esta concepción por el hallazgo del sueño con movimientos oculares rápidos (sueño MOR). Sin embargo, a pesar de numerosos descubrimientos en este campo, en la actualidad de la función del sueño poco se sabe. De todas maneras se plantean las funciones reparadora, adaptativa, homeostática y de consolidación de algunas funciones cognoscitivas, según se trate de una u otra de las dos grandes fases del dormir: el estado de sueño no MOR o MOR (14),(15),(16),(17),(18).
Hoy en día se conoce que el hombre tiene tres estados vitales: un estado de vigilia y dos estados de sueño: el sueño MOR y el sueño no MOR. El primero es un estado en el cual los movimientos oculares son rápidos y episódicos (sueño paradójico) y hay atonía muscular de prácticamente todos los músculos estriados, excepto los que garantizan la respiración. Por otra parte, el sueño no MOR, que tiene una fisiología completamente diferente, es un estado en el cual no hay movimientos oculares rápidos. En la fase de sueño no MOR se presentan cuatro etapas o estadios que se conocen como S1, S2, S3 y S4. Los dos primeros (S1 y S2) constituyen el sueño lento superficial y los siguientes (S3 y S4), el sueño lento profundo (6).
Normalmente la somnolencia es más evidente en horas de la noche; pero temprano en la tarde se puede presentar un nuevo episodio de somnolencia fisiológica, durante el cual frecuentemente se toma la siesta (19). Se reporta que siestas entre diez y cuarenta minutos disminuyen el cansancio cerebral y físico durante el día, aumentan la productividad, disminuyen el estrés y reducen la saturación mental. Las siestas refuerzan la memoria y la concentración, ya que permiten reiniciar un ciclo cerebral de actividad en una forma más relajada. Sin embargo, ésta no debe ser prolongada e, idealmente, no más de una al día en el adulto, puesto que puede alterar el patrón normal de sueño (20).
Epidemiología
No se conoce la prevalencia real del hipersomnio. Aproximadamente del 5% al 10% de los individuos que acuden a centros especializados en sueño son diagnosticados con hipersomnio primario. Los estudios epidemiológicos en población general detectan el problema entre el 0,5% y el 5% de los adultos. Entre tanto, la prevalencia global del hipersomnio clínicamente significativo es de, al menos, un 16%, y la incidencia en cuatro años es alrededor del 8% (21). Es menos común que el insomnio y, según varias series de estudios, afecta más a personas jóvenes y a desempleados.
Existen pocos estudios sobre la prevalencia de la somnolencia diurna. En Colombia no hay estudios poblacionales, y se desconoce su efecto sobre la salud de los trabajadores correturnos como vigilantes, personal de salud, conductores, pilotos, controladores de tránsito aéreo, auxiliares de vuelo, militares, entre otros. Además, se calcula que del 15% al 30% de los accidentes de tránsito se deben a somnolencia frente al volante. Se calcula que el 34% de las personas ronca y que el 19% lo hace diariamente. La apnea se presenta en el 6,5% de la población general, aunque es más frecuente el problema conforme avanza la edad. Los hipersomnios disminuyen la productividad laboral y el funcionamiento social en las personas afectadas (22).
Evaluación del paciente con hipersomnio
El paciente con somnolencia diurna excesiva es aquel que manifiesta un irresistible deseo de dor mir ante cualquier circunstancia, incluso en actividades que demandan mucha alerta (23). Cuando se evalúa un paciente con hipersomnio, se debe hacer una historia clínica completa, es decir, se necesita obtener una anamnesis detallada de los hábitos del paciente durante el ciclo vigilia-sueño; además de la heteroanamnesis, que consiste en interrogar a la persona con la cual duerme el paciente o quien está cerca durante el dormir (24).
Luego se le suministra al paciente la agenda del ciclo vigiliasueño y, en casa, debe registrar diariamente, durante dos semanas continuas, los eventos ocurridos más importantes. Esto sirve de forma objetiva para calcular las horas de sueño totales, los despertares nocturnos y la latencia de sueño. Se registran las horas de levantarse, acostarse, dormir y despertar, así como la calidad del sueño, la vigilia y los medicamentos que tuvo necesidad de tomar (1),(23).
También se utilizan investigaciones somáticas (cuadro hemático, parcial de orina, química sanguínea, etc.) y psicológicas. Se pueden utilizar pruebas como las de depresión y ansiedad de Hamilton o de Zung, el mini mental state y, en ocasiones, la aplicación de pruebas de personalidad como el Inventario multifásico de personalidad de Minnesota MMPI, que ayudan a esclarecer la patología psiquiátrica asociada (28). En los centros de sueño se usan corrientemente cuestionarios de evaluación del ciclo vigilia-sueño, como el índice de calidad de sueño de Pittsburg, la escala de Epworth, la agenda de sueño y, para complementar el diagnóstico clínico, evaluaciones objetivas realizadas en el laboratorio de sueño, mediante el uso de la polisomnografía clínica estándar (PSG), la videofilmación nocturna, la actigrafía y la prueba de latencia múltiple del sueño (PLMS) y la de mantenimiento de la vigilia (PMV), tal como se señala en la Tabla 1 (29).

La PSG con videofilmación sirve para establecer la etiología del cuadro clínico en pacientes con hipersomnio crónico. Esto permite correlacionar en la pantalla del computador los hallazgos poligráficos, el registro videográfico y el cuadro clínico (17). La actigrafía permite identificar indirectamente las características del ciclo vigilia-sueño del paciente y establecer el patrón de sueño (30).
Para ser considerada patológica, la somnolencia diurna se debe presentar por un período que varía entre semanas y meses (31), y de acuerdo con su gravedad puede clasificarse como sigue a continuación (32):
1. Somnolencia leve: cuando no hay episodios de sueño involuntario, pero la persona bosteza con frecuencia y presenta alteraciones en la atención y concentración.
2. Somnolencia moderada: cuando la persona se duerme contra su voluntad al realizar actividades sedentarias.
3. Somnolencia grave: cuando se presenta el sueño en forma involuntaria, aun durante la actividad física.
Adicionalmente se puede presentar en dos patrones (32):
1. Patrón persistente: por ejemplo, el encontrado en los pacientes con narcolepsia o en pacientes con apnea de sueño sintomática.
2. Patrón intermitente: por ejemplo, la hipersomnolencia desencadenada por el ciclo menstrual o en el síndrome de Kleine- Levin.
Indicación de la polisomnografía en hipersomnio
La polisomnografía se realiza en el laboratorio de sueño. Hoy se cuenta con equipos digitales que tienen hasta 120 canales y que permiten registrar cualquier actividad eléctrica fisiológica, que sea accesible y medible, del ser humano (6). Durante el estudio se registra la actividad eléctrica cortical, mediante electroencefalografía (EEG); la actividad oculomotriz, mediante electrooculograma (EOG), y el tono muscular, mediante electromiografía (EMG) de los músculos del mentón. Basándose en los anteriores parámetros se establecen los estadios del sueño.
En la PSG se establecen los estadios del sueño, su distribución porcentual, los diferentes cálculos de las épocas del dormir y la arquitectura del sueño, conocida como hipnograma. Así se pueden establecer patrones patológicos del dormir y determinar la etiología del hipersomnio crónico.
En el hipnograma se observa la distribución porcentual de los dife rentes estadios del sueño. En un adulto joven predomina en el primer tercio de la noche el sueño delta profundo y en la segunda mitad de la noche el sueño MOR. La PSG estándar tiene indicación en el hipersomnio crónico y se requiere para establecer la etiología (29),(33). En el hipersomnio ocasional y de corta duración no está indicado.
Diagnóstico
El diagnóstico de hipersomnio se hace por medio de la historia clínica y del examen físico, con la ayuda de un diario de sueño llevado por el paciente. Aunque generalmente se le asocia a insomnio, se debe buscar una causa orgánica. Las características clínicas importantes se resumen en episodios de somnolencia o sueño durante el día, dificultad para mantener el estado de alerta y propensión a quedarse dormido en cualquier lugar y situación.
Muchas enfermedades y medicamentos pueden producir sintomatología similar, razón por la cual dichos eventos deben quedar registrados en la historia clínica. Asimismo, la sintomatología aparentemente no asociada (como la hipotensión ortostática, la hipoglucemia, la epilepsia, entre otros) puede resultar clave en el momento de diferenciar crisis atónicas de episodios de cataplejía. Se debe indagar acerca de los hábitos del paciente, el peso y el apetito, el trabajo desempeñado, el ambiente en el cual se desenvuelve, las quejas somáticas y si existen cuadros clínicos familiares similares.
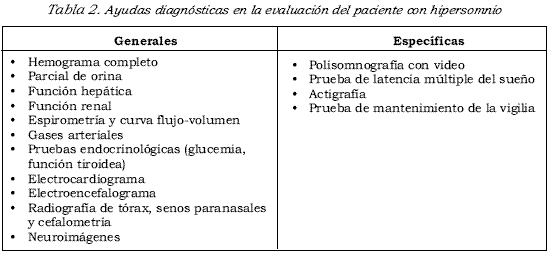
En la evaluación integral del paciente, y según lo encontrado al examen físico, es pertinente la toma de exámenes paraclínicos generales y específicos según la impresión diagnóstica y la condición clínica del paciente (véase Tabla 2).
El hipersomnio puede ser primario o secundario. Dada la diferencia en la frecuencia de cada uno, de estos tipos de hipersomnio, es necesario que inicialmente se considere secundario, para encontrar después la condición subyacente.
Una vez descartadas otras causas, se debe considerar un hipersomnio primario. Se consideran patologías del hipersomnio primario: la narcolepsia y el hipersomnio idiopático (véase Tabla 3).

El examen físico puede ser normal, por ejemplo, en los pacientes con narcolepsia o síndrome de resistencia aumentada en las vías aéreas superiores (RAVAS); o puede dar las claves diagnósticas del síndrome de apnea-hipopnea obstructiva del sueño (SAHOS), de la enfermedad tiroidea, entre otros (33).
Existen, además, varias escalas de somnolencia realizadas en forma de cuestionario, que tienen como fin evaluar rápidamente, en forma cualitativa y cuantitativa, la somnolencia manifestada por el paciente. De este tipo de pruebas las más difundidas son las escalas de somnolencia de Epworth y la de Stanford (25),(27). También existen herramientas paraclínicas que contribuyen a la construcción de un diagnóstico, es decir, son pruebas fisiológicas que buscan objetivar las quejas del paciente (36):
• Prueba de latencia múltiple del sueño (PLMS): es la mejor ayuda diagnóstica en la evaluación del hipersomnio y se utiliza ampliamente. Se lleva a cabo durante el día (en el horario contrario al período de sueño principal), con el fin de verificar la presencia del hipersomnio y determinar el impacto de la somnolencia diurna. Consiste en el registro de la actividad eléctrica cerebral, ocular y muscular durante cuatro o cinco siestas, con duración de veinte minutos cada una, a intervalos de dos horas realizadas durante el día (34).
• Polisomnografía (PSG): incluye el registro de electroencefalografía, electrooculografía, electrocardiografía, electromiografía y actividad respiratoria y ventilatoria, con o sin registro audiovisual complementario (35).
• Actigrafía: es un examen que se usa para evaluar el ciclo actividad- reposo en el paciente. Se usa una especie de reloj que porta la persona durante el tiempo indicado y que registra en una tarjeta electrónica el ciclo actividad-reposo (30).
• Prueba de mantenimiento de la vigilia: es un registro poligráfico hecho durante el día, que sirve para evaluar la capacidad de alerta del individuo. La técnica es parecida a la PLMS. En este caso se le indica al paciente no dormir, a pesar de encontrarse en un ambiente propicio (36).
• Vigilancia del sueño MOR durante 24 horas: este examen se realiza por medio de un polisomnograma nocturno, seguido por una prueba de latencia múltiple del sueño.
Síndrome de apnea-hipopnea obstructiva del sueño (SAHOS)
El SAHOS es el trastorno más importante que causa hipersomnio, en términos de morbimortalidad. Ocurre con mayor frecuencia en adultos entre los treinta y los sesenta años. La prevalencia de hipersomnio en pacientes con SAHOS es más alta en mujeres que en hombres, aunque no así la prevalencia del SAHOS, de aproximadamente 25% en hombres y 10% en mujeres. La frecuencia de las apneas aumenta con la edad y se correlaciona con la obesidad y el género masculino. Alcanza un máximo entre la quinta y la sexta década de la vida, incluso en las mujeres posmenopáusicas, cuando se ha perdido el efecto estrogénico protector (37).
El SAHOS es una condición insidiosa y progresiva. Se caracteriza por episodios recurrentes de apneas causadas por la obstrucción de las vías aéreas superiores durante el sueño; puesto que éste predispone su estrechamiento por la reducción del tono muscular en la faringe (38 Clínicamente, el cuadro se presenta en un hombre de edad media, con sobrepeso, roncador crónico, quien aqueja sueño no reparador y somnolencia diurna excesiva, hipertensión arterial sistémica, impotencia y depresión.
El SAHOS no es una entidad nosológica, sino la vía final común de múltiples entidades. Los pacientes que lo tienen presentan poliuria y natriuresis, acompañado de edema periférico, que puede estar relacionado con la secreción anómala del factor natriurético atrial. Estas personas pierden su variación circadiana y las concentraciones son significativamente más altas.
La importancia de establecer un diagnóstico certero radica en que varios estudios han identificado al roncador habitual como un sujeto con riesgo aumentado para hipertensión arterial sistémica, cardiopatía isquémica, enfermedad cerebrovascular y muerte (39)(40),(41). Es de anotar que el índice de apneahipopnea (IAH), número de apneashipopneas por hora, se correlaciona en forma directa con la gravedad de la hipertensión arterial, presente hasta en el 50% de los pacientes con SAHOS (42),(43).
Incluso algunos autores recomiendan que en un sujeto con hipertensión arterial refractaria acompañada por sintomatología que sugiera SAHOS es necesario el estudio polisomnográfico (33),(44), (45), (46); pues en éste se pueden encontrar asistolias de hasta trece segundos de duración, bloqueos auriculoventriculares de segundo grado y extrasístoles ventriculares durante los períodos de apneas (44),(45),(46).
Además de la sintomatología mencionada, los allegados al paciente describen cambios en la personalidad, dados por una marcada irritabilidad, ansiedad, agresividad y depresión, debidas al sueño fragmentado. Los pacientes se quejan de dificultad para concentrarse, pérdida de la memoria, aumento de los errores relacionados con el trabajo, disminución de la libido e impotencia, en el 20%-40% de los casos (47). Pueden manifestar cefalea, confusión y desorientación matutina por la hipoxemia nocturna o hipercapnia durante el sueño (48),(49).
El PSG es un método diagnóstico sensible para evaluar los trastornos respiratorios durante el sueño; sin embargo, el registro puede variar entre noches, por lo cual se recomienda la toma de más de uno. En este estudio se determina el índice de apneas, su duración, su correlación con la saturación arterial de oxígeno y la presencia de alte raciones del ritmo cardiaco (33) –parámetros que se usan para clasificar la gravedad del cuadro clínico–. La PLMS es útil para evaluar el impacto del SAHOS al día siguiente (49),(50).
Algunos estudios prospectivos sugieren la posibilidad de realizar una oximetría nocturna como abordaje inicial para determinar la necesidad de realizar un PSG (dados sus elevados costos), ya que la mayoría de estos estudios coinciden en que un examen negativo descarta el SAHOS (33),(51).
Tratamiento del SAHOS
La indicación de tratamiento basado en el índice de apneas se discute. Inicialmente se acepta que un IAH de cinco o mayor, obliga a dar un tratamiento con presión positiva continua en la vía aérea (CPAP, su sigla en inglés). Se recomienda también la reducción y mantenimiento del peso en pacientes obesos, así como la eliminación de alcohol, cigarrillos, medicamentos o drogas depresoras del SNC, especialmente a la hora de acostarse (38). Se debe disminuir la resistencia nasal en los pacientes que sufren de rinitis alérgica por medio de soluciones tópicas.
El uso de CPAP, además de ayudar a regular la tensión arterial, restablece las concentraciones y el patrón circadiano del péptido natriurético atrial y causa una drástica mejoría en la sintomatología, con reducción en el IAH y desaturación de oxígeno arterial, el cual además puede reducir el reflujo gastroesofágico (RGE) que presentan algunos de estos pacientes. La presión aérea positiva bilateral (BiPAP, por su sigla en inglés) utiliza diferentes presiones para la inspiración y la espiración. Es más cómodo para el paciente, y especialmente útil en aquellos que requieren altas presiones (52).
Se puede plantear la opción quirúrgica por medio de la uvulopalatofaringoplastía (UPFP), combinada con la tonsilectomía y la resección de mucosa redundante del tejido blando de la úvula, del paladar blando, de la faringe y de los pilares posteriores con el fin de ampliar la luz orofaríngea (53). Esta cirugía está indicada en los casos en los cuales la anatomía de las estructuras mencionadas desempeñe un papel importante en la patología del paciente. Se describen otros procedimientos quirúrgicos, como el avance geniotubercular, la hioidectomía con miotomía infrahioidea y la traqueostomía, destinadas a casos muy graves; el avance mandibular con prótesis, el retenedor de lengua y la tonsilectomía, en los niños, con o sin adenoidectomía, así como la necesidad de manejos ortodónsicos y la cirugía maxilofacial, de ser necesario (53),(54).
Síndrome de apnea central del sueño (SAC)
El SAC se puede presentar como insomnio de múltiples despertares o con somnolencia diurna. En su presentación, la gran mayoría de las veces acompaña al SAHOS (46). Se puede encontrar en enfermedades neuromusculares, músculoesqueléticas en el tórax, en alteraciones del tronco cerebral, en lesiones del nervio frénico y en insuficiencia cardiaca congestiva o como parte de enfermedades neurológicas que incluyan la respiración de Cheyne-Stokes como patrón –ése es el caso de lesiones bihemisféricas o del tronco cerebral– (55).
El SAC se confirma por medio de PSG. El tratamiento sintomático generalmente ofrece una pobre respuesta. Se recomienda la atención de la condición de base y, de ser pertinente, el uso de CPAP en el SAC idiopático (56),(57).
Síndrome de resistencia aumentada en la vía aérea superior (SRAVAS)
El SRAVAS es una condición poco frecuente, generalmente presente en pacientes longilíneos y roncadores, que se quejan de somnolencia diurna, pero que no presentan el SAHOS. Se ha documentado un aumento del esfuerzo respiratorio, y se acompaña de disminución del volumen corriente antes de los alertamientos o despertares, en ausencia de hallazgos anatómicos que justifiquen la sintomatología (58),(59).
Este tipo de pacientes responde frecuentemente al manejo con CPAP, con mejoría del hipersomnio y disminución del número de despertares por hora. Su principal diagnóstico diferencial es el hipersomnio idiopático, por la ausencia de patología estructural del trastorno respiratorio.
Patología pulmonar crónica
Adicionalmente, el sueño se puede ver alterado en personas con patología crónica de origen pulmonar. Regularmente se encuentran desaturaciones de oxígeno con períodos de hipoventilación asociados a episodios de apneas (60).
La patología pulmonar crónica también es frecuente en pacientes obesos, los cuales presentan restricción extrínseca de su capacidad pulmonar, por lo que desarrollan un síndrome denominado de obesidadhipoventilación. Los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) presentan hipoxemia durante el sueño, la cual se hace más acusada durante el sueño MOR, y lleva a que éste sea de poca calidad, asociado a despertares múltiples y aumento del S1 con disminución del sueño MOR (60).
En estos pacientes se ha asociado un aumento en la incidencia de arritmias cardiacas, especialmente durante el sueño, al parecer desencadenadas por la hipoxemiahipercapnia. Se encuentra un síntoma importante la somnolencia diurna. El estudio de sueño se indica en pacientes con EPOC, que sean obesos, roncadores crónicos y que presenten cefalea matutina (59). En aquellos que sólo cursen con EPOC está indicada la oxigenoterapia durante la noche, pero no si coexiste con SAHOS, en los cuales está indicado el CPAP (60).
Trastornos motores por movimientos durante el sueño
La presencia de pequeños o cortos movimientos, rítmicos o periódicos, incluidas las sacudidas de los miembros, el bruxismo y los movimientos rítmicos de la cabeza (jactatio capitis), pueden resultar en alteraciones durante el período de sueño, con consecuencias importantes como el hipersomnio posterior.
El diagnóstico de los trastornos motores por movimientos durante el sueño se hace usualmente con videopolisomnografía. Los movimientos periódicos de las piernas durante el sueño (que es un trastorno común) se caracterizan por la contracción del músculo tibial anterior, el cual se considera benigno y su incidencia aumenta con la edad (59). Es una condición que puede ser familiar y está frecuentemente asociada con una sensación de inquietud antes de conciliar el sueño. El diagnóstico se establece con el electromiograma realizado durante la PSG.
Narcolepsia
La narcolepsia es un trastorno específico caracterizado por hipersomnio, episodios de sueño, alucinaciones hipnagógicas, cataplejía, parálisis del sueño y manifestaciones anormales durante el sueño MOR. No suele ser progresiva, pero sí incapacitante e incurable.
Los síntomas menos frecuentes incluyen cambios en la memoria, sueño nocturno alterado, comportamiento automático y visión borrosa o diplopía. Tiene una prevalencia inferior al 0,1% y una distribución uniforme entre hombres y mujeres (61). Los síntomas comúnmente aparecen en la tercera década de la vida. Puede ser idiopática, la más común, o sintomática, secundaria a otra condición médica (por ejemplo, traumatismos craneoencefálicos, neoplasias intracraneales o neuroinfección).
El hipersomnio es el síntoma inicial más común. Se caracteriza por episodios de somnolencia marcada durante el día, más evidentes ante situaciones sedentarias aunque también se hacen presentes en pe ríodos de actividad. La cataplejía se considera un fenómeno exclusivo de la narcolepsia y consiste en un episodio breve y paroxístico de pérdida del tono muscular –puede ser generalizado y producir caída al suelo o ser limitado, especialmente en músculos del cuello y miembros (61)–. La parálisis del sueño se refiere a episodios de imposibilidad para moverse, abrir los ojos o hablar al inicio o al final del sueño, con conservación del nivel de conciencia y capacidad para recordar el episodio. Algunos pacientes refieren simultáneamente alucinaciones. A menudo termina en forma espontánea o después de un estímulo sensorial. No es un síntoma exclusivo de la narcolepsia. Las alucinaciones ligadas al sueño –llamadas hipnagógicas cuando se presentan al inicio o hipnopómpicas cuando se presentan al final– con mayor frecuencia son visuales, aunque también pueden ser auditivas, táctiles o cenestésicas. Tienden a darse en forma normal en la población general, desencadenadas por alteraciones en los patrones normales de sueño, pero ocurren en forma más frecuente en personas con narcolepsia.
Se ha encontrado una estrecha relación entre la narcolepsia y la presencia del HLA-DR2 (DRw15 Dw2 Dw6), hasta en un 98% de los pacientes con la primera enfermedad. Sin embargo, esta asociación no es necesaria, ya que indica su origen multifactorial. En resumen, el diagnóstico de narcolepsia se hace basándose en la historia clínica, el PSG y la PLMS (62).
El estudio de sueño puede mostrar una disminución importante en la latencia del sueño MOR en los primeros veinte minutos, fragmentación y múltiples despertares. Mientras que en la PLMS se encuentra la presencia de sueño MOR durante dos o más siestas de las cuatro o cinco del estudio, con latencias de sueño de cinco minutos o menos, para una sensibilidad del 84% (32).
El tratamiento se inicia con la determinación de hábitos e higiene del sueño. Se sugiere la toma de una o varias siestas de corta duración (alrededor de quince minutos durante el día), en un horario establecido según las necesidades del paciente. Sin embargo, se hace hincapié en un horario de sueño nocturno adecuado, así como en las demás recomendaciones de higiene de sueño (63).Dicho tratamiento puede ser complementado de forma farmacológica con estimulantes que van desde la cafeína hasta el metilfenidato, la dexanfetamina y el modafinil (64). La cataplejía y la parálisis del sueño requieren tratamiento independiente que se base en los derivados tricíclicos (62),(63).
Hipersomnio idiopático
El hipersomnio idiopático se caracteriza por somnolencia diurna re currente sin los demás síntomas de la narcolepsia. Aparece generalmente entre los quince y los treinta años de edad, de forma progresiva, y una vez establecido permanece sin cambios. Se caracteriza por un sueño nocturno prolongado y sin alteraciones, a pesar de lo cual los pacientes presentan dificultades al despertar, confusión mental y agresividad, con largos períodos de somnolencia diurna, la cual se torna incapacitante, por lo que se toman largas siestas sin lograr mejoría.
La PSG muestra un acortamiento en la latencia del sueño no MOR, asociado a un aumento del S2 y a una disminución del sueño lento profundo, con latencia para MOR normal o discretamente prolongada y distribución normal de los estadios de sueño. En la PLMS se evidencia el acortamiento en la latencia del sueño no MOR y ausencia del sueño MOR (65). Su etiología se desconoce y no existe tratamiento específico, únicamente sintomático con estimulantes del SNC.
Síndrome de insuficiencia crónica de sueño
El síndrome de insuficiencia crónica de sueño es la principal causa del hipersomnio y una de las causas más comunes de trastornos del sueño en nuestra sociedad. Esta privación voluntaria aguda o crónica de sueño usualmente se produce por estrés ante factores sociales o económicos (66). Se ha determinado que el hombre actual duerme 25% menos que sus antepasados de un siglo atrás y que alrededor del 20% de los trabajadores de países industrializados trabajan por turnos.
Los correturnos nocturnos tienen menos de ocho horas de sueño por semana que los sujetos que realizan turnos diurnos. Este problema se está incrementando proporcionalmente al crecimiento de los trabajadores por turno, más rápido que la fuerza laboral (66). Además la alternancia semanal de tunos diurnos, vespertinos y nocturnos en un mismo sujeto determinan una imposibilidad de adaptación del ciclo sueño-vigilia, que se asocia con frecuencia a insomnio y somnolencia excesiva diurna (65).
Otras situaciones, como la posibilidad de hacer negocios o realizar actividades nocturnas, la televisión, internet, el jet-lag y demás actividades del mundo actual alientan a la privación voluntaria de sueño. De esta manera, al no conciliar un sueño suficiente, genéticamente determinado para cada persona, se puede estar ante una severa privación que empeora el desempeño y rendimiento en las actividades de la vida.
Esta causa constituye alrededor del 6% de las consultas por somnolencia excesiva diurna en laborato rios de sueño. Dicha somnolencia se manifiesta preferiblemente con predominio vesperal, que implica trastornos digestivos, irritabilidad y progresiva disminución en la atención y la coordinación. El análisis polisomnográfico con frecuencia señala un incremento del tiempo total de sueño y rebote de sueño lento profundo. La prueba de latencia múltiple del sueño muestra una disminución en las latencias de sueño (66).
Accidentes y sueño
Se conoce de tiempo atrás que accidentes graves, como el hundimiento del buque Exxon Valdez, la caída del Challenger, la explosión de la Central Nuclear de Chernobyl y numerosos accidentes aéreos, de trenes y tránsito automotor se han debido a personas que en momentos importantes presentaron somnolencia.
Los accidentes de tránsito provocados por vehículos automotores son una de las causas de muerte más importantes en la sociedad moderna. Sin embargo, el peso otorgado a la somnolencia y cómo contribuye ésta a tales accidentes se comprende poco a la fecha. Se conoce que muchos accidentes de tránsito son causados por conductores que se quedan dormidos en la carretera o también porque cometen errores relacionados con las consecuencias de la somnolencia sobre el estado de alerta o con el juicio al manejar (67).
Estudios que se han realizado en poblaciones implicadas en accidentes relacionados con el sueño no presentan resultados directos o ajustados a la prevalencia y enfermedades asociadas con somnolencia diurna (68). En estos casos el componente conductual es quizá el principal factor para explicar la tasa de accidentes incrementada en jóvenes conductores.
El tiempo y la hora del día son factores clave en la ocurrencia de accidentes relacionados con el sueño. Esto puede explicarse por que los conductores y los trabajadores por turnos son más vulnerables. Algunos autores han mostrado que las vulnerabilidades individuales existen, lo cual puede explicar por qué unas personas son más capaces para adaptarse a cambios rápidos de agendas de sueño (69).
Bibliografía
1. Chesson A Jr, Hartse K, Anderson WM, Davila D, Johnson S, Littner M, et al. Practice parameters for the evaluation of chronic insomnia. An American Academy of Sleep Medicine report. Standards of Practice Committee of the American Academy of Sleep Medicine. Sleep 2000 Mar 15;23(2):237-41. [ Links ]
2. Kupfer D. Pathophysiology and management of insomnia during depression. Ann Clin Psychiatry 1999;11:267-76. [ Links ]
3. Borbely A. A two-process model of sleep regulation. Human Neurobiol 1982; 1:195-204. [ Links ]
4. Daan S, Beersma DG, Borbely AA. Timing of human sleep: recovery process gated by a circadian pacemaker. Am J Physiol 1984;246(2 Pt 2):R161-83. [ Links ]
5. Benoît O. Régulation circadienne des états de veille et de sommeil. In: Le sommeil humain. Bases expérimentales physiologiques et physiopathologiques. Paris: Masson; 1995. p. 105-24. [ Links ]
6. Borbely A, Acheman P. Concepts and models of sleep regulation: an overview. J Sleep Res 1992;1:63-79. [ Links ]
7. Daan S, Beersma D, Borbely A. Timing of human sleep: recovery process gated by a circadian pacemaker. Am J Physiol 1984;246:R161-78. [ Links ]
8. Folkard S, Akerestedt T. A three process model of regulation of alertness sleepiness. In: Broughton R, Olgivie R, editors. Sleep arousal and performance. Boston: Birkhauser; 1992. p. 11-26. [ Links ]
9. Foret J. Variations spontanées et expérimentales. In: Benoît O, editor. Le sommeil humain. Bases expérimentales, physiologiques et physiopathologiques. 2nd ed. Paris: Masson; 1995. p. 75-88. [ Links ]
10. Besset A. Régulation du sommeil. Rev Prat 1996;46:2411-5. [ Links ]
11. Gaillard J. Le sommeil normal et les éléments de physiologie. In: Le sommeil: ses mécanismes et ses troubles. Paris: Doin; 1990. p. 31-92. [ Links ]
12. Winfree AT. Circadian timing of sleepiness in man and woman. Am J Physiol 1982;243:R193-204. [ Links ]
13. Nakao M, Yamamoto K, Honma K, Hashimoto S, Honma S, Katayama N, et al. A phase dynamics model of human circadian rhythms. J Biol Rhythms 2002; 17(5):476-89. [ Links ]
14. Karni A, Tanne D, Rubenstein B, Askenasy J, Sagi D. Dependence on REM sleep of overnight improvement of a perceptual skill. Science 1994;265:679-82. [ Links ]
15. Rotenberg V. Sleep and memory: I. The influence of different sleep stages on memory. Neurosci Biobehav Rev 1992;16:497-502. [ Links ]
16. American Sleep Disorders Association. International classification of sleep disorders, revised, diagnostic and coding manual. Rochester; 1997. [ Links ]
17. Escobar F. La medicina del sueño: una nueva especialidad. Rev Fac Med Univ Nac Colomb 1999;47(1):26-31. [ Links ]
18. Van Dongen HP, Maislin G, Mullington JM, Dinges DF. The cumulative cost of additional wakefulness: dose-response effects on neurobehavioral functions and sleep physiology from chronic sleep restriction and total sleep deprivation. Sleep 2003;26(2):117-26. [ Links ]
19. Tietzel AJ, Lack LC. The recuperative value of brief and ultra-brief naps on alertness and cognitive performance. J Sleep Res 2002;11(3):213-8. [ Links ]
20. Cottrell L, Karraker KH. Correlates of nap taking in mothers of young infants. J Sleep Res 2002;11(3):209-12. [ Links ]
21. American Psychiatric Association. Manual diagnóstico y estadístico de los trastornos mentales, DSM-IV-TR, texto revisado. Barcelona: Masson; 2002. p. 667-739. [ Links ]
22. Valencia M, Salín R, Pérez R. Trastornos del dormir. México: McGraw-Hill Interamericana; 2000. p. 221-71. [ Links ]
23. Krieger J. Clinical approach to excessive daytime sleepiness. Sleep 2000;23 Suppl 4:S95-8. [ Links ]
24. Escobar F, Echeverry J, Lorenzana P. Evaluación clínica del insomnio (1ª parte). Rev Fac Med Univ Nac Colomb 2001;49(2):81-2. [ Links ]
25. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep 1991;14:540-5. [ Links ]
26. Buysse DJ, Reynolds III CF, Monk TH, Berman SR, Kupfer DJ. The Pittsburg sleep quality index: a new instrument for psychiatric practice and research. Psychiatry Res 1989;28:193-213. [ Links ]
27. Hoddes E, Zarcone P, Smythe H, Phillips R, Dement WC. Quantification of sleepiness: a new approach. Psychophysiology 1973;10:431-6. [ Links ]
28. Escobar F. Trastornos del sueño asociados a alteraciones psiquiátricas. En: Osuna E. Enfoque del paciente con trastornos del sueño. Bogotá: Asociación Colombiana de Medicina del Sueño; 2000 p. 57-69. [ Links ]
29. Weaver TE. Outcome measurement in sleep medicine practice and research. Part 1: assessment of symptoms, subjective and objective daytime sleepiness, health-related quality of life and functional status. Sleep Med Rev 2001;5(2):103-28. [ Links ]
30. De Souza L, Benedito-Silva AA, Pires Ml, Poyares D, Tufik S, Calil Hm. Further validation of actigraphy for sleep studies. Sleep 2003;26(1):81-5. [ Links ]
31. National Sleep Foundation. Sleep in America: 1995 Gallup Poll conducted for the National Sleep Foundation. Available 2004 February 23. Available from: http://www.sleepfoundation.org/publications/ SleepInAmerica1995.cfm. [ Links ]
32. Osuna E, Rubiano A. El paciente con hipersomnio (somnolencia). En: Osuna E, Rubiano A. Principios de la medicina del sueño. Bogotá: Upjohn Company; 1994. p. 139-79. [ Links ]
33. AASM Task Force. Sleep-related breathing disorders in adults recommendations for syndrome definition and measurement techniques in clinical research. Sleep 1999;22(5):667-87. [ Links ]
34. Carskadon MA, Dement WC. The multiple sleep latency test: what does measure? Sleep 1985;5:S67-72. [ Links ]
35. Dixon JB, Schachter LM, O'Brien PE. Predicting sleep apnea and excessive day sleepiness in the severely obese: indicators for polysomnography. Chest 2003;123(4):1134-41. [ Links ]
36. Mitler M, Gujavarty KS, Browman CP. Maintenance of wakefulness test: a polysomnographic technique for evaluating treatment inpatients with excessive somnolence. Electroencephalogr Clin Neurophysiol 1982;153: 658-61. [ Links ]
37. Kripke DF, Ancoli-Israel S, Klauber MR, Wingard DL, Mason WJ, Mullaney DJ. Prevalence of sleep disordered breathing in age 40-64 years: a population- based survey. Sleep 1997;20:65-76. [ Links ]
38. Mascitelli L, Pezzetta F. Obstructive sleep apnea. Lancet 2002;360(9350): 2079. [ Links ]
39. Norton PG, Dunn EV. Snoring as a risk factor for disease: an epidemiologic survey. BMJ 1985;29: 630-3. [ Links ]
40. Naughton MT. Assessment and management of the patient presenting with snoring. Aust Fam Physician 2002; 31(11):985-8. [ Links ]
41. Meslier N, Ouksel H, Racineux JL. Obstructive sleep apnea syndrome and cardiovascular risk. Rev Neurol (Paris) 2001;157(11 Pt 2):S42-5. [ Links ]
42. Billiard M, Ondze B. Disorders of awakening. Second part: secondary disorders. Rev Neurol (Paris) 2001;157(5):480-96. [ Links ]
43. Janssen JP, Pautex S, Hilleret H, Michel JP. Sleep disordered breathing in the elderly. Aging (Milano) 2000;12(6):417- 29. [ Links ]
44. Hoffstein V, Mateika S. Cardiac arrhythmias, snoring, and sleep apnea. Chest 1994;106 (2):466-71. [ Links ]
45. Peled N, Abinader EG, Pillar G, Sharif D, Lavie P. Nocturnal ischemic events in patients with obstructive sleep apnea syndrome and ischemic heart disease: effects of continuous positive air pressure treatment. J Am Coll Cardiol 1999;34(6):1744-9. [ Links ]
46. Flemons WW, Remmers JE, Gillis AM. Sleep apnea and cardiac arrhythmias. Is there a relationship? Am Rev Respir Dis 1993;148(3):618-21. [ Links ]
47. Kim HC, Young T, Matthews CG, Weber SM, Woodard AR, Palta M. Sleep-disordered breathing and neuropsychological deficit. J Respir Crit Care Med 1997;157:1813-9. [ Links ]
48. Xie A, Rutherford R, Rabkin F, Wong B, Bradley TD. Hypocapnia and increased ventilatory responsiveness in patients with idiopathic central sleep apnea. Am J Respir Crit Care Med 1995;152:1950-5. [ Links ]
49. Xie A, Wong B, Phillipson EA, Slutsky AS, Bradley TD. Interaction of hyperventilation an arousal in the pathogenesis of idiopathic central sleep apnea. Am J Respir Crit Care Med 1994;250:489-95. [ Links ]
50. Kermit M, Eide AJ, Lindblad T. Early online detection of upper airway obstructions in obstructive sleep apnea syndrome (OSAS) patients. J Med Eng Technol 2002;26(6):259-64. [ Links ]
51. Golpe R, Jiménez A, Carpizo R. Home sleep studies in the assessment of sleep apnea/hipopnea syndrome. Chest 2002;122(4):1156-61. [ Links ]
52. Engleman HM, Wild MR. Improving CPAP use by patients with the sleep apnea/hipopnea syndrome (SAHS). Sleep Med Rev 2003;7(1):81-99. [ Links ]
53. Cimino A, Speciale R, Gallina S, Cimino M, Marrone O, Salvaggio A, Insalaco G, et al. The surgical treatment of obstructive sleep apnea syndrome. Acta Otorhinolaryngol Ital 1995;15(2 Suppl 47):3-14. [ Links ]
54. Sher AE. Upper airway surgery for obstructive sleep apnea. Sleep Med Rev 2002;6(3):195-212. [ Links ]
55. Krachman SL, Crocetti J, Berger TJ, Chatila W, Eisen HJ, D'Alonzo GE. Effects of nasal continuous positive airway pressure on oxygen body stores in patients with Cheyne-Stokes respiration and congestive heart failure. Chest 2003;123(1):59-66. [ Links ]
56. Ancoli-Israel S, Kripke DF, Mason W. Characteristics of obstructive and central sleep apnea in the elderly: an interim report. Biol Psychiatry 1987;22(6):741-50. [ Links ]
57. Kohnlein T, Welte T, Tan LB, Eliot MW. Central sleep apnea syndrome in patients with chronic heart disease: a critical review of the current literature. Thorax 2002;57(6):547-54. [ Links ]
58. Guilleminault C, Palombini L, Poyares D, Chowdhuri S. Chronic insomnia, premenopausal women and sleep disordered breathing: part 2. Comparison of no drug treatment trials in normal breathing and UARS post menopausal women complaining of chronic insomnia. J Psychosom Res 2002;53(1):617-23. [ Links ]
59. Guilleminault C, Palombini L, Poyares D, Chowdhuri S. Chronic insomnia, postmenopausal women, and sleep disordered breathing: part 1. Frequency of sleep disordered breathing in a cohort. J Psychosom Res 2002; 53(1): 611-5. [ Links ]
60. Douglas NJ, Flenley DC. Breathing during sleep in patients with obstructive lung diseases. Am Rev Resp Dis 1990; 141:1055-70. [ Links ]
61. Bassetti C, Aldrich MS. Narcolepsy. Neurol Clin 1996;14(3):545-71. [ Links ]
62. Singh SM, George CF, Krieger MH, Jung JH. Genetic heterogeneity in narcolepsy. Lancet 1990; 335(8691):726-7. [ Links ]
63. Mitler MM, Aldrich MS, Koob GF, Zarcone VP. Narcolepsy and its treatment with stimulants. ASDA standards of practice. Sleep 1994;17(4):352-71. [ Links ]
64. Rogers AE, Aldrich MS, Berrios AM, Rosenberg RS. Compliance with stimulant medications in patients with narcolepsy. Sleep 1997;20(1):28-33. [ Links ]
65. Billiard M, Dauvilliers Y. Idiopathic hypersomnia. Sleep Med Rev 2001; 5(5): 349-58. [ Links ]
66. Bonnet M, Arand D. We are chronically sleep deprived. Sleep 1995;18:908-11. [ Links ]
67. Escobar F. Accidentes de tránsito y sueño. En Asociación Colombiana de Medicina Legal y Ciencias Forenses. Memorias X Congreso Nacional de Medicina Legal y Ciencias Forenses. Bogotá; 2000. p. 38-40. [ Links ]
68. Stoohs RA, Guilleminault C, Itoi A, Dement WC. Traffic accidents in commercial long-haul truck drivers: the influence of sleep-disordered breathing and obesity. Sleep 1994;17(7):619-23. [ Links ]
69. Quera-Salva MA, Guilleminault C, Claustrat B, De France R, Gajdos P, McCann CC, De Lattre J. Rapid shift in peak melatonin secretion associated with improved performance in short shift work schedule. Sleep 1997;20(12): 1145-50. [ Links ]














