Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.33 suppl.1 Bogotá Oct. 2004
ARTÍCULO DE REVISIÓN
FUNDAMENTOS MOLECULARES Y CELULARES DE LA DEPRESIÓN Y DE LOS MECANISMOS ANTIDEPRESIVOS
MOLECULAR AND CELLULAR BASIS OF DEPRESSION AND ANTIDEPRESSANTS MECHANISM
César Augusto Arango-Dávila*
Martha Isabel Escobar**
Hernán José Pimienta J.***
* Médico psiquiatra de la Pontificia Universidad Javeriana, magíster en Ciencias Básicas Médicas, candidato a Ph. D. en Neurociencias de la Universidad del Valle.
** Bióloga, profesora titular e investigadora del Centro de Estudios Cerebrales de la Universidad del Valle.
*** Biólogo, profesor titular de la Universidad del Valle, director del Centro de Estudios Cerebrales, Facultad de Salud de la Universidad del Valle.
Resumen
Durante la segunda mitad del siglo pasado los progresos en biología molecular permitieron desarrollar métodos para estudiar las sustancias neurotransmisoras del cerebro y su relación con las neuronas a través de los receptores. En los últimos treinta años se ha generado un cuerpo de conocimientos que se aproxima a explicar cómo los receptores neuronales generan cambios en el interior de las células. Además, desde hace veinte años se han desarrollado estrategias para evaluar las modificaciones en la transcripción genética y el vínculo entre la estimulación de los receptores y la expresión genética de las neuronas.
La sistematización de la información proveniente de estas investigaciones ha permitido perfilar una secuencia de sucesos en la que se observa que la transmisión intracelular de la información se hace paso a paso. Cada uno de estos pasos presenta determinada peculiaridad bioquímica o fisiológica que repercute en el paso siguiente. Por tratarse de la traducción secuencial de la información desde la superficie celular hasta el núcleo celular y hasta desencadenar la respuesta celular definitiva, a las sustancias implicadas en estos procesos se les ha denominado mensajeros. El presente artículo es una aproximación a los procesos celulares y moleculares que subyacen debajo de los mecanismos antidepresivos y al posible papel de estos mecanismos en la fisiopatología de la depresión.
Palabras clave: antidepresivos, depresión fisiopatológica, receptor celular, mensajero intracelular.
Abstract
Progress in molecular biology during the second half of last century made way to the development of methods to study neurotransmitter substances of the brain and the relationship of these substances with the neurons via the receptors. In the last thirty years a body of knowledge has been generated that examines the way in which neuronal receptors generate changes in the cells. For twenty years strategies have been developed to evaluate modifications in genetic transcription and the relationship between the stimulation of receptors and the genetic expression of neurons.
The systematizing of the information arising from these investigations permitted the profiling of a sequence of events in which it is observed that intracellular transmission of information is made step by step. Each one of these steps presents a certain biochemical or physiological peculiarity that rebounds in the following step. Because of the sequential translation of information from cellular surface to cellular nucleus to the unchaining of the definitive cellular expression, the substances implied in these processes have been named messengers. The present article examines the cellular and molecular processes that underlie antidepressant mechanisms and the possible role of these mechanisms in the physiophatology of depression.
Key words: Antidepressants, depression, physiophatology, cellular receptor, intracellular messenger.
Introducción
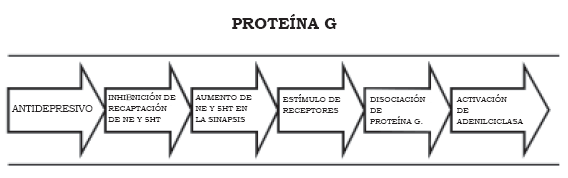
En los últimos años el uso de medicamentos antidepresivos se ha convertido en una de las principales estrategias para el tratamiento de la depresión y de otros trastornos psiquiátricos. Los inhibidores de la monoaminooxidasa (IMAO) y los antidepresivos tricíclicos (ADT) fueron los medicamentos de elección durante varias décadas, y su efectividad abrió las puertas para la comprensión de los posibles mecanismos fisiopatológicos de la depresión.
En la última década, los inhibidores selectivos de recaptación de serotonina (ISRS), los inhibidores selectivos de la recaptación de norepinefrina (ISRN) y los inhibidores duales se han constituido en medicamentos de suma importancia en el tratamiento de la depresión, no sólo porque en todos los casos su efectividad es comparable a la de los ADT, sino también por la seguridad en el uso, pues sus efectos colaterales son menos molestos y menos frecuentes. La especificidad del mecanismo de acción de los nuevos antidepresivos ha hecho posible estudiar de una manera más detallada los aspectos farmacológicos y los posibles fenómenos subyacentes detrás de la fisiopatología de la depresión (1),(2).
Durante la segunda mitad del siglo pasado los progresos en biología molecular permitieron desarrollar métodos para estudiar las sustancias neurotransmisoras del cerebro y su relación con las neuronas a través de los receptores. En los últimos treinta años se ha generado un cuerpo de conocimientos que se aproxima a explicar la forma como los receptores neuronales generan cambios en el interior de las células. Desde hace veinte años se han desarrollado estrategias para evaluar las modificaciones en la transcripción genética y el vínculo entre la estimulación de los receptores y la expresión genética de las neuronas (3).
La sistematización de la información proveniente de estas investigaciones ha permitido perfilar una secuencia de sucesos, en la que se observa que la transmisión intracelular de la información se hace paso a paso. Cada uno de estos pasos presenta determinada peculiaridad bioquímica o fisiológica que repercute en el paso siguiente (4). Por tratarse de la traducción secuencial de la información desde la superficie celular hasta el núcleo celular y hasta desencadenar la respuesta celular definitiva, a las sustancias implicadas en estos procesos se les ha denominado mensajeros.
Primer mensajero
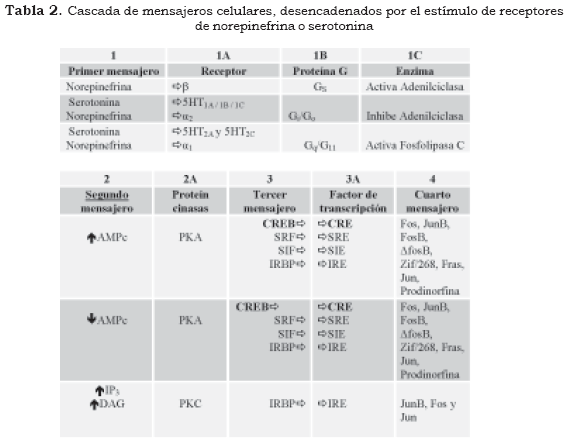
Los primeros mensajeros corresponden a sustancias químicas que producen su efecto en las neuronas y desencadenan una secuencia de fenómenos bioquímicos intracelulares (Figura 1 y Tabla 2 [1]). Los neurotransmisores y los neuromoduladores son primeros mensajeros que actúan sobre receptores específicos localizados normalmente en la superficie de la neurona (Figura 1 y Tabla 2 [1A]) mientras que las hormonas son los primeros mensajeros que actúan en receptores intracelulares (5). Los receptores sobre los cuales ejercen su efecto los primeros mensajeros se pueden dividir en varios grupos:
• Receptores ionotróficos: relacionados con la activación de un canal iónico, el cual, dependiendo del receptor, tiene una determinada selectividad a un ión. Su estimulación produce efectos rápidos de excitación o inhibición en la célula.
• Receptores metabotróficos: consisten en una larga molécula proteica con siete segmentos que atraviesan la membrana celular, se relacionan de forma directa con las proteínas G y su efecto fisiológico es más retardado que el de los receptores ionotróficos. Se postula que más del 80% de las sinapsis del cerebro se encuentran relacionadas con proteínas G y la activación de segundos mensajeros.
• Receptores con actividad enzimática intrínseca: la porción extracelular es el receptor propiamente dicho, y la porción intracelular corresponde a una enzima con actividad metabólica directa. Se han reconocido en diferentes tipos de receptores de este tipo enzimas como la tirosin cinasa, la guanilato ciclasa, la tirosin fosfatasa o la serin/treonin cinasa.
• Receptores sin actividad enzimática intrínseca que activan tirosin cinasas (receptores JAK/ STAT): la porción extracelular es el receptor propiamente dicho, y aunque la porción intracelular no es una enzima, su estructura se asocia con una tirosin cinasa citoplasmática de la subfamilia JAK (janus tirosine kinasa). Puede regular la expresión genética de la célula a través de unas proteínas intermedias denominadas STAT (signal transducer and activator of transcription).
• Receptores hormonales: son básicamente intracelulares y al activarse actúan como elementos transcripcionales.
El vínculo entre los receptores celulares metabotróficos y la activación del segundo mensajero está mediado por las proteínas transductoras denominadas proteínas G (proteínas ligadas a nucleótidos de guanosina). Las proteínas G se encuentran adosadas por enlaces covalentes en el interior de la membrana celular y están constituidas por tres subunidades diferentes (heterotrimérica) α, β y γ. En estado de reposo la subunidad α se encuentra acoplada a la guanosina difosfato (GDP) y a las unidades βγ (Figura 1 y Tabla 2 (1B).
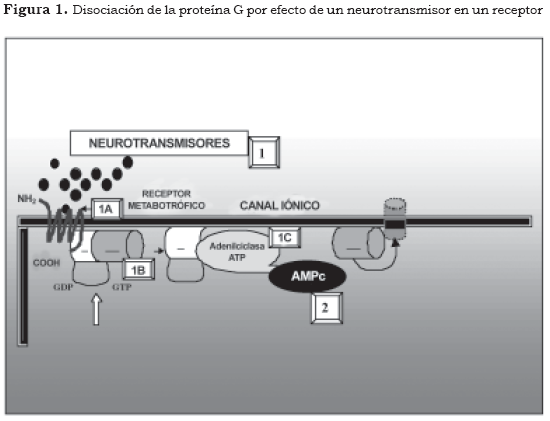
1. Neurotransmisor-primer mensajero
1A. Receptor
1B. Proteína G
1C. Enzima
2. Segundo mensajero
De acuerdo con la figura anterior, los antidepresivos aumentan la disponibilidad de serotonina y norepinefrina en el espacio sináptico, pero este aumento no se encuentra en relación directa con el efecto antidepresivo. Cuando un neurotransmisor se une a un receptor, la estructura tridimensional del receptor se modifica e induce un cambio en la conformación de la subunidad α de la proteína G, la cual se desliga de la molécula de GDP y se une a una molécula de guanosina trifosfato (GTP). Esta subunidad α-GTP y el dímero βγ tienen efectos fisiológicos, especialmente en la modificación de la actividad de las enzimas que sintetizan a los segundos mensajeros como la adenilciclasa, la guanidilciclasa, la fosfolipasa A y la fosfolipasa C; por su parte, el dímero âã tiene propiedades fisiológicas que le permiten variar las características de permeabilidad de algunos canales iónicos de potasio (Figura 1 [1A], [1B] y [1C]) (6).
Un estímulo de un receptor metabotrófico desencadena una respuesta intracelular ampliada gracias a la proteína G, pues ésta puede activar muchas veces la enzima efectora y generar la formación de muchas moléculas de segundos mensajeros. Después de que se desencadena este mecanismo, la subunidad á hidroliza espontáneamente a la GTP, así se vuelve al estado α-GDP, el cual nuevamente se une al dímero βγ y se forma otra vez el heterotrímero proteína G.
Primer mensajero y trastorno depresivo
La primera hipótesis contrastable relacionada con el origen biológico de la depresión partió de la observación de que muchos pacientes que tomaban reserpina, un medicamento antihipertensivo, desarrollaban cuadros depresivos graves. Experimentos de laboratorio mostraron que la reserpina tenía la capacidad de disminuir de forma drástica las aminas biógenas del cerebro, especialmente la norepinefrina y la serotonina, mediante un mecanismo de desaminación y disminución de la síntesis de estos neurotransmisores.
Se planteó entonces que la depresión podría ser el resultado de la disminución en la disponibilidad de aminas biógenas en el cerebro y que el incremento de éstos neurotransmisores en el espacio sináptico podrían aliviarla. Observaciones clínicas mostraron que algunos medicamentos utilizados para el tratamiento de la tuberculosis mejoraban de forma notable el estado de ánimo de los pacientes. Al rimifón (hidrácido del ácido isonicotínico) y a la iproniazida se les comprobó el efecto de inhibir a la enzima monoaminooxidasa. A partir de estas moléculas se sintetizaron posteriormente la tranilcipromina y la fenelzina, IMAO que incrementaban las aminas biógenas en el cerebro (7).
Además de los IMAO, todos los medicamentos antidepresivos utilizados en la clínica como los ADT, los ISRS, los ISRN y los antidepresivos modernos con acción dual tienen la capacidad de incrementar la serotonina o la norepinefrina en el cerebro. Partiendo de este hecho, se ha reforzado la teoría de que la depresión podría ser una alteración en la disponibilidad de serotonina o norepinefrina, sin embargo, las mediciones de estos neurotransmisores en estudios preclínicos y clínicos no han sido contundentes en demostrar su relación directa con la etiopatogenia de la depresión.
Algunos estudios post mórtem de pacientes suicidas han mostrado disminución de la concentración de serotonina en el cerebro, sin embargo, este hallazgo no es concluyente de que el déficit sea el responsable inmediato de la depresión (7). Cuando se usan medicamentos antidepresivos, se puede comprobar que la respuesta clínica no depende directamente de la modificación de la disponibilidad de la serotonina en el espacio sináptico, horas o minutos después del consumo de un ISRS. Cuando éste ha sido absorbido y alcanza el cerebro, pueden aparecer manifestaciones clínicas que resultan del incremento de la actividad de la serotonina como inquietud, ansiedad y temblor. La respuesta clínica antidepresiva es evidente sólo de la tercera a la quinta semana del tratamiento, mucho tiempo después del incremento del neurotransmisor en el espacio sináptico.
Por otro lado, estudios en pacientes depresivos a los que se mide el metabolito de la norepinefrina 3- metoxi-4-hidroxifenilglicol (MHPG) en orina de 24 horas han mostrado incremento en algunos y disminución o normalidad en otros. En el plasma de pacientes depresivos supresores del test de dexametasona se han detectado grandes concentraciones de norepinefrina (8). Los anteriores resultados corroboran el planteamiento de que la alteración primaria de la depresión no depende de la disponibilidad del neurotransmisor; se piensa, entonces, que en los casos del incremento de la norepinefrina o de su metabolito la alteración pueda deberse a la hiposensibilidad de los receptores. De hecho, se ha comprobado disminución de sitios de ligandos â adrenérgicos en plaquetas de pacientes depresivos (7).
Las alteraciones en la actividad noradrenérgica y serotoninérgica no han sido implicadas exclusivamente con la depresión, cambios en el metabolismo de estos neurotransmisores también se han comprobado en otras patologías como el trastorno obsesivo-compulsivo, los trastornos de ansiedad, los trastornos de la alimentación, el alcoholismo, el síndrome premenstrual y el trastornos por discontrol de impulsos (4),(9).
Segundo mensajero
El calcio (Ca++) es un importante segundo mensajero de la célula que ingresa al citoplasma por la activación de canales de calcio de la membrana celular o a través de los receptores glutamatérgicos ionotróficos de N-metil-D-aspartato (NMDA). Otros segundos mensajeros como el adenosin monofosfato cíclico (AMPc), el guanosin monofosfato cíclico (GMPc), el trifosfato de inositol (IP3), el diacilglicerol (DAG) y el ácido araquidónico resultan de la modificación de la actividad de enzimas sobre las que actúa la proteína G (Tabla 1).

Uno de los mecanismos más conocidos mediante los cuales los segundos mensajeros ejercen su efecto está dado por la capacidad que tienen de activar las proteín cinasas, especialmente la calciocalmodulin- proteín-cinasa II (CaMK II), la proteín cinasa A (PKA) y la proteín cinasa C (PKC) (Figura 2 y Tabla 2 [2] [2A]). La actividad de las proteín cinasas define en gran parte cambios moleculares y funcionales en la célula, pues mediante la fosforilación tienen la capacidad de modificar la actividad de receptores celulares, canales iónicos, proteínas del citoesqueleto, enzimas de síntesis de neurotransmisores, proteínas de las vesículas sinápticas y pueden modificar factores trancripcionales (terceros mensajeros) en el núcleo celular, lo que repercute en la expresión genética de la neurona (3),(10).
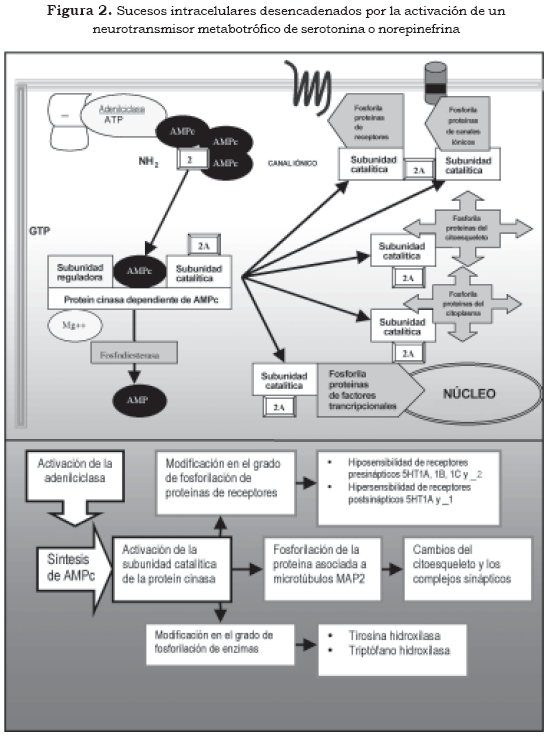
El Ca++ como segundo mensajero, además de promover la activación de las PKC, tiene la capacidad de promover la desfosforilación de proteínas por la activación de la calcineurina, que es una fosfatasa. De esta manera modifica de forma importante las estructuras proteicas y ejerce un poderoso efecto intracelular con implicaciones fisiológicas y metabólicas importantes. El Ca++ puede incrementar o disminuir el AMPc por efecto sobre las enzimas adenilciclasa y fosfodiesterasa, y puede activar la fosfolipasa A2, encargada de la síntesis del segundo mensajero ácido araquidónico. Por otra parte, el complejo Ca++/calmodulina tiene efecto sobre la óxido nítrico sintasa (NOS), enzima encargada de la síntesis del neurotransmisor gaseoso, y sobre el óxido nítrico (NO), que activa a la guanilciclasa, encargada de la síntesis del segundo mensajero GMPc. Además, el Ca++ tiene efectos sobre proteínas de transcripción, y así actúa en la regulación de la expresión de genes (8).
Segundo mensajero y trastorno depresivo
Como consecuencia del limitado poder explicativo de una alteración en la disponibilidad de neurotransmisores en el espacio sináptico en la depresión, en los últimos años se ha postulado el concurso de los sistemas intracelulares de mensajeros, no sólo en la etiopatogenia de la depresión, sino en el mecanismo de acción de los antidepresivos y los moduladores del afecto. En cultivos de fibroblastos de piel de pacientes con depresión mayor se comprueba una disminución en la capacidad de producción de AMPc basal al estimular los receptores β adrenérgicos. Similar hallazgo se encuentra en linfocitos expuestos al isoproterenol.
Se describe una relación significativa entre la presencia de insomnio de despertar, signo cardinal de la depresión mayor y una respuesta retardada a la estimulación del AMPc en linfocitos (11).
Como prueba del papel de los segundos mensajeros en la respuesta farmacológica antidepresiva, se ha desarrollado el rolipram, un medicamento inhibidor de la enzima fosfodiesterasa 4, encargada de la degradación del AMPc. Tal medicamento ocasiona un incremento de este segundo mensajero, ejerce un efecto antidepresivo y puede potenciar el efecto antidepresivo de otras drogas (12).
El incremento de serotonina o de norepinefrina en el espacio sináptico, producido por los antidepresivos por el bloqueo de los autorreceptores de serotonina (5HT1A, 5HT1B y 5HT1D) y por el bloqueo del autorreceptor adrenérgico α2, respectivamente, ocasiona una estimulación sostenida de los receptores postsinápticos serotoninérgicos 5-HT4, 5-HT6 y 5- HT7 y de receptores β adrenérgicos, los cuales a través de la proteína Gs activan la adenilciclasa e incrementan el AMPc, especialmente en compartimientos celulares como terminales sinápticas o fracciones de microtúbulos (12).
La estimulación de la proteína Gs, la consecuente liberación del dímero βγ y la producción del AMPc ocasionan cambios relativamente rápidos en la fisiología de los receptores tanto presinápticos como postsinápticos. Estos cambios pueden deberse en parte a la activación de proteín cinasas citoplasmáticas, que desencadenan modificaciones en el grado de fosforilación de las proteínas del receptor, lo cual se puede traducir en un aumento o una disminución de la capacidad de respuesta eléctrica de la membrana neuronal (3),(4).
Los receptores presinápticos de serotonina (5TH1A, 5HT1B y 5TH1D) y los autorreceptores α2 de la corteza cerebral se tornan hiposensibles pocos días después de iniciado el tratamiento antidepresivo. Este fenómeno ocasiona un incremento de la disponibilidad del neurotransmisor en el espacio sináptico, pues se disminuye la retroalimentación de inhibición. Sin embargo, en experimentos clínicos y preclínicos se ha mostrado que el antagonismo farmacológico como tal de estos receptores no es el responsable directo del efecto antidepresivo, sino que ocurre en el transcurso de pocas horas después de consumir el medicamento, y, a pesar de esto, tal efecto tarda varias semanas en manifestarse (5).
Si bien, el receptor presináptico de 5TH1A se hace hiposensible pocos días después de iniciado el tratamiento antidepresivo, los receptores postsinápticos 5TH1A se tornan hipersensibles por cambios en su estado de fosforilación. Observaciones preclínicas muestran que este efecto es necesario, pero no suficiente para producir el resultado antidepresivo (7).
2. Segundo mensajero
2A Fosforilación de proteínas por la subunidad catalítica de la proteín cinasa
En estudios preclínicos se ha observado que los antidepresivos disminuyen la actividad funcional (hiposensibilidad) de los receptores β1 adrenérgicos en la corteza cerebral y en las estructuras límbicas, como la corteza del cíngulo, la corteza entorrinal y el hipocampo. Este cambio se observa en los primeros cinco días del tratamiento, mucho antes de que se presente la respuesta antidepresiva. Sin embargo, la modificación en la sensibilidad del receptor β1 no se asocia con el efecto antidepresivo, pues se ha observado que la inhibición de los receptores β adrenérgicos con antagonistas selectivos no mejoran la depresión, al contrario, la facilitan (7).
En estudios preclínicos se ha encontrado que el tratamiento crónico con desipramina, un antidepresivo clásico, incrementa el grado de fosforilación de los residuos de serina de la proteína asociada a microtúbulos (MAP2), sin afectar la concentración de proteína. Para tal efecto, participan proteín cinasas activadas por segundos mensajeros como la PKA y la CaMK II. El incremento del estado de fosforilación de la MAP2 disminuye la capacidad de ensamblaje de las unidades de tubulina de los microtúbulos y de esta manera modifica el citoesqueleto de la neurona, especialmente en las terminales sinápticas y las dendritas, lo que hace evidente un fenómeno de plasticidad. Este efecto, también se ha observado en el lapso de los primeros cinco días de uso de los ISRS, pero no con el uso de IMAO (13).
Por otro lado, la actividad y el estado de fosforilación de la tirosina hidroxilasa y de la triptófano hidroxilasa, enzimas implicadas en la síntesis de dopamina y serotonina respectivamente, se encuentran modificadas por el uso prolongado de antidepresivos. Al parecer la activación de algunas proteín cinasas con efecto específico sobre estas enzimas son el resultado de la modificación en la disponibilidad de los segundos mensajeros en la neurona (5).
Estudios preclínicos han mostrado que el uso crónico de antidepresivos puede inhibir de forma directa la disociación de algunas proteínas G y de esta manera interferir con la activación de la adenilciclasa, la producción de AMPc y la activación de la PKA (6). Algunos inhibidores de receptores de recaptación interfieren con la unión entre el AMPc y la subunidad reguladora de la PKA tipo II, pero no con la PKA tipo I. Si bien la actividad de la PKA se puede disminuir, en el citoplasma se ha observado que se incrementa en fracciones nucleares de la corteza prefrontal de ratas. El efecto de los antidepresivos sobre la PKA parece ser específico, pero no se ha observado con haloperidol, morfina o carbamacepina, y aún se desconoce si esta disminución se da en condiciones clínicas y si tiene alguna repercusión en el mecanismo antidepresivo (8).
El litio es un medicamento que tiene una importante función terapéutica como modulador del afecto y, asimismo, es un ejemplo de sustancia que actúa directamente sobre los sistemas de segundos mensajeros intracelulares (14). El litio modifica la actividad de la PLC, enzima que repercute sobre las concentraciones de DAG e IP3. Se conoce que el IP3 regula el Ca++ intracitoplasmático, al modular los canales de Ca++ del retículo endoplásmico, la mitocondria y los calciosomas. A través de esta vía, el litio, además, puede regular la función de los receptores á1 adrenérgicos y 5-HT2.
El litio incrementa la actividad y la expresión de la adenilciclasa I y II, lo cual influye en la disponibilidad del AMPc en la célula, y se ha observado especialmente en neuronas de la corteza prefrontal (15). Por otro lado, el litio puede inhibir de forma directa la actividad de fosfotransferasa de la PKA, por competición con el magnesio en la subunidad catalítica de esta proteín cinasa. Un fenómeno similar se ha comprobado con la carbamacepina (14).
Se ha demostrado clínicamente la capacidad que tiene el carbonato de litio para potenciar el efecto terapéutico de los antidepresivos (9); mientras que la PKA puede modificar el estado funcional de los receptores serotoninérgicos y noradrenérgicos. El efecto que tiene el litio sobre la fosfotransferasa de PKA puede considerarse como uno de los mecanismos asociados con la potenciación del efecto antidepresivo. Por otro lado, los cambios en la actividad y expresión de la adenilciclasa, sin duda, tienen también un efecto en la modificación de la respuesta antidepresiva (15).
Con las anteriores observaciones se puede inferir que el papel de la cascada segundo mensajero-activación de proteín cinasa-fosforilación de proteínas parece desempeñar una importante función en el efecto farmacológico de los antidepresivos, especialmente en los primeros días del tratamiento; pero es muy discutido su desempeño en la respuesta a largo plazo o en la etiopatogenia de la depresión. Es posible que la activación o inhibición de sistemas de segundos mensajeros en el citoplasma celular sea la antesala para el establecimiento de eventos más definidos y definitivos en la célula por la repercusión que estas vías ejercen sobre la célula en el núcleo celular a través de los terceros mensajeros.
Tercer mensajero
Las subunidades catalíticas de las proteín cinasas, activadas con el concurso del AMPc, además de producir su efecto sobre las proteínas de la membrana o del citoplasma, pueden ser transferidas al núcleo donde actúan sobre los sistemas reguladores relacionados con la transcripción genética de la neurona. Estos sistemas reguladores definen qué fragmento de ADN se va a transcribir, en cuáles circunstancias bioquímicas y en qué momento se debe finalizar la transcripción (3),(4),(10). Los elementos transcripcionales más conocidos por sus repercusiones fisiológicas son el CREB (ciclic AMP response element binding protein) y el factor nuclear Kappa B (FN-κB), que modificados por la fosforilación se consideran los terceros mensajeros de la cascada bioquímica desencadenada por los neurotransmisores y las hormonas (Figura 3 y Tabla 2 [3]).
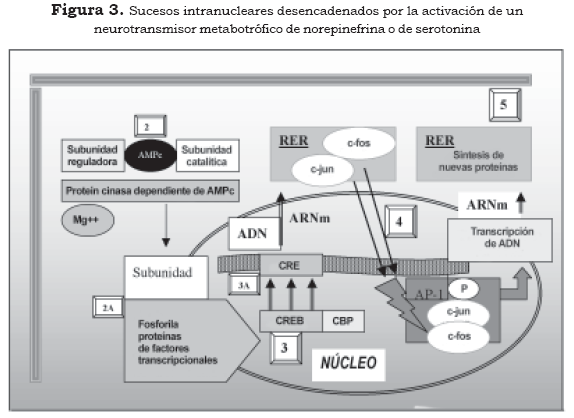
2. Segundo mensajero
2A Fosforilación de proteínas
3. Elemento transcripcional-CREB
3A Elemento transcripcional-CRE
4. Cuarto mensajero
5. Quinto mensajero
*RER: retículo endoplásmico rugoso El FN-κB es un factor transcripcional que se diferencia del CREB, porque se activa en la membrana celular por la fosforilación a cargo de la PKC, se traslada al núcleo donde se acopla al elemento transcripcional adosado al ADN y activa genes que se relacionan con la síntesis de citocinas (10). El traspaso de fracciones catalíticas activadas de proteín cinasas al núcleo celular pueden fosforilar muchos otros tipos de proteínas relacionadas con la regulación de la transcripción genética como la ARN-polimerasa, la topoisomerasa, las histonas y los factores de iniciación y de elongación (10).
Tercer mensajero y trastorno depresivo
En pacientes con depresión mayor no tratados se ha comprobado al teración en la activación y disminución en las concentraciones del CREB en células sanguíneas (16). Esta observación abre las puertas para plantear la hipótesis de la etiopatogenia de la depresión como una alteración de los sistemas transcripcionales, que pueden tener repercusión en las características funcionales y estructurales de la célula.
Tanto los antidepresivos como los estabilizadores del estado de ánimo influyen en el grado de fosforilación de la CREB y pueden modular su función y su síntesis, efectos no observados con haloperidol, morfina o cocaína. En general, los antidepresivos que aumentan las concentraciones de serotonina o norepinefrina desencadenan respuestas bioquímicas que finalmente generan un aumento de ARNm del CREB (14), (16). En el hipocampo, el incremento del AMPc por el rolipram, inhibidor selectivo de la fosfodiesterasa 4, produce de forma rápida la fosforilación del CREB (17).
Parece que el efecto del CREB en el núcleo puede tener repercusión en la síntesis de proteínas de receptores de aminas biógenas, lo que ocasiona una modificación de la sensibilidad de la neurona a la serotonina o a la norepinefrina. Estos efectos ocurren en el transcurso de semana y podrían tener relación con la respuesta antidepresiva a los fármacos (7),(16).
Cuarto mensajero
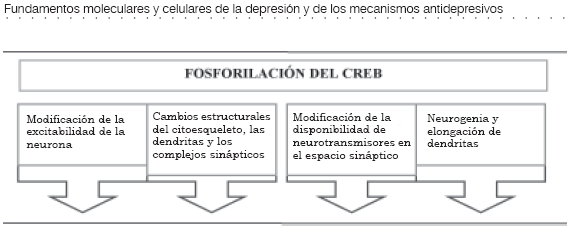
El elemento transcripcional CREB al ensamblarse con el elemento CRE tiene la capacidad de activar genes de expresión rápida de la familia fos (c-Fos, Fra-1, Fra-2 y Fos-B) y de la familia jun (c-Jun, Jun-B y Jun-D) (Figura 3 y tabla 2 [4]). La proteína fos o la proteína jun, que resulta de la transcripción de estos genes, forman homodímeros (fos-fos o jun-jun) o heterodímeros (fos-jun), que hacen parte de la estructura transcripcional denominada complejo AP-1 (activator protein-1) (10).
El complejo AP-1 tiene la capacidad de regular la transcripción de genes de expresión tardía y se considera que es uno de los efectores finales mediante el cual las neuronas se adaptan a los patrones de estimulación.
El resultado definitivo es la síntesis de una proteína que ejercerá su efecto en algún lugar definido de la célula y se puede considerar a esta proteína el quinto mensajero (Figura 3 y tabla 2 (5) (3), (4),(10).
Cuarto mensajero y trastorno depresivo
Después de varios días, cuando se observa tolerancia a los efectos adversos agudos de los antidepresivos, se empieza a insinuar la respuesta clínica esperada, lo cual ocurre entre las semanas tercera a sexta de tratamiento. Se piensa que son los cambios en la transcripción genética de la neurona los hechos que pueden estar implicados en la respuesta clínica definitiva a estos fármacos.
Se ha observado que los antidepresivos tienen la capacidad de regular la síntesis de proteína c-fos en el cerebro. La modulación de genes c-fos es un indicio de la repercusión que tienen los antidepresivos en el núcleo celular. De hecho, la inducción de genes c-fos, ocasionada por el estrés, es revertida por los antidepresivos (18).
Tanto los antidepresivos como los estabilizadores del estado de ánimo influyen en la concentración y en el grado de fosforilación del complejo transcripcional AP-1. Las consecuencias de estos cambios cada vez generan más interés, pues se ha observado en estudios clínicos y preclínicos que a largo plazo los antidepresivos tienen ingerencia en la activación o desactivación de la síntesis de proteínas funcionales y estructurales. Entre los hallazgos más reconocidos se encuentran los siguientes (7),(8),(10):
• Disminución de la densidad de los receptores 5HT2 y 5-HT7 corticales.
• Incremento de la densidad de los receptores postsinápticos 5HT1A del sistema límbico.
• Incremento de la densidad de receptores α1 adrenérgicos corticales.
• Disminución de la densidad de receptores β1 adrenérgicos en corteza cerebral y en estructuras límbicas, como la corteza del cíngulo, la corteza entorrinal y el hipocampo.
• Incremento de la síntesis de fracciones de microtúbulos en compartimientos específicos de la célula. Por lo tanto, cambios en las características del citoesqueleto neuronal y posible remodelación de las dendritas y complejos sinápticos.
• Incremento de la inmunorreactividad y la densidad de receptores de glucocorticoides en los cuerpos celulares de neuronas serotoninérgicas y dopaminérgicas.
• Disminución del ácido ribonucleico mensajero (ARNm) de la tirosina hidroxilasa en células noradrenérgicas
• Incremento de la síntesis y de las concentraciones del factor neurotrófico derivado del cerebro (BDNF).
• Incremento de la síntesis del receptor de tirosin cinasa de la neurotrofina B (TrkB).
• Incremento de factor 2 de crecimiento fibroblástico.
Los cambios en la proporción de receptores celulares y de enzimas modifican de forma importante la sensibilidad de las células y su realidad fisiológica. Estos cambios repercuten sobre otras neuronas con las cuales tiene conexiones, y de esta forma se generalizan respuestas neurofisiológicas que podrían ser las responsables del efecto antidepresivo. El incremento en la síntesis de proteínas estructurales y, especialmente, la activación de los genes del BDNF, del factor 2 de crecimiento fibroblástico y del receptor de tirosin cinasa TrkB, que repercuten sobre la organización dendrítica y la división celular de las neuronas, agregan una dimensión insospechada al efecto de los antidepresivos en el sistema nervioso (10).
Modificaciones estructurales y morfológicas
El estudio del cerebro adulto en las últimas dos décadas ha sorprendido a los científicos, por los hallazgos de los permanentes cambios que tienen las neuronas como respuesta a los estímulos provenientes del ambiente interno y del ambiente externo (19). Estos cambios se expresan no sólo en el entorno de lo molecular, sino en los aspectos morfológicos, en la permanente formación y retracción de espinas dendríticas y en la estimulación o inhibición de la división celular en estructuras particulares del cerebro como el giro dentado del hipocampo y el bulbo olfatorio.
Se ha estimado que en el giro dentado de un roedor adulto se producen alrededor de 250.000 neuronas granulares nuevas por mes, es decir, 6% del número total de células de esta estructura. De igual manera, durante el mismo período desaparece una proporción similar de neuronas, esto hace que el tamaño de la estructura permanezca estable —aproximadamente el 75% de estas nuevas células corresponden a neuronas, el 10% a células gliales y el resto a células no determinadas (10)—.
Los ambientes ricos en estímulos sensoriales, la interacción social, el juego y el ejercicio estimulan la neurogenia (20).
Se ha comprobado experimentalmente que los antidepresivos producen a largo plazo un incremento del número de células que captan las bases nitrogenadas [3H]timidina y Bromo- deoxi-uridina (BrdU) en el hipocampo como signo del aumento de la síntesis de ácidos nucleicos. El incremento de AMPc y de Ca++ intracelular, desencadenado por el aumentos de serotonina y norepinefrina, facilitan la fosforilación del CREB, la activación de genes de expresión rápida y, después, la activación de genes de expresión tardía que, entre otros, corresponden a los factores tróficos BDNF y Factor 2 de crecimiento fibroblástico, los cuales tienen la capacidad de fomentar la sobrevida de las neuronas y de la glia, estimular la neurogenia e intervenir en la remodelación de las espinas sinápticas (10).
Los hallazgos de neuroprotección y neurogenia son notables cuando se comprueba el efecto clínico de los antidepresivos. De hecho, la inhibición de la actividad serotoninérgica, especialmente de los receptores 5-HT2A y 5-HT7, disminuye significativamente la expresión de BDNF y, por lo tanto, la proliferación de las células granulares en el hipocampo (7). Con los medicamentos antipsicóticos no se han comprobado efectos sobre la neurogenia.
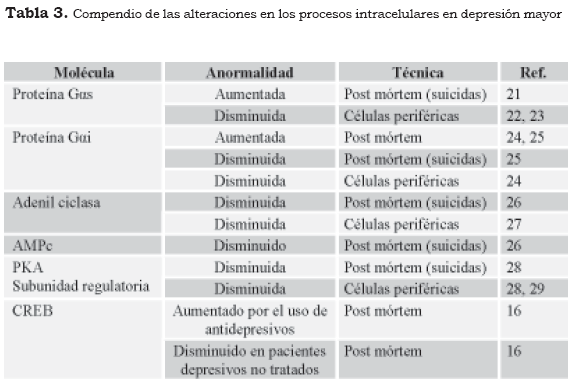
El estrés crónico ocasiona un incremento sostenido de gluococorticoides sanguíneos, los cuales al actuar sobre el receptor hormonal modifican la actividad del CREB y disminuyen la síntesis del BDNF. En estudios imagenológicos, por ejemplo, la resonancia magnética nuclear, de pacientes con hipercortisolemia, como en la enfermedad de Cushing, en la depresión mayor y en el trastorno de estrés postraumático, se ha observado la disminución del volumen del hipocampo, si se compara con personas asintomáticas, pues con el tratamiento antidepresivo a largo plazo se recupera el tamaño y la conectividad del hipocampo (9). En la Tabla 3 se muestran los cambios en estudios clínicos y post mórtem, que señalan la participación de los sistemas de mensajeros en el trastorno depresivo mayor.
Conclusión
La modificación de la actividad de algún receptor celular por el efecto de una sustancia endógena o por una sustancia exógena agonista o antagonista puede tener variadas repercusiones en los sistemas de segundos mensajeros de la célula, lo cual depende del tiempo de estimulación o de bloqueo del receptor. La respuesta celular se despliega en secuencias temporales, es decir, el efecto final de activación de genes de expresión tardía resulta después de días de estimulación y puede significar la síntesis de factores neurotróficos que tienen implicaciones evidentes en la neurona, como la formación de nuevas espinas dendríticas o la síntesis de receptores celulares. El avance en la comprensión de los sucesos intracelulares desencadenados por la modificación de la actividad de receptores por efecto de sustancias endógenas o exógenas ha ampliado significativamente el panorama de las posibilidades terapéuticas y de las explicaciones fisiopatológicas de los trastornos psiquiátricos. Seguramente en el futuro se crearán medicamentos con la posibilidad de modular directamente los sistemas intracelulares y se avanzará en la comprensión de los efectos reales del bloqueo o de la activación de receptores en la superficie de la membrana neuronal. La repercusión clínica y farmacológica de éstos avances es indiscutible.
Bibliografía
1. Arango C, Pimienta H, Escobar M. Depresión postisquemia cerebral: una aproximación fisiopatológica y clínica. Revista Colombiana Psiquiatría 2000; 24:321-44. [ Links ]
2. Arango C. Mecanismos celulares de los antidepresivos. Avances en Psiquiatría Biológica 2002;3:98-109. [ Links ]
3. Arango C. Aspectos moleculares y funcionales de los receptores, los neurotransmisores, los neuromoduladores y las hormonas. In: Fundamentos de psiquiatría clínica: niños, adolescentes y adultos. Gómez-Restrepo C, Hernández G, Rojas A, Santacruz H, Uribe M., editors. Bogotá: Centro Editorial Javeriano (CEJA); 2002. p. 49-59. [ Links ]
4. Arango C. Aspectos celulares y moleculares en psiquiatría. In: Fundamentos de psiquiatría clínica: niños, adolescentes y adultos. Gómez-Restrepo C, Hernández G, Rojas A, Santacruz H, Uribe M, editors. Bogotá: Centro Editorial Javeriano (CEJA); 2002. p. 36-48. [ Links ]
5. Duman RS, Nestler EJ. Signal transduction pathways for catecholamine receptors. In: Bloom FE, Kupfer DJ, editors. Psychopharmacology: the fourth generation of progress. New York: Raven Press; 1995. p. 303-20. [ Links ]
6. Manji HK. G proteins: implications for psychiatry. Am J Psychiatry 1992; 149: 746-60. [ Links ]
7. Duman RS, Heninger GR, Nestler EJ. A molecular and cellular theory of depression. Arch Gen Psychiatry 1997; 54: 597-606. [ Links ]
8. Charney D, Nestler E, Bunney B. Neurobiology of mental illness. Oxford: Oxford University Press; 1999. p. 958. [ Links ]
9. Fogel B, Schiffer R. Neuropsichiatry. Williams and Wilkins; 1998. p. 131. [ Links ]
10. Reith M. Cerebral signal trasduction: from first to fourth messengers. Human Press; 2001. p. 292. [ Links ]
11. Mann JJ, Halper JP, Wilner PJ, et al. Subsensitivity of adenylyl cyclase-coupled receptors on mononuclear leukocytes from drug-free inpatients with a major depressive episode. Biol Psychiatry 1997; 42:859-70. [ Links ]
12. Pérez J, Tardito D, Mori S, Racagni G, Smeraldi E, Zanardi R. Abnormalities of cAMP signaling in affective disorders: implication for pathophysiology and treatment. Bipolar Disord 2000; 2:27-36. [ Links ]
13. Manier DH, Eiring A, Shelton RC, Sulser F. B-adrenoreceptor-linked protein kinase A (PKA) activity in human fibroblasts from normal subjects and from patients with major depression. Neuropsychopharmacol 1996;15:555-61. [ Links ]
14. Manji HK, Potter WZ, Lenox RH. Signal transduction pathways: molecular targets for lithium’s actions. [Arch Gen Psychiatry 1995;52:531-43. [ Links ]
15. Zanardi R, Racagni G, Smeraldi E, Pérez J. Differential effects of lithium on platelet protein phosphorylation in bipolar patients and healthy subjects. Psychopharmacol 1997;129:44-7. [ Links ]
16. Dowlatshahi D, MacQueen GM, Wang JF, Young LT. Increased temporal cortex CREB concentrations and antidepressant treatment in major depression. Lancet 1998;352:1754-5. [ Links ]
17. Mooney JJ, Samson JA, McHale NL, et al. Signal transduction by platelet adenylate cyclase: alterations in depressed patients may reflect impairment in the coordinate integration of cellular signals (coincidence detection). Biol Psychiatry 1998;43:574-83. [ Links ]
18. García-Sevilla JA, Escriba PV, Ozaita A, et al. Up-regulation of immunolabelled a2A-adrenoreceptors, Gi coupling proteins, and regulatory receptor kinases in the prefrontal cortex of depressed suicides. J Neurochem 1999;72:282-91. [ Links ]
19. Arango-Dávila C, Cardona-Gómez, Gallego- Gómez J, Escobar M, García- Segura LM, Pimienta H. Down-regulation of Bcl-2 in rat substantia nigra after focal cerebral ischemia. Neuroreport 2004; 15:1437-41. [ Links ]
20. Trejo J, Carro E, Torres-Alemán I. Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. The Journal of Neuroscience 2001;2:1628-34. [ Links ]
21. Ozawa H, Gsell W, Frolich L. Imbalance of the Gs and Gi/o function in post-mortem human brain of depressed patients. J Neural Transm Gen Sect 1993;94:63-9. [ Links ]
22. Pacheco MA, Stockmeier C, Meltzer HY, Overholser JC, Dilley GE, Jope RS. Alterations in phosphoinositide signaling and G-protein levels in depressed suicide brain. Brain Res 1996;723:37-45. [ Links ]
23. Young LT, Li PP, Kamble A, Siu KP, Warsh JJ. Mononuclear leukocyte levels of G proteins in depressed patients with bipolar disorder or major depressive disorder. Am J Psychiatry 1994;151:594-6. [ Links ]
24. Avissar S, Nechamkin Y, Roitman G, Schreiber G. Dynamics of ECT normalization of low G protein function and immunoreactivity in mononuclear leukocytes of patients with major depression. Am J Psychiatry 1998;155:666-71. [ Links ]
25. García-Sevilla JA, Walzer C, Busquets X, Escriba PV, Balant L, Guimón J. Density of guanine nucleotide-binding proteins in platelets of patients with major depression: increased abundance of the G Dowlatshahi D, MacQueen GM, Wang JF, Reiach JS, Young TL. G protein-coupled cyclic AMP signaling in postmortem brain of subjects with mood disorders: effects of diagnosis, suicide, and treatment at the time of death. J Neurochem 1999; 73: 1121-6. [ Links ]
26. Musselman DL, Tomer A, Manatunga AK, et al. Exaggerated platelet reactivity in major depression. Am J Psychiatry. 1996; 153:1313-1317. [ Links ]
27. i2 subunit and down-regulation by antidepressant drug treatment. Biol Psychiatry 1997:42:704-12. [ Links ]
28. Dwivedi Y, Conley R, Roberts R, Tamminga C, Faludi G, Pandey GN. Reduced [3H] cyclic AMP binding sites and PKA activity in the prefrontal cortex of suicide subjects. Abstr Soc Neurosci 1999; 839: 2097. [ Links ]
29. Pérez J, Tardito D, Racagni G, Smeraldi E, Zanardi R. Protein kinase A and Rap1 levels in platelets of untreated patients with major depression. Mol Psychiatry 2001;6:44-9. [ Links ]














