Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Psiquiatría
versão impressa ISSN 0034-7450
rev.colomb.psiquiatr. v.35 n.2 Bogotá abr./jun. 2006
Silvia Lucía Gaviria A.1
1 Médica psiquiatra, jefe del Área de Psiquiatría, Universidad CES, Medellín. sgaviria1@epm.net.co
Resumen
Objetivo: Examinar la literatura actual sobre los factores que producen estrés en la madre embarazada, con posibles repercusiones en el neurodesarrollo del feto. Método: Se realiza una revisión de artículos relevantes relacionados con el tema en MedLine y otras fuentes científicas. Conclusiones:La mayoría de los trastornos mentales y del neurodesarrollo no se deben únicamente a una causa lineal; son el resultado de la interacción de factores de riesgo genético y ambiental. El estrés materno puede provenir de factores psicosociales, complicaciones obstétricas, enfermedades psiquiátricas, respuesta emocional al embarazo u otras causas. Estas variables producen respuestas emocionales y fisiológicas en la madre, las cuales repercuten en feto. Las respuestas emocionales y fisiológicas de la madre a los estresores se traducen en cambios fisiológicos y metabólicos, como hipoxia, aumento de los niveles de cortisol, desnutrición y presencia de sustancias tóxicas. El feto puede responder en forma adaptativa o desadaptativa. Solamente en las últimas décadas hemos podido comprender que nuestra vida fuera del útero es determinada en gran parte por las 40 semanas que vivimos dentro de él. Existen suficientes pruebas de que muchos de los trastornos neurológicos y del comportamiento tienen sus orígenes durante la vida fetal.
Palabras clave: estrés, neurodesarrollo, psicopatología.
Abstract
Objective: The objective of this revision is to examine recent literature in relation to the factors that produce stress in the pregnant mother which could affect her physical and mental health with possible repercussions in the neurodevelopment of the fetus. Method: A review was undertaken of relevants articles on MedLine and other scientific sources. Conclusion: Most of the mental and neurodevelopment disorders are not due only to one lineal cause; they are the result of the interaction between genetic and environmental risk factors. Maternal stress can be attributed to psychosocial factors, obstetric complications, psychiatric disorders, emotional response to pregnancy and other causes. These variables produce funemotional and physiological responses in the mother, these in turn, can influence the fetal wellbeing. The physiological and emotional responses of the mother to stressors are in turn reflected in physiological and metabolic changes, such as hypoxia, increase of cortical levels, malnutrition, the existence of toxic substances that may affect the maternal fetal unity and of course, the uterine environment. The fetus may respond in an adaptative or non-adaptative way. Only in the last decades we have been able to understand that our life outside the uterus is determined in great extent by the 40 weeks that we live inside it. There is enough evidence alluding to the fact that many of the neurological and behavioral disorders have their origins during life in the uterus.
Key words: Prenatal stress, uterine environment, neurodevelopment, psychopathology.
Para entender bien la plasticidad del cerebro en desarrollo, hay que crear primero una plasticidad en nuestro modo de pensar. Harvey B. Sarnat
Introducción
La hipótesis que relaciona el estrés prenatal materno con trastornos del neurodesarrollo en el niño fue propuesta muchos años atrás, pero los pocos estudios existentes en esta área adolecen de fallas metodol ógicas, como muestras pequeñas, falta de control estadístico de las variables de confusión o informes retrospectivos que fallan en distinguir el estrés prenatal del estrés posnatal (1).
Los trastornos del neurodesarrollo son lesiones cerebrales que se expresan como trastornos neuropsiqui átricos, cuyo origen estaría relacionado tanto con los períodos del desarrollo intrauterino como con el período sensitivo posparto (2).
Existen numerosos estudios en animales que demuestran cómo el estrés prenatal materno puede causar alteraciones comportamentales en la cría. Experimentalmente, el estrés prenatal inducido aumenta las alteraciones en un rango de comportamientos. En las ratas aparece disminuci ón del comportamiento típico de género, incremento de la respuesta al estrés y retardo neuromotor, y una disminución en el período de atención en los primates no humanos (1).
El ambiente intrauterino puede afectar significativamente el desarrollo cerebral del feto. En los modelos experimentales con animales, en los cuales se inducen condiciones intrauterinas adversas, que podrían existir durante la gestación humana, se han evaluado los efectos de las exposiciones agudas y crónicas a factores nocivos y las alteraciones producidas por los procesos inflamatorios (3). Los modelos animales est án ayudando a clarificar el papel de las citocinas en el comportamiento de la enfermedad psiquiátrica. Éstas ocupan una posición central en la teoría del neurodesarrollo en la esquizofrenia (4).
Períodos relativamente breves de hipoxia pueden tener efectos significativos en el cerebro fetal y producir pérdida de neuronas y daños en la materia blanca. La insuficiencia placentaria crónica puede resultar en deficiencias en las conexiones neuronales que inciden en las funciones en la vida posnatal, como son la auditiva y la visual. La exposición aguda y repetida a agentes inflamatorios resulta en daño subcortical difuso de la materia blanca y en algunos casos en necrosis periventricular (3).
Las regiones cerebrales se forman en diferentes momentos o etapas de la gestación. El primero es el tallo, luego los hemisferios y, por último, el cerebelo. En consecuencia, el momento de la gestación en que ocurre la lesión, su gravedad y su extensión determinarán el tipo de afectación funcional del individuo después de nacer y la expresión de los trastornos neurocognitivos y comportamentales.
El desarrollo de la corteza cerebral ocurre en etapas gestacionales definidas, conocidas como neurogé- nesis, migración neuronal y diferenciaci ón neuronal. Estos eventos suceden durante discretas ventanas de tiempo y se extienden hasta el período prenatal tardío y período posnatal temprano en roedores, primates y humanos. Las lesiones en estados particulares del desarrollo pueden conducir a distintas anormalidades corticales, incluida hipoplasia cortical (reducido número de células), ectopia cortical (anormalidades en la migración) y displasia cortical (anormalidades en la forma o número de dendritas) (5).
Solamente en las últimas décadas hemos podido comprender que nuestra vida fuera del útero es determinada en gran parte por las cuarenta semanas que vivimos dentro de él. Existen suficientes hallazgos respecto a que muchos de los trastornos neurológicos y del comportamiento, que se expresaban después del nacimiento, tienen sus orígenes durante la vida fetal (3,6).
La disfunción cerebral mínima, tipificada por dificultades en la escritura, la lectura y problemas cognitivos, a menudo se asocia con retardo en el crecimiento intrauterino. La esquizofrenia no puede ser atribuida enteramente a la herencia genética. Sobre la base de las observaciones histológicas y neuroqu ímicas se ha propuesto que la exposición prenatal a circunstancias ambientales nocivas resulta en una vulnerabilidad para el desarrollo cerebral en individuos con factores de riesgo predisponentes (como la herencia genética). La epilepsia y el autismo también son considerados, en parte, resultado de problemas del neurodesarrollo (7-10).
El impacto de la vida fetal en la salud a través del curso de la vida cobra cada vez mayor importancia en las diferentes disciplinas médicas. Aspectos como la nutrición intrauterina, factores endocrinos como la hormona del crecimiento, los glucocorticoides y el peso al momento de nacer son estudiados en relación con el desarrollo físico y psíquico del individuo. Recientemente ha merecido gran interés al peso del feto al nacer como indicador de enfermedades cardiovasculares, cáncer de seno y problemas del neurodesarrollo (6).
En esta revisión se aplica un modelo integracional centrado en el hecho de que el comportamiento humano se ordena paulatinamente desde el ambiente intrauterino. Los sistemas de relación se organizan hacia la complejidad a partir de procesos de diferenciación celular y de especialización funcional. Por lo tanto, es necesario invocar el análisis del desarrollo neurocognitivo y comportamental no sólo dentro del texto implícito de sus finas dinámicas moleculares, sino también a partir de su contexto.
Cambios en el modelo conceptual de la etiopatogenia
En los escritos hipocráticos aparecen referencias específicas con relación a susceptibilidad a la enfermedad en etapas tempranas del desarrollo fetal, pero en aquella época fue poca la importancia atribuida al proceso del desarrollo temprano del individuo.
Durante el siglo XVII predominan los modelos físico-matemáticos para el entendimiento de los fenó- menos naturales. La tendencia mecanicista se enfocó en la interpretaci ón de los órganos sensoriales y al sistema nervioso del sujeto que percibe.
En el siglo XIX, cuando el modelo positivista se consolida, se da paso a una fisiología del sistema nervioso tangible y registrable. Los logros alcanzados por Ramón y Cajal no se limitan a las descripciones morfológicas, sino que trascienden el campo de la fisiología, con diferentes propuestas acerca de la diversidad y especificidad funcional de la neurona, que se constituyó en la plataforma de múltiples progresos cient íficos y tecnológicos del siglo XX.
En la segunda mitad del siglo XX se rompe con el modelo molecularista (reduccionista) para explicar la vida y su tendencia a la complejidad. Surge la teoría general de sistemas, como propuesta de unificación del comportamiento de los sistemas en función de los procesos y no de sus componentes aislados. Los principios de unicausalidad se transforman en relaciones multidireccionales, multicausales y multidimensionales. La ontogenia, mirada desde el conjunto de las poblaciones celulares integradas en sus múltiples relaciones de interdependencia intrínsecas (léase genómicas) y extrínsecas (léase ambientales), establece una diferencia radical en las concepciones previas reduccionistas y de alguna forma desintegrativas (2,11,12).
El neurodesarrollo: un continuo
La psicopatología y la neuropsiquiatr ía del desarrollo hacen hincapi é en el complejo interjuego entre múltiples factores de riesgo y factores protectores. Tales factores son de orden genético, neuroendocrino, ambiental y psicosocial, que interact úan con factores adversos durante el embarazo, el parto, el período neonatal y durante la infancia. Los factores de riesgo se han visto como causales, pero, más que esto, contribuyen con un proceso dinámico e interactivo en el tiempo (13).
Las condiciones adversas en el ambiente uterino no necesariamente producen resultados adversos, pero la combinación de factores de riesgo puede producir mayor vulnerabilidad. Los hallazgos de los estudios de adopción han resaltado la importancia de la interacción genambiente en la etiología de los trastornos mentales y cómo el ambiente moldea y modifica los procesos vinculados al desarrollo biológico.
El genoma nos reporta el plano básico de construcción del sistema. Pero éste se presenta como un plano flexible, ajustable a las condiciones mismas de su construcción. Las proteínas, como secuencia primaria de aminoácidos, son codificadas por los genes, pero luego sufren modificaciones relativas a su singular estructura espacial y tridimensional. Estas modificaciones son dinámicas, abiertas a múltiples factores y de una complejidad infinita (11,2).
A pesar de ser muchos los hallazgos que respaldan lo enunciado, aún son numerosas las preguntas en torno a los múltiples aspectos involucrados y todavía nos es difícil imaginar nuestro cerebro cambiando “plásticamente” a partir de la experiencia cotidiana.
Neurodesarrollo y psicopatología
En el transcurso de las dos dé- cadas pasadas emergió como una nueva ciencia la psicopatología del desarrollo, la cual se refiere al estudio del origen y al curso de los patrones individuales de comportamientos maladaptativos. Ésta conlleva la integraci ón de una variedad de disciplinas, entre éstas la epidemiología, la genética, la psiquiatría, la psicolog ía, las neurociencias y la sociología (14).
Hay muchas características de la psicopatología del desarrollo que podrían ser importantes, pero en definitiva pueden ser reducidas a tres aspectos clave:
1. El entendimiento de los procesos causales. Se conoce ampliamente que la mayoría de los trastornos mentales no se debe únicamente a una causa lineal. Los factores de riesgo individuales son casi siempre fuertes pero, más frecuentemente, la psicopatología se origina de la interacción entre múltiples factores de riesgo y factores protectores, algunos gené- ticos y otros ambientales.
2. Un concepto central. Éste constituye el blanco de muchas investigaciones del desarrollo, es el relieve puesto en entender los procesos del desarrollo y en investigar la emergencia de patrones de adaptación y maladaptación en el tiempo. El análisis del desarrollo, por lo tanto, tiende a ser progresivo, un paso tras el otro, para reconocer cómo los mecanismos causales pueden involucrar procesos dinámicos en el tiempo, usando varias rutas para llegar al mismo resultado.
3. Un enfoque sobre el vínculo entre normalidad y patología. Muchas investigaciones causales se han basado en la idea de que las categorías diagnósticas representan alguna clase de “verdad” diferente al comportamiento normal. En contraste, muchos conceptos psicopatológicos del desarrollo son dimensionales, por lo que necesario tener en cuenta las variaciones a través del tiempo (9,14,15).
La mayoría de los estudios que existen acerca de los eventos adversos sobre el desarrollo cerebral describen estresores que son, obviamente, traumáticos e inusuales, como situaciones de extrema tensi ón o violencia (15). En nuestros días, aumentan las investigaciones acerca de los efectos de la salud mental materna en la salud del niño y de los eventos prenatales y obst étricos asociados con algunos problemas de salud mental claramente definidos, por ejemplo, complicaciones obstétricas y su relación con la esquizofrenia en sujetos con vulnerabilidad genética (9) y con los trastornos afectivos (16).
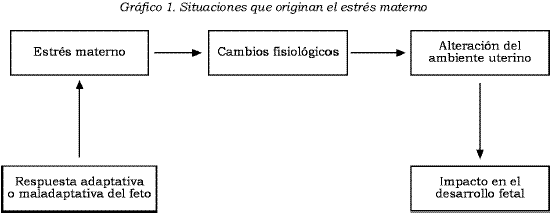
Entre diversas causas, el estrés materno puede originarse de factores psicosociales, complicaciones obstétricas, enfermedades psiquiá- tricas o respuesta emocional al embarazo. Estas variables producen respuestas emocionales y fisiológicas en la madre, que repercuten en el bienestar fetal. Las respuestas emocionales y fisiológicas de la madre a los estresores se traducen en cambios fisiológicos y metabólicos (hipoxia, aumento de las concentraciones de cortisol, desnutrición, sustancias tóxicas, etc.) que pueden afectar la unidad materno-fetal y, por supuesto, el ambiente uterino. El feto puede responder en forma adaptativa o maladaptativa. Esta cadena de situaciones generaría un círculo vicioso entre salud materna y salud fetal (véase Gráfico 1).
Memoria fetal
Muchos cambios se han dado en relación con el conocimiento del feto durante las últimas décadas: los neurobiólogos empiezan a avanzar en el entendimiento de cómo el cerebro se desarrolla en el útero, los psicólogos experimentales han descubierto un gran campo acerca del aprendizaje fetal, los pediatras han vinculado toda clase de problemas al estrés fetal, mientras los biologistas pensaban que debido a que el feto tenía incompleta la mielinización de las neuronas, éstas no podrían almacenar memoria. Este último concepto ha sido revaluado, ya que los impulsos pueden ser completamente llevados por los delgados nervios mielinizados del feto a una velocidad menor, pero que es compensada con las peque- ñas distancias recorridas.
Lejos de tratarse de un ser insensible, se ha encontrado una exquisita sensibilidad del feto a su mundo circundante, y los más tempranos sentimientos serían entonces codificados en nuestra memoria emocional centrada en la amígdala, bastante distinta del sistema de memoria declarativa centrada en el hipocampo, la cual sólo se vuelve funcional, posteriormente, en la infancia. Es usual que esta memoria emocional no acceda a la conciencia; en cambio, la memoria declarativa evoca temores de los estadios tempranos del desarrollo. Cada feto desarrolla su propio patr ón de actividad, el cual puede ser reconocido a través de las técnicas de ultrasonido (17).
Factores de riesgo genéticos, ambiente, desarrollo y enfermedad mental
Depresión
Existen hallazgos que sugieren la relación del síndrome depresivo siguiente a eventos adversos con la respuesta anormal del eje hipotálamo- hipófisis-adrenal (HPA). Esto puede deberse a factores genéticos o puede ser resultado del estrés durante períodos críticos del desarrollo cerebral. Algunos experimentos demuestran que las ratas adultas que han sido sometidas a situaciones de estrés psicológico siendo beb és, como separación materna, aislamiento o expuestas a agresiones inmunológicas, demuestran exagerada respuesta del eje HPA al estrés.
Las ratas sometidas a aislamiento muestran muchas de las caracter ísticas asociadas con los modelos animales de depresión, como poca exploración de nuevos ambientes.
Estas respuestas comportamentales y endocrinas al estrés son estables en el tiempo y parecen ser mediadas por la densidad de los receptores glucocorticoides en el hipocampo. La hipersecreción del eje HPA es inhibida por un proceso de retroalimentación negativo, debido a que las concentraciones elevadas de cortisol actúan primero sobre receptores de glucocorticoides en el hipocampo para disminuir la síntesis de hormona liberadora de corticotropina (CRH). La disminución de la disponibilidad del receptor en el hipocampo conduce a una inhibición atenuada, y por lo tanto a la hiperreactividad del eje HPA.E (18).
Hay pocos experimentos en humanos que examinen los efectos del estrés en los niños sobre el eje HPA. Un estudio publicado en el 2000 demostr ó que la respuesta al estrés está alterada de acuerdo con la forma del parto. El estudio encontró que la respuesta del cortisol salival al estrés de inoculación, a las ocho semanas, fue mayor en neonatos que habían nacido mediante parto natural, en comparación con aquellos que nacieron por cesárea electiva.
Los estados hipercortisolémicos producen muchos de los síntomas y comportamientos asociados con depresi ón. Estos efectos comportamentales son ocasionados por la unión del cortisol a los receptores nucleares en el cerebro, la mayoría densamente concentrados en el hipocampo, y la subsecuente activación transcripcional. Muchos procesos biológicos y cognitivos son modificados por el cortisol, entre éstos sueño, apetito, libido, energía, motivación, concentraci ón y memoria (19).
Poco se conoce del mecanismo de activación del eje HPA siguiente al estrés psicológico, pero éste puede involucrar los neurotransmisores del estrés, la 5 hidroxitriptamina (5HT) o la noradrenalina (NA). La propia estimulación de estos sistemas de neurotransmisores resulta en liberación de hormona adrenocorticotropa (ACTH) desde el hipot álamo, seguida de la liberación de hormona ACTH desde la glándula pituitaria anterior. El mecanismo de activación del eje HPA siguiente al trauma físico involucra estimulación de la CRH mediada por citocinas. Estas últimas son liberadas siguiendo al daño tisular y como parte de la respuesta inmune inflamatoria. Algunos investigadores del campo de la psicoinmunología invocan a las citocinas en el mecanismo de la activaci ón del eje HPA siguiente a eventos psicológicos.
La respuesta anormal del eje HPA al estrés puede ser también genéticamente determinada. Holsboer y cols. demostraron que parientes de primer grado de pacientes con DDM, quienes nunca habían sufrido un episodio de depresión mayor, tenían respuestas del eje HPA similares a sus parientes afectados y diferente a las de sus controles sanos (20).
Ansiedad
El estudio publicado por O’Connor y cols., en 2002, describe cómo la ansiedad de la madre gestante incrementa el riesgo de problemas comportamentales en la infancia, lo cual sugiere que éstos podrían deberse al efecto directo de la ansiedad de la madre sobre el desarrollo cerebral fetal (13). Este estudio también contribuye a incrementar los hallazgos que sugieren que las dificultades del niño están relacionadas con la salud de la madre (8).
El citado estudio de O’Connor y cols. evaluó problemas comportamentales y emocionales en niños de cuatro años de edad, hijos de madres quienes fueron captadas entre la población femenina gestante que dio a luz entre el 1 de abril de 1991 y 31 de diciembre de 1992, en el área de Avon, Reino Unido. Se estima que entre el 85% y el 90% de la poblaci ón elegible participó. El promedio de edad de las mujeres embarazadas fue de 28 años, aproximadamente, donde el 45% de las mujeres esperaban su primer hijo y el 6% de las mujeres tenían tres o más hijos. Los datos fueron recolectados a trav és de cuestionarios por vía postal. El resultado de la muestra fue de 7.448 madres, después de aplicar criterios de exclusión. Se incluyeron sólo quienes completaron a cabalidad los cuestionarios. La ansiedad y la depresión fueron evaluadas en dos ocasiones: en el período prenatal (18 y 32 semanas de gestaci ón) y a las 8 semanas, 8 meses, 21 meses y 33 meses posparto. Los datos de los problemas comportamentales y emocionales de los ni- ños fueron recolectados a los 47 meses de vida.
La ansiedad materna fue medida mediante los ítems de ansiedad del Crown-Crisp Index. Se encontró asociación entre la ansiedad materna y una serie de trastornos en los niños, aun después de controlar riesgos obstétricos y sociodemográ- ficos. En el período posnatal se midieron los ítems correspondientes a ansiedad y depresión en las madres. El más sorprendente hallazgo es que los niveles de ansiedad de la madre en la gestación tardía estuvieron asociados con hiperactividad e inatención en los niños y problemas comportamentales y emocionales en ambos, niños y niñas (1).
El estudio de Austin y cols. evalu ó el vínculo existente entre las caracter ísticas de la ansiedad materna, los eventos vitales estresantes y la depresión y el temperamento del infante. Las mujeres respondieron un cuestionario en el tercer trimestre para evaluar ansiedad (STAI); el temperamento del niño fue evaluado a los 4 y 6 meses de haber nacido, a través del reporte de la madre y el padre, respectivamente, y la depresi ón materna fue evaluada a los cuatro y seis meses (Edinburg Scale).
Se evaluaron 970 sujetos y se indicó que los altos puntajes de ansiedad de la madre durante el embarazo se correlacionaban con la caracterización de un temperamento “difícil” en el niño. Los resultados de la medición de la depresión en la madre también fueron predictores del temperamento del niño. El estudio concluye que las características de la ansiedad materna fueron predictoras de temperamento difícil en el niño, independiente de la depresi ón concomitante y las variables sociodemográficas y los factores de riesgo obstétrico (21).
Estudios experimentales en beb és ratas, cuyas madres habían sido sometidas a situaciones nocivas durante la gestación, han mostrado, además de la hiperactividad del eje HPA y aumento en las concentraciones de las hormonas relacionadas con el estrés, deficiencia de receptores del ácido gamma-aminobutírico (GABA) y de benzodiacepinas, ambos necesarios para la acción calmante en situaciones de estrés (17).
Esquizofrenia
Aunque los factores de riesgo genéticos claramente desempeñan un papel en la etiología de la esquizofrenia, existe abundante literatura médica sobre la importancia de los factores no genéticos. El hecho de que la tasa de concordancia entre gemelos monocigóticos para esquizofrenia es sólo del 50% indica que los factores ambientales estar ían también involucrados y que el 20% y 30% de la varianza podría ser atribuible a factores no genéticos (8).
Un estudio realizado en una gran población indica que nacer en área urbana y al final del invierno o al principio de la primavera se asocia mucho más a esquizofrenia que tener un pariente de primer grado afectado. De manera similar, la mayoría de los factores de riesgo ambientales, como el estrés materno y la desnutrición prenatal, probablemente afectarían el desarollo perinatal del cerebro (22).
Dados los indicios del papel de la genética en la esquizofrenia, no es sorprendente que muchos investigadores se enfoquen en la identificaci ón de marcadores específicos; sin embargo, la interacción con el ambiente ha sido incorporada a dichos estudios como variable epigenética. La hipótesis relacionada con las complicaciones obstétricas y la influenza durante el segundo trimestre del embarazo genera preguntas del tipo ¿podrían ser mediados los efectos de la predisposición genética a la esquizofrenia a través de una vulnerabilidad incrementada por la exposición prenatal o perinatal a factores ambientales? (11).
Los pacientes esquizofrénicos, como grupo, experimentan un mayor número de complicaciones al nacer, que los controles. La revisión de las complicaciones particulares asociadas con esquizofrenia sugiere que el daño cerebral por hipoxia e isquemia puede ser el mecanismo común. Los esquizofrénicos que han sufrido complicaciones perinatales muy probablemente muestran daño en los ventrículos laterales y disminuci ón del volumen del hipocampo. Recientes hallazgos en una cohorte seguida durante 28 años, desde el nacimiento, muestra que los niños con daño cerebral perinatal (definida como convulsiones neonatales, Apgar de bajo puntaje, asfixia, hemorragia intraventricular o signos neurológicos anormales en el período neonatal) fueron siete veces más propensos a desarrollar esquizofrenia en la adultez que el resto de la cohorte (8).
Los hallazgos epidemiológicos que asocian las complicaciones obst étricas a esquizofrenia han sido positivos pero inconclusos. Aunque las influencias genéticas parecen ser la etiología primaria de la esquizofrenia, otros factores pueden contribuir al proceso causal. Entre las condiciones adversas que sugieren un trastorno temprano del desarrollo cerebral, las complicaciones obst étricas se han considerado la segunda más importante categoría entre los factores de riesgo para esquizofrenia (23).
Una razón para que los hallazgos sean inconclusos puede ser la inconsistencia inherente a la medici ón del desarrollo anormal del cerebro basado en marcadores de salud materna. Las condiciones obst étricas maternas son heterogéneas en su etiología y a menudo sólo est án indirectamente relacionadas con el desarrollo cerebral del feto.
Trastorno afectivo bipolar
Estudios de neuroimágenes muestran anormalidades estructurales y funcionales en trastornos del humor, lo cual sugiere que alteraciones en el neurodesarrollo podrían subyacer a la macropatología vista por imágenes en vivo.
Los mecanismos propuestos como subyacentes al trastorno del humor primario no incluyen usualmente un componente neuropatoló- gico. Sin embargo, existe significativa literatura médica sobre RMI, que testifica anormalidades estructurales en algunas áreas cerebrales, lo cual estimula las investigaciones neuropatol ógicas desde donde empiezan a emerger las correlaciones histopatol ógicas. En particular, hay varios reportes de alteraciones citoarquitect ónicas en el cíngulo anterior y la corteza prefrontal, caracterizadas por una disminución en el número o densidad de la neuroglia. La reducción en la talla y la densidad de algunas poblaciones neuronales también ha sido descrita, acompañada por alteraciones de terminales sinápticas y dendríticas. Esta forma de patología puede reflejar neurodesarrollo aberrante o deterioro en la plasticidad cerebral (24).
En la revisión que hacen Baumann y Bogerts acerca de los estudios neuroanatómicos de la en fermedad bipolar, refieren que los ganglios basales son más pequeños en pacientes con depresión, sin tener en cuenta el diagnóstico de polaridad. Además, hay un mayor número de neuronas en el locus ceruleus de pacientes con trastorno afectivo bipolar comparado con aquellos con depresión unipolar. Los pacientes con enfermedad bipolar, al igual que los unipolares, muestran déficit estructural subyacente en el rafe dorsal. Histológicamente, los datos son consistentes con una reducción regional en la síntesis de noradrenalina y serotonina. Los estudios existentes sugieren que, aparte de la desregulación funcional, las anormalidades estructurales subyacentes pueden contribuir a la patogenia de los trastornos del humor (24).
En la revisión llevada a cabo por Bearden y cols. se concluye que es posible que las anomalías del neurodesarrollo puedan ejercer un papel, pero es necesario determinar también si alguna progresión patofisiol ógica ocurre con los episodios repetidos a lo largo del curso de la enfermedad bipolar. La investigación debería centrarse más en pacientes con un primer episodio (25).
Referencias
1. O’Connor TG, Heron J, Golding J, Beveridge M, Glover V. Maternal antenatal anxiety and children’s behavioural/emotional problems at 4 years. Report from the Avon Longitudinal Study of Parents and Children. Br J Psychiatry. 2002;180:502-8. [ Links ]
2. Zuluaga JA. Neurodesarrollo y estimulaci ón. 1st ed. Bogotá: Editorial Médica; 2001. [ Links ]
3. Rees S, Harding R. Brain development during fetal life: influences of the intrauterine environment [Review]. Neurosci Lett. 2004;361(1-3):111-4. [ Links ]
4. Sharma A, Valadi N, Miller AH, Pearce BD. Neonatal viral infection decreases neuronal progenitors and impairs adult neurogenesis in the hippocampus. Neurobiol Dis. 2002 Nov;11(2):246-56. [ Links ]
5. Berger-Sweeney J, Hohmann CF. Behavioral consequences of abnormal cortical development: insights into developmental disabilities [Review]. Behav Brain Res. 1997;86(2):121-142. [ Links ]
6. Terry MB, Susser E. Commentary: the impact of fetal and infant exposures along the life course. Int J Epidemiol. 2001;30(1):95-6. [ Links ]
7. Fan AP, Eaton WW. Longitudinal study assessing the joint effects of socioeconomic status and birth risks on adult emotional and nervous conditions. Br J Psychiatry. 2001;178:S78-S83. [ Links ]
8. Cannon M, Jones PB, Murray RM. Obstetric complications and schizophrenia: historical and meta-analytic review. Am J Psychiatry. 2002;159(7):1080-92. [ Links ]
9. Tsuang MT, Stone WS, Faraone SV. Genes, environment and schizophrenia [Review]. Br J Psychiatry Suppl. 2001; 40:S18-S24. [ Links ]
10. Laplante DP, Barr RG, Brunet A, Galbaud du Fort G, Meaney ML, Saucier JF, et al. Stress during pregnancy affects general intellectual and language functioning in human toddlers. Pediatr Res. 2004;56(3):400-10. [ Links ]
11. Cooper B. Nature, nurture and mental disorder: old concepts in the new millennium. Br J Psychiatry Suppl. 2001 Apr;40:s91-101. [ Links ]
12. Huizink AC, Mulder EJ, Buitelaar JK. Prenatal stress and risk for psychopatology early or later in life: specific effects or induction of general susceptibility? Psychol Bull. 2004 Jan;130(1):115-42. Review. [ Links ]
13. Oates MR. Adverse effects of maternal antenatal anxiety on children: causal effect or developmental continuum? Br J Psychiatry. 2002;180:478-9. [ Links ]
14. Harrington R. Causal processes in development and psychopathology. Br J Psychiatry. 2001;179:93-4. [ Links ]
15. Rutter M, Sroufe L. Developmental psychopatology: concepts and challenges. Dev Psychopatol. 2000;12:265- 96. [ Links ]
16. O’Keane V. Evolving model of depression as an expression of multiple interacting risk factors [Editorial]. Br J Psychiatry. 2000;177:482-3. [ Links ]
17. DeMause L. Restaging fetal traumas in war and social violence. Part 2. Psychohistory. [En linea]. [fecha de acceso: marzo de 2005]. URL disponible en: http://www.geocities.com/kidhistory/ ldfetal2.htm. 18. De Kloet ER. Hormones and the stressed brain. Ann N Y Acad Sci. 2004; 1018:1-15. Review. [ Links ]
19. Gale CR, Martyn CN. Birth weight and later risk of depression in a national birth cohort. Br J Psychiatry. 2004;184:28-33. [ Links ]
20. Austin MP, Hadzi-Pavlovic D, Leader L, Saint K, Parker G. Maternal trait anxiety, depression and life event stress in pregnancy: relationships with infant temperament. Early Hum Dev. 2005; 81(2):183-90. [ Links ]
21. Miyamoto S, LaMantia AS, Duncan GE, Sullivan P, Gilmore JH, Lieberman JA. Recent advances in the neurobiology of schizophrenia. Mol Interv. 2003 Feb; 3(1):27-39. [ Links ]
22. Zornberg GL, Buka SL, Tsuang MT. Hypoxic-ischemia-related fetal/neonatal complications and risk of schizophrenia and other nonaffective psychoses: a 19- year longitudinal study. Am J Psychiatry. 2000;157(2):196-202. [ Links ]
23. Harrison P. The neuropathology of primary mood disorder. Brain. 2002 Jul;125(7): 1428-49. [ Links ]
24. Baumann B, Bogerts B. Neuroanatomical studies on bipolar disorder. Br J Psychiatry. 2001;178 Suppl 41:142-7. [ Links ]
25. Bearden CE, Hoffman KM, Cannon TD. The neuropsychology and neuroanatomy of bipolar affective disorder: a critical review. Bipolar Disor. 2001; 3(3):106-50. [ Links ]
26. Abel KM. Foetal origins of schizophrenia: testable hypotheses of genetic and environmental influences. Br J Psychiatry. 2004;184:383-5. [ Links ]
27. Brennan PA, Grekin ER, Mednick SA. Maternal smoking during pregnancy and adult male criminal outcomes. Arch Gen Psychiatry. 1999;56(3):215-9. [ Links ]
28. Brown AS, Begg MD, Gravenstein S, Schaefer CA, Wyatt RJ, Bresnahan M, et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Arch Gen Psychiatry. 2004;61(8):774-80. [ Links ]
29. Browne R, Byrne M, Mulryan N, Scully A, Morris M, Kinsella A, et al. Labour and delivery complications at birth and later mania: an irish case register study. Br J Psychiatry. 2000;176:369-72. [ Links ]
30. Cotter D, Pariante CM. Stress and the progression of the developmental hypothesis of schizophrenia. Br J Psychiatry. 2002;181:363-5. Review. [ Links ]
31. DeLong R. Autism and familial major mood disorder: are they related? J Neuropsychiatry Clin Neurosci. 2004;16(2):199-213. Review. [ Links ]
32. DeMause L. Restaging fetal traumas in war and social violence. Part 1. Psychohistory. [en línea]. [fecha de acceso: marzo de 2005]. URL disponible en: http://www.geocities.com/kidhistory/ ldfetal1.htm. [ Links ]
33. DeMause L. Restaging fetal traumas in war and social violence. Part 3. Digital archive of psychohistory. [en línea]. [fecha de acceso: marzo de 2005]. URL disponible en: http://www.geocities. com/kidhistory/ldfetal3.htm. [ Links ]
34. De Mause L. Restaging fetal traumas in war and social violence. Part 4. Digital archive of psychohistory. [en línea]. [fecha de acceso: marzo de 2005]. URL disponible en: http://www.geocities. com/kidhistory/ldfetal4.htm. [ Links ]
35. Friedman EH. Neurocognitive deficits in infants of mothers with schizophrenia. Br J Psychiatry. 2000;177:564-5. [ Links ]
36. Huttunen MO, Niskanen P. Prenatal loss of father and psychiatric disorders. Arch Gen Psychiatry. 1978;35(4):429-31. [ Links ]
37. Kelly RH, Russo J, Holt VL, Danielsen BH, Zatzick DF, Walker E, et al Psychiatric and substance use disorders as risk factors for low birth weight and preterm delivery. Obstet Gynecol. 2002; 100(2):297-304. [ Links ]
38. Kelly YJ, Nazroo JY, McMunn A, Boreham R, Marmot M. Birthweight and behavioural problems in children: a modifiable effect? Int J Epidemiol. 2001;30(1):88-94. [ Links ]
39. Leon DA. Commentary: Getting to grips with fetal programming-aspects of a rapidly evolving agenda. Int J Epidemiol. 2001;30(1):96-8. [ Links ]
40. Lilienfeld AM, Pasamanick B, Rogers M. Relationships between pregnancy experiences and the development of certain neuropsychiatric disorders in childhood. Am J Public Health. 1955; 45:637-43. [ Links ]
41. Linnet KM, Dalsgaard S, Obel C, Wisborg K, Henriksen TB, Rodriguez A, et al. Maternal lifestyle factors in pregnancy risk of attention deficit hyperactivity disorder and associated behaviors: review of the current evidence. Am J Psychiatry. 2003;160(6):1028-40. Review. [ Links ]
42. Martyn CN, Gale CR, Sayer AA, Fall C. Growth in utero and cognitive function in adult life: follow up study of people born between 1920 and 1943. Br Med J. 1996;312(7043):1393-6. [ Links ]
43. Maughan B, Taylor A, Caspi A, Moffitt TE. Prenatal smoking and early childhood conduct problems: testing genetic and environmental explanations of the association. Arch Gen Psychiatry. 2004;61(8):836-43. [ Links ]
44. McArdle P. Attention-deficit hyperactivity disorder and life-span development. Br J Psychiatry. 2004;184:468-9. [ Links ]
45. Nilsson PM, Nilsson JA, Ostergren PO, Rasmussen F. Fetal growth predicts stress susceptibility independent of parental education in 161991 adolescent Swedish male conscripts. J Epidemiol Community Health. 2004;58(7):571-3. [ Links ]
46. Nilsson PM, Nyberg P, Ostergren PO. Increased susceptibility to stress at a psychological assessment of stress tolerance is associated with impaired fetal growth. Int J Epidemiol. 2001;30(1): 75-80. [ Links ]
47. O’Brien F, Roth S, Stewart A, Rifkin L, Rushe T, Wyatt J. The neurodevelopmental progress of infants less than 33 weeks into adolescence. Arch Dis Child. 2004;89:207-11. [ Links ]
48. Parker KJ, Buckmaster CL, Schatzberg AF, Lyons DM. Prospective investigation of stress inoculation in young monkeys. Arch Gen Psychiatry. 2004;61(9):933-41. [ Links ]
49. Romagnoli C, Zecca E, Luciano R, Torrioli G, Tortorolo G. A three year follow up of preterm infants after moderately early treatment with dexamethasone. Arch Dis Child Fetal Neonatal Ed. 2002;87(1):F55-F58. [ Links ]
50. Rosa Neto P, Lou H, Cumming P, Pryds O, Gjedde A. Methylphenidate-evoked potentiation of extracellular dopamine in the brain of adolescents with premature birth: correlation with attentional deficit. Ann N Y Acad Sci. 2002;965:434-9. [ Links ]
51. Sabban EL, Hebert MA, Liu X, Nankova B, Serova L. Differential effects of stress on gene transcription factors in catecholaminergic systems. Ann N Y Acad Sci. 2004;1032:130-40. [ Links ]
52. Saugstad L. Age at puberty and mental illness. Towards a neurodevelopmental aetiology of Kraepelin’s endogenous psychoses. Br J Psychiatry. 1989;155: 536-44. [ Links ]
53. Schelling G, Roozendaal B, De Quervain DJ. Can posttraumatic stress disorderbe prevented with glucocorticoids? Ann N Y Acad Sci. 2004;1032:158-66. [ Links ]
54. Seng JS, Oakley DJ, Sampselle CM, Killion C, Graham-Bermann S, Liberzon I. Posttraumatic stress disorder and pregnancy complications. Obstet Gynecol. 2001;97(1):17-22. [ Links ]
55. Sorensen HT, Sabroe S, Olsen J, Rothman KJ, Gillman MW, Fischer P. Birth weight and cognitive function in young adult life: historical cohort study. Br Med J. 1997;315(7105):401-3. [ Links ]
56. Waddington JL. Invited commentaries on: obstetric complications and schizophrenia/ affective psychoses. Br J Psychiatry. 2000;176:527-30. [ Links ]
57. Wust S, Federenko IS, van Rossum EF, Koper JW, Kumsta R, Entringer S, Hellhammer DH. A psychobiological perspective on genetic determinants of hypothalamus-pituitary-adrenal axis activity. Ann N Y Acad Sci. 2004;1032:52- 62. Review. [ Links ]
58. Yoshida K, Marks MN, Craggs M, Smith B, Kumar R. Sensorimotor and cognitive development of infants of mothers with schizophrenia. Br J Psychiatry. 1999;175:380-7. [ Links ]
Recibido para evaluación: 10 de noviembre de 2005
Aceptado para publicación: 28 de marzo de 2006














