Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Psiquiatría
versão impressa ISSN 0034-7450
rev.colomb.psiquiatr. v.35 n.2 Bogotá abr./jun. 2006
1 Médico psiquiatra. Director científico del Hospital Mental Nuestra Señora del Perpetuo Socorro, San Juan de Pasto. mdelae@javeriana.edu.co
2 Médica psiquiatra, especialista en Epidemiología, Hospital Mental Nuestra Señora del Perpetuo Socorro, San Juan de Pasto.
3 Residente de primer año de Psiquiatría, Pontificia Universidad Javeriana.
Resumen
Objetivo: revisar los efectos adversos poco comunes en el sistema hepático presentados por el uso de haloperidol. Resultados: se trata de una mujer de 37 años, quien desarrolló ictericia posterior al inicio de la terapia con haloperidol, con elevación de la fosfatasa alcalina, TGP, TGO, sin otra causa. Conclusiones: el uso de haloperidol se asocia con la ictericia colestásica inducida por hipersensibilidad.
Palabras clave: ictericia colestásica, haloperidol, efectos secundarios.
Abstract
Objectives: to discuss liver dysfunction associated with haloperidol therapy. Methods: a single case-report. Results: a 37 year old woman, who developed jaundice after the onset of haloperidol therapy, with elevation of alkaline phosphatase, SGPT, SGOT, without other causes of jaundice. Conclusions: Haloperidol therapy is associated with hypersensitiveinduced cholestasis.
Key words: Cholestasis jaundice, haloperidol, adverse effects.
Introducción
El haloperidol se usa frecuentemente para el manejo de la agitaci ón y los síntomas psicóticos positivos. En la literatura médica, los principales efectos adversos reportados se orientan a los síntomas extrapiramidales. Desde 1967 hasta la fecha existen pocos casos reportados sobre los efectos adversos en el sistema hepático (1).
Metabolismo del haloperidol
Los procesos oxidativos (Ndesalquilaci ón) son las principales vías metabólicas del haloperidol y otras butirofenonas. Éstos son mediados en grado importante por oxidasas microsómicas hepáticas y procesos de conjugación controlados de manera genética. Los metabolitos hidrófilos se excretan principalmente por medio de la orina y en algún porcentaje por la bilis. Se considera que casi todos los metabolitos del haloperidol son inactivos (2).
Las subfamilias del citocromo P450 que más frecuentemente participan en las reacciones oxidativas del haloperidol son CYP1A2, CYP2C9, CYP2D6, CYP2E1, CYP3A4, CYP3A5. El polimorfismo (CYP) 2D6 está implicado en la mayor o menor actividad enzimática. Ésta es importante en el metabolismo de otras drogas comúnmente prescritas en psiquiatr ía, como son los antidepresivos tricíclicos, los inhibidores selectivos de la receptación de serotonina, entre otros. Otras isoformas, CYP1A2 y CYP3A, también están involucradas (3-9).
Las drogas que inhiben estas enzimas incrementan las concentraciones plasmáticas de los antipsicó- ticos. Estos incrementos pueden producir una exacerbación de sus efectos adversos, entre éstos cardiotoxicidad, efectos anticolinérgicos e hipotensión ortostática. El haloperidol, la perfenazina, la tioridazina y la clorpromazina aumentan las concentraciones plasmáticas de nortriptilina, desipramina y propanolol, que son sustratos de CYP2D6 y 1A2 (2, 10-12).
Efectos secundarios del haloperidol
Los principales efectos adversos del haloperidol que se describen en la literatura médica son los neuroló- gicos, como parkinsonismo, distonía, acatisia y discinesia tardía y secundarios al bloqueo dopaminérgico en la vía nigroestriada. En menor grado se han reportado efectos cardiovasculares, los cuales, aunque raros, incluyen reportes de Torsade de Pointes posterior a una sobredosis de haloperidol por vía endovenosa. En el sistema endocrino, el incremento de la secreción de prolactina por bloqueo dopaminérgico en el tracto tuberoinfundibular (1-15). La ictericia por colestasis es un efecto adverso poco frecuente, con una tasa de 1/1.000, en comparación con el tratamiento con clorpromazina (1/ 100). Se ha especulado que las impurezas en la fabricación del medicamento son la causa de esta reacción, porque a medida que se han mejorado los procesos, se ha reducido su aparición. Antes de 1967 se habían reportado 21 casos de disfunci ón hepática asociada con haloperidol (16-17).
Cuando se presenta, se observa en los primeros treinta días de tratamiento. Los síntomas usuales son dolor abdominal superior, náuseas, vómitos, exantema, un síndrome similar al resfriado común y fiebre. Los laboratorios muestran eosinofilia, hiperbilirrubinemia, bilirrubinuria, elevación de la fosfatasa alcalina y transaminasas hepáticas en el plasma. El cuadro corresponde a una ictericia colestásica con un árbol biliar normal. En la patología se observa aumento de la celularidad perivascular. Por la patología y los laboratorios, se considera que la colestasis es una reacción de hipersensibilidad. Una vez se presenta la ictericia colestásica, la primera conducta de los clínicos es suspender la medicación; sin embargo, no se ha comprobado que con ésta el pronóstico cambie (1).
También se ha reportado enfermedad colestásica crónica con el uso de haloperidol, donde se ha encontrado un grave daño en el epitelio de las vías biliares asociado a anormalidades bioquímicas, como la ictericia prolongada. Es similar al presentado con la clorpromazina, un síndrome similar a la cirrosis. Los cambios histológicos incluyen degeneraci ón vacuolar, tríada hepática con edema e infiltrado neutrófilo y eosinófilo (17).
Reporte de caso
Se trata de una mujer de 32 años, trabajadora sexual, quien ingresa por alteraciones comportamentales, actitud alucinatoria visual, posterior a consumo de sustancias psicoactivas (cannabinoides y alcohol). Como antecedentes personales de importancia se considera el trauma craneoencefálico sufrido hace seis meses, manejado en la unidad de cuidados intensivos. Se desconoce si hubo antecedente de transfusi ón. Presenta alergia a la lana, ginecoobstétricos G4P3A1V3C0, menstruación presente al ingreso, ciclos regulares, relaciones sexuales sin protección. Se desconocen antecedentes familiares.
En la revisión por sistemas manifestaba prurito generalizado. En el examen físico de ingreso se encontraba normotensa, afebril, taquic árdica, abdomen normal, sin déficit neurológico. En el examen mental está alerta, desorientada en tiempo, hipoproséxica y con afecto inapropiado lábil, pensamiento ilógico bradipsíquico y bloqueos, ideación delirante paranoide persecutoria poco estructurada, actitud alucinatoria visual, lenguaje de tono bajo, soliloquios, introspección nula, prospección incierta, así como juicio y raciocinio afectados.
La mujer se hospitalizó con un diagnóstico de episodio psicótico agudo secundario a abuso de múltiples sustancias. Se inició manejo con haloperidol: 5 mg/día, que se incremento a 10 mg al segundo día; levomepromazina: 25 mg/día (dosis única), y lorazepam: 2 mg/día, todos por vía oral. A las 48 horas de hospitalización presentó taquicardia y dolor abdominal, y a las 72 horas, ictericia mucocutánea.
Se reportaron laboratorios así: hemograma dentro de límites normales, glucemia 114 mg/dL (postprandial VN<200 mg/dL), creatinina 0,8 mg/dL (<1,3 mg/dL), transaminasas TGO 187 U/L (hasta 40 U/l), TGP 133 U/l (hasta 40U/ l), serología VDRL no reactiva, bilirrubinas totales 0,6 mg/dL (0,3- 1 mg/dl), directa 0,1 mg/dL (0,1- 0,3 mg/dL), indirecta 0,5 mg/dL (hasta 1 mg/dL), fosfatasa alcalina 264 UI/L (VN 44 a 147UI/L).
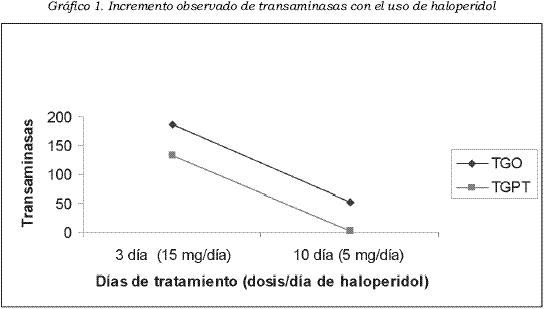
Al cuarto día, coincidiendo con el incremento del haloperidol a 15 mg/día por síntomas psicóticos prominentes, presentó intensificación de la ictericia mucocutánea, por lo que se disminuyó la dosis a 5 mg/día nuevamente, y el cuadro de ictericia cedió en 72 horas. Para estudio del síndrome se solicitó ecografía hepatobiliar reportada como normal, transaminasas de control GPT 3 UI/ L, TGO 53 UI/L. Además, se recibió HIV negativo (Elisa). Desde el punto de vista psiquiátrico la evolución fue favorable con la dosis de 5 mg de haloperidol sin recurrencia del cuadro de ictericia. En el Gráfico 1 observamos la evolución de las concentraciones de transaminasas con el uso y disminución de dosis de haloperidol.
Discusión
Se trata de una paciente con historia de abuso de sustancias y con un gran riesgo de padecer alguna enfermedad de transmisión sexual, por el trabajo que desempeña. Era necesario descartar una insuficiencia hepática secundaria a toxicidad o a infección. Considerando que entre las causas más frecuentes de ictericia está la obstrucción de la vía biliar por litiasis, se realizó una ecografía hepatobiliar.
Fue imposible realizar pruebas para descartar hepatitis infecciosa; sin embargo, no consideramos que se trataba de hepatitis, porque la elevación de las transaminasas en esta enfermedad es mayor, el descenso es lento y progresivo, se presenta hepatomegalia que no tenía (cuando se presenta ictericia dura entre 10 y 20 días), hay ictericia de predominio indirecto (usualmente la fosfatasa alcalina está dentro de los valores normales) y cuando es hepatitis colestásica la hiperbilirrubinemia es intensa y los valores por encima de 20 mg/dl son de muy mal pronóstico.
Por lo tanto, teniendo en cuenta la teoría de un fenómeno de hipersensibilidad en la colestasis por haloperidol, se destaca que la paciente tenía un antecedente de fen ómenos alérgicos en su historial y que podría tener una vulnerabilidad hepática presente. La paciente ven ía recibiendo otro antipsicótico con igual ruta de metabolismo que el haloperidol, que incrementó los efectos secundarios de éste; sin embargo, no consideramos que se deba a levomepromazina, porque se usó en dosis única (1-2,17-18).
El curso de la ictericia que empieza con la exposición al haloperidol y remite posterior a la disminución de su dosis, con un árbol biliar normal, y descartando otras posibles causas, nos lleva a concluir que pudo tratarse de un cuadro de ictericia colestásica como efecto adverso del haloperidol (1).
Conclusiones
La ictericia colestásica por haloperidol corresponde a una reacción de hipersensibilidad poco frecuente. Se presenta con síntomas inespecí- ficos como fiebre, dolor abdominal, exantema e ictericia, asociados a la alteración de enzimas hepáticas, transaminasas, fosfatasa alcalina, bilirrubinas, con un árbol biliar normal, en personas que reciben haloperidol sin otra comorbilidad. El diagnóstico debe hacerse una vez se hayan descartado otras causas de ictericia colestásica. Según la literatura médica, la sintomatología se reduce con la suspensión del haloperidol o sin ésta; sin embargo, nosotros observamos que fue dosis dependiente en una paciente con alg ún tipo de predisposición por atopía y desnutrición.
Referencias
1. Fuller CM, Yessinger S, Donlon P, Imperato TJ, Ruebner B. Haloperidolinduced liver disease. West J Med. 1977;127:515-8. [ Links ]
2. Hardman JG, Limbird Le, Molinoff PB, Ruddon RW, Goodman-Gillman A. Las bases farmacológicas de la terapéutica. 9th ed. México: McGraw Hill Interamericana; 1996. [ Links ]
3. Michalets EM. Update: clinically significant cytochrome P-450 drug interactions. Pharmacotherapy. 1998;18: 84-112. [ Links ]
4. Shin J, Soukhova N, Flockhart DA. Effect of antipsychotic drugs on human liver cytochrome P-450 (CYP) isoforms in vitro: preferential inhibition of CYP2D61. Drug Metab Dispos. 1999;27:1078-84. [ Links ]
5. Taylor D, Lader M. Cytochromes and psychotropic drug interactions. Br J Psychiatry. 1996;168:529-32. [ Links ]
6. Sproule BA, Naranjo CA, Bremner KE, Hassan PC. Selective serotonin reuptake inhibitors and CNS drug interactions: a critical review of the evidence. Clin Pharmacokinet. 1997;33:454-71. [ Links ]
7. Eiermann B, Endel G, Johansson I, Zanger, Bertilsson L. The involvement of CYP1A2 and CYP3A4 in the metabolism of clozapine. Br J Clin Pharmacol. 1997;44:439-46. [ Links ]
8. Pan LP, Wijnant P, De Vriendt C, Rosseel MT, Belpaire FM. Characterization of the cytochrome P450 isozymes involved in the in vitro N-dealkylation of haloperidol. Br J Clin Pharmacol. 1997;44:557-64. [ Links ]
9. Desta Z, Kerbusch T, Soukhova N, Richard E, Ko JW, Flockhart DA. Identification and characterization of human cytochrome P450 isoforms interacting with pimozide. J Pharmacol Exp Ther. 1998;285:428-37. [ Links ]
10. Goff DC, Baldessarini RJ. Drug interactions with antipsychotic agents. J Clin Psychopharmacol. 1993;13:57- 67. [ Links ]
11. Ereshefsky L. Pharmacokinetics and drug interactions: update for new antipsychotics. J Clin Psychiatry. 1996;57(Suppl 11):12-25. [ Links ]
12. Desta Z, Kerbusch T, Flockhart DA. Effect of clarithromycin on the pharmacokinetics and pharmacodynamics of pimozide in healthy poor and extensive metabolizer of cytochrome P450 2D6 (CYP2D6). Clin Pharmacol Ther. 1999; 65:10-20. [ Links ]
13. Niemegeers CJE. Paul Janssen and the discovery of haloperidol and other neuroleptics. Beerse: Janssen Research Foundation; 1988. 2 [ Links ]
14. Granger B, Albu S. The haloperidol story. Ann Clin Psychiatry. 2005;17:137-40. 3 [ Links ]
15. Alvarez GF, Skowronski GA. Remember the side effects of haloperidol: a case report. Crit Care Resusc. 2003;5:266-9. [ Links ]
16. Ayd RJ. Haloperidol: fifteen years of clinical experience. Dis Nerv Sys. 1972;33:465-9. [ Links ]
17. Dincsoy HP, Saelinger DA. Haloperidolinduced chronic cholestatic liver disease. Gastroenterology 1982;83: 694-700. [ Links ]
18. Braunwald EH. Principios de medicina interna. 15th ed. Madrid: McGraw Hill; 2001. [ Links ]
Recibido para evaluación: 16 de marzo de 2006
Aceptado para publicación: 10 de mayo de 2006














