Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Psiquiatría
versão impressa ISSN 0034-7450
rev.colomb.psiquiatr. v.37 n.1 Bogotá jan./mar. 2008
Artículos de revisión/actualización
Demencia asociada con infección por VIH
HIV-Associated Dementia
Ángela María Iragorri Cucalón1
1 Médica neuróloga de la Clínica de Trastornos Cognitivos y Memoria y de la Clínica La Inmaculada, Bogotá, Colombia. Residente de Psiquiatría, Pontificia Universidad Javeriana, Bogotá, Colombia. airagorri@gmail.com
Resumen
Introducción: La demencia asociada con infección por VIH es la causa de demencia no traumática más frecuente en pacientes jóvenes. Objetivo: Señalar sus características clínicas, los métodos diagnósticos y el tratamiento de la demencia asociada con infección por VIH. Método: Revisión de la literatura médica publicada sobre el tema, utilizando las bases de datos Medline, Ovid y Hinari. Resultados: Las características clínicas en fases iniciales son hipoprosexia, bradipsiquia y apatía, que pueden simular depresión. En fases más avanzadas se presentan cambios cognoscitivos más específicos, como pérdida de memoria, cambios en la personalidad, asociados con insuficiencia motora y esfinteriana, como resultado de una mielopatía vacuolar. Conclusiones: Se deben realizar estudios complementarios para descartar otras causas de los cambios comportamentales y cognoscitivos. Las alteraciones vistas en resonancia magnética cerebral simple incluyen atrofia cortical y lesiones difusas de sustancia blanca. Las pruebas neuropsicológicas son útiles en el diagnóstico y, por lo general, muestran alteraciones en la velocidad psicomotora, atención, funciones del lóbulo frontal y memoria verbal y no verbal. La terapia HAART ha reducido de forma importante la incidencia de este tipo de demencia, que ahora afecta aproximadamente al 10% de los pacientes con sida en estadios avanzados.
Palabras clave: demencia, VIH, síndrome de inmunodeficiencia adquirida, HAART.
Abstract
Introduction: HIV-associated dementia is the most common nontraumatic dementia among young people. Objective: To describe the clinical features, diagnostic methods and treatment of HIV-associated dementia. Method: Review of the medical literature, available in Medline, Ovid and Hinari data bases. Results: The clinical features in the early stages may be mild with symptoms of poor concentration, mental slowing, and apathy which may mimic depression. Later on, as the syndrome progresses, more specific cognitive changes develop with memory loss and personality change associated with motor and sphincter difficulties as a result of an associated vacuolar myelopathy. Conclusions: Investigations are indicated to exclude other causes. MRI typically shows evidence of atrophy and diffuse white matter signal changes. Neuropsychological assessment typically shows abnormalities in the following cognitive domains: Psychomotor speed, attention, frontal lobe function, and verbal and non-verbalmemory. HAART has reduced its incidence and it now affects approximately 10% of patients with advanced disease.
Key words: Dementia, HIV, acquired immunodeficiency syndrome, HAART.
Introducción
El virus de inmunodeficiencia humana (VIH) es un virus lento (subfamilia Lentiviridae) de la familia de retrovirus, y se han identificado dos variantes, VIH-1 y VIH-2, que se diferencian por su genoma y su antigenicidad. El VIH-1 es el factor etiológico del sida. La infección por VIH se ha convertido en un gran problema de salud pública en el mundo, y la Organización Mundial de la Salud (OMS) estima que hay 40,3 millones personas infectadas en el mundo, por lo que la ha considerado una epidemia (1-2).
Según los pronósticos epidemiológicos avanzados por organismos especializados, la propagación del VIH continuará de forma imparable y constante, sobre todo en los países de menor desarrollo económico, y se convertirá en este milenio en uno de los principales retos para la misma supervivencia humana (3-4).
Hay indicios de una importante propagación del VIH en Colombia: con una prevalencia en pacientes jóvenes (15-24 años de edad) y mujeres embarazadas, que va de 1,2%-1,3% en Santander y Valle a 2,4% en Atlántico. Además de las generalizadas desigualdades por razón del sexo, es posible que el desplazamiento forzoso provocado por el largo conflicto civil pueda estar aumentando el riesgo de que las mujeres contraigan el VIH (5).
Se sabe que el VIH entra al sistema nervioso central en las primeras horas o días de la infección y que permanece “secuestrado” dentro del cerebro. Muchos de los pacientes infectados por el VIH presentan enfermedades del sistema nervioso central, y una de las más graves es la demencia asociada c on VIH, que puede afectar la progresión de la enfermedad, disminuir la adherencia al tratamiento y aumentar la tasa de mortalidad (1,6).
Clasificación de las infecciones por VIH
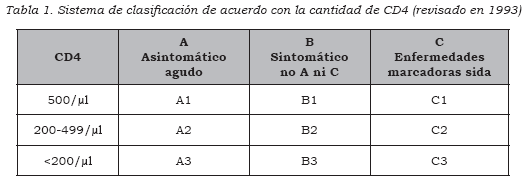
El Centro de Control de Enfermedades (CDC) en Estados Unidos, desarrolló la clasificación más utilizada actualmente. La categorización de los estados clínicos se basa en la presencia de síntomas y signos determinados y de ciertas condiciones y hallazgos clínicos, en la disponibilidad de exámenes para evidenciar el VIH y en el grado de inmunosupresión dado por el recuento de linfocitos T CD4 (Tabla 1).
Demencia asociada con la infección por VIH
La asociación de un cuadro de demencia con la infección por el VIH-1 se denominó inicialmente encefalitis subaguda asociada con el SIDA, encefalitis por VIH y, con la expresión más extendida, complejo demencia-SIDA. Sin embargo, en los últimos años tales denominaciones se han sustituido por el llamado complejo cognitivo-motor asociado con el VIH-1, que engloba los datos clínicos más característicos: demencia subaguda, alteraciones de la conducta y síntomas motores, aun cuando el cuadro completo no aparece en todos los pacientes (la alteración motora por mielopatía sólo se da en el 30% de los pacientes con demencia) (7).
Por otra parte, se ha acuñado también la expresión alteración cognitivo- motora menor asociada al VIH- 1 para referirse a la situación en que los síntomas son mínimos y no interfieren de forma importante con la vida del paciente (7-8). La demencia asociada con la infección por VIH es la causa de demencia no traumática más frecuente en pacientes jóvenes, con una incidencia anual de entre el 7% y el 14% en pacientes infectados asintomáticos (9,10).
En el grupo de pacientes asintomáticos con conteo de CD4<200 (grupo A3), la incidencia es del 9% al año; mientras que en pacientes con SIDA (grupo C) puede llegar al 20% (9,11). También puede verse en estos pacientes cuadros de deterioro cognoscitivo leve, que no cumplen criterios para demencia. Sin tratamiento, la supervivencia promedio de estos pacientes es de seis meses, es decir, la mitad de la expectativa de supervivencia de los pacientes sin afectación cognoscitiva (11).
Los síntomas principales son de tres tipos: cognoscitivos, conductuales y motores. El inicio de la enfermedad suele ser poco llamativo; aparece dificultad para realizar tareas habituales y déficit de concentración. Las alteraciones del comportamiento comienzan como apatía e indiferencia ante las relaciones familiares y sociales (frecuentemente diagnosticadas como depresión). Los signos motores pueden pasar inadvertidos; la bradicinesia es frecuente y se asocia con una marcha alterada con debilidad en las extremidades inferiores (7-8).
Con la progresión de la enfermedad, la bradicinesia se hace más evidente y se deteriora el lenguaje espontáneo, lo que constituye un cuadro típico de demencia considerada de tipo subcortical, ya que no aparecen afasias, apraxias o agnosias (típicas de las demencias corticales), salvo en estadios muy avanzados de la enfermedad. Los pacientes se muestran indiferentes hacia sí mismos y hacia lo que les rodea, por lo que descuidan la higiene y el cuidado personal, la vida social y el trabajo. La bradicinesia cada vez se hace más incapacitante, ya que se acompaña de una gran dificultad para la marcha y puede asociarse con paraparesia espástica con hiperreflexia e incontinencia esfinteriana, como consecuencia de una mielopatía (7,12).
Otras alteraciones cognoscitivas incluyen disminución en la atención y la concentración, lentificación del pensamiento, pérdida de la memoria reciente y afectación de la memoria de trabajo. Usualmente se demoran mucho tiempo en contestar las pruebas neuropsicológicas y tienen una dificultad importante en las tareas que involucran más de una instrucción. Algunos pacientes presentan, además, síntomas afectivos, con ánimo triste, apatía o agitación psicomotora, manía y psicosis, e incluso hay quienes desarrollan un comportamiento con rasgos obsesivos- compulsivos (13-14).
En un pequeño porcentaje de los sujetos, la enfermedad comienza de forma atípica, como un trastorno afectivo, psicosis o crisis epiléptica. Se han registrado trastornos psicóticos agudos, con alucinaciones, delirios paranoides o de grandeza, alteraciones afectivas y del pensamiento (3).
No se describió una enfermedad similar antes del surgimiento del sida, ni en individuos con inmunodepresión por otras causas. Ocurre sólo durante este síndrome y es la afectación neurológica más frecuente, incluso antes de que aparezca el deterioro del sistema inmunológico, por lo que, a menudo, constituye el primer signo de infección por VIH (3).
Una limitación importante en la actualidad es el desconocimiento de los factores que pueden predisponer a la demencia en las personas infectadas. No se sabe si los casos con anomalías neurológicas y del comportamiento se exponen a un riesgo mayor de presentar demencia. Ciertos autores consideran como predictores poderosos para estimar el riesgo de demencia el recuento de linfocitos TCD4, la anemia, las infecciones que definen el sida y el cáncer (3,15).
Fisiopatología
El mecanismo exacto por el cual el VIH-1 produce demencia todavía no se conoce con exactitud. Una teoría aceptada es el modelo de los cuatro compartimentos celulares. Las primeras células implicadas son los monocitos y macrófagos infectados por el VIH-1 que, además de introducir el virus al sistema nervioso central, expresan genes víricos y producen citocinas neurotóxicas (factor activador de plaquetas, ácido araquidónico, óxido nítrico).
Los astrocitos serían las células amplificadoras que traducen y amplían el proceso desencadenado por monocitos y macrófagos, los cuales producen más citocinas y otras sustancias neurotóxicas en un fenómeno de retroalimentación positiva. Los oligodendrocitos y las neuronas son las células diana que sufren el efecto de esas sustancias nocivas y alteran su función. No son infectadas directamente por el VIH-1. El déficit de CD4, que son las células moduladoras, provoca una regulación insuficiente de los macrófagos y de esta manera continúa la producción anómala de sustancias neurotóxicas (7,16).
Se ha demostrado de forma experimental el efecto de muerte neuronal provocado por la proteína gp120 viral y por la activación de los receptores del N-metil-D-aspartato (NMDA), al aumentar la concentración de calcio intraneuronal y de radicales libres, hechos que se producen en la infección por VIH-1 en el cerebro (7).
La apoptosis de astrocitos puede ser mediada por el ligando Fas, y estudios in vitro han demostrado que los macrófagos infectados por VIH liberan Fas, y este desencadena apoptosis en astrocitos no infectados. Towfighi y cols. (17) sugieren que este modelo de señalización por Fas puede ser también otro de los mecanismos que contribuye en la fisiopatología de la demencia asociada con VIH.
Adicionalmente, algunos estudios han demostrado una propagación de células neurales progenitoras, capaces de diferenciarse en astrocitos y neuronas y formar nuevas conexiones sinápticas (18-21), y el giro dentado del hipocampo es una de las áreas del cerebro donde se ha observado este comportamiento. En el hipocampo, las nuevas neuronas permiten una mayor capacidad de memoria y reemplazan algunas neuronas que se pierden con la edad (22-23).
Krathwohl y Kaiser (6) examinaron el hipocampo de tejido obtenido en autopsias de pacientes con demencia asociada con VIH. Ellos encontraron un número reducido de células neurales progenitoras al compararlo con el tejido de pacientes sin demencia, por lo que sugieren que el VIH-1 podría inhibir la proliferación de células progenitoras y disminuir la capacidad de formar nuevas memorias (24). Esta inhibición parece estar mediada por una inducción de señales a través de receptores de quimiocinas, que regulan la proliferación celular en condiciones homeostáticas y son usados por el virus como correceptores (CXCR4 o CCR3) (18,25).
La sensibilidad a los bloqueadores de receptores de dopamina sugiere una profunda y quizás selectiva anormalidad en los sistemas estriatal dopaminérgicos en los ganglios basales con pérdida de neuronas dopaminérgicas (26). Investigaciones electrofisiológicas, patológicas, víricas, metabólicas y radiológicas indican que los ganglios basales son una gran diana de la infección por VIH, con pérdida de las neuronas dopaminérgicas, que explican los síntomas de déficit de dopamina (3).
En algunos pacientes se ha demostrado una disminución de proteína beta-amiloide, y aumento de proteina tau, lo cual sugiere que podría estar también asociada con un proceso degenerativo similar al que ocurre en la enfermedad de Alzheimer (27).
Diagnóstico
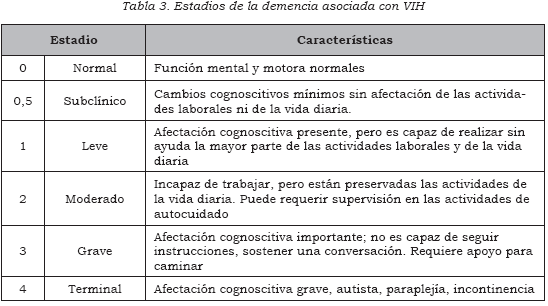
El diagnóstico de la demencia asociada con VIH es clínico (Tabla 2); por lo tanto, una adecuada historia clínica y una exploración física detallada son fundamentales. Los exámenes paraclínicos son importantes para hacer un diagnóstico diferencial y descartar otros procesos que pueden simularla. La demencia asociada con infección por VIH ha sido clasificada en cuatro estadios, de acuerdo con la gravedad de la afectación (Tabla 3).

Examen mental y neurológico
El cambio más temprano evidente en el examen mental es la disminución de la velocidad psicomotora (28). A medida que progresa la enfermedad, hay un incremento en la apatía, se afecta la memoria y aparecen alteraciones en la función visuoespacial, la abstracción y el cálculo, aun cuando se preservan las funciones del lenguaje. Tanto la enfermedad como el deterioro cognoscitivo tienen una evolución lentamente progresiva, y en las fases terminales se observa retardo psicomotor grave, disminución en el lenguaje espontáneo y apatía, e incluso pueden permanecer postrados en cama, acinéticos y en estado de mutismo.
En las pruebas neuropsicológicas se evidencia una importante afectación en los tiempos de reacción, en la velocidad para procesar la información dada y en la flexibilidad mental. Así mismo, se pueden presentar alteraciones en las pruebas atencionales, daño en la memoria verbal y no verbal y disminución de la fluidez verbal (11).
En el examen neurológico puede observarse paraparesia, afectación de los esfínteres, alteración en la sensibilidad profunda (propiocepción y vibración), hiperreflexia generalizada, alteración de los movimientos sacádicos de la mirada, dismetría, disdiadococinesia y signos de liberación frontal (29).
Diagnóstico diferencial
El diagnóstico diferencial de la demencia asociada con infección por VIH es amplio e incluye numerosas infecciones oportunistas y lesiones neoplásicas (Tabla 4).

Exámenes paraclínicos
La infección por VIH produce leucopenia a expensas de linfocitos CD4, con una disminución importante de los linfocitos CD4 T4 helper, mientras los T8 supresores permanecen normales, por lo que presenta una alteración en la tasa T4/T8.
En el líquido cefalorraquídeo, la presencia de ARN viral apoya el diagnóstico de demencia asociada con VIH. Dos terceras partes de los pacientes presentan hiperproteinorraquia, y el 20%, pleocitosis linfocítica leve. Puede haber elevación de las concentraciones de IgG y bandas oligoclonales. Sin embargo, la medida más específica para determinar un daño del sistema nervioso central secundario a infección por VIH es la carga viral en el líquido cefalorraquídeo (30).
Ni en el plasma ni en el líquido cefalorraquídeo se han descubierto marcadores sensitivos y específicos de demencia asociada con infección por VIH. Los marcadores sustitutos de disfunción del sistema nervioso central son la ß-2-microglobulina, la neopterina y el ácido quinolínico, pues sus concentraciones se elevan en el plasma o en el líquido cefalorraquídeo en proporción con el trastorno del sistema nervioso central. Estos cambios se han atribuido a una activación inmune general, pero se desconoce su verdadero signifi- cado fisiopatológico (3). Los estudios imagenológicos deben ser el primer paso para hacer el diagnóstico diferencial con infecciones oportunistas y neoplasias. En la resonancia magnética cerebral, en pacientes con demencia asociada con infección por VIH, se observa atrofia cortical generalizada y atro- fia del núcleo caudado (31-33). La extensión de la atrofia cortical no predice la presencia o el grado de afectación cognoscitiva (33). Las secuencias T2 pueden mostrar la presencia de lesiones hiperintensas de sustancia blanca, y el deterioro cognoscitivo aumenta en relación con la gravedad de la afectación de la sustancia blanca. Se puede ver también realce meníngeo con el medio de contraste, por alteraciones de la barrera hematoencefálica.
Es razonable pensar que los cambios funcionales cerebrales preceden a los cambios estructurales. Las dos técnicas que se utilizan con mayor frecuencia para el estudio de los procesos bioquímicos y fisiológicos son la tomografía por emisión de positrones (PET) y la tomografía computarizada con emisión de fotón único (SPECT). El PET muestra el metabolismo de la glucosa, mediante la utilización del trazador fluorodeoxiglocosa (FDG), y el SPECT permite determinar la presencia de cambios en el flujo sanguíneo cerebral regional y el metabolismo de oxígeno (34).
Las imágenes de SPECT pueden mostrar alteraciones de la perfusión, con un patrón en parches, y áreas de hipoperfusión cortical,que pueden ser secundarias a una reacción inflamatoria o por lesión directa del virus sobre el sistema nervioso central (35). También pueden verse áreas de hipoperfusión subcortical, con una predilección por los ganglios basales, que incluso pueden estar presentes antes de los síntomas cognoscitivos (36-38).
Estudios con PET, que utilizan fluorodeoxiglucosa, han mostrado cambios en las tasas metabólicas regionales para la glucosa, con múltiples focos de hipometabolismo en áreas prefrontales corticales y subcorticales en fases tempranas de la enfermedad y, posteriormente, afectación de otras áreas corticales (36).
En la espectroscopía por resonancia magnética se ha demostrado una reducción global de N-acetylasparato (NAA), un marcador neuronal, y aumento en la colina, un componente de las membranas celulares (39-40). Los estudios neurofisiológicos son una valiosa herramienta para el diagnóstico de la encefalopatía, y apoyan los datos clínicos. El electroencefalograma (EEG) y los potenciales evocados (PE) resultan útiles para evaluar las alteraciones funcionales del sistema nervioso cental en individuos infectados por VIH (3,41).
Neuropatología
En estudios realizados en autopsias, las principales lesiones corresponden a encefalitis y a leucoencefalopatía. La leucoencefalopatía por VIH afecta la microglía en múltiples focos, con un aumento importante en el número de macrófagos activados, y células multinucleadas gigantes en la sustancia blanca y estructuras nucleares subcorticales (42). Otros cambios inflamatorios incluyen la presencia de infiltrados linfocíticos perivasculares y parenquimatosos, astrocitosis reactiva, meningitis linfocitaria y vasculitis cerebral con células gigantes multinucleadas y linfocidos en la pared de los vasos sanguíneos.
Tratamiento
La efectividad clínica de la terapia antirretroviral ha mejorado durante los últimos años. Datos publicados a finales de la década de los noventa estimaban una reducción de la tasa de mortalidad en pacientes con conteo de CD4 menor de 100 de 2/3 a <8 por 100 pacientes/ año, en países desarrollados, con una reducción global en la prevalencia de la demencia asociada con la infección por VIH, que ahora se calcula en 10% (1).
Los medicamentos utilizados en la actualidad para el tratamiento de la infección por VIH se pueden dividir en cuatro grandes grupos: análogos de nucleósidos, que actúan como factores que detienen la formación de cadenas de ADN e inhiben la trascripción reversa de ARN viral a ADN; inhibidores no nucleósidos de la trascrisptasa reversa, los cuales se unen e inhiben la trascriptasa reversa; inhibidores de proteasa, que se unen a la proteasa viral (enzima necesaria para la ruptura de proteínas precursoras, gag y pol, y permiten la entrada de partículas virales a la célula), y bloqueadores de fusión, que impiden el ingreso de viriones a las células diana.
Las combinaciones de medicamentos antirretrovirales incluyen, por lo general, tres medicamentos, y se ha denominado terapia HAART (de la sigla en inglés ‘highly active antiretroviral therapy’): dos análogos de nucleósidos y um inhibidor de proteasa o un inhibidor no nucleósido de la trascriptasa reversa (43).
La terapia HAART disminuye las concentraciones de ARN viral, y esto se correlaciona con una mejoría del déficit cognoscitivo (44). Zidovudina, un inhibidor de trascriptasa reversa, fue el primer medicamento antirretroviral que demostró un efecto benéfico, pero temporal, en el afectamiento del sistema nervioso central por VIH (45-46). A principios de la década de los noventa, la disponibilidad en el mercado de otros inhibidores de trascripatasa reversa, en especial análogos de nucleósidos, se asoció con una disminución de la incidencia de la demencia asociada con VIH (45).
Estudios epidemiológicos indican que con la aparición de nuevos medicamentos y la terapia HAART la incidencia continúa disminuyendo. En un estudio multicéntrico se demostró que la incidencia disminuyó a 7% al principio de los años noventa (47), y Maschke y cols. (26), en un estudio restrospectivo, encontraron una reducción de la prevalencia después de 1996 (48).
Posteriormente, Robertson y cols. (23) evaluaron en 48 pacientes que recibieron terapia HAART, seis meses después del inicio del tratamiento, las concentraciones de ARN viral en el plasma y en el líquido cefalorraquídeo. Encontraron una reducción significativa de sus cantidades y una mejoría significativa en las funciones cognoscitivas (45).
Los síntomas neuropsiquiátricos merecen especial atención. Los pacientes con demencia asociada con infección por VIH son extremadamente susceptibles a los efectos adversos de fármacos psicoactivos, como los ansiolíticos e hipnóticos, que deberán evitarse. Se podrían necesitar dosis bajas de neurolépticos en pacientes agitados o agresivos; sin embargo, estos pacientes son muy sensibles a estos medicamentos, y los síntomas extrapiramidales colaterales se dan 2,5 veces más que en los sujetos no infectados por VIH (3).
Los síntomas depresivos responden a antidepresivos tricíclicos o inhibidores selectivos de la captación de serotonina, incluso con dosis 25%-50% menores de las usuales (3). Los síntomas depresivos pueden ser tratados con medicamentos antidepresivos convencionales, pero la manía responde a la terapia HAART (49). El retardo psicomotor, la apatía y los déficits atencionales pueden mejorar con psicoestimulantes, como el metilfenidato o dextroanfetaminas (50).
Conclusiones
La demencia asociada con la infección por VIH es la causa de demencia no traumática más frecuente en pacientes jóvenes, con una incidencia anual que oscila entre el 7% y el 14% en pacientes infectados asintomáticos.
Los síntomas principales son de tres tipos: cognoscitivos, conductuales y motores. El inicio de la enfermedad suele ser poco llamativo; aparece dificultad para realizar tareas habituales y déficits de concentración. Las alteraciones del comportamiento comienzan como apatía, indiferencia ante las relaciones familiares y sociales (frecuentemente son diagnosticadas como depresión). Los signos motores pueden pasar inadvertidos; la bradicinesia es frecuente y se asocia con una marcha alterada con debilidad en las extremidades inferiores.
Una limitación importante en la actualidad es el desconocimiento de los factores que pueden predisponer a la demencia en las personas infectadas. No se sabe si los casos con anomalías neurológicas y del comportamiento se exponen a un riesgo mayor de presentar demencia. Ciertos autores consideran como predictores poderosos para estimar el riesgo de demencia el recuento de linfocitos TCD4, la anemia, las infecciones que definen el sida y el cáncer.
El diagnóstico es clínico. Por lo tanto, una adecuada historia clínica y una exploración física detallada son fundamentales para el diagnóstico.
Los exámenes paraclínicos son importantes para hacer un diagnóstico diferencial y descartar otros procesos que pueden simular una demencia asociada con infección por VIH. La efectividad clínica de la terapia antirretroviral ha mejorado durante los últimos años, con una reducción global en la prevalencia de la demencia asociada con la infección por VIH, que ahora se calcula en 10%.
Referencias
1. McArthur JC, Hoover DR, Bacellar H, Miller EN, Cohen BA, Becker JT, et al. Dementia in AIDS patients: incidence and risk factors. Multicenter AIDS cohort study. Neurology. 1993;43(11):2245-52. [ Links ]
2. Day JJ, Grant I, Atkinson JH, Brysk LT, McCutchan JA, Hesselink JR, et al. Incidence of AIDS dementia in a two-year follow-up of AIDS andARC patients on an initial phase II AZT placebo-controlled study: San Diego cohort. J Neuropsychiatry Clin Neurosci. 1992;4(1):15-20. [ Links ]
3. McArthur JC, Sacktor N, Selnes O. Human immunodeficiency virus-associated dementia. Semin Neurol. 1999;19(2):129-50. [ Links ]
4. Lyketsos CG, Schwartz J, Fishman M, Treisman G. AIDS mania. J Neuropsychiatry Clin Neurosci. 1997;9(2):277-9. [ Links ]
5. Lyketsos CG, Hoover DR, Guccione M, Senterfitt W, Dew MA, Wesch J, et al. Depressive symptoms as predictors of medical outcomes in HIV infection. Multicenter AIDS cohort study. JAMA. 1993;270(21):2563-7. [ Links ]
6. Krathwohl MD, Kaiser JL. HIV-1 Promotes quiescence in human neural progenitor cells. J Infect Dis. 2004;190(2):216-26. [ Links ]
7. Roy N, Benraiss A, Wang S, Fraser RA, Goodman R, Couldwell WT, et al. Promoter-targeted selection and isolation of neural progenitor cells from the adult human ventricular zone. J Neurosci Res. 2000; 59(3):321-31. [ Links ]
8. Palmer TD, Schwartz PH, Taupin P, Kaspar B, Stein SA, Gage FH. Progenitor cells from human brain after death. Nature. 2001;411(6833):42-3. [ Links ]
9. Roy NS, Wang S, Jiang L, Kang J, Benraiss A, Harrison-Restelli C, et al. In vitro neurogenesis by progenitor cells isolated from the adult human hippocampus. Nat Med. 2000; 6(3):271-7. [ Links ]
10. Fuchs E, Gould E. In vivo neurogenesis in the adult brain: regulation and functional implications. Eur J Neurosci. 2000;12(7):2211-4. [ Links ]
11. Kempermann G. Why new neurons? Possible functions for adult hippocampal neurogenesis. J Neurosci. 2002;22(3):635-8. [ Links ]
12. Locati M, Murphy PM. Chemokines and chemokine receptors: biology and clinical relevance in inflammation and AIDS. Ann Rev Med. 1999;50:425-40. [ Links ]
13. Sacktor NC, Bacellar H, Hoover DR, Nance-Sproson TE, Selnes OA, Miller EN, et al. Psychomotor slowing in HIV infection: a predictor of dementia, AIDS and death. J Neurovirol. 1996;2(6):404–10. [ Links ]
14. Wiley CA, Soontornniyomkij V, Radhakrishnan L, Masliah E, Mellors J, Hermann SA, et al. Distribution of brain HIV load in AIDS. Brain Pathol. 1998;8(2):277-84. [ Links ]
15. Aylward EH, Henderer JD, McArthur JC, Brettschneider PD, Harris GJ, Barta PE, et al. Reduced basal ganglia volume in HIV-1-associated dementia: results from quantitative neuroimaging. Neurology. 1993;43(10):2099-104. [ Links ]
16. Dal Pan GJ, McArthur JH, Aylward E, Selnes OA, Nance-Sproson E, Kumar AJ, et al. Patterns of cerebral atrophy in HIV-1-infected individuals: results of a quantitative MRI analysis. Neurology. 1992;42(11):2125-30. [ Links ]
17. Towfighi A, Skolasky RL, St. Hillaire C, Conant K, McArthur JC. CSF soluble Fas correlates with the severity of HIV-associated dementia. Neurology. 2004;62(4);654-6. [ Links ]
18. Christensson B, Ljungberg B, Ryding E, Svenson G, Rosén I. SPECT with 99mTc-HMPAO in subjects with HIV infection: cognitive dysfunction correlates with high uptake. Scand J Infect Dis. 1999;31(4):349-54. [ Links ]
19. Cecil KM, Lenkinski RE. Proton MR spectroscopy in inflammatory and infectious brain disorders. Neuroimaging Clin N Am. 1998;8(4):863-80. [ Links ]
20. Chong WK, Paley M, Wilkinson ID, Hall-Craggs MA, Sweeney B, Harrison MJ, et al. Localized cerebral proton MR spectroscopy in HIV infection and AIDS. AJNR Am J Neuroradiol. 1994;15(1):21-5. [ Links ]
21. Glass JD, Wesselingh SL, Selnes OA, McArthur JC. Clinical-neuropathologic correlation in HIV-associated dementia. Neurology. 1993;43(11):2230-7. [ Links ]
22. Graham NM, Hoover DR, Park LP, Stein DS, Phair JP, Mellors JW, et al. Survival in HIV-infected patients who have received zidovudine: comparison of combination therapy with sequential monotherapy and continued zidovudine monotherapy. Multicenter AIDS Cohort Study Group. Ann Intern Med. 1996;124(12):1031-8. [ Links ]
23. Robertson KR, Robertson WT, Ford S, Watson D, Fiscus S, Harp AG, et al. Highly Active Antiretroviral Therapy Improves Neurocognitive Functioning. J Acquir Immune Defic Syndr. 2004;36(1):562-6. [ Links ]
24. Schmitt FA, Bigley JW, McKinnis R, Logue PE, Evans RW, Drucker JL. Neuropsychological outcome of zidovudine (AZT) treatment of patients with AIDS and AIDS related complex. N Engl J Med. 1988;319(24):1573-8. [ Links ]
25. Sacktor N, Lyles RH, Skolasky R, Kleeberger C, Selnes OA, Miller EN, et al. HIV-associated neurologic disease incidence changes:: Multicenter AIDS Cohort Study, 1990-1998. Neurology. 2001;56(2):257-60. [ Links ]
26. Maschke M, Kastrup O, Esser S, Ross B, Hengge U, Hufnagel A. Incidence and prevalence of neurological disorders associated with HIV since the introduction of highly active antiretroviral therapy (HAART). J Neurol Neurosurg Psychiatry. 2000;69(3):376-80. [ Links ]
27. Mijch AM, Judd FK, Lyketsos CG, Ellen S, Cockram A. Secondary mania in patients with HIV infection: are antiretrovirals protective? J Neuropsychiatry Clin Neurosci. 1999;11(4):475-80. [ Links ]
28. Fernandez F, Levy JK, Galizzi H. Response of HIV-related depression to psychostimulants: case reports. Hosp Community Psychiatry. 1988;39(6):628-31. [ Links ]
29. Prieto F, Osorio A, De Neira M. Prevalencia de VIH en Población General Colombia 2003: VI Estudio Nacional Centinela de VIH 2003-2004. Primera Fase. Información Quincenal Epidemiologica Nacional (Colombia). 2004; 9:362-76. [ Links ]
30. Yugueros-Fernández MI, Tola-Arribas MA, Fernández-Buey N. Demencia asociada a la enfermedad por VIH-1. Medicine 1998;7:4474-6. [ Links ]
31. Nomenclature and research case definitions for neurologic manifestations of human immunodeficiency virus-type 1 (HIV-1) infection. Report of a Working Group of the American Academy of Neurology AIDS Task Force. Neurology. 1991;41(6):778-85. [ Links ]
32. Simpson DM, Tagliati M. Neurologic manifestations of HIV infection. Ann Intern Med. 1994;121(10):769-85. [ Links ]
33. Casanova Sotolongo P, Casanova Carrillo P, Casanova C Lima G, Aldana L, Acosta M. Manifestaciones neuropsiquiátricas de la infección por el Virus de la Inmunodeficiencia Humana. Rev Cubana Med Milit. 2002;31(3):194- 200. [ Links ]
34. Pakrasi S, O’Brien JT. Emission tomography in dementia. Nucl Med Comun 2005;26(3):189-96. [ Links ]
35. Sacktor N, Prohovnik I, Van Heertum RL, Dooneief G, Gorman J, Marder K, et al. Cerebral single-photon emission computed tomography abnormalities in human immunodeficiency virus type 1-infected gay men without cognitive impairment. Arch Neurol. 1990;52(6):607-11. [ Links ]
36. Arendt G, von Giesen HJ. Human immunodeficiency virus dementia: evidence of a subcortical process from studies of fine finger movements. J Neurovirol. 2002;8 Suppl 2:27-32. [ Links ]
37. Brew BJ, González-Scarano F. HIVassociated dementia. An inconvenient truth. Neurology. 2007;68(5):324-5. [ Links ]
38. Valcour VG, Sithinamsuwan P, Nidhinandana S, Thitivichianlert S, Ratto- Kim S, Apateerapong W, et al. Neuropsychological abnormalities in patients with dementia in CRF 01_AE HIV-1 infection. Neurology. 2007;68(7):525- 7. [ Links ]
39. McArthur JC, Brew BJ, Nath A. Neurological complications of HIV infection. Lancet Neurol. 2005;4(9):543-55. [ Links ]
40. Di Sclafani V, Mackay RD, Meyerhoff DJ, Norman D, Weiner MW, Fein G. Brain atrophy in HIV infection is more strongly associated with CDC clinical stage than with cognitive impairment. J Int Neuropsychol Soc. 1997;3(3):276- 87. [ Links ]
41. Brew BJ, Pemberton L, Blennow K, Wallin A, Hagberg L. CSF amyloid beta42 and tau levels correlate with AIDS dementia complex. Neurology. 2005;65(9);1490-2. [ Links ]
42. Van der Flier WM, Scheltens P. Use of laboratory and imaging investigations in dementia. J Neurol Neurosurg Psychiatry. 2005;76 Suppl 5:v45-52. [ Links ]
43. Manji H, Miller R. The neurology of HIV infection. J Neurol Neurosurg Psychiatry. 2004;75 Suppl 1:i29-35. [ Links ]
44. Casanova Sotolongo P, Casanova Carrillo P, Casanova Carrillo C. Demencia asociada al SIDA. Rev Neurol. 2002;34(8):781-7. [ Links ]
45. Sacktor N, Lyles RH, Skolasky R, Kleeberger C, Selnes OA, Miller EN, et al. HIV associated neurologic disease incidence changes: the Multicenter AIDS Cohort Study, 1990-1998. Neurology. 2001;56(2):257-60. [ Links ]
46. Stern Y, McDermott MP, Albert S, Palumbo D, Selnes OA, McArthur J, et al. Factors associated with incident human immunodeficiency virus dementia. Arch Neurol. 2001;58(3):473-9. [ Links ]
47. Polich J, Ilan A, Poceta JS, Mitler MM, Darko DF. Neuroelectric assessment of HIV: EEG, ERP and viral load. Int J Psychophysiol. 2000;38(1):97-108. [ Links ]
48. Steinbrook R. The AIDS Epidemic in 2004. N Eng J Med. 2004;351(2):115- 7. [ Links ]
49. Kao AW, Price RW. Chemokine receptors, neural progenitor cells, and the AIDS dementia complex. J Infect Dis. 2004;190(2):211-5. [ Links ]
50. Yeni PG, Hammer SM, Hirsch MS, Saag MS, Schechter M, Carpenter CC, et al. Treatment for Adult HIV Infection. 2004 Recommendations of the International AIDS Society-USA Panel. JAMA. 2004; 292(2):251-65. [ Links ]
Recibido para evaluación: 28 de febrero de 2007 Aceptado para publicación: 3 de octubre de 2007














