Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.38 no.3 Bogotá July/Sept. 2009
Anormalidades cromosómicas y esquizofrenia
Cromosomal Abnormalities and Schizophrenia
Ruth Maribel Forero Castro1, Carolina Cortés Duque2, Mayely Paola Sánchez Espinosa3, Zayda Lorena Corredor Rozo3
1Bióloga. Magíster en Ciencias Biológicas con énfasis en Genética Humana. Profesora asistente de tiempo completo, Facultad de Ciencias, Escuela de Ciencias Biológicas, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia.
2Médica psiquiatra del Centro de Rehabilitación Integral de Boyacá (CRIB), Tunja, Colombia.
3Bióloga, Facultad de Ciencias, Escuela de Biología, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia.
Correspondencia Ruth Maribel Forero Castro Facultad de Ciencias Escuela de Ciencias Biológicas Universidad Pedagógica y Tecnológica de Colombia Avenida Central del Norte Tunja, Colombia
Recibido para evaluación: 18 de abril del 2009 Aprobado para publicación: 17 de julio del 2009
Resumen
Introducción: La esquizofrenia es un trastorno mental que afecta a la población mundial, con una prevalencia del 1% y con heredabilidad hasta del 80%. Se han postulado cuatro enfoques para identificar genes de susceptibilidad y establecer marcadores moleculares asociados con la enfermedad: estudios de ligamiento genético, convergencia genómica, asociación y anormalidades cromosómicas. Objetivo: Mostrar anormalidades cromosómicas reportadas en pacientes con esquizofrenia como parte de los factores genéticos hallados en esta patología. Método: Se hizo una selección estratégica de 68 artículos publicados desde 1954 hasta 2008 en bases de datos científicas, clasificando las alteraciones de tipo numérico, estructural y mosaicos, tomando en cuenta sus contribuciones al estudio y relevancia. Resultados: Los cromosomas principalmente involucrados fueron, en orden de mayor a menor frecuencia, 18, 9, 11, 1, X, 22 y 21. En cuanto al tipo de anormalidad se encontraron alteraciones estructurales, mosaicismos, numéricas y también polimorfismos. Las anormalidades estructurales principalmente fueron translocaciones recíprocas balanceadas. Conclusiones: Con esta revisión no solamente se logró un acercamiento hacia la estimación de la frecuencia de estos hallazgos, sino tener un referente del tipo y frecuencia de estas alteraciones para evaluar el factor genético de la esquizofrenia, encaminados a comprender su patogenia.
Palabras clave: esquizofrenia, aberraciones cromosómicas, análisis citogenético.
Abstract
Introduction: Schizophrenia is a mental disorder that affects the world population with a prevalence of 1% and a hereditability of up to 80% . Four approaches have been postulated to identify susceptibility genes and to establish molecular markers associated with the disease: Genetic linkage studies, genomic convergence, association, and chromosomal abnormalities. Objective: To show chromosomal abnormalities reported in patients with schizophrenia as part of the genetic factors found in this condition. Methods: A strategic selection was made of 68 articles published from 1954 to 2008 in scientific databases, and numerical, structural and mosaical type alterations were classified, taking into account their contributions to the study and relevance. Results:
The mainly involved chromosomes were, in order of frequency, 18, 9, 11, 1, X, 22 and 21. As to type of abnormalities, structural and numerical alterations were found, as well as mosaicims and polymorphisms. Conclusions: With this review not only the calculation of the frequency of these findings was made more possible, but it also provided a reference of the type and frequency of these alterations to evaluate the genetic factor of schizophrenia, aimed at understanding its pathogeny
Key words: Schizophrenia, chromosomal aberrations, cytogenetic analysis.
Introducción
El término esquizofrenia fue introducido por Bleuler al inicio del siglo XX. La palabra se deriva de dos raíces griegas: schizo, que significa rasgar o separar, y phren, que significa el intelecto o la mente, y fue usada para referirse a una disfunción emocional. Así, la palabra esquizofrenia significa la escisión de la mente y la estabilidad emocional del paciente. Esta enfermedad afecta a una de cada 100 personas (1% de la población mundial) en algún momento de su vida, ya que es un trastorno complejo de los procesos mentales y del funcionamiento psicológico en varios puntos a lo largo del desarrollo.
Modelos genéticos formales planteados sugieren que los factores medioambientales no contribuyen significativamente a su patogenia; sin embargo, datos de gemelos y estudios de adopción en esquizofrenia han dado luces sobre la importancia de la vulnerabilidad genética como resultado de la combinación de factores estocásticos, psicológicos, culturales, biológicos y ambientales en la generación de la enfermedad.
El riesgo para desarrollar la esquizofrenia se incrementa según el grado de relación genética con los individuos afectados. Estudios realizados demuestran que el miembro no afectado de una pareja de gemelos monocigóticos tiene un elevado riesgo de desarrollar la enfermedad (50%). Así mismo, los familiares en primer grado de consanguinidad tienen un riesgo de 5%-16%; en segundo grado, del 2%-5%, y en tercer grado, del 2%.
Igualmente, la enfermedad involucra la interacción entre múltiples genes, pero los loci específicos no han sido identificados en su totalidad, debido al desconocimiento de la patofisiología de genes asociados con el funcionamiento cerebral y a la amplia heterogeneidad genética en la mayoría de las enfermedades psicóticas. Ante esto, algunos investigadores adicionan que los cuatro enfoques principales para identificar genes de susceptibilidad y establecer marcadores moleculares asociados son los estudios de ligamiento genético, de convergencia genómica, de asociación y de anormalidades cromosómicas.
En el mundo se han reportado gran variedad de anormalidades citogenéticas en pacientes con esquizofrenia, que afectan los cromosomas sexuales y autosómicos. Por tal razón, el objetivo de esta revisión es mostrar las diferentes anormalidades cromosómicas reportadas mundialmente en pacientes con esquizofrenia como parte de los factores genéticos hallados en esta patología. Para esta revisión se hizo una selección estratégica de artículos publicados desde 1954 hasta 2008.
Primero se menciona la información existente en el mundo frente a la frecuencia de anormalidades cromosómicas. Enseguida se discute el tipo de anormalidades numéricas, estructurales y en mosaico, así como su prevalencia en la literatura revisada. Luego se mencionan los cromosomas que se han involucrado en dichas alteraciones, enunciando de manera general las regiones cromosómicas cobijadas y que pueden servir como referente para estudiar la patogenia de este trastorno. Finalmente, se recopilan las anormalidades cromosómicas numéricas, estructurales y mosaicos; el tipo de alteraciones dentro de cada grupo, y los complementos cromosómicos reportados con las respectivas referencias donde fueron halladas.
Método
La literatura sobre anormalidades cromosómicas reportadas en pacientes con esquizofrenia fue adquirida a través de múltiples recursos. Para ello se realizó una búsqueda de literatura médica en las bases de datos en línea de la Online Mendelian Inheritance in Man (OMIM): http://www.ncbi.nlm.nih.gov/omim/; ScienceDirect: http://www.sciencedirect.com; la iniciativa InterRed-Salud de Acceso a la Investigación (HINARI): http://www.who.int/hinari/es; InterScience: http://www.interscience.wiley.com; Pubmed: http://www.interscience.wiley.com, y otras relacionadas.
Para esta revisión se hizo una selección estratégica de artículos publicados desde 1954 hasta 2008, empleando como palabra clave esquizofrenia con los términos chromosomal abnormalities, chromosomopaties, chromosomal aberrations, chromosomal disorders, cytogenetic analysis, chromosomal mapping y cariotipification.
La información acerca de las anormalidades cromosómicas se registró de acuerdo con los siguientes criterios: (a) artículos de cualquier tipo de estudio (poblacionales, caso control, caso reporte, revisiones sistemáticas o metaanálisis publicados, etc.); (b) con técnicas citogenéticas convencionales o moleculares; (c) con técnicas de biología molecular; (d) de cualquier año y cualquier tipo de población; (e) pacientes con diagnóstico confirmado de esquizofrenia, según criterios psiquiátricos del Manual diagnósticos y estadístico de los trastornos mentales (DSM) vigentes, y (f) artículos tanto en inglés como en español.
Una vez recopilada la información, se seleccionaron 68 publicaciones y con ellas se hizo una clasificación de las anormalidades citogenéticas de tipo numérico, estructural y mosaicos, tomando en cuenta sus contribuciones al estudio y relevancia.
Anormalidades cromosómicas reportadas mundialmente en pacientes con esquizofrenia
Diversos reportes de casos clínicos, así como de diagnóstico citogenético y molecular, han dado a conocer un gran número de anormalidades cromosómicas en pacientes con esquizofrenia que involucran tanto cromosomas autosómicos como sexuales. A pesar de los hallazgos citogenéticos para esta enfermedad, no hay ningún estudio que reporte de forma clara la frecuencia de las anormalidades cromosómicas. Ante esto, se seleccionaron siete estudios poblacionales para diagnóstico sobre muestras de sangre periférica y alteraciones cromosómicas mediante técnicas de citogenética convencional, con bandeo GTG, alta resolución, bandeo C, prueba de X frágil, en población con esquizofrenia diagnosticada según criterios del DSM vigentes.
A partir de ellos, se estableció que aproximadamente, en promedio, el 11% de la población estudiada presenta algún tipo de anormalidad: DeLisi y cols. (0/46=0%) (1), Nanko y cols. (7/120=5,8%) (2); Kumra y cols. (1/38=2,6%) (3); Kunugi y cols. (1/250=6%) (4); Nicolson (5/47=10,6%) (5); Toyota y cols. (21/161 = 13%) (6), Demirhan y cols. (43/134=32%) (7) (Tabla 1).
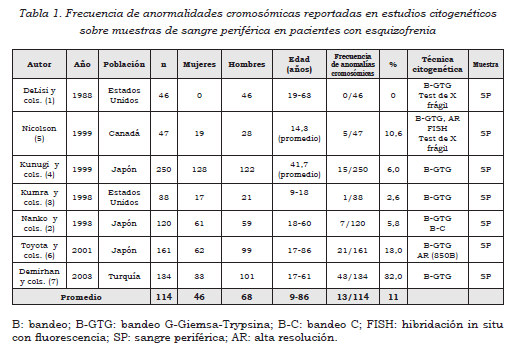
La recopilación de anormalidades cromosómicas descritas en pacientes afectados por esquizofrenia, en publicaciones mundiales encontradas entre 1954 y 2008, se mencionan en la Tabla 2 (5,8-66). A partir de esta, se pudo determinar que los cromosomas que han sido principalmente involucrados en dichas alteraciones son en orden de mayor a menor frecuencia: 18, 9, 11, 1, X, 22, 21; también 5, 2, 6, 7 , 13, 4, 8, 14, Y, 15, 10, 3, 12 y 17. En la revisión hecha no se publicaron alteraciones en 16, 19 y 20. En orden de prevalencia en cuanto al tipo de anormalidad, se encuentran las alteraciones estructurales, mosaicismos, numéricas y también se reportan polimorfismos. Las anormalidades estructurales cobijan principalmente translocaciones recíprocas balanceadas, así como eliminaciones mayormente terminales, inversiones pericéntricas y anillos.
Es evidente que la mayoría de mosaicos reportan anormalidades cromosómicas de baja proporción (presencia de líneas celulares anormales en menos del 10% o del 6% [69]) y que portan en mayor porcentaje líneas con complemento cromosómico normal y presencia de una sola línea celular alterada.
Los mosaicos cobijan líneas aberrantes numérica o estructuralmente. Dentro de los mosaicos numéricos se involucran principalmente anormalidades en cromosomas sexuales, como las aneuploidías del X. Los mosaicismos con líneas estructurales muestran principalmente sobre cromosomas autosómicos, eliminaciones terminales y algunos polimorfismos. Los mosaicos con líneas alteradas, tanto numérica como estructuralmente, involucran en su mayoría cromosomas autosómicos con eliminaciones y endorreduplicaciones.
Existen dos aspectos que se deben debatir frente a las publicaciones analizadas en cuanto a los mosaicismos y polimorfismos cromosómicos referenciados. Respecto a los primeros, es discutible la categorización de alteraciones en mosaicismo, cuya carga cromosómica incluya complementos anormales en tan sólo una sola célula hallada, pues el International System for Human Cytogenetic Nomenclature 2005 (ISCN 2005) (70) define como mosaico anormalidades en las cuales coexisten en un mismo organismo dos o más líneas celulares cromosómicamente diferentes; cada condición detectada en el mosaico debe ser vista como mínimo en dos células.
En relación con los polimorfismos, es particular el hecho de reportar dentro de las anormalidades cromosómicas universales y en mosaicismos polimorfismos cromosómicos en satélites, heterocromatina pericentromérica y región distal (46, XX, 13 ps+; 46,XX,15ps+; 46,XX,21ps+; 46,XY,9qh+ y 46,XY,Yqh+), puesto que estos hallazgos son reconocidos por el ISCN 2005 como variaciones morfológicas normales en el cariotipo. Dichos aspectos fueron observados en la publicación de Demirhan y cols. (7).
Finalmente, dentro de las anormalidades numéricas se involucran principalmente los cromosomas sexuales en las trisomías (47,XXX; 47,XXY; 47,XYY) y en la monosomía del cromosoma X (45,X). También se reportan trisomías en dos cromosomas autosómicos con complementos 47,XY,+21 y 47,XY, +5.
De acuerdo con los complementos cromosómicos anormales reportados en pacientes con esquizofrenia, en la Tabla 3 se analizan las características de las aberraciones cromosómicas más involucradas en cuanto a tipo de anormalidad, tipo de cromosomas, subtipos de anormalidades y regiones cromosómicas.
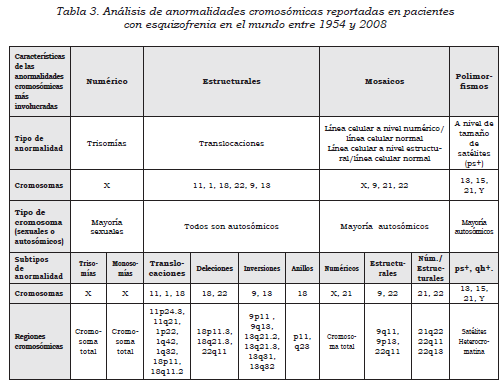
A continuación se mencionan los cromosomas que han sido principalmente involucrados en anormalidades cromosómicas y se enuncian de manera general las regiones cobijadas en las alteraciones reportadas y que pueden contribuir a descifrar la generación de la esquizofrenia:
Cromosoma 1
Surge como un interesante candidato para portar los loci de predisposición a esquizofrenia ubicados en las regiones 1p21 a 1p36 (71), 1q21 a 1q23 (72), 1q32 (73), 1q42(18) y 1q44 (74). Los loci de susceptibilidad sobre el brazo largo del cromosoma 1 están sustentandos por análisis de ligamiento, y están fuertemente asociados con los marcadores DIS1653-DSI679 en la región q21-22 (75).
Por otra parte, este cromosoma también está implicado en translocaciones balanceadas con el cromosoma 11, así demostrado por Klar (14), Evans y cols. (15) Blackwood y cols. (16), Millar y cols. (17) y Clair (18), quienes reportan t(1;11)(q42;q14), t(1;11)(q42;q14.3), t(1;11)(q43;q21). Además, los estudios de ligamiento confirman que cerca de la región 1q42.1 existen puntos de ruptura involucrados en la translocación (73,76). Entre las translocaciones, Cordeiro y cols. (20) reportan la t(1;4)(p21;p14) y Gordon y cols. (22) la t(1;7)(p22q21.3) en niños, al sugerirlas como regiones interesantes para investigaciones genéticas sobre esquizofrenia y otros trastornos psicóticos.
Cromosoma 2
Se ha reportado un caso de translocación recíproca entre los cromosomas 2 y 18 en un hombre con esquizofrenia, t(2;18)(p11.2;q11.2) (27) y una trisomía parcial, 46,XX,der(8), ins(8;2)(p21.3;q21.1q11.2) en una mujer con trastorno esquizoafectivo, enfermedad psicótica y discapacidad de aprendizaje (38).
Cromosoma 4
Palmour y cols. (40) describieron una inversión del cromosoma 4 en un hombre con esquizofrenia. Su progenitora también la presentó y mostró síntomas de personalidad esquizotípica. La inversión inv(4)(p15.2q21.3) es considerada algo rara; pero se sugiere tenerla en cuenta, porque puede prevalecer en baja magnitud en la población esquizofrénica.
Cromosoma 5
Malaspina y cols. (10) encontraron un cariotipo 46,XY,t(5;14)(p 14.1;q32.3) posiblemente con eliminación en 5p14, lo que constituye una trisomía parcial en un caso de esquizofrenia. Bassett y cols. (21) también reportaron una anomalía de tipo estructural en este cromosoma, correspondiente a la eliminación intersticial del(5)(q22q23.3).
Cromosoma 6
Dentro de los reportes encontrados de Holland y Gosden (29) y Baysal (30) se puede ver la implicación del cromosoma 6 con el 11 en la translocación t(6;11)(q14.2;q25); entre tanto, en el trabajo de Caluseriu y cols. (49) se evidencia la eliminación en 6p25, que se hace presente en un paciente con esquizofrenia, y aunque no hay más estudios que reporten esta misma anormalidad, los autores sugieren que hay evidencias moleculares que demuestran que en la región 6p pueden haber loci de susceptibilidad para la esquizofrenia, dentro de los cuales cabe mencionar el más estudiado de la región 6p22, correspondiente al locus candidato DTNBP1 (Disbindina) y el NRN-1 (Neuregulina) de la región 6p25, propuesto como mayormente implicado en la patogenia del neurodesarrollo. De igual forma, Bogani y cols. (77) señalan que la región 6p25-pter está asociada con varias eliminaciones contiguas que pueden surgir como consecuencia de la pérdida acumulativa de varios genes.
Cromosoma 7
Las anormalidades que involucran este cromosoma están asociadas a las translocaciones. Por ejemplo, la translocación recíproca t(1;7)(p22;q21.3) fue encontrada y descrita en un niño con esquizofrenia en el trabajo realizado por Gordon y cols. (22); por su parte, la translocación t(7;8)(p12;p23) encontrada por Price y cols. (32) en un caso de esquizofrenia inquieta sobre la presencia de posibles loci de susceptibilidad localizados en este cromosoma, así como lo sugieren Blouin y cols. (74) y Faraone (78), especialmente en la región 7q21-22.
Cromosoma 8
Glass y cols. (38) describieron una anomalía desbalanceada 46,XX,der(8),ins(8;2) (p21.3;q21.1q11.2); una rara transmisión directa de una trisomía autosómica parcial, es decir, una trisomía proximal en la región 2q, que resulta a partir de una inserción intercromosomal. Esta anomalía se encontró en una madre y su hija, quienes presentaban retardo metal, baja estatura, dismorfismo facial, dependencia a la insulina por diabetes mellitus y enfermedades psicóticas. Por tal razón se sugiere esta rara anormalidad como una región susceptible a la esquizofrenia.
Cromosoma 9
La inversión pericéntrica del cromosoma 9 y el polimorfismo en la región pericentromérica 9qh+ son considerados variantes normales del cromosoma 9 en los humanos (79). Sin embargo, aunque los posibles efectos clínicos de 9qh+ son desconocidos, Liu y cols. (79) sugirieron que la inversión del 9 y del 9qh+ está asociada con varias enfermedades desfavorables para la reproducción humana.
La inversión pericéntrica del cromosoma 9 es la más común en la población en general. Serra y cols. (80) examinaron 7.613 recién nacidos y estimaron la prevalencia de la inversión del 9 en un 0,085% en descendientes europeos. La incidencia fue de 1,65% en 1.513 recién nacidos normales en Japón (81) y 1,2% en 1.350 recién nacidos taiwaneses (82). Se estimó que la incidencia en poblaciones asiáticas es aproximadamente del 1,5%. No obstante, algunos estudios recientes de la región pericéntrica del cromosoma 9 indican su posible asociación con la esquizofrenia (2,4,6,7, 41--45).
Axelsson y Wahlström (28) reportaron un incremento de la inversión del cromosoma 9 (9,7%) entre pacientes masculinos con psicosis paranoide. Kunugi y cols. (4) encontraron que el 4% de las personas con esquizofrenia portaban una inversión del cromosoma 9 y su incidencia en japoneses con esquizofrenia fue significativamente alta respecto a la población general. En contraste, DeLisi y cols. (1) no encontraron individuos con inversión del 9 en 46 hombres con esquizofrenia.
La región pericéntrica del cromosoma 9 estuvo involucrada en un 5,2% (7/134) en los pacientes del estudio de Demirhan y cols. (7). En dos de ellos, la anormalidad fue inv(9)(q11q13), mientras que dos pacientes tenían las eliminaciones del (9)(q11q13) y del (9)(q13), y los otros tres pacientes presentaron el polimorfismo 9qh+. Esto indica que los efectos de la región 9qh en el desarrollo de la esquizofrenia pueden no ser significativos, pero no se descarta que sea probablemente un factor de alto riesgo. Levinson y cols. (83) desarrollaron un estudio genómico para ligamiento con esquizofrenia y obtuvieron un resultado positivo para un marcador (D9S257).
La prevalencia de esta inversión, según los estudios de Nanko y cols. (2), Kunugi y cols. (4), Toyota y cols. (6) y Demirhan y cols. (7), para hombres y mujeres, fue en promedio de 32,6%, con edades entre 17 y 86 años, y 43,8%, con edades entre 19 y 74 años, respectivamente, lo que muestra una mayor incidencia en las mujeres.
Cromosoma 11
En el estudio de Demirhan y cols. (7) se detectó una eliminación en la región 11q23 del cromosoma 11 en tres pacientes con esquizofrenia. Adicionalmente, en otros estudios también ha sido implicado este cromosoma, sobre todo en la región 11q21-22, ya que contiene genes que incrementan la posibilidad de presentar esquizofrenia (14-19,32).
Así mismo, Doody y cols. (25), Clair y cols. (18), Blackwood y cols. (84), Millar y cols. (85) registraron algunas translocaciones balanceadas en las regiones q14.3,q21, q22.3 y q25 del cromosoma 11, presentes en la esquizofrenia y en otros trastornos psiquiátricos. También, así demostrado por Klar (14), Evans y cols. (15), Blackwood y cols. (16), Millar y cols. (17) y Clair (18), quienes reportan t(1;11)(q42;q14), t(1;11)(q42;q14.3), t(1;11)(q43;q21). Ello sustenta el gran interés e importancia de este cromosoma como aporte al conocimiento de la esquizofrenia y su patofisiología.
Cromosoma 13
MacIntyre y cols. (34) reportaron, mediante el estudio de un pedigrí, una inserción invertida en el cromosoma 13 [inv, ins(13)(q21.3q32q31)], el cual aparece segregado con la psicosis y la inestabilidad del aprendizaje. Además, la región 13q32 ha sido reportada en pacientes con esquizofrenia y trastorno bipolar. Así, es una región significativamente asociada con la etiología de la enfermedad.
Cromosoma 14
Este cromosoma ha sido implicado principalmente en translocaciones robertsonianas entre los cromosomas 13 y 21, respectivamente. En la literatura mundial hasta ahora reportada sólo el estudio citogenético de niños con trastornos psiquiátricos de Escobar (33) reporta un caso de translocación recíproca entre el cromosoma 13 y 14 en un paciente con esquizofrenia. Mientras que el estudio de Toyota y cols. (6) reporta la translocación robertsoniana 45,XY der(14;21)(q10;q10) en un hombre de 50 años con esquizofrenia residual. También ha estado involucrado en translocaciones recíprocas con el cromosoma 18.
Cromosoma 18
Se han reportado varios casos de anormalidades del cromosoma 18, relacionados con enfermedades mentales, pero son relevantes las anormalidades que implican ambos brazos del cromosoma (34,51). Los registros citogenéticos en Escocia (51) revelaron a dos individuos con una rara inversión pericéntrica inv(18)(p11.3q21.1), de los cuales uno presentaba esquizofrenia y el otro trastorno bipolar. Además, Smith y cols. (37) reportaron que dos hermanos con esquizofrenia presentaron una translocación balanceada entre los cromosomas 18 y 21: t(18;21) (p11.1;p11.1).
MacIntyre y cols. (34) reportaron anomalías que involucran el brazo largo del cromosoma 18, específicamente en una mujer con trastornos esquizoafectivos, quien presentó una translocación entre los cromosomas 14 y 18: t(14;18)(q11.2;q22.1) y en dos individuos; uno con trastorno bipolar y el otro con trastorno esquizoafectivo, quienes presentaron una translocación entre los cromosomas 15 y 18: t(15;18)(q13.3;q22.3) (35). Lo anterior sustenta que las regiones 18p11 y 18q22 pueden ser interesantes para investigaciones acerca de la esquizofrenia y otras enfermedades mentales (34).
Cromosoma 21
Respecto a este cromosoma, la trisomía 21 está implicada tanto en anormalidades numéricas (8,9) como en mosaicos (6,7). Por otra parte, la región 21p11.1 en la translocación: t(18;21) (p11.1;p11.1) ha sido hallada en un caso reporte por Smith y cols. (37); por su parte, en el estudio de Toyota y cols. (6), un hombre de 50 años presentó una translocación robertsoniana con el cromosoma 14: der(14;21)(q10;q10).
Cromosoma 22
Las técnicas citogenéticas de alta resolución y la hibridación in situ con fluorescencia (FISH, por su sigla en inglés) han permitido reportar sobre el cromosoma 22 la microeliminación 22q11 asociada con el subtipo genético de la esquizofrenia, llamado síndrome 22qDS (19).
El síndrome 22qDS está asociado con la microeliminación en el cromosoma 22q11 con una estimación de 1 en 4.500 (0,02%) en la población general (7), y está enmarcado en varios síndromes genéticos, incluido el síndrome velocardiofacial descrito en 1978 (57). Adicionalmente, a este síndrome se le ha reconocido un fenotipo de carácter psiquiátrico (57) y se ha confirmado la asociación de la microeliminación en 22q11 con la esquizofrenia (58), la cual es aproximadamente 100 veces más frecuente en adultos con esquizofrenia (2%) que en la población general (0,02%) (5). En la niñez ocurre en más del 6% de los casos (86).
Estos estudios preliminares indican que la tasa del síndrome 22qDS en esquizofrenia puede ser aproximadamente 80 veces la estimada para la tasa de población general de eliminaciones 22q11.2 (1/4.000). Por lo anterior se ha propuesto el síndrome 22qDS como un subtipo genético de la esquizofrenia (61). Se ha reportado la alta prevalencia de serias enfermedades psiquiátricas en pacientes adultos con síndrome 22qDS. En el estudio de Murphy y Owen (59), realizado en 40 adultos con el síndrome 22qDS, se encontró que el trastorno psiquiátrico más comúnmente diagnosticado bajo el criterio de diagnóstico del DSM-IV fue la esquizofrenia (25%), seguido por depresión mayor (13%) y el trastorno bipolar (2,5%). Así mismo, Pulver y cols. (60) reportaron en 13 adultos con síndrome 22qDS (31%) que tenían esquizofrenia o trastornos esquizoafectivos, según criterio del DSM-III-R.
Comúnmente, el síndrome 22qDS se presenta como una manera esporádica en las familias, originado por una mutación (de novo) en el 90% de los casos. Este síndrome es heredado mediante un patrón autosómico dominante en sólo un 10% de los casos. Por lo tanto, estos pacientes con el síndrome tienen un 50% de transmitir la eliminación a su descendencia (61). Se han establecido ocho criterios para identificar pacientes con esquizofrenia, candidatos a presentar el síndrome de elminación 22qDS:
1. Problemas de comportamiento.
2. Habla hipernasal, historia de terapia del lenguaje, incompetencia velofaringeal o paladar hendido (usualmente submucoso).
3. Rasgos faciales: cara estrecha, alargada, fisuras palpebrales estrechas, mejillas caídas, nariz prominente, orejas pequeñas, boca pequeña o mentón retraído.
4. Dificultades del aprendizaje, historia de educación especial, retardo mental.
5. Defectos congénitos del corazón: defecto del tabique ventricular, tetralogía de Fallot, arco aórtico derecho, doble arco aórtico.
6. Otras anormalidades congénitas: polidactilia, escoliosis, anomalía renal, hipospadias.
7. Historia de hipocalciemia (neonatal, niñez, adolescencia o adultez temprana) o hipoparatiroidismo.
8. Historia de atimia o deficiencia inmune severa en la infancia (87).
La frecuencia de este trastorno cromosómico en la población general es del 2% (87); pero aumenta en niños con esquizofrenia en un 6%, según Usiskin y cols. (86); entre tanto, en adultos que presenten dos o tres de los criterios citados por Bassett y cols. (87) presenta un riesgo incrementado de portar la microeliminación 22q11 hasta en un 32%.
El síndrome de eliminación 22qDS tiende a ser ampliamente subdiagnosticado, debido a la variabilidad que se presenta en su fenotipo y a su conocimiento limitado. Ante ello, el estudio citogenético molecular de la microeliminación 22q11 en pacientes con esquizofrenia surge como una necesidad dentro del diagnóstico clínico de este síndrome.
Cromosoma X
Se ha demostrado que hay una proporción significativa donde se asocia la esquizofrenia con aneuploidías del cromosoma X, y en casos más raros con autosomas (19,66,89). Así, por ejemplo, Woodhouse y cols. (12) encontraron un caso de esquizofrenia y un caso de trastorno esquizoafectivo con cariotipo 47,XXX.
Luego, DeLisi y cols. (66) examinaron pacientes esquizofrénicos y revisaron múltiples estudios, de lo cual encontraron que 4 de 77 mujeres con esquizofrenia presentaban el mosaicismo 45,X/46,XX y en una menor incidencia los cariotipos 47,XXX y 47,XXY. De igual forma, Kunugi y cols. (4), Kawanishi y cols. (67) y Prior y cols. (68) encontraron pacientes con el mismo cariotipo en mosaico 45,X/46,XX. En la revisión de literatura de estos últimos autores se sugieren también 11 casos de mosaicismo X/XX en 6.482 mujeres con esquizofrenia. Kaplan y Cotton (90), igualmente, notaron que los mosaicismos del cromosoma X eran incrementados en las mujeres con esquizofrenia.
Cromosoma Y
Las anormalidades en el cromosoma Y se han reportado en los estudios de Rajagopalan y cols. (13), Mors y cols. (11) con el cariotipo 47,XYY. Finalmente, Nanko y cols. (91) encontraron un cariotipo que involucraba una inserción de material del cromosoma Y dentro del cromosoma X en el cariotipo 46,X, t(X;Y)(p22.33;p11.2) en un paciente con esquizofrenia. Aún así, no hay reportes suficientes para indicar si la esquizofrenia y los trastornos relacionados se incrementan en pacientes con este tipo de anormalidades (92).
Conclusiones
La revisión de las diferentes anormalidades cromosómicas reportadas en 68 publicaciones mundiales de los últimos 54 años, no solamente permitió lograr un acercamiento hacia la estimación de la frecuencia de estos hallazgos en pacientes afectados con esquizofrenia, la cual en promedio se acerca al 11%, sino tener un referente del tipo y frecuencia de estas alteraciones en los planos numérico, estructural y mosaicismo, para la evaluación del factor genético de este trastorno, mediante futuros estudios de ligamiento genético, de convergencia genómica o de asociación, encaminados a comprender el origen de la esquizofrenia.
Se espera que con esta publicación la integración dinámica de la genética médica en la práctica psiquiátrica, al igual que los análisis citogenéticos, sean contemplados dentro del estudio de pacientes con esquizofrenia en quienes se sospeche un posible factor genético y que contribuyan a orientar la asesoría genética a la hora de establecer los riesgos de recurrencia, riesgos de padecer la enfermedad cuando se tiene un pariente afectado y toma de decisiones informadas.
Referencias
1. DeLisi LE, Reiss AL, White BJ, Gershon ES. Cytogenetic studies of males with schizophrenia screening for the fragile X chromosome and other chromosomal abnormalities. Schizophr Res. 1988;1(4):277-81. [ Links ]
2. Nanko S, Kunugi H, Sasaki T, Fukuda R, Kawate T, Kazamatsuri H. Pericentric region for linkage study of schizophrenia. Biol Psychiatry. 1993;33 (8-9):655-8. [ Links ]
3. Kumra S, Wiggs E, Krasnewich D, Meck J, Smith AC, Bedwell J, et al.Association of sex chromosome anomalies with childhood-onset psychotic disorders. J Am Acad Child Adolesc Psychiatry. 1998;37(3):292-6. [ Links ]
4. Kunugi H, Lee KB, Nanko S. Cytogenetic findings in 250 schizophrenics: evidence confirming an excess of the X chromosome aneuploidies and pericentric inversion of chromosome 9. Schizophr Res. 1999;40(1):43-7. [ Links ]
5. Nicolson R, Giedd JN, Lenane M, Hamburger S, Singaracharlu S, Bedwell J, et al. Clinical and neurobiological correlates of cytogenetic abnormalities in childhood-onset schizophrenia. Am J Psychiatry. 1999;156(10):1575-9. [ Links ]
6. Toyota T, Shimizu H, Yamada K, Yoshitsugu K, Meerabux J, Hattori E, et al. Karyotype analysis of 161 unrelated schizophrenics: no increased rates of X chromosome mosaicism or inv(9), using ethnically matched and agestratified controls. Schizophr Res. 2001;52(3):171-9. [ Links ]
7. Demirhan O, Tastemir D. Chromosome aberrations in schizophrenia population. Schizophr Res. 2003;65(1):1-7. [ Links ]
8. Neville J. Paranoid schizophrenia in a mongoloid defective: some theoretical considerations derived from an unusual case. J Ment Sci. 1959;105(43 9):444 -7. [ Links ]
9. Cook EH Jr, Leventhal BL. Down's syndrome and mania. Br J Psychiatry. 1987;150:249-50. [ Links ]
10. Malaspina D, Warburton D, Amador X, Harris M, Kaufmann CA. Association of schizophrenia and partial trisomy of chromosome 5p. A case report. Schizophr Res. 1992;7(2):191-6. [ Links ]
11. Mors O, Mortensen PB, Ewald H. No evidence of increased risk for schizophrenia or bipolar affective disorder in persons with aneuploidies of the sex chromosomes. Psychol Med. 2001;31(3):425-30. [ Links ]
12. Woodhouse WJ, Holland AJ, McLean G, Reveley AM. The association between triple X and psychosis. Br J Psychiatry. 1992;160:554-7. [ Links ]
13. Rajagopalan M, MacBeth R, Varma SL. XYY chromosome anomaly and schizophrenia. Am J Med Genet. 1998;81(1):64-5. [ Links ]
14. Klar AJ. The chromosome 1;11 translocation provides the best evidence supporting genetic etiology for schizophrenia and bipolar affective disorders. Genetics. 2002;160(4):1745-7. [ Links ]
15. Evans KL, Muir WJ, Blackwood DH, Porteous DJ. Nuts and bolts of psychiatric genetics: building on the Human Genome Project. Trends Genet. 2001;17(1):35-40. [ Links ]
16. Blackwood DH, Fordyce A, Walker MT, St.Clair DM, Porteous DJ, Muir WJ. Schizophrenia and affective disorderscosegregation with a translocation at chromosome 1q42 that directly disrupts brain-expressed genes: clinical and P300 findings in a family. Am J Hum Genet. 2001;69(2):428-33. [ Links ]
17. Millar JK, Christie S, Porteous DJ. Yeast two-hybrid screens implicate DISC1 in brain development and function. Biochem Biophys Res Commun. 2003;311(4):1019-25. [ Links ]
18. St. Clair D, Blackwood D, Muir W, Carothers A, Walker M, Spowart G, et al. Association within a family of a balanced autosomal translocation with major mental illness. Lancet. 1990;336(8706):13-6. [ Links ]
19. Bassett AS, Chow EW, Weksberg R. Chromosomal abnormalities and schizophrenia. Am J Med Genet. 2000;97(1):45-51. [ Links ]
20. Cordeiro Q, Zung S, Campanha EV, Vallada H. Chromosomal translocation t(1;4) (p21;p14 ) indicating possible susceptibility loci for schizophreniform disorder and mental retardation. J Neuropsychiatry Clin Neurosci. 2007;19(3):339. [ Links ]
21. Bassett AS, McGillivray BC, Jones BD, Pantzar JT. Partial trisomy chromosome 5 cosegregating with schizophrenia. Lancet. 1988:1(8589):799-801. [ Links ]
22. Gordon CT, Krasnewich D, White B, Lenane M, Rapoport JL. Brief report: translocation involving chromosomes 1 and 7 in a boy with childhood-onset schizophrenia. J Autism Dev Disord. 1994;24(4):537-45. [ Links ]
23. Impagnatiello F, Guidotti AR, Pesold C, Dwivedi Y, Caruncho H, Pisu MG, et al. A decrease of reelin expression as a putative vulnerability factor in schizophrenia. Proc Natl Acad Sci U S A. 1998;95(26):15718-23. [ Links ]
24. Krag-Olsen B, Brask BH, Jacobsen P. Is there an increased risk of psychoses in patients with ring 18 and deletion long arm 18? En: Schmid W, Nielsen J (editors). Human Behavior Genetics. Amsterdam: Elsevier/North Holland; 1981. p. 211-20. [ Links ]
25. Doody GA, Johnstone EC, Sanderson TL, Owens, Muir WJ. "Pfropfschizophrenie" revisited: schizophrenia in people with mild learning disability. Br J Psychiatry. 1998;173:145-53. [ Links ]
26. Genest P, Dumas L, Genest FB. Ch r omo s oma l t r a n s l o c a t i o n t(2;18)(q21;q23) in a schizophrenic individual and his daughter. Union Med Can. 1976;105(11):1676-81. [ Links ]
27. Maziade M, Debraekeleer M, Genest P, Cliche D, Fournier JP, Garneau Y, et al. A balanced 2:18 translocation and familial schizophrenia: falling short of an association. Arch Gen Psychiatry. 1993;50(1):73-5. [ Links ]
28. Axelsson R, Wahistrom J. Chromosome aberrations in patients with paranoid psychosis. Hereditas. 1984;100(1):29- 31. [ Links ]
29. Holland T, Gosden C. A balanced chromosomal translocation partially cosegregating with psychotic illness in a family. Psychiatry Res. 1990:32(1);1-8. [ Links ]
30. Baysal BE, Potkin SG, Farr JE, Higgins MJ, Korcz J, Gollin SM, et al. Bipolar affective disorder partially cosegregates with a balanced t(9;11 )(p24;q23.1) chromosomal translocation in a small pedigree. Am J Med Genet. 1998;81(1):81-91. [ Links ]
31. Price WH, Brunton M, Buckton K, Jacobs PA. Chromosome survey of new patients admitted to the four maximum security hospitals in the United Kingdom. Clin Genet. 1976;9(4):389-98. [ Links ]
32. Smith M, Wasmuth JJ, McPherson JD. Cosegregation of an 11 q22.3-9p22 translocation with affective disorder: proximity of the dopamine D2 receptor gene relative to the translocation breakpoint. Am J Hum Genet. 1989;45: A178. [ Links ]
33. Escobar JI. A cytogenetic study of children with psychiatric disorders. Compr Psychiatry. 1976;17(2):309-13. [ Links ]
34 . MacIntyre DJ, Blackwood DH, Porteous DJ, Pickard BS, Muir WJ. Chromosomal abnormalities and mental illness. Mol Psychiatry. 2003;8(3):275-87. [ Links ]
35. Calzolari E, Aiello V, Palazzi P, Sensi A, Calzolari S, Orrico D, et al. Psychiatric disorder in a familial 15;18 translocation and sublocalization of myelin basic protein to 18q22.3. Am J Med Genet. 1996;67(2):154-61. [ Links ]
36. Hoshi S. Acute promyelocytic leukemia with t(11 ;17)(q23;q21). Rinsho Ketsueki 1999;40(2):11 9-23. [ Links ]
37. Smith AB, Peterson P, Wieland J, Moriarty T, DeLisi LE. Chromosome 18 translocation (18;21) (p11 .1;p11 .1) asociated with psychosis in one family. Am J Med Genet. 1996;67(6):560-3. [ Links ]
38. Glass IA, Stormer P, Oei PT, Hacking E, Cotter PD. Trisomy 2q11 .2-q21.1 resulting from an unbalanced insertion in two generations. J Med Genet. 1998;35(4):319-22. [ Links ]
39. Romain DR, Chapman CJ, Columbano- Green L, Smithe RH, Gebbie O. Two pericentric inversions, inv(2) (p11q13) and inv(5)(p13q13), in a patient referred for psychiatric problems. J Med Genet. 1982;19(2):153-5. [ Links ]
40. Palmour RM, Miller S, Fielding A, Vekemans M, Ervin FR. A contribution to the differential diagnosis of the "Group of Schizophrenias": Structural abnormality of chromosome 4. J Psychiatry Neurosci. 1994;19(4):270-7. [ Links ]
41. Miyaoka T, Seno H, Itoga M, Ishino H. A case of small cerebral cyst and pericentric inversion of chromosome 9 that developed schizophrenia-like psychosis. Psychiatry Clin Neurosci. 1999;53(5):599-602. [ Links ]
42. Gardner RJM, Sutherland GR. Chromosome abnormalities and genetic counseling. New York: Oxford University Press; 1989. p. 175-83. [ Links ]
43. Uechara S, Akai Y, Takeyama Y, Takabayashi T, Okamura K, Yajima A. Pericentric inversión of chromosome 9 in prenatal diagnosis and infertility. Tohoku J Exp Med. 1992;166(4):417- 27. [ Links ]
44. Thompson MW, McInnes RR, Willard HF. Genetics in medicine. Philadelphia: Thompson & Thompson, 1991. [ Links ]
45. Jean-Pierre F, Buggenhout GV. Structural chromosome rearrangements in couples with recurrent fetal wastage. Eur J Obstet Gynecol Reprod Biol. 1998;81(2):171-6. [ Links ]
46. Roberts SH, Cowie VA, Singh KR. Intrachromosomal insertion of chromosome 13 in a family with psychosis and mental subnormality. J Ment Defic Res. 1986;30(Pt3):227-32. [ Links ]
47. Bennett RL, Karayiorgou M, Sobin CA, Norwood TH, Kay MA. Identification of an interstitial deletion in an adult female with schizophrenia, mental retardation, and dysmorphic features: further support for a putative schizophrenia susceptibility locus at 5q21-23.1. Am J Hum Genet. 1997;61(6):1450-4. [ Links ]
48. Davies AF, Mirza G, Sekhon G, Turnpenny P, Leroy F, Speleman F, et al. Delineation of two distinct 6p deletion syndromes. Hum Genet. 1996;104:64- 72. [ Links ]
49. Caluseriu O, Mirza G, Ragoussis J, Chow EWC, MacCrimmon D, Bassett AS. Schizophrenia in an adult with 6p25 deletion syndrome. Am J Med Genet A. 2006;140(11)1208-13. [ Links ]
50. Park JP, Moeschler JB, Berg SZ, Wurster- Hill DH. Schizophrenia and mental retardation in an adult male with a the novo intersticial deletion 9 (q32q34 .1). J Med Genet. 1991;28(4):282-3. [ Links ]
51. Mors O, Ewald H, Blackwood D, Muir W. Cytogenetic abnormalities on chromosome 18 associated with bipolar affective disorder or schizophrenia. Br J Psychiatry. 1997;170:278-80. [ Links ]
52. Stine OC, Xu J, Koskela R, McMahon FJ, Gschwend M, Friddle C, et al. Evidence for linkage of bipolar disorder to chromosome 18 with a parent- of-origin effect. Am J Hum Genet. 1995;57(6):1384-94. [ Links ]
53. De bruyn A, Souery D, Mendelbaum K, Mendlewicz J, Van Broeckhoven C. Linkage analysis of families with bipolar illness and chromosome 18 markers. Biol Psychiatry. 1996;39(8):679-88. [ Links ]
54. Coon H, Hoff M, Holik J, Hadley D, Fang N, Reimherr F, et al. Analysis of chromosome 18 DNA markers in multiplex pedigrees with manic depression. Biol Psychiatry 1996;39:689-96. [ Links ]
55. Freimer NB, Reus VI, Escamilla MA, McInnes LA, Spesny N, Leon P. Genetic mapping, using haplotype, association and linkage methods, suggests a locus for severe bipolar disorder (BPI) at 18q2- 23. Nat Genet. 1996;12(4):43 6-41 . [ Links ]
56. El-Badramany MH, Farag TI, al-Awadi SA, Hammad IM, Abdelkader A, Murthy DS. Familial manic-depressive illness with deleted short arm of chromosome 21: coincidental or causal? Br J Psychiatry. 1989;155:856-7. [ Links ]
57. Pinquier C, Heron D, de Carvalho W, Lazar G, Mazet P, Cohen D. Microdeletion 22q11: apropos of case of schizophrenia in an adolescent. Encephale. 2001;27(1):45-50. [ Links ]
58. Bassett AS, Chow EW, AbdelMalik P, Gheorghiu M, Husted J, Weksberg R. The schizophrenia phenotype in 22q11 deletion syndrome. Am J Psychiatry. 2003;160(9):1580-6. [ Links ]
59. Murphy KC, Own MJ. The behavioural phenotype in velo-cardio-facial-syndrome. Am J Hum Genet. 1997:61:A5. [ Links ]
60. Pulver AE, Lasseter VK, Kasch L, Wolyniec P, Nestadt G, Blouin JL, et al. Schizophrenia: A genome scan targets chromosomes 3p and 8p as potential sites of susceptibility genes. Am J Med Genet. 1995;60(3):252-60. [ Links ]
61. Bassett AS, Chow WC. 22q11 deletion syndrome: a genetic subtype of schizophrenia. Biol Psychiatry. 1999;46(1):882-91. [ Links ]
62. Papolos DF, Faedda GL, Veit S, Goldberg R, Morrow B, Kucherlapati R, et al. Bipolar spectrum disorders in patients diagnosed with velo-cardio-facial syndrome: does a hemizygous deletion of chromosome 22q11 result in bipolar affective disorder? Am J Psychiatry. 1996;153(12):1541-7. [ Links ]
63. Murphy KC, Jones LA, Owen MJ. High rates of schizophrenia in adults with velo-cardio-facial syndrome. Arch Gen Psychiatry. 1999;56(10):940-5. [ Links ]
64. Shprintzen RJ, Goldberg R, Golding- Kushner KJ, Marion RW. Late-onset psychosis in the velo-cardio-facial syndrome. Am J Med Genet. 1992;42(1):141 -2. [ Links ]
65. Christensen KR, Friedrich U, Jacobsen P, Jensen K, Nielsen J, Tsuboi T. Ring chromosome 18 in mother and daughter. J Ment Defic Res. 1970;14 (1):49- 67. [ Links ]
66. DeLisi LE, Friedrich U, Wahlstrom J, BoccioSmith A, Forsman A, Eklund K, et al. Schizophrenia and sex chromosome anomalies. Schizophr Bull. 1994;20(3):495-505. [ Links ]
67. Kawanishi C, Kono M, Onishi H, Ishii N, Ishii K. A Case of Turner syndrome with schizophrenia: genetic relationship between Turner syndrome and psychosis. Psychiatry Clin Neurosci. 1997;51(2):83-5. [ Links ]
68. Prior TI, Chue PS, Tibbo P. Investigation of Turner syndrome in schizophrenia. Am J Med Genet. 2000;96(3):373-8. [ Links ]
69. Morel F, Gallon F, Amice V, Le Bris MJ, Le Martelot MT, Roche S, et al. Sex chromosome mosaicism in couples undergoing intracytoplasmic sperm injection. Hum Reprod. 2002;17(10):2552-5. [ Links ]
70. Shaffer LG, Tommerup N. International System for Human Cytogenetics Nomenclature ISCN. Suiza: Karger; 2005. [ Links ]
71. Garver DL, Barnes R, Holcomb J, Filbey F, Wilson R, Bowcock A. Genome- wide scan and schizophrenia in African-Americans. Am J Hum Genet. 1998;81:454-5. [ Links ]
72. Shaw SH, Kelly M, Smith AB, Shields G, Hopkins PJ, Loftus J, et al. A genome- wide search for schizophrenia susceptibility genes. Am J Med Genet. 1998;81(5):364-76. [ Links ]
73. Hovatta I, Varilo T, Suvisaari J, Terwilliger JD, Ollikainen V, Arajärvi R, et al. A genomewide screen for schizophrenia genes in an isolated Finnish subpopulation, suggesting multiple susceptibility loci. Am J Hum Genet. 1999;65(4):1114-24. [ Links ]
74. Blouin JL, Dombroski BA, Nath SK, Lasseter VK, Wolyniec PS, Nestadt G, et al. Schizophrenia susceptibility loci on chromosomes 13 q32 and 8p21. Nat Genet. 1998;20(1):70-3. [ Links ]
75. Brzustowicz M, Hodgkinson A, Chow CW, Hone G, Basset AS. Location of a major susceptibility locus for familial schizophrenia on chromosome 1q21- q22. Science. 2000;288(5466):678-82. [ Links ]
76. Ekelund J, Lichtermann D, Hovatta I, Ellonen P, Suvisaari J, Terwilliger JD, et al. Genome-wide scan for schizophrenia in the Finnish population: evidence for a locus on chromosome 7q22. Hum Mol Genet. 2000;9(7):1049-57. [ Links ]
77. Bogani D, Willoughby C, Davies J, Kaur K, Mirza G, Paudyao A, et al. Dissecting the genetic complexity of human 6p deletion syndromes by using a region-specific, phenotype-driven mouse screen. Proc Natl Acad Sci USA. 2005;102(35):12477-82. [ Links ]
78. Faraone SV, Matise T, Svrakic D, Pepple J, Malaspina D, Suarez B, et al. Genome scan of European-American schizophrenia pedigrees: results of the NIMH Genetics Initiative and Millennium Consortium. Am J Med Genet. 1998;81(4):290-5. [ Links ]
79. Liu Y-C, Lee M-L, Chen C-P, Lee C-C, Lin S-J, Chao M-C, et al. Inversion and enlargement of the heterochromatin region of chromosome no. 9 among Taiwanese. Tzu Chin Med J. 1997;9(3):159-67. [ Links ]
80. Serra A, Brahe C, Millington-Ward A, Neri G, Tedeschi B, Tassane F, et al. Pericentric inversion of chromosome 9: prevalence in 300 Down syndrome families and molecular studies of nondisjunction. Am J Med Genet. 1990;7:162-8. [ Links ]
81. Yamada K. Population studies of INV(9) chromosomes in 4,300 Japanese: incidence, sex difference and clinical significance. Jpn J Hum Genet. 1992;37(4):293-301. [ Links ]
82. Ko TM, Hsieh FJ, Chang LS, Pan MF, Lee TY. Pericentric inversions of chromosome 9 in Taiwanese fetuses. J Formos Med Assoc. 1992;91(4):473-4. [ Links ]
83. Levinson DF, Mahtani MM, Nancarrow DJ, Brown DM, Kruglyak L, Kirby A, et al. Genome scan of schizophrenia. Am J Psychiatry. 1998;155(6):741 -50. [ Links ]
84. Blackwood D, Fordyce A, Walker M, St Clair D, Porteous D, Muir W. Thirty year follow up of a family showing association of schizophrenia with a balanced translocation t(1:11 )(q42.1, q14 .3). Am J Med Genet. 1998;81:532-33. [ Links ]
85. Millar JK, Wilson-Annan JC, Anderson S, Christie S, Taylor MS, Semple CA, et al. Disruption of two novel genes by a translocation co-segregating with schizophrenia. Hum Mol Genet. 2000; 9(9):1415-23. [ Links ]
86. Usiskin SI, Nicolson R, Krasnewich DM, Yan W, Lenane M, Wudarsky M, et al. Velocardiofacial syndrome in childhood-onset schizophrenia. Am Acad Child Adolesc Psychiatry. 1999;38(12):1536-43. [ Links ]
87. Karayiorgou M, Morris MA, Morrow B, Shprintzen RJ, Goldberg R, Borrow J, et al. Schizophrenia susceptibility associated with interstitial deletions of chromosome 22q11. Proc Natl Acad Sci USA. 1995;92(17):7612-6. [ Links ]
88. Liu H, Abecasis GR, Heath SC, Knowles A, Demars S, Chen Y-J, et al. Genetic variation in the 22q11 locus and susceptibility to schizophrenia. Proc Nat Acad Sci USA. 2002;99(6):3717-22. [ Links ]
89. Iurov IY, Vorsanova SG, Yurov YB. Chromosomal variation in mammalian neuronal cells: known facts and attractive hypotheses. Int Rev Cytol. 2006;249:143-91. [ Links ]
90. Kaplan AR, Cotton JE. Chromosomal abnormalities in female schizophrenics. J Nerv Ment Dis. 1986;14 7(4):402-17. [ Links ]
91. Nanko S. Schizophrenia-like psychosis in a 46,XX male. Folia Psychiatrry Neurol Jpn. 1981;35(4):461-3. [ Links ]
92. Yurov YB, Iourov IY, Vorsanova SG, Demidova IA, Kravetz VS, Beresheva AK, et al. The schizophrenia brain exhibits low-level aneuploidy involving chromosome 1. Schizophr Res. 2008;98(1-3):139-47. [ Links ]
Conflicto de interés: los autores manifestamos que no tenemos ningún conflicto de interés en este artículo.














