Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.41 no.1 Bogotá Jan./Apr. 2012
Polimorfismos en el gen del transportador de serotonina (SLC6A4) y el trastorno afectivo bipolar en dos centros regionales de salud mental del Eje Cafetero*
Polymorphism in the Serotonin Transporter Gene (SLC6A4) and Emotional Bipolar Disorder in Two Regional Mental Health Centers from the Eje Cafetero (Colombia)
Duverney Gaviria Arias1
Liliana Salazar Salazar2
Juan Pablo Vélez3
Stella Lozano Pardo4
*Este proyecto fue financiado por la Red de Universidades Públicas del Eje Cafetero 'Alma Mater'. Resultados parciales de esta investigación fueron presentados en el XLV Congreso Nacional de Ciencias Biológicas realizado en Armenia, Quindío, entre el 5 y el 8 de octubre. Ponente: Stella Lozano Pardo.
1Magíster en Biología Molecular y Biotecnología, Centro de Biología Molecular y Biotecnología de la Universidad Tecnológica de Pereira, vereda La Julita, Pereira, Risaralda, Colombia.
2Psiquiatra, directora científica del Instituto Especializado en Salud Mental, Clínica El Prado, Armenia, Quindío, Colombia.
3Médico, subdirector científico del Hospital Mental de Risaralda (HOMERIS), Pereira, Risaralda, Colombia.
4Psicóloga, estudiante de Maestría en Biología Molecular y Biotecnología de la Universidad Tecnológica de Pereira, vereda La Julita, Pereira, Risaralda, Colombia.
Conflictos de interés: Los autores manifiestan que no tienen conflictos de interés en este artículo.
Correspondencia
Lucero Rengifo Ramos
Centro de Biología Molecular y Biotecnología
Universidad Tecnológica de Pereira
Vereda La Julita
Pereira, Risaralda, Colombia
cenbiotep@utp.edu.co
Recibido para evaluación: 13 de septiembre de 2011 Aceptado para publicación: 25 de enero de 2012
Resumen
Introducción: Los polimorfismos indel en la región promotora y los polimorfismos de tamaño en el intrón 2 del gen transportador de serotonina se han asociado con el trastorno afectivo bipolar 1 (TAB 1) en diferentes poblaciones. El objetivo fue analizar las frecuencias genotípicas y alélicas en ambas regiones del gen en un estudio de casos y controles en Risaralda y Quindío (Colombia) para encontrar una asociación con TAB 1 y compararlas con estudios similares. Métodos: Se analizaron 133 pacientes y 120 controles. Con PCR se analizaron los polimorfismos indel L y S de la región promotora y los de tamaño (VNTR) STin 2.10 y STin 2.12 del segundo intrón del gen SLC6A4. Resultados: Las frecuencias genotípicas y alélicas en los polimorfismos S y L fueron muy similares en casos y controles. Sin embargo, el genotipo LL se encontró incrementado no significativamente en la población general con TAB 1 (OR=1,89; IC95%= 1,1-3,68) y al separarla por género. Los OR para este genotipo en la población general (OR=1,89; IC95%=1,1-3,68) en mujeres (OR=2,22; IC95%=1,04-5,66) y en hombres (OR=1,62; IC95%=0,71-4,39). En los polimorfismos VNTR STin 2.10 y STin2.212 tampoco se observaron diferencias significativas entre las frecuencias genotípicas y alélicas. Conclusiones: No encontramos asociación entre los polimorfismos de las regiones 5-HTTLPR y el intrón 2 del gen transportador de serotonina en los pacientes con TAB 1, ni en la población total, ni al separarla por género. Nuestros resultados son similares a los encontrados en poblaciones caucásicas y difieren de los encontrados en asiáticas y brasileras.
Palabras clave: Transportador de serotonina, promotor, segundo intron, frecuencias genotipicas, frecuencias alélicas.
Abstract
Introduction: The indel polymorphisms in the promoting region and the 2nd intron polymorphisms in the serotonin transporter gene (SLC6A4) have been associated to bipolar disorder 1 (BD1) in several population studies. The objective was to analyze the genotypic and allelic frequencies in both gene regions in a study of cases and controls with individuals from Risaralda and Quindío (Colombia) so as to establish possible associations to BD1, and compare results with previous and similar studies. Methods: 133 patients and 120 controls were studied. L and S indel polymorphisms in the promoting region were analyzed by PCR, together with VNTR STin2.10 and STin 2.12 VNTRs polymorphisms in the 2nd intron of the SL-C6A4 gene Results: Genotypic and allelic frequencies for the S and L polymorphisms were similar both in cases and controls. However, the LL genotype was significantly increased both in BD1 population (OR=1.89; CI95%=1.1-3.68), and when discriminated by gender. This particular genotype in general population is OR=2.22; IC95%=1.04-5.66 for women, and OR=1.62; IC 95%=0.71-4.39 for men. No significant genotypic and allelic differences were found for VNTR STin2.10 and STin 2.12. polymorphisms. Conclusions: No association was found between polymorphisms of 5-HTTLPR polymorphisms and the 2nd intron of the serotonin transporting gene in general patients with BD1, nor when compared by gender. Our results are similar to those reported for Caucasian populations and differ from those of Asian and Brazilian populations.
Key words: Serotonin transporter, promoter, 2nd intron, genotype frequency, allelic frequency.
Introducción
El trastorno afectivo bipolar (TAB) es una enfermedad psiquiátrica del grupo de los trastornos del estado del ánimo, los cuales se definen según la fluctuación del afecto, en un espectro que va de la depresión a la manía y a veces acompañados de síntomas psicóticos y alteraciones cognitivas. De acuerdo con el sistema de clasificación DSM- IV-TR (Diagnostic and Statistical Manual of Mental Disorders), los trastornos bipolares se clasifican en TAB I, TAB II y trastorno ciclotímico (1). Es una enfermedad altamente incapacitante y de morbilidad elevada.
El riesgo aproximado de presentar TAB I en la población general es del 1%-2%; en parientes de primer grado, 9%, y en gemelos monocigóticos, de 40%-45% (2). Hombres y mujeres tienen el mismo riesgo; la edad promedio de manifestación es de 18 años (3), y el riesgo latente de suicidio a través de la vida es del 20% (4). En el Estudio Nacional de Salud Mental de Colombia, en el 2003 (5), el 15% de la población ha tenido algún trastorno del ánimo, y en el informe de trastornos mentales en América Latina y el Caribe se estableció que 4,7 millones de personas mayores de 15 años provenientes de estas regiones tienen TAB, y la tasa de prevalencia para Colombia es de 2% (6).
Estudios epidemiológicos, genéticos y moleculares se han realizado en busca de las características genéticas, moleculares y patrones de heredabilidad del TAB, con el fin de establecer las bases moleculares de la enfermedad y orientar el diagnóstico, manejo y pronóstico. Diversos loci y marcadores se han establecido, en ocasiones con resultados controversiales, según los grupos poblacionales y el diseño de los estudios. Por otra parte, es una enfermedad multifactorial, con una heredabilidad del 79%-93% (7), que plantea la interacción de las características genéticas con factores ambientales en su expresión, curso y respuesta al tratamiento. La asociación de diversos genes y regiones genómicas de susceptibilidad para el TAB sustentan la importancia de estos estudios (8).
Los genes candidatos que han generado interés son: el activador de la D-aminoácido oxidasa (DAOA a.k.a G72), el receptor δ de los activadores proliferativos de los peroxisomas (PPARD), monoaminoxidasa A (MAO), catecol-o-metil transferasa (COMT) tirosina hidroxilasa, el transportador del glutamato neuronal (SLC1A1), el transportador de dopamina (SLC6A3), el factor neurotrófico derivado de cerebro (BDNF), la subunidad 2B del NMDA receptor de glutamato (GRIN2B) y el transportador del neurotransmisor serotonina (SLC6A4), conocido también como 5-HTT (5-hydroxytryptamine transporter), entre otros (7). No obstante, los resultados de los análisis realizados en estos genes han mostrado tanto resultados positivos como negativos, en parte por efecto de tamaño muestral o diferencias geográficas en las distribuciones (9). Metaanálisis de estudios de ligamiento en rastreos amplios del genoma han encontrados varias regiones cromosómicas, entre ellas 1q, 3q, 6q, 7p y 15q, que pueden conferir susceptibilidad al trastorno bipolar (7-10).
El gen SLC6A4 ha sido clonado y mapeado en una región que abarca 37.8 kb en el cromosoma 17q11.1-q12 (11). Está compuesto por 14 exones que codifican una proteína de 630 aa.; otros autores reportan 15 exones, incluyendo un exón no codificante 1A y 2B. Este último fue encontrado aproximadamente 14 kb corriente abajo del exon 1 y 737 corriente arriba del exon 2, y no está presente en todos los mRNA. El gen utiliza promotores alternos con corte y empalme diferencial en los exones 1A, B y C en tejidos específicos; también, tiene sitios alternos de poliadenilación que generan múltiples especies de mRNA, que participan en la regulación de la expresión de la proteína en humanos (12).
La asociación de regiones polimórficas en este gen con la susceptibilidad por desarrollar trastornos del afecto se ha analizado en diferentes estudios poblacionales. Varios de estos estudios se han centrado en los polimorfismos indel de 43 pb en la región 5' del promotor del gen (5-HTTLPR) (13-19). Aunque se han reportado más de diez alelos en poblaciones caucásicas y japonesas (19), los más comunes son el largo (L) de 16 repeticiones (528pb) y el corto (S) de 14 repeticiones (484pb), y están asociados con variaciones en la actividad transcripcional (20). El alelo L tiene aproximadamente tres veces la actividad basal del alelo S (21), aunque se han reportado excepciones (22,23). El alelo S es dominante sobre el L (13), aunque se ha reportado el L dominante sobre el S (24). El alelo S se asocia con una reducción en la actividad del receptor 5-HT1A. La baja eficiencia transcripcional asociada con el alelo corto lleva a disminución de la función de 5-HTT (25) y al comportamiento suicida en individuos con TAB I (26). Polimorfismos en la región 5' del promotor afecta la función serotoninérgica. Individuos con el genotipo L/L tienen una retoma de serotina significativamente más elevada en plaquetas, comparados con individuos con los genotipos L/S o S/S (27).
Otras regiones polimórficas que se han estudiado son los polimorfismos de repeticiones en tándem de número variable (VNTR, por sus siglas en inglés variable number tandem repetition) en los intrones 2 y 7. Variaciones en el segundo intrón de este gen denominado STin 2 contiene un número variable de repeticiones en tándem de 17 pb., lo cual genera tres alelos de VNTR: STin2.9, STin2.10 y STin 2.12 (28). STin2.10 y STin 2.12 se han asociado con alteraciones neurológicas, incluyendo los trastornos del afecto. Las implicaciones de estos polimorfismos no son hasta ahora bien entendidos; sin embargo, se ha demostrado previamente que actúan como elementos de regulación transcripcional de SLC6A4 en cerebro embriónico de ratón, y STin2.12 se asocia con niveles altos transcripcionales y con el inicio tardío del TAB I (29).
Existe relación genética entre el trastorno bipolar y la esquizofrenia. Estudios de cosegregación familiar evidencian esta relación (30). Por estudios de ligamiento moleculares se han identificado varios loci de susceptibilidad que son comunes para ambas enfermedades. Es probable que múltiples genes interactúen para incrementar la susceptibilidad en ambas enfermedades (31).
En este estudio se estimaron las frecuencias genotípicas y alélicas de los polimorfismos en las regiones 5-HTTLPR y segundo intrón del gen SLC6A4, en una población de dos centros de referencia de salud mental de Risaralda y Quindío, y en una población control, con originarios de la misma región. Los resultados se compararon con estudios similares realizados en otros grupos étnicos.
Materiales y métodos
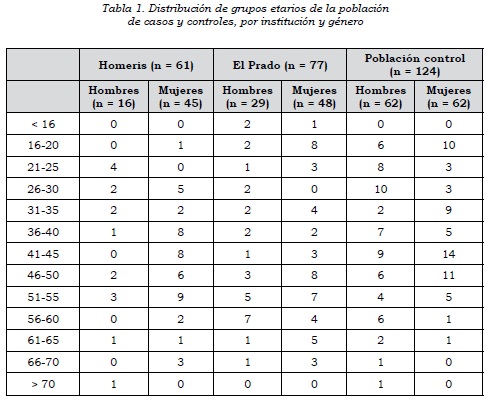
Se evaluaron inicialmente 138 pacientes con trastorno afectivo bipolar I (TAB-I) (45 hombres y 93 mujeres) de dos instituciones de salud mental localizadas en Pereira (Hospital Mental de Risaralda 'HOMERIS') y Armenia (Clínica Especializada en Salud Mental 'El Prado'), entre 12 y 77 años de edad. En todos los casos, el diagnóstico de TAB-I fue realizado por médicos, quienes utilizaron la entrevista diagnóstica para estudios genéticos (DIGS ver 3.0) como herramienta. Los controles fueron 124 (62 hombres y 62 mujeres) individuos apareados por edad y género, y de origen geográfico similar a los pacientes (tabla 1). Tanto los casos como los controles solo pudieron ser ingresados al proyecto previa firma de un consentimiento informado evaluado y avalado por el comité de bioética de la Universidad Tecnológica de Pereira.
Del total de individuos evaluados, se les realizaron los estudios moleculares a 133 casos y 120 controles; 5 pacientes y 4 controles no accedieron a la toma de muestra. A los individuos seleccionados se les realizó la extracción de ADN a partir de 5 ml de sangre anticoagulada con EDTA, utilizando un estuche comercial (GFX Genomic Blodd DNA purification kit-Amersham Biosciences). Por medio de amplificación por PCR se analizaron los polimorfismos indel en la región 5' del promotor, siguiendo los protocolos descritos en Ogilvie y colaboradores (32), y los polimorfismos de tamaño (VNTR) del intrón 2, de acuerdo con el método descrito por Heils y colaboradores (13), del gen (SLC6A4).
En un volumen final de 10 ul se hizo la amplificación del polimorfismo en el promotor usando 0,4 mM de los iniciadores (sentido: 5'-GGCGTTGCCGCTCTGAATGC-3', antisentido: 5'-GAGGGACTGAGCTG-GACAACCAC-3'), 2,5 mM de dNTPs, 200 ng de ADN, 0,5 U de la enzima polimerasa Go Taq (Promega) y 4 μl del buffer de la enzima. El programa de temperaturas consistió en un paso inicial de desnaturalización (94 °C) de dos minutos, y, posteriormente, 35 ciclos de temperaturas de 94 °C, 61 °C y 72 °C, durante un minuto cada temperatura, y un paso final a 72 °C durante siete minutos. El resultado final fue evaluado en geles de poliacrilamida al 12%, teñidos con bromuro de etidio. Fragmentos de dos tamaños diferentes, el alelo corto (S) con 484 pb y el alelo largo con 528 pb fueron observados.
El segundo intrón se evaluó por medio de una amplificación por PCR. En un volumen final de 10 μl, que contenía 0,4 mM de los iniciadores (sentido: 5'-GTCAGTATCACAGGCT-GCGAG-3', antisentido: 5'-TGTTCC-TAGTCTTACGCCAGT-3'), 2,5 mM de dNTPs, 200 ng de DNA, 0,5 U de la enzima polimerasa Go Taq (Promega) y 4 μl del buffer de la enzima. El programa de temperaturas consistió en un paso inicial de denaturación a 95 °C durante 3 minutos, seguido por 45 ciclos, que consistieron en 95 °C-30s, 53 °C-30s segundos y 72 °C-45s, con un paso final de extensión a 72 °C durante 5 minutos. La evaluación de los amplicones se llevó a cabo en geles de poliacrilamida al 12%, teñidos con bromuro de etidio. Los resultados observados correspondieron a fragmentos de 264 y 298 pb para 10 y 12 repeticiones, respectivamente.
Para los análisis estadísticos, los datos fueron evaluados con la ayuda del paquete estadístico SPSS versión 15. Se determinaron las frecuencias alélicas y genotípicas de los polimorfismos evaluados tanto en la población de casos como en los controles. Se realizaron análisis, con el fin de determinar que las frecuencias alélicas y genotípicas en ambas poblaciones se encontraran en equilibrio de Hardy Weinberg, utilizando pruebas de χ2 para bondad de ajuste. Mediante el uso de pruebas χ2 de Pearson para tablas de contingencia se realizaron comparaciones entre las poblaciones. Estos análisis se realizaron tanto en la población general como al separarla por género.
Finalmente, se evaluó el OR para el alelo y genotipo más frecuente en la población de individuos con TAB I.
Resultados
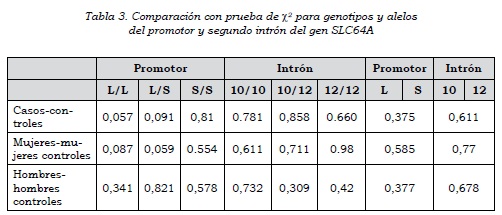
La caracterización poblacional de los 253 individuos evaluados se presenta en la tabla 1, donde se muestra el origen, el género y la edad. Se analizaron por conteo directo las frecuencias alélicas y genotípicas de los polimorfismos en el gen del transportador de serotonina (SLC6A4), correspondientes al promotor y al segundo intrón para las poblaciones de casos y controles (tabla 2). Los genotipos analizados tanto en la población de casos como de controles fueron preliminarmente evaluados, con el fin de determinar si las frecuencias genotípicas se encontraban en equilibrio de Hardy-Weinberg. Para los genotipos del promotor, los valores fueron (χ2 = 2,52; gl = 2; p > 0,05) para la población de casos con TAB I, y (χ2 = 2,29; gl = 2; p > 0,05) para la población de controles. En los genotipos del intrón 2 los valores identificados en la población de casos (χ2 = 1,71; gl = 2; p > 0,05), y en la población de controles (χ2 = 0,60; gl = 2; p > 0,05), significa que las frecuencias genotípicas tanto para el promotor como para el intrón 2 se encuentran en equilibrio H-W en ambas poblaciones.
En el promotor, el genotipo más frecuente en las poblaciones de casos y controles fue el heterocigótico (LS), con 44,4% y 55%, respectivamente. El genotipo LL se encuentra incrementado en la población de casos en relación con la población control (22,6% frente a 13,3%); sin embargo, esta diferencia no fue estadísticamente significativa. El genotipo SS presenta frecuencias muy similares en ambas poblaciones (tabla 2). Al comparar las frecuencias genotípicas en las poblaciones de casos y controles no se encontraron diferencias estadísticamente significativas para los polimorfismos en HTTRLP (tabla 3). Al separar por género la frecuencia del genotipo LL se encuentra incrementado en las mujeres afectadas en relación con las mujeres controles (22,7% frente a 11,6%), y prácticamente la misma frecuencia entre hombres y mujeres afectados.
Entre hombres y mujeres afectados, el genotipo LS está incrementado en hombres en relación con las mujeres (51,1% frente a 40,9%) y es menos frecuente en las mujeres afectadas que en las mujeres de la población control (40,9% frente a 56,7%). El genotipo SS se observa incrementado en mujeres en relación con los hombres afectados (36,3% frente a 26,6%) (tabla 2), y en relación con las mujeres de la población control (36,6% frente a 31,7%); sin embargo, no se encontraron diferencias estadísticamente significativas (tabla 3). Las frecuencias alélicas de L y S son muy similares en la población general, y al separar por género cuando se compara con la población control (tablas 2 y 3).
En el intrón 2 los genotipos 10/10, 10/12 y 12/12 presentan frecuencias muy similares, al igual que los alelos STin2.10 y STin 2.12 (tabla 2), y no se encontraron diferencias estadísticamente significativas (tabla 3). Al separar por género se observa un incremento en el genotipo 10/12 en hombres afectados, en relación con los controles (53,3% frente a 43,3%). En el resto son muy similares. Al comparar hombres con mujeres afectadas, el genotipo 10/12 se encuentra incrementado en hombres en relación con mujeres afectadas (53,3% frente a 38,6%), y el genotipo 12/12, más incrementado en mujeres que en hombres afectados (43,2 frente a 35,6). En los alelos STnt2.10 y STnt 2.12, las frecuencias son muy similares entre hombres y mujeres en casos comparados con hombres y mujeres controles, y entre hombres y mujeres afectados (tabla 2).
Basándonos en estos resultados, realizamos un análisis de OR (odds ratio), tanto para las frecuencias alélicas como genotípicas, en la región 5-HTTLPR y en el segundo intrón. Los análisis en el intrón no arrojaron resultados positivos; sin embargo, para 5-HTTLPR se identificaron valores de OR altos en la población general, mujeres y hombres para el genotipo LL. En la población general (OR = 1,89; IC 95% = 1,1-3,68), en mujeres (OR = 2,22; IC 95% = 1,04-5,66) y en hombres (OR = 1,62; IC 95% = 0,71-4,39).
Al combinar los dos polimorfismos, los haplotipos más frecuentes en casos fueron LS-10/12 y en controles, LS-12/12. No hubo diferencias al separar por género, y ningún haplotipo se encontró asociado con TAB I.
Discusión
Los polimorfismos del 5-HTTLPR y los VNTR del segundo intrón han sido analizados en diferentes poblaciones y grupos étnicos, utilizando estudios de metaanálisis (33). Collier y colaboradores (14) encontraron una asociación del alelo S con trastorno bipolar y unipolar en una población europea de 450 casos y 570 controles. Una relación similar fue encontrada en 74 pacientes españoles con desorden bipolar y 159 americanos con depresión mayor (15,34). En otro estudio relacionado, el genotipo SS fue significativamente más frecuente en individuos con trastorno bipolar que en depresión unipolar y en controles, aunque no se observaron diferencias significativas en las distribuciones alélicas, lo que sugiere un efecto recesivo de susceptibilidad para el desorden bipolar (35).
Ospina-Duque y colaboradores (17), en una población de Antioquia de 103 casos y 112 controles, no encontraron asociación entre los polimorfismos del 5-HTTLPR y TAB I. No obstante, observaron un exceso del alelo S en individuos jóvenes y en individuos con síntomas psicóticos. En nuestra población, el genotipo SS se encontró incrementado en mujeres afectadas, en relación con hombres afectados, aunque en los hombres y mujeres controles tienen frecuencias muy similares. El alelo S no mostró un exceso en casos ni al separar por género.
Se ha reportado que los individuos con el alelo L tienen incrementada la actividad transcripcional basal, se ha asociado con niveles elevados de 5-HTT en cerebro y plaquetas (36) y se ha encontrado asociado con TAB I (18). En nuestra población se observó un exceso de individuos con el genotipo LL, aunque no hubo diferencias estadísticamente significativas al comparar con la población control. A diferencia del genotipo SS, el genotipo LL mostró frecuencias muy similares en ambos sexos (tabla 2). Sin embargo, la frecuencia del alelo L no está incrementada en los casos ni al separar por género. En una población de 266 individuos bipolares y 306 controles del Brasil se encontró significativamente elevado el alelo L, pero el genotipo LL no fue significativo en relación con el LS y el SS (18). Varios estudios similares con poblaciones asiáticas, europeas y norteamericana no han encontrado asociación con trastorno bipolar y el 5-HTTLPR (13,34,37).
Se ha encontrado relación entre los polimorfismos VNTR de 9 y 10 repeticiones en el intrón 2 del gen SLC6A4, y enfermedades psiquiátricas, como depresión unipolar, trastorno bipolar y esquizofrenia (15,38). Ohara y colaboradores (39) encontraron asociación entre el alelo STin2.12 y desórdenes de ansiedad en un subgrupo de individuos con TAB I. Otros estudios similares de casos y controles, y metaanálisis se han realizado para encontrar la asociación del alelo STin 2.12 con trastorno bipolar, y los resultados fueron negativos (15,16,38).
En nuestra población no encontramos incrementado ni el genotipo 12/12 ni el alelo STin2.12 en casos al comparar con controles. Resultados semejantes fueron observados al separar por género. No se encontraron los alelos STin2.9 y STin2.11. Los alelos STin 2.10 y STin2.12, y los genotipos 10/10, 12/12 y 10/12 mostraron frecuencias muy similares en casos y al separar por género. Sin embargo, observamos el genotipo 10/10 más elevado en hombres que en mujeres afectadas (53,3% frente a 38,6%), y que en hombres de la población control (53,3% frente a 43,3%).
Varios estudios de casos y controles incluyendo metaanálisis que combinan los dos polimorfismos, en la región 5-HTTLPR y en el intrón 2 del SLC6A4, son controversiales. Cho y colaboradores (33) reunieron 17 estudios de diferentes grupos étnicos y de 6 grupos familiares para la región 5-HTTLPR, y 16 grupos y 4 estudios familiares para el intrón 2. Los resultados mostraron asociaciones significativas, las cuales fueron independientes de la etnicidad (caucásicos frente a no caucásicos), y de los grupos frente a las familias, que contribuyeron a la heterogeneidad del metaanálisis. Las diferencias en los OR pueden indicar un efecto pequeño aditivo cuando se combinan los dos loci de susceptibilidad para desarrollar el trastorno bipolar.
Kunigi y colaboradores (37) encontraron diferencias significativas en las frecuencias de estos polimorfismos en la población japonesa con TAB I comparados con la población caucásica y una asociación significativa entre TAB I y los VNTR del intrón 2, pero ninguna asociación con los alelos de la región 5-HTTL-PR. El alelo STin 2.12 y el genotipo 12/12 fueron significativamente más frecuentes en pacientes con TAB I que en controles. En la población japonesa, al igual que en nuestra población, tampoco se encontró el alelo Stin 2.9.
Bellivier y colaboradores (29) encontraron que los portadores del alelo STin2.12 comenzaban con los síntomas de la enfermedad más tardíamente, y los individuos, con el genotipo SS más temprano. Estos hallazgos sugieren heterogeneidad fenotípica en el trastorno bipolar. La edad de aparición de los síntomas de la enfermedad podría utilizarse como un marcador para una clasificación más homogénea de los individuos afectados, que ayudaría con el análisis genético de estos polimorfismos en el gen SLC6A4.
Al evaluar en nuestro estudio conjuntamente los polimorfismos en las dos regiones del gen no se observaron diferencias significativas en la comparación con la población control ni al separar por géneros (datos no mostrados). Aunque el haplotipo más frecuente entre los individuos afectados fue LS-10/12, encontramos incrementado no significativamente los haplotipos LL-12/12 y SS-12/12 en mujeres más que en hombres afectados.
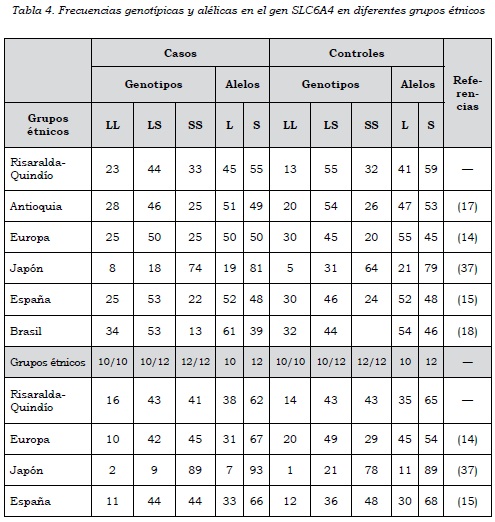
Al comparar nuestros resultados con estudios similares en otras poblaciones (tabla 4) en la región 5-HHTLPR, encontramos semejanzas con las poblaciones de Europa y España particularmente, pero difieren de las poblaciones de Brasil y Japón.
Con la población de Antioquia encontramos una mayor frecuencia del genotipo SS en nuestra población de casos y controles. En relación con el intrón 2, nuestros resultados difieren de las otras poblaciones cuando comparamos el genotipo 10/10, el cual se encuentra incrementado. Sin embargo, la frecuencia alélica de Stin 2.10 es muy similar, excepto con la población japonesa.
Conclusiones
No encontramos asociación entre los polimorfismos de las regiones 5-HTTLPR y el intrón 2 del gen transportador de serotonina en los pacientes con TAB I, ni al separar por géneros en esta población. Dicha asociación tampoco se encontró al analizar conjuntamente ambos polimorfismos. Sin embargo, encontramos incrementado el genotipo LL en la población general de individuos afectados y al separar por género, y los OR para este genotipo fueron altos. En la población general (OR = 1,89; IC 95% = 1,1-3,68), en mujeres (OR = 2,22; IC 95% = 1,04-5,66) y en hombres (OR= 1,62; IC 95% = 0,71-4,39).
Los alelos STin 9 y 11 no se encontraron en esta población. Nuestros resultados concuerdan con otros estudios en los cuales no se observó correlación entre la presencia del genotipo y la presencia de TAB I; sin embargo, las frecuencias genotípicas y alélicas difieren con las poblaciones asiáticas.
Agradecimientos
A la Red de Universidades Públicas del Eje Cafetero 'Alma Mater' y a la Vicerrectoría de Investigaciones de la Universidad Tecnológica de Pereira; al personal médico y auxiliar del Hospital Mental de Risaralda, y al personal médico y auxiliar del Instituto Especializado en Salud Mental Clínica 'El Prado.
Referencias
1. American Pychyatric Association (APA). Diagnostic and statistical manual of mental disorders, 4th ed. Washington: APA; 2005. [ Links ]
2. Smoller JW, Finn CT. Family, twin, and adoption studies of bipolar disorder. Am J Med Genet C Semin Med Genet. 2003;123C:48-58. [ Links ]
3. Merikangas KR, Akiskal HS, Angst J, et al. Lifetime and 12-month prevalence of bipolar spectrum disorder in the national comorbidity survey replication. Arch Gen Psychiatry. 2007;64:543-52. [ Links ]
4. Goldberg JF, Harrow M. Consistency of remission and outcome in bipolar and unipolar mood disorders: a 10-year prospective follow-up. J Affect Disord. 2004;81:123-31. [ Links ]
5. República de Colombia. Ministerio de la Protección Social (MPS), FES. Estudio Nacional de Salud Mental-Colombia 2003. Bogotá: MPS, FES; 2005. [ Links ]
6. Kohn RL. Los trastornos mentales en América Latina y el Caribe: asunto prioritario para la salud pública. Rev Panam Salud Pública/Pan Am J Public Health. 2005;18:229-40. [ Links ]
7. Barnett JH, Smoller JW. The genetics of bipolar disorder (review). Neuroscience. 2009;164:331-43. [ Links ]
8. Craddock NF. Genetics of affective (mood) disorders. Euro J Hum Genet. 2006;14:660-8. [ Links ]
9. Tsuang MT, Taylor L, Faraone SV. An overview of the genetics of psychotic mood disorders. J Psychiatr Res. 2004;38;3-15. [ Links ]
10. McQueen MB, Devlin B, Faraone SV, et al. Combined analysis from eleven linkage studies of bipolar disorder provides strong evidence of susceptibility loci on chromosomes 6q and 8q. Am J Hum Genet. 2005;77:582-95. [ Links ]
11. Ramamoorthy S, Bauman AL, Moore KR, et al. Antidepressant- and cocaine-sensitive human serotonin transporter: molecular cloning, expression, and chromosomal localization. Proc Natl Acad Sci USA. 1993;90:2542-6. [ Links ]
12. Kim SJ, Cox N, Courchesne R, et al. Transmission disequilibrium mapping at the serotonin transporter gene (SL-C6A4) region in autistic disorder. Mol Psychiatry. 2002;7:278-88. [ Links ]
13. Heils A, Teufel A, Petri S, et al. Allelic variation of the human serotonin transporter gene expression. J Neurochem. 1996;66:2621-4. [ Links ]
14. Collier DA, Stober G, Li T, et al. A novel functional polymorphism within the promoter of the serotonin transporter gene: possible role in susceptibility to affective disorders. Mol Psychiatry. 1996;1:453-60. [ Links ]
15. Gutiérrez B, Arranz MJ, Collier DA, et al. Serotonin transporter gene and risk for bipolar affective disorder: An association study in a Spanish. Biol Psychiatry. 1998;43;843-7. [ Links ]
16. Hoehe MR, Wendel B, Grunewald I, et al. Serotonin transporter (5-HTT) gene polymorphisms are not associated with susceptibility to mood disorders. Am J Med Genet. 1998;81:1-3. [ Links ]
17. Ospina-Duque J, Duque C, Carvajal-Carmona L, et al. An association study of bipolar mood disorder (type I) with the 5-HTTLPR serotonin transporter polymorphism in a human population isolate from Colombia. Neurosci Lett. 2002;292:199-202. [ Links ]
18. Meira-Lima I, Michelon l, Cordeiro Q, et al. Allelic association analysis of the functional insertion/deletion polymorphism in the promoter region of the serotonin transporter gene in bipolar affective disorder. J Mol Neurosci. 2005;27:219-24. [ Links ]
19. Nakamura M, Ueno S, Sano A, et al. The human serotonin transporter gene inked polymorphism (5-HTTLPR) shows ten novel allelic variants. Mol Psychiatry. 2000;5:32-8. [ Links ]
20. Bloch MH, Landeros-Weisenberger A, Sen S, et al. Association of the SERT polymorphism and OCD: Systematic review. Am J Med Genet B Neuropsych Genet. 2008;147B:850-8. [ Links ]
21. Lesch K P, Bengel D, Heils A, et al. Association of anxiety-related traits with a polymorphism in the serotonin transporter gene regulatory region. Science. 1996;274:1527-31. [ Links ]
22. Willeit M, Stastny J, Pirker W, et al. No evidence for in vivo regulation of midbrain serotonin transporter availability by serotonin transporter promoter gene polymorphism. Biol Psychiatry. 2001;50:8-12. [ Links ]
23. Kaiser R, Muller-Oerlinghausen B, Filler D, et al. Correlation between serotonin uptake in human blood platelets with the 44-bp polymorphism and the 17-bp variable number of tandem repeat of the serotonin transporter. Am J Med Genet. 2002;114:323-8. [ Links ]
24. Williams RB, Marchuk DA, Gadde KM, et al. Serotonin-related gene polymorphisms and central nervous system serotonin function. Neuropsychopharmacol. 2003;28:533-41. [ Links ]
25. David S P, Murthy NV, Rabiner EA, et al. A functional genetic variation of the serotonin5-HT transporter polymorphism affects 5-HT1A receptor binding in humans. J. Neurosci. 2005;25:2586-90. [ Links ]
26. Silva-Neves F, Malloy-Diniz L, Romano-Silva MA, et al. Is the serotonin transporter polymorphism (5-HTTLPR) a potential marker for suicidal behavior in bipolar disorder patients? J Affect Disorders. 2010;125:98-102. [ Links ]
27. Nobile M, Begni B, Giorda R, et al. Effects of serotonin transporter promoter genotype on platelet serotonin transporter functionality in depressed children and adolescents. J Am Acac Child Psy. 1999;38:1396-402. [ Links ]
28. Craddock N, Owen MJ. Modern molecular genetic approaches to psychiatric disease. Br Med Bull. 1996:52:434-52. [ Links ]
29. Bellivier F, Leroux M, Henry CH, et al. Serotonin transporter gene polymorphism influence age at onset in patients with bipolar affective disorder. Neurosci Lett. 2002;334:17-20. [ Links ]
30. Cardno AG, Rijsdijk FV, Sham PC, et al. A twin study of genetic relationships between psychotic symptoms. Am J Psychiatry. 2002;159:539-45. [ Links ]
31. Berrettini WH. Molecular linkage studies of bipolar disorders. Bipolar Disorders. 2001;3:276-83. [ Links ]
32. Ogilvie AD, Battersby S, Bubb VJ, et al. Polymorphism in serotonin transporter gene associated with susceptibility to major depression. Lancet. 1996;347:731-3. [ Links ]
33. Cho HJ, Meira-Lima I, Cordeiro Q, et al. Population-based and family-based studies on the serotonin transporter gene polymorphisms and bipolar disorder: a systematic review and meta-analysis. Mol Psychiatry. 2005;10:771-81. [ Links ]
34. Mann JJ, Huang YY, Underwood MD, et al. A serotonin transporter gene promoter polymorphism (5-HTTLPR) and prefrontal cortical binding in major depression and suicide. Arch Gen Psychiatry. 2000;57:729-38. [ Links ]
35. Bellivier F, Henry CH, Szöke A, et al. Serotonin transporter gene polymorphisms in patients with unipolar or bipolar depression. Neurosci Lett. 1998;255:143-6. [ Links ]
36. Heinz A, Jones DW, Mazzanti CH, et al. A Relationship between Serotonin transporter genotype and in vivo protein expression and alcohol neurotoxicity. Biol Psychiatry. 2000;47:643-9. [ Links ]
37. Kunugi H, Hattori M, Kato T, et al. Serotonin transporter gene polymorphisms: ethnic difference and possible association with bipolar affective disorder. Mol Psychiatry. 1997;2:457-62. [ Links ]
38. Fan JB, Sklar P. Meta-analysis reveals association between serotonin transporter gene STin2 VNTR polymorphism and schizophrenia. Mol Psychiatry. 2005;10:928-38. [ Links ]
39. Ohara K, Suzuki Y, Ochiai M, et al. A Variable-number-tandem-repeat of the seroton transporter gene and anxiety disorder. Prog Neuropsychopharmacol Biol Psychiatry. 1999;23:5565. [ Links ]