Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.41 no.1 Bogotá Jan./Apr. 2012
Aplicación clínica de marcadores periféricos de respuesta a la terapia antidepresiva: neurotrofinas y citocinas
Clinical Applications of Peripheral Markers of Response in Antidepressant Treatment: Neurotrophins and Cytokines
1 Médica psiquiatra, estudiante del Doctorado en Salud Mental, Universidad de Concepción, Concepción, Chile.
Conflictos de interés: La autora manifiesta que no tiene conflictos de interés en este artículo.
Correspondencia
Constanza Mendoza Bermúdez
Sargento Aldea No. 615 Chillán, Chile
constanzamendozab@gmail.com
Recibido para evaluación: 2 de noviembre de 2011 Aceptado para publicación: 10 de febrero de 2012
Resumen
Introducción: Las teorías explicativas de la depresión han avanzado en las últimas décadas, desde la monoaminérgica hasta la alteración de la neurogénesis, pasando por la hipótesis neurohormonal, que incluye la disfunción de la respuesta inflamatoria. Actualmente existe un creciente interés por el desarrollo de biomarcadores que contribuyan diagnóstico y tratamiento adecuado. Objetivos: Describir el rol de las neurotrofinas especialmente del factor neurotrópico derivado del cerebro (BDNF) y de las citocinas en la fisiopatología del trastorno depresivo; además, revisar y analizar la evidencia respecto de su aplicación clínica como biomarcadores de la terapia antidepresiva. Método: Búsqueda de información relevante en diferentes bases de datos. Resultados y conclusiones: En los últimos años ha crecido la evidencia de la alteración en la neurogénesis mediada por la expresión del BDNF en el hipocampo, en la fisiopatología de la depresión y el respaldo en cuanto a su uso como biomarcador del diagnóstico y la efectividad del tratamiento antidepresivo. Existe menor información para otras neurotrofinas. También se observa un mayor interés respecto a la depresión como una "enfermedad inflamatoria", relacionando también la "cascada" de citocinas con su patogénesis. Se ha reportado evidencia amplia acerca de la utilidad de algunas citosinas, especialmente de la IL-1 (interleucina 1), IL-6 (interleucina 6) y FNT (factor de necrosis tumoral) como biomarcadores de la respuesta farmacológica antidepresiva en humanos.
Palabras clave: Factor neurotrófico derivado del cerebro, neurotrofinas, citocinas, biomarcadores, depresión.
Abstract
Introduction: Explanatory theories of depression have advanced in recent decades from the monoaminergic hypothesis to neurogenesis alterations to the neurohormonal hypothesis that includes the dysfunction of the inflammatory response. Currently there is a growing interest in the development of biomarkers that can contribute to diagnosis and proper treatment. Objectives: To describe the role of neurotrophins such as brain-derived neurotrophic factor (BDNF) and cytokines in the pathophysiology of depressive disorder in addition to reviewing and analyzing evidence about their clinical application as biomarkers of antidepressant therapy. Method: Relevant data research in several databases. Results and conclusions: In recent years evidence of alterations in neurogenesis mediated by the expression of BDNF in the hippocampus in the pathophysiology of depression has increased and there is ample evidence that BDNF is a marker of the diagnosis of depressive disorder and also of treatment effectiveness. There is little information about other neurotrophins. There has also been increased interest in relation to depression as an "inflammatory disease" and the link with cytokines in its pathogenesis. Evidence has been found for the usefulness of some cytokines especially IL-1 (interleukin 1), IL-6 (interleukin 6), and TNF (tumor necrosis factor) as biomarkers of antidepressant drug response in humans.
Key words: Brain-derived neurotrophic factor, neurotrophins, cytokines, biomarkers, depression.
Introducción
Los modelos explicativos de los trastornos depresivos durante gran parte del siglo XX se centraron en la teoría de las monoaminas, con especial énfasis en el papel de la serotonina y noradrenalina; se planteó para la depresión una regulación a la baja de sus concentraciones sinápticas y vías de transmisión (1,2). Con base en esta teoría explicativa, el tratamiento antidepresivo apuntó a regular los niveles sinápticos de las monoaminas para amplificar su acción postsináptica (1,2). Algunos de los hallazgos en pacientes deprimidos en que se fundamenta la teoría monoaminérgica incluyen: a. mayor frecuencia de la mutación del gen de triptófano hidroxilasa; b. baja sensibilidad del receptor 5HT1A; c. inadecuado funcionamiento del receptor 5HT1B; d. decremento en la función de p11 -que regula este receptor-; e. polimorfismo del transportador de serotonina; f. bajos niveles de AMPc (adenosín monofosfato cíclico), inositol y CREB (factor de respuesta al AMPc) encontrado en cerebros post mórtem (3,4).
Teorías posteriores se han centrado en la influencia del cortisol, y la cascada activada por el estrés, que incluiría la modulación de la respuesta inmune e inflamatoria, como factores que explicarían el inicio y la recaída de episodios depresivos (4,5). Actualmente se pretende establecer modelos integradores que den cuenta de la interacción de aspectos genéticos, así como de la exposición temprana a eventos perturbadores, como predisposición y reforzamiento de la distorsión cognitiva característica de la depresión (6). Se propone que las interacciones entre los genes y los factores ambientales constituyen factores predictores más consistentes que cada grupo por separado (7).
Recientemente, los investigadores han focalizado su interés en los mecanismos y efectos crónicos del uso de antidepresivos, ya que existen hallazgos de su modulación sobre elementos intracelulares tendientes a la resiliencia celular y la neuroplasticidad.
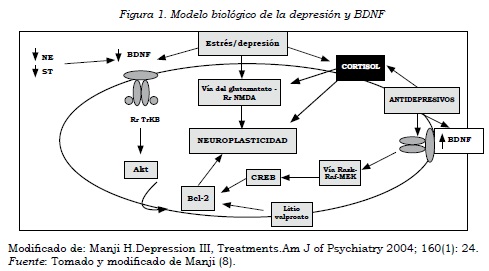
Dos vías intracelulares con efectos neuroplásticos incluyen la proteína neuroprotectora Bcl-2 y el BDNF, moduladas tanto por los antidepresivos como por los estabilizadores del afecto (por ejemplo, litio, ácido valproico). La vía del BDNF requiere la activación de MAPK (proteínas cinasas activadas por mitógenos), que conducen a un incremento del CREB y, finalmente, de la transcripción de Bcl-2. Una segunda vía envuelve la activación de la adenilciclasa y la PKA (proteína kinasa A), por mediación de receptores ligados con proteínas G, que conduce a la activación del CREB, y el subsecuente aumento en la expresión del BDNF (8) (figura 1). Varios estudios han encontrado asociación de la depresión con la alteración en la neurogénesis y el desarrollo de atrofia hipocampal (4,9), mediadas por la disregulación del BDNF (4). Se han evidenciado cambios estructurales (por ejemplo, alteración del subiculum) (10) y pérdida de volumen del hipocampo en pacientes deprimidos, tanto de inicio temprano como tardío de su condición (11-13); con una relación significativa entre la atrofia hipocampal, y las deficiencias cognitivas para las personas con depresión de inicio tardío (11).
Además, se ha propuesto que el estrés agudo y el crónico pueden disminuir la expresión del RNAm del BDNF en el hipocampo (14), y comprometer la neurogénesis en esta zona cerebral (15). Los efectos del estrés sobre el BDNF pueden ser explicados parcialmente por los glucocorticoides, pero también por la alteración de la función serotoninérgica (16) (figura 1). Existen reportes de que el tratamiento antidepresivo crónico (para varias investigaciones corresponde a un tiempo mayor a dos o tres semanas) en ratas posibilita la neurogénesis en el hipocampo, lo que sería esperable también en humanos. La estimulación de las vías neuroprotectoras, por lo tanto, sería un efecto común para los antidepresivos y los estabilizadores del afecto (8).
La investigación de las citocinas en los trastornos depresivos aún está en desarrollo. Varios modelos animales que intentaron aumentar la liberación de citocinas proinflamatorias, a través de la inducción de infecciones, eventos vasculares encefálicos y estrés psicológico, mostraron la aparición de sintomatología de tipo depresivo (17).
Aunque existen diversas teorías explicativas de los trastornos afectivos, incluyendo la depresión, su neurobiología más precisa no ha sido entendida completamente. De esta forma, el uso de biomarcadores puede conducir a una mejor comprensión, diagnóstico y tratamiento de estos trastornos. Teniendo en cuenta que la implementación de biomarcadores para los trastornos depresivos tendría especial relevancia, en vista de su alta prevalencia, probabilidad de curso crónico y refractario, e importante discapacidad asociada; además de proveer utilidad para la prevención e intervención temprana en sujetos a riesgo de desarrollarlos. Actualmente no existen biomarcadores disponibles para la depresión en la práctica clínica; sin embargo, la fácil accesibilidad a los distintos fluidos corporales podría ser una ventaja para su detección (18). Un sinnúmero de estudios respaldarían con mayor consistencia la utilidad del BDNF y menor para algunas citocinas como biomarcadores de la respuesta al tratamiento antidepresivo, postulándolos como mediadores de su acción.
Con base en estos antecedentes, los objetivos de la presente revisión son describir el rol de las neurotrofinas, especialmente del BDNF, y de las citocinas en la fisiopatología del trastorno depresivo, además de revisar y analizar la evidencia respecto a la detección de sus niveles periféricos como biomarcadores de la terapia antidepresiva.
Metodología
Se realizó una búsqueda de información en diferentes bases de datos electrónicas: Medline, Science Direct (Elsevier), ProQuest, Scielo y Ovid. En dos periodos: en el último trimestre de 2010 y en diciembre del presente año. Se utilizaron como palabras clave las siguientes: factor neurotrópico derivado del cerebro, BDNF, neurotrofinas, citocinas, biomarcadores, depresión, tratamiento antidepresivo.
La búsqueda se restringió a literatura médica, en español e inglés, artículos originales y revisiones de la literatura, publicados desde 1960 hasta la actualidad. Se seleccionaron un total de 51 artículos, correspondientes a 21 revisiones, y 30 artículos originales. Además de la inclusión de una imagen comentada como una referencia adicional. La selección final de los artículos fue realizada por la autora, con base en el nivel de impacto, la capacidad explicativa y la relevancia de las respectivas publicaciones.
Neurotrofinas
Aspectos generales
Son factores tróficos que constituyen una familia de péptidos relacionados que regulan el desarrollo, mantenimiento, diferenciación, sobrevida y muerte de las neuronas y otras células del sistema nervioso central y periférico, lo que incluye acciones sobre soma, axones y dendritas. Durante la embriogénesis, las neurotrofinas cumplen un rol fundamental en los procesos de neurogénesis, sinaptogénesis, diferenciación y migración celular (19,20). En la vida adulta se cree que el rol de neurotrofinas como el BDNF, principalmente, se dirige a la plasticidad neuronal, más que a la supervivencia, por lo que estaría relacionado con la potenciación neuronal a largo plazo, el aprendizaje y la memoria (14). Por lo tanto, al ser segregadas en un área, determinan la cantidad final de neuronas, al protegerlas de la apoptosis, facilitar la plasticidad neuronal y regular las células progenitoras neuronales (19,20). La hipótesis de las neurotrofinas propone que la estimulación neuronal repetida aumenta la expresión, secreción y actividad de estos factores sobre la transmisión sináptica y la conectividad (19,20).
Esta familia incluye las siguientes (19,21):
- El factor de crecimiento neuronal (del inglés neuronal derived factor, NGF): Es producido por el hipocampo, bulbo olfatorio y corteza. Cumple funciones en el sistema simpático, sensorial, y en la actividad colinérgica del sistema nervioso central (SNC).
- El factor neurotrópico derivado del cerebro (del inglés brain derived neurotrophic factor, BDNF): Es el más abundante y ampliamente distribuido en el SNC. Se ha asociado con la patogénesis de varios trastornos psiquiátricos, como la depresión, el trastorno afectivo bipolar, la demencia tipo Alzheimer y la esquizofrenia.
- Neurotrofina 3 (NT-3).
- Neurotrofina 4/5 (NT-4/5).
- Neurotrofina 6 (NT-6).
Las neurotrofinas son sintetizadas como proteínas precursoras de 240 a 260 aminoácidos, que son procesadas hasta su secreción al espacio extracelular, como proteínas homodiméricas maduras. El descubrimiento de que la glándula submaxilar del ratón contenía grandes cantidades de NGF permitió su posterior purificación, hasta lograr secuenciarla. Se constató que era un homodímero de dos polipéptidos de 118 residuos (19). De forma llamativa se ha descrito que las proneurotrofinas inducen la degeneración y apoptosis de neuronas.
Hay dos clases de receptores de neurotrofinas: a. el receptor p75, denominado de baja afinidad, pues las proneurotrofinas se unen a este con una afinidad mayor que las neurotrofinas maduras; y b. los receptores de tirosina-kinasa (Trk), que incluyen TrkA, TrkB y TrkC. TrkA es el receptor de NGF; TrkB, el de BDNF y NT-4/5, y TrkC, es de NT-3, aunque esta neurotrofina puede unirse con menor afinidad a los otros receptores (19).
La acción del receptor p75 parece no estar completamente clara, ya que puede formar complejos polidiméricos con los receptores de Trk; asociación que podría incrementar la afinidad de estos por sus ligandos. Sin embargo, se ha descrito que la unión de neurotrofinas al receptor p75 en ausencia de TrkA puede inducir la apoptosis más que evitarla, por hidrólisis de esfingomielina y activación del receptor NMDA (N-metil-D-aspartato) en el hipocampo (22). También, a diferencia de los receptores de Trk, permite la unión de ligandos no neurotróficos, como la glicoproteína del virus de la rabia, y péptidos amiloides. Además, no posee actividad catalítica per se; por lo tanto, su señalización depende de la interacción con otras proteínas intracelulares (22).
Las acciones de las neurotrofinas finalmente son mediadas por la unión a los receptores de Trk, considerados específicos por ser de alta afinidad, y que tienen una actividad enzimática intrínseca que estimula una cascada interna de reacciones enzimáticas. Estos receptores poseen una única hélice α transmembranal. Al unirse con el BDNF se modifica su conformación y se dimerizan, lo que activa su dominio citosólico con función enzimática de tirosina kinasa, que conduce a la fosforilación de residuos de tirosina inicialmente del par receptor, que se conoce como autofosforilación (19) (figura 1).
Se ha encontrado que la supervivencia y el crecimiento de neuronas serotoninérgicas en el cerebro adulto son incrementados por el BDNF, y, en menor grado, por la neurotrofina-3, no así por el NGF. Sumado a que las neurotrofinas pueden influenciar la transmisión neuronal, como se demuestra por el aumento de las conexiones sinápticas de cultivos neuronales de cortes hipocampales. Por otra parte, las monoaminas son capaces de aumentar la acción neurotrófica, por lo que conjuntamente pueden participar en la regulación de sus funciones, lo que aplica también para su deficiencia (19) (figura 1).
Papel de las neurotrofinas en la depresión
Basado en estudios en animales y clínicos, se propone que en los trastornos afectivos se produce atrofia y pérdida neuronal, especialmente en el hipocampo y neocórtex (21). La evidencia actual destaca el papel del BDNF a través de su unión al receptor de TrkB, en la patogénesis de los trastornos afectivos, y específicamente de la depresión.
Aunque los estudios en animales en que se suprime genéticamente la expresión del BDNF tienen la dificultad de comprometer la supervivencia de los animales, por su rol crítico en la neurogénesis, Monteggia y colaboradores (23) encontraron bajos potenciales a largo plazo en el hipocampo de ratones knockout, en los que se suprimió el gen del BDNF a las 12 semanas de edad, en comparación con los controles. Además, observaron diferencias de género en la expresión clínica de aquellos ratones. Para los machos se observaron conductas de hiperactividad, y para las hembras, la presencia de elementos depresivos sin hiperactividad.
Con lo anterior, puede sostenerse que la deficiencia del BDNF constituiría un factor de mayor vulnerabilidad para el desarrollo de cuadros depresivos en el género femenino ante la presencia de estresores, lo cual es concordante con el aumento en la prevalencia de trastornos depresivos en las mujeres, adultas en comparación con los hombres del mismo rango de edad.
Frodl y colaboradores (24) (n = 120) evaluaron los efectos del polimorfismo del gen BDNF Val66Met en el área promotora -asociado con una alteración en la exocitosis y menor secreción del BDNF-, en los volúmenes del hipocampo y amígdala, en controles sanos y personas con trastorno depresivo mayor; se encontró que el tamaño del hipocampo era significativamente menor para los últimos (p = 0,02), y que los portadores homocigotos del alelo de metionina para el gen BDNF tenían volúmenes hipocampales también significativamente menores que los otros genotipos (p = 0,006). No hubo diferencias para el volumen amigdalino. Otro estudio corroboró la reducción en el volumen del hipocampo en mujeres con trastorno depresivo mayor (n = 38), que se asoció significativamente con el tiempo en que el episodio depresivo estuvo sin tratamiento antidepresivo (p < 0,001) (25).
De forma semejante a la función del BDNF, la activación del receptor 5HT1A estimula la neurogénesis en el hipocampo, lo que parece ser importante para la acción antidepresiva (14). Además, esta neurotrofina estimula la acción serotoninérgica; se encontró que el BDNF promueve la supervivencia y diferenciación celular de las neuronas serotoninérgicas in vivo y en cultivos celulares, además de ser coexpresado junto con su receptor de TrkB en dichas neuronas al nivel del rafe (14). Luego de la infusión del BDNF en el SNC se observó un aumento de la actividad serotoninérgica en diferentes áreas del cerebro (21).
Para explicar la relación entre serotonina y BDNF se describe una retroalimentación de tipo auto- o paracrino de la primera, al regular la expresión del RNAm del BDNF.
Así, la reducción en la liberación de BDNF inducida por el estrés puede ser mediada al menos parcialmente por una disfunción del sistema serotoninérgico. Lo anterior podría ser revertido por el tratamiento con inhibidores selectivos de la recaptación de serotonina (ISRS) y por otros antidepresivos, al potenciar la transmisión serotoninérgica (20).
Adicionalmente, se ha reportado la acción antidepresiva del BDNF, al infundirlo directamente al hipocampo, y, paradójicamente, un efecto pro depresivo en la vía del área tegmental ventral (ATV) al núcleo accumbens (NA) (14). Esta probable acción dicotómica ha permitido considerar dos vías diferentes para: a. anhedonia y pérdida del interés, y b. ansiedad y estrés. Al parecer, esta contraposición en sus acciones estaría explicada por una secreción predominante por neuronas en el hipocampo, y por células gliales en la vía del ATV al NA (14). Otra explicación puede ser la de una mayor acción del BDNF maduro en el hipocampo, y la de su precursor en el sistema de recompensa.
Como se describirá posteriormente, se observa un aumento en la función del BDNF con distintos antidepresivos y con la terapia electroconvulsiva, además de la regulación de otras neurotrofinas (4). Sin embargo, existen detractores que cuestionan la especificidad de estos datos, al plantear que la función intracerebral del BDNF puede alterarse por factores adicionales a la depresión en sí misma (por ejemplo, toxinas, inflamación), y que su disregulación puede ser común a otros trastornos psiquiátricos (4).
En relación con otras neurotrofinas, existen reportes menos claros. Un estudio encontró elevaciones séricas de NGF en pacientes deprimidos. A su vez, en un modelo animal de depresión en ratas sometidas a un estímulo electroconvulsivo se observaron mayores concentraciones en hipocampo y estriado del NGF, que disminuyeron en corteza prefrontal (21).
Para la NT-3 se reportaron concentraciones más altas en personas deprimidas, en comparación con controles sanos (21). Esta observación ha generado discusiones respecto a su vinculación con alteraciones en el sistema noradrenérgico, pues in vivo se ha demostrado que la NT-3 previene la muerte de neuronas noradrenérgicas adultas (21).
Estudios recientes han mencionado la relación de otro factor trófico con la reacción al estrés y la terapia antidepresiva. Se trata del factor trófico derivado del endotelio vascular (del inglés vascular endothelial growth factor, VEGF). Existen reportes acerca de su rol en la actividad neuronal, aumento de los potenciales a largo plazo en el hipocampo y en la transmisión sináptica (26). Se reportó que la administración de varios antidepresivos (ISRS, ISRN) incrementó la expresión del RNAm del VEGF; por otro lado, el estrés redujo sus niveles (26,27). Además, la infusión directa del VEGF en los ventrículos laterales incrementó la neurogénesis y produjo una respuesta antidepresiva a corto y largo plazos, al evaluar varios test en animales (por ejemplo, desesperanza aprendida, nado forzado, hipofagia inducida). En contraste, la inhibición de su señal a través del bloqueo de su receptor (VEGF-R2) suprimió los efectos antidepresivos y la neurogénesis inducida en este modelo (26). Estos datos hacen pensar que los diferentes factores tróficos ejercen acciones complementarias o sinérgicas, si bien distintos hallazgos resaltan el rol central del BDNF, y quizás del VEGF, como relevantes para la acción antidepresiva (26,27).
Neurotrofinas como biomarcadores de la terapia antidepresiva
Dada la información que respalda su vinculación con la patogénesis de la depresión, dentro de las neurotrofinas, la que más se ha estudiado como biomarcador ha sido el BDNF. El retraso en lograr una respuesta terapéutica, al menos por dos semanas de antidepresivos como los ISRS -cuyo mecanismo de acción consiste en inhibir la recaptación de serotonina del espacio extracelular, y que ocurre en las primeras 48 horas-, ha permitido considerar que su farmacodinamia trasciende la sinapsis y genera modificaciones estructurales y funcionales; lo cual se atribuye a su influencia sobre la plasticidad neuronal por regulación de la expresión o secreción del BDNF (14).
Las primeras asociaciones de la terapia antidepresiva y el BDNF datan de la década de los años noventa, provienen de estudios que reportaron aumento en la transcripción del BDNF en el hipocampo y corteza durante su administración crónica a ratones (14). Posteriormente, se observó que una dosis única en infusión directa del BDNF bilateral en el giro dentado o en la región C3 del hipocampo de ratones mostraba similitud con la respuesta antidepresiva, al evaluar los tests de nado forzado y desesperanza aprendida (16). De forma paradójica, también se reportó que la infusión del BDNF en el área tegmental ventral (ATV) o la potenciación en su acción en el núcleo accumbens (NA) producía efectos depresógenos, lo que propuso un perfil diferencial de su acción en hipocampo y en la vía del ATV-NA, como se mencionó previamente (16). Más allá de estos hallazgos, actualmente se propone esta neurotrofina como un mediador importante de la acción de los antidepresivos.
Respecto al inicio de la respuesta clínica, un estudio en ratas (n = 115) comparó la acción de reboxetina y citalopram, y su administración conjunta con el ejercicio físico; encontró aumento significativo en los niveles del RNAm de BDNF, desde los dos días para ambos antidepresivos, frente al grupo control. Para el caso de la reboxetina, en todas las regiones del hipocampo evaluadas (CA1-CA4, y giro dentado) se encontraron cambios que se mantuvieron luego de dos semanas de actividad física, y para el citalopram, solo en la región CA2, a los dos días, con extensión a la zona CA4 y giro dentado luego de dos semanas de actividad física (28).
Rantamâki y colaboradores (29), también en ratones, destacaron la rápida activación del receptor TrkB como efecto común, tras administrar diferentes antidepresivos (fluoxetina, reboxetina, citalopram, imipramina, clomipramina), lo que estaría mediado por el aumento de monoaminas en la sinapsis.
Se postula que los antidepresivos pueden regular el BDNF a través de la activación del CREB (por fosforilación), estimulando su transcripción al actuar sobre el promotor, lo que ocurre por cualquiera de estas tres vías: AMPc-PKA, calcio-calmodulina y MAPK. Se cree que los efectos agudos se deben a un aumento en la secreción del BDNF, y que los crónicos corresponden más a la regulación en la expresión del gen de esta neurotrofina y/o de su receptor TrkB (8). En este sentido, existen reportes que destacan un up-regulation del AMPc en el hipocampo y neocórtex durante el tratamiento crónico con antidepresivos, y se considera que un inhibidor de la fosfodiesterasa (enzima que degrada el AMPc) tendría efectos antidepresivos, como se intentó con el rolipram, un inhibidor de la fosfodiesterasa tipo 4, pero que mostró dificultad en su uso, por numerosos efectos adversos en humanos (17,29).
Factores epigenéticos, como la respuesta al estrés, pueden interferir con la acción antidepresiva, al favorecer la metilación de histonas que bloquean la transcripción del BDNF. Por su parte, la administración crónica de imipramina favorece la acetilación de histonas que estimulan su transcripción, al plantearse que los antidepresivos cumplirían cierta "función protectora" frente a situaciones generadoras de estrés (14). Molteni y colaboradores (30) también corroboraron un aumento en los niveles de BDNF (maduro) en la sinapsis de ratas tratadas con duloxetina por 21 días, que fueron expuestas a un evento estresante; no así en el grupo control. Además, varios modelos animales resaltan que la administración de diferentes antidepresivos puede revertir la reducción de arborizaciones dendríticas inducida por el estrés en neuronas del hipocampo, a través de su acción sobre BDNF (16).
Se ha descrito que el BDNF podría cruzar la barrera remato-encefálica, y que puede detectarse en sangre, además de que sus niveles en suero concuerdan con lo que ocurre en el SNC (18). La mayoría del BDNF en suero se encuentra en las plaquetas, y es captado por estas a través de un transportador no caracterizado (31).
Karege y colaboradores (2002) (32) reportaron valores significativamente más bajos en sangre (medidos con ELISA) en sujetos deprimidos (n = 30) sin tratamiento antidepresivo, en comparación con controles sanos (n = 30). Los niveles del BDNF se correlacionaron con la severidad de la depresión, evaluada a través de la escala de Montgomery-Asberg. En 2003, estos resultados fueron corroborados por Shimizu y su equipo utilizando tres grupos (sanos, depresivos no tratados y depresivos en tratamiento farmacológico), al evaluar la severidad con la escala de depresión de Hamilton y encontrar resultados a favor del tratamiento antidepresivo (33). Deveci y colaboradores (2007) (34) reportaron niveles significativamente más bajos del BDNF, en pacientes con trastorno depresivo mayor (n = 24) y con intentos de suicidio (n = 10), en comparación con controles sanos (n = 26) (p = 0,004).
Varios estudios han reportado hallazgos similares en pacientes deprimidos en comparación con personas sanas, y su variación luego del tratamiento antidepresivo (33,35,36). Un metaanálisis (Sen y colaboradores, 2008) (37) destacó valores significativamente más bajos de BDNF para sujetos con depresión frente a controles sanos. Otro metaanálisis (Brunoni y colaboradores, 2008) (38) reportó el aumento significativo en estos valores durante el tratamiento antidepresivo, con un tamaño del efecto moderado (0,62; p = 0,02).
Los datos anteriores sustentarían la hipótesis que relaciona la mejoría sintomática en la depresión con cambios neuroplásticos, y que la concentración en suero del BDNF pueda usarse como biomarcador de la actividad de este trastorno y de la respuesta a la terapia antidepresiva farmacológica (18).
También, se ha señalado un aumento de los niveles de BDNF luego de la terapia electroconvulsiva (TEC) en pacientes con trastorno depresivo resistente, aunque algunos reportes no replican estos resultados. Por su parte, Lang y colaboradores (39) no encontraron variaciones en los niveles de BDNF en pacientes deprimidos (n = 24) manejados con estimulación magnética transcraneal repetitiva (EMTr) y estimulación del nervio vago (ENV), considerando un mecanismo de acción no ligado con BDNF; por ello se requieren estudios posteriores para profundizar en la asociación entre BDNF e intervenciones no farmacológicas (por ejemplo, TEC, EMTr, ENV) (18).
En relación con investigaciones posteriores, se requiere mejorar las técnicas de detección del BDNF en suero, pues el actual test de ELISA solo logra detectar el BDNF maduro; quizá sería necesario discriminar los niveles de pro-BDNF del BDNF como biomarcadores. También, estudiar con mayor profundidad la relación entre la transmisión glutamatérgica, el BDNF y los cambios neuroplásticos (18).
Citocinas
Aspectos generales
Son un grupo diverso de pequeñas proteínas que pueden ser consideradas las hormonas del sistema inmune. Pueden ser secretadas por diversas células en respuesta a una lesión o infección. Su acción como mediadores entre el sistema nervioso central y el sistema inmune fue descubierta hace aproximadamente 20 años. Su acción generalmente ocurre a través de una "cascada", en la que una citocina liberada tempranamente luego induce y amplifica la liberación de otras citocinas (por ejemplo, IL-1 estimula la liberación de la IL-2, la IL-6 y del factor de necrosis tumoral) (17).
Se pueden identificar al menos cuatro grupos de citocinas según su estructura: a. interferones: α, β y g; b.factor de necrosis tumoral: α, β; c. factores estimulantes: eritropoyetina, y factor estimulante de los granulocitos (FEG); d. interleucinas: IL-1α, IL-1β, IL-2 a IL-13. En relación con su acción, pueden clasificarse como: a. proinflamatorias: se incluyen IL-1, IL-6 y FNT; b. antiinflamatorias: como la IL-4, IL-10 e IL-13; c.hematopoyéticas: incluyen la IL-3, IL-5, eritropoyetina y FEG (17).
Para cumplir su acción biológica, deben unirse con receptores específicos celulares, cuya unión puede ser inhibida por la forma soluble del receptor; se ha encontrado evidencia de receptores en SNC para la mayoría de citocinas (17).
Se ha reportado la asociación de las citocinas y la inmunogénesis en la patofisiología de varias enfermedades médicas, entre ellas: el cáncer, las enfermedades infecciosas e inflamatorias, el shock séptico, los eventos vasculares encefálicos, las enfermedades cardiovasculares, las alergias y las enfermedades autoinmunes. El polimorfismo genético de citocinas específicas y su asociación con diversas enfermedades ha sido estudiado ampliamente. Especialmente, se reporta la vinculación de los genes del FNT con la esclerosis múltiple, el asma, el shock séptico y la miastenia gravis. Hasta el momento no se ha encontrado asociación entre las enfermedades psiquiátricas y el polimorfismo genético de citocinas (17).
El SNC tiene particularidades respecto a su respuesta inmune; aunque no exhibe la "clásica respuesta inflamatoria" marcada por la invasión de macrófagos y leucocitos, su reacción incluye el edema, la activación de macrófagos residentes (microglias), la invasión local de células inmunes circulantes y la producción de citocinas -que pueden ser secretadas tanto por neuronas como por microglias y astrocitos-.
Se han postulado cuatro mecanismos de disponibilidad de las citocinas en el SNC: a. pasivo, de zonas adyacentes a regiones del SNC carente de barrera hematoencefálica (BHE); b. unión de citocinas al endotelio vascular y activación de mensajeros como prostaglandinas y óxido nítrico; c. paso mediado por un transportador a través de la BHE; y d. conducción desde un terminal nervioso aferente hasta el lugar donde son liberadas. Cumpliendo en el SNC con funciones diversas, como: inmunológica (por ejemplo, IL-1 se asocia con aumento de microglias), neuroquímica (por ejemplo, infusión de IL-1β intraperitoneal mostró aumento en los metabolitos de serotonina y noradrenalina en ratones), neuroendocrina (por ejemplo, IL-1 asociada con aumento de factor liberador de corticotropina [CRF], ACTH y corticoesteroides) y modulación conductual (por ejemplo, IL-1 y FNT-α asociadas con somnolencia) (17).
Papel de las citocinas en la depresión y su utilidad como biomarcadores en este trastorno
Se ha descrito que ciertas citocinas pueden alterar directa o indirectamente el metabolismo de la serotonina. Se ha planteado que el FNT-α y el interferón-γ podrían inducir el catabolismo del triptófano a través de la inducción de la indolamina 2,3-dioxigenasa (IDO), disminuyendo así la síntesis de la serotonina (40). Además, se ha reportado aumento de los niveles del FNT-α en pacientes deprimidos (41).
Maes y colaboradores (1995, 1999) (42,43) encontraron un incremento en las concentraciones plasmáticas e in vitro en la producción de IL-1 e IL-6, en pacientes con trastorno depresivo mayor. Estos investigadores también encontraron un aumento en las concentraciones de receptores solubles de IL-2 e IL-6, además de proteínas de fase aguda. Concluyeron que existe un aumento de las citocinas proinflamatorias en pacientes deprimidos, que se correlacionaría con la actividad sintomática, con la severidad del trastorno y con la hiperactivación del eje hipotálamo-pituitario-adrenal (HPA) (17,42-44).
Sin embargo, respecto al aumento de citocinas proinflamatorias en el trastorno depresivo, no existe unanimidad en los resultados de los estudios, pues también se ha observado una reducción de IL-1β e IL-2 en sujetos depresivos, en comparación con controles sanos (17). Aunque la mayoría de investigadores sí ha logrado confirmar un aumento en las proteínas de fase aguda, especialmente de la haptoglobina, y existen reportes de incremento de otros reactantes, como la proteína C-reactiva (PCR), leucocitosis y neutrofilia, lo cual sugiere una respuesta inflamatoria leve en la depresión que estaría mediada por las citocinas (17,45,46). Además, se ha reportado que el aumento en el índice fagocitario puede representar un biomarcador altamente específico del trastorno depresivo (47).
Más allá de los resultados heterogéneos de los estudios en relación con las citocinas, actualmente existe una mayor evidencia respecto a la asociación de la depresión y la respuesta inflamatoria, lo cual explicaría la alta prevalencia de la depresión en pacientes oncológicos, con enfermedades infecciosas crónicas, autoinmunes y cardiovasculares, o con tratamientos inmunológicos, en comparación con la población general (40). También, se ha planteado que la asociación entre depresión y citocinas sería especialmente relevante en adultos mayores, pues presentan un alto riesgo de alteraciones cognitivas y condiciones proinflamatorias (40,45,46).
En 1992 fue identificado el polimorfismo (C/T) en la región promotora del gen de IL-1β (posición -511); se encontró que los individuos homocigotos -511T secretaban niveles significativamente más altos que los heterocigotos, y estos, más altos que los homocigotos -511C. Basados en estos antecedentes, Yu y colaboradores (48), aunque no evidenciaron mayor prevalencia de trastornos depresivos en sujetos portadores del polimorfismo en comparación con los controles, reportaron de forma llamativa que los homocigotos -511T tenían menor severidad sintomática y mostraron una mejor respuesta al tratamiento con fluoxetina.
Godbout y colaboradores (40) compararon los niveles de serotonina y su metabolito, IL-6, e IDO, en ratones jóvenes (3-6 meses de edad) y ancianos (20-24 meses de edad), luego de activar el sistema inmune con liposácaridos de Escherichia coli. Encontraron que ambos grupos desarrollaron sintomatología de tipo depresiva, que se mantuvo aun después de la recuperación de la infección, con diferencias significativas para los ratones ancianos en los valores de IDO e IL-6, frente a los más jóvenes.
Siguiendo esta hipótesis, Thomas y su equipo (49) evaluaron adultos mayores de 60 años (n = 60) sin otras condiciones inflamatorias ni demencia, a través de la medición de la IL-1β en tres grupos comparativos: a. sujetos con depresión mayor (n = 19); b. otros con síntomas depresivos subsindromáticos (n = 20), y c. controles sanos (n = 21), utilizando la escala de Montgomery-Asberg y la escala de depresión geriátrica. Se encontraron valores significativamente más altos de IL-1β en las personas con trastorno depresivo mayor, en comparación con los controles sanos, que además se correlacionaron con la duración del episodio actual y la severidad clínica reportada por las escalas. No hubo diferencias para el grupo subsindromático, lo cual hablaría de una relación en el aumento de IL-1β con el "estado depresivo"; es decir, con la actividad de la condición. Lanquillon y colaboradores (50) desarrollaron un ensayo clínico controlado con 24 pacientes deprimidos, para evaluar la respuesta a amitriptilina luego de seis semanas de tratamiento; midieron IL-6, FNT-α, y PCR, antes y después de esta intervención. Utilizaron las escalas de depresión de Hamilton y Montgomery-Asberg para determinar el grado de respuesta clínica (quiénes respondían o no lo hacían, determinado por un cambio en el puntaje de las escalas ≥ o < 50%, respectivamente). Se observó que en el pretratamiento, la concentración de PCR fue significativamente más alta para los sujetos depresivos que en los controles. Además, la IL-6 se comportó como un marcador de respuesta clínica, pues, al comparar a los pacientes que respondían al tratamiento con quienes no, se observaron valores pretratamiento significativamente más bajos para los primeros. Los valores de IL-6 en quienes no respondían fueron también significativamente más altos que los controles. El FNT-α mostró una reducción significativa en los que respondían retornando al valor de los controles, y ausencia de diferencia en quienes no lo hicieron. Es decir, sus valores corrieron de forma paralela con la mejoría clínica. Estos resultados mostraron perfiles diferenciales de respuesta clínica, y propone que los valores altos de IL-6 podrían encontrarse en los pacientes depresivos que tendrán un curso crónico o refractario, y no de forma generalizada.
Discusión y conclusiones
La utilidad clínica de los biomarcadores para la depresión y otros trastornos psiquiátricos plantea varios niveles, de acuerdo con el propósito de su aplicación: 1. prevención y diagnóstico temprano en población vulnerable; 2. diagnóstico específico de la depresión: que muestre un perfil diferencial en controles sanos en comparación con los depresivos, y que permita distinguirla de otros trastornos psiquiátricos; 3. respuesta al tratamiento: marcadores de presencia o ausencia de respuesta frente a un antidepresivo, o que permita comparaciones de efectividad entre distintos antidepresivos.
El interrogante que surge es si un solo tipo de biomarcador puede cumplir con los propósitos antes mencionados de forma eficiente, si su elección depende del objetivo, o quizá debieran complementarse para mejorar su rendimiento. El biomarcador ideal debería brindar más especificidad frente al diagnóstico clínico, y a la respuesta al tratamiento. Por lo tanto, los biomarcadores no solo deben comportarse de forma diferente entre sanos y enfermos, sino facilitar la discriminación según niveles de severidad en una misma condición, y entre esta y otros trastornos, al mostrar una mayor o menor asociación. Para la presente revisión se ha profundizado acerca de la vinculación del BDNF y las citocinas con la depresión, y su subsecuente aplicabilidad, como biomarcadores de la terapia antidepresiva.
Respecto a las neurotrofinas, en los últimos años ha crecido la evidencia -como resultado de modelos animales- de que las alteraciones en la expresión del BDNF (que ha sido la más estudiada), especialmente en el hipocampo, tienen relación con la fisiopatología de la depresión, y su reversión con la respuesta al tratamiento crónico. Como se describió previamente, varios estudios han reportado niveles bajos de BDNF en suero en pacientes con trastorno depresivo mayor, que se correlacionan con la severidad de la sintomatología, y su aumento con la terapia antidepresiva; por lo tanto, podría utilizarse como un biomarcador para el diagnóstico y tratamiento de esta entidad. Sin embargo, existe un aspecto que ha generado controversia, y es si los valores periféricos en suero concuerdan con lo que ocurre en SNC.
Para algunos autores no es posible (31) que el BDNF cruce la BHE, por lo cual los valores en suero corresponderían solo a su concentración en las plaquetas; para otros es factible que pueda atravesarla (18), lo cual constituye un punto crucial para extrapolar de forma confiable los niveles periféricos del BDNF como biomarcador de la actividad de la depresión o de la respuesta al tratamiento.
En este sentido, es interesante un estudio reciente de Schmidt y Duman (51) en ratones, a los que les fue administrado BDNF en infusión vía periférica, y luego se evaluó la respuesta comportamental, los cambios en la neurogénesis en células del hipocampo, la expresión del BDNF en hipocampo y estriado, la activación de kinasas extracelulares y del CREB. Se observó una mayor tolerancia ante estímulos generadores de estrés (evaluado por los test del laberinto, nado forzado, hipofagia inducida, entre otros) y un aumento en la expresión del BDNF, con una mayor activación de kinasas y del CREB.
Esto no solo corrobora que las concentraciones en suero del BDNF pueden ser utilizadas de forma consistente como biomarcadores para la depresión, y que son expresión de su funcionamiento y vías de señalización en SNC, pues también refuerza la posibilidad de que el BDNF periférico pudiese pasar la BHE hacia el cerebro, con efectos directos sobre los circuitos neuronales. Por ahora, estos datos respaldarían que la acción antidepresiva estaría mediada por el BDNF, pero se requieren estudios posteriores para precisar si el BDNF periférico cumple un efecto directo o indirecto, y que aclaren la contribución de otros tejidos (además del SNC) en los niveles séricos del BDNF. Otro aspecto importante de este estudio es cuestionarse nuevamente la efectividad clínica del tratamiento con BDNF, pero su utilidad tendría dificultades desde el punto de vista farmacocinético, como otros factores neurotróficos (por ejemplo, la escasa penetrabilidad a la BHE, la corta vida media y la pobre biodisponibilidad), así como riesgo de efectos adversos (por ejemplo, tumores) (31).
La utilidad de su precursor, el pro-BDNF, para aumentar su biodisponibilidad sería más compleja, ya que se ha asociado con aumento en la apoptosis. En relación con el precursor del BDNF también se requieren técnicas de medición adecuadas que puedan diferenciar, a nivel periférico, el BDNF maduro del pro-BDNF, y precisar si podrían constituir perfiles antagónicos como biomarcadores de la depresión y de la respuesta clínica al tratamiento, considerando que sus acciones son opuestas.
La aplicación del BDNF para el diagnóstico temprano e implementación de programas de prevención requeriría su evaluación en población vulnerable, como familiares de pacientes con trastornos depresivos, especialmente en población adolescente y joven con factores de riesgo para el inicio de cuadros depresivos. En este sentido, sería necesaria la determinación del polimorfismo del gen de BDNF (Val66Met) en población susceptible, además de la evaluación de otras variables conducentes para la determinación del riesgo, para diseñar intervenciones de prevención posteriores.
En relación con la utilidad del BDNF como marcador de diagnóstico, sería importante avanzar en cuanto al establecimiento de un perfil de distinción en sujetos cursando con episodios depresivos dentro de un trastorno depresivo unipolar o bipolar, como diagnóstico diferencial más próximo. Esto tiene especial relevancia respecto al tratamiento farmacológico y al pronóstico, ya que muchos pacientes bipolares en sus primeros años de evolución son inadecuadamente considerados y tratados como depresivos unipolares, lo que aumenta la morbilidad y riesgo de complicaciones.
Respecto al BDNF como biomarcador de la respuesta antidepresiva, sería especialmente útil desarrollar estudios clínicos en los que se pueda comparar el perfil de respuesta de distintos antidepresivos (por ejemplo, ISRS, ISRN, duales) con mediciones pre- y postratamiento, para evaluar el tiempo de inicio de cambios neurogénicos y la intensidad de la respuesta clínica lograda, en contraposición con los niveles periféricos del BDNF. Esto aportaría datos adicionales y consistentes al momento de establecer protocolos de tratamiento antidepresivo, en términos de su potencia y efectividad.
La implementación de las citocinas como biomarcadores de la depresión, aunque es prometedora, tiene menor evidencia que el BDNF y se encuentra en desarrollo. Pese a que algunos estudios encuentran un aumento de ciertas IL, y otros no logran ratificar estos hallazgos, como ocurre con el estudio de Lanquillon y colaboradores (50), es interesante el hallazgo de la IL-6 como un marcador diferencial de respuesta al tratamiento antidepresivo, al plantear que estaría elevada solo en pacientes depresivos que evolucionan hacia la cronicidad o refractariedad.
El reparo que presenta este estudio es que, siendo reciente, haya utilizado como antidepresivo amitriptilina y no un ISRS, como proponen los protocolos actuales. También, es especialmente relevante el estudio de Thomas y su equipo (49) en adultos mayores, el cual plantea como hipótesis que esta población tendría una mayor respuesta inflamatoria y riesgo asociado de depresión. Teniendo en cuenta que para este estudio pueden existir otras variables confundentes (presencia de otros trastornos infamatorios en esta población), fue consistente que los investigadores los precisaran como criterios de exclusión.
Desde la perspectiva de las citocinas como biomarcadores, la depresión se constituye como un trastorno infamatorio, muy próximo a otras enfermedades que alteran el sistema inmune. Faltaría aclarar mejor la interacción del sistema de citocinas y el eje HPA en pacientes deprimidos; sería interesante medir, al mismo tiempo, niveles de cortisol, CRF e interleucinas, pensando en que mostraría un patrón de correlación.
La integración de estas dos vías (BDNF y citocinas) tiene un punto temprano de encuentro en la influencia del estrés sobre la reducción del BDNF, lo cual está más claro; sin embargo, su vía final común no está establecida. Podría representar el impacto de cada una en la función glutamatérgica, lo que requiere estudios adicionales, con el fin de explicar mejor la mediación del glutamato en la patogénesis de la depresión.
En el futuro, el establecimiento de biomarcadores basados en el material genético de cada individuo, con el aporte de la farmacogenética, sería ideal para lograr una precisión diagnóstica y terapéutica mayor, siempre y cuando puedan utilizarse técnicas justificables en términos de costo y efectividad.
Referencias
1. Schildkaut JJ. The catecholamine hypothesis of affective disorders: a review of supporting evidence. Am J Psychiatry. 1965;122:509-22. [ Links ]
2. Bunney WE, Davis J. Norepinephrine in depressive reactions: a review. Arch Gen Psychiatry. 1965;13:483-94. [ Links ]
3. Duman RS, Heninger GR, Nestler EJ. A molecular and cellular theory of depression. Arch Gen Psychiatry. 1997;54:597-606. [ Links ]
4. Belmarker RH, Agam G. Major depressive disorder mechanisms of disease. N Engl J Med. 2008;358:55-68. [ Links ]
5. Willner P. Chronic mild stress (CMS) revisited: consistency and behavioral-neurobiological concordance in the effects of CMS. Neuropsychobiology. 2005;52:90-110. [ Links ]
6. Beck A. The evolution of cognitive model of depression and its neurobiological correlates. Am J Psychiatry. 2008;165:969-77. [ Links ]
7. Rot M, Mathew SJ, Charney DS. Neurobiological mechanisms in major depressive disorder. CMAJ. 2009;180:309-13. [ Links ]
8. Manji H. Depression, III: Treatments. Am J Psychiatry. 2003;160:24. [ Links ]
9. Arias-Carrión O, Olivares-Buñuelos T, Drucker-Colín R. Neurogénesis en el cerebro adulto. Rev Neurol. 2007;44:541-50. [ Links ]
10. Posener JA, Wang L, Price JL, et al. Trazado dimensional del hipocampo en la depresión. Am J Psychiatry. 2003;160:83-9. [ Links ]
11. Ballmaier M, Narr KL, Toga AW, et al. Morfología del hipocampo y distinción entre la depresión de inicio tardío y la depresión de inicio precoz en ancianos. Am J Psychiatry. 2008;165:229-37. [ Links ]
12. Videbech P, Ravnkilde B. Hippocampal volume and depression: a meta-analysis of MRI studies. Am J Psychiatry. 2004;161:1957-66. [ Links ]
13. Campbell S, Marriott M, Nahmias C, et al. Lower hippocampal volume in patients suffering from depression: a meta-analysis. Am J Psychiatry. 2004;161:598-607. [ Links ]
14. Martinowich K, Lu Bai. Interaction between BDNF and Serotonin: role in mood disorders. Neuropsychopharmacology. 2008;33:73-83. [ Links ]
15. Thomas RM, Hotsenpiller G, Peterson DA. Acute psychosocial stress reduces cell survival in adult hippocampal neurogenesis without altering proliferation. J Neurosci. 2007;27:2734-43. [ Links ]
16. Nestler E, Barrot M, Dileone RJ, et al. Neurobiology of depression. Neuron. 2002;34:13-25. [ Links ]
17. Kronfol Z, Remick DG. Cytokines and the brain: implications for clinical psychiatry. Am J Psychiatry. 2000;157:683-94. [ Links ]
18. Hashimoto K. Brain-derived neurotrophic factor as a biomarker for mood disorders: An historical overview and future directions. Psychiatry Clin Neurosci. 2010;64:341-57. [ Links ]
19. Taleisnik S. Receptores celulares y la transmisión de señales. Temas de Biología Celular. Buenos Aires: Editorial Encuentro; 2006. [ Links ]
20. Huang EJ, Reichardt L F. Neurotrophins: roles in neuronal development and function. Annu Rev Neurosci. 2001;24:677-736. [ Links ]
21. Lang UE, Jockers-Scherûbl MC, Hellweg R. State of the art of the neurotrophin hipótesis in psychiatric disorders: implications and limitations. J Neural Transm. 2004;111:387-411. [ Links ]
22. Álamo C, López-Muñoz F, Cuenca E. Contribución de los antidepresivos y estabilizadores del humor al conocimiento de las bases neurobiológicas de los trastornos afectivos. Psiquiatría.Com (revista electronic). 1998;2. ISSN 1137-3148. [ Links ]
23. Monteggia LM, Luikart B, Barrot M, et al. BDNF conditional knockouts show gender differences in depression related behaviors. Biol Psychiatry. 2007;61:187-97. [ Links ]
24. Frodl T, Shûle C, Schmitt G, et al. Association of the brain-derived neurotrophic factor val66met polymorphism with reduced hippocampal volumes in major depression. Arch Gen Psychiatry. 2007;64:410-6. [ Links ]
25. Sheline YI, Gado MH, Kraemer HC. Untreated Depression and hippocampal volume loss. Am J Psychiatry. 2003;160:1516-8. [ Links ]
26. Pittenger C, Duman RS. Stress, depression, and neuroplasticity: a convergence of mechanisms. Neuropsychopharmacology. 2008;33:88-109. [ Links ]
27. Sandi C, Bisaz R. A model for the involvement of neural cell adhesion molecules in stress-related mood disorders. Neuropsychopharmacology. 2007;85:158-76. [ Links ]
28. Russo-Neustadt AA, Alejandre H, García C, et al. Hippocampal brain-derived neurotrophic factor expression following treatment with reboxetine, citalopram, and physical exercise. Neuropsychopharmacology. 2004;29:2189-99. [ Links ]
29. Rantamâki T, Hendolin P, Kankaanpââ A, et al. Pharmacologically diverse antidepressants rapidly activate brain-derived neurotrophic factor receptor TrkB and nduce phospholipase-Cy signaling pathways in mouse brain. Neuropsychopharmacology. 2007;32:2152-62. [ Links ]
30. Molteni R, Calabrese F, Cattaneo A, et al. Acute stress responsiveness of the neurotrophin bdnf in the rat hippocampus is modulated by chronic treatment with the antidepressant duloxetine. Neuropsychopharmacology. 2009;34:1523-32. [ Links ]
31. Castrén E, Rantamâki T. The Role of BDNF and its receptors in depression and antidepressant drug action: reactivation and developmental plasticity. Dev Neurobiol. 2010;70:289-97. [ Links ]
32. Karege F, Perret G, Bondolfi G, et al. Decreased serum brain-derived neurotrophic factor levels in major depressed patients. Psychiatry Res. 2002;109:143-8. [ Links ]
33. Shimizu E, Hashimoto K, Okamura N, et al. Alterations of serum levels of brain-derived neurotrophic factor (BDNF) in depressed patients with or without antidepressants. Biol Psychiatry. 2003;54:70-5. [ Links ]
34. Deveci A, Aydemir O, Taskin O, et al. Serum BDNF levels in suicide attempters related to psychosocial stressors: a comparative study with depression. Neuropsychobiology. 2007;56:93-7. [ Links ]
35. Aydemir O, Deveci A, Taneli F. The effect of chronic antidepressant treatment on serum brain-derived neurotrophic factor levels in depressed patients: a preliminary study. Prog Neuropsychopharmacol Biol Psychiatry. 2005;29:261-5. [ Links ]
36. Gonul AS, Akdeniz F, Taneli F, et al. Effect of treatment on serum brain-derived neurotrophic factor levels in depressed patients. Eur Arch Psychiatry Clin Neurosci. 2005;255:381-6. [ Links ]
37. Sen S, Duman R, Sanacora G. Serum brain-derived neurotrophic factor, depression, and antidepressant medications: meta-analyses and implications. Biol Psychiatry. 2008;64:527-32. [ Links ]
38. Brunoni AR, Lopes M, Fregni F. A systematic review and meta-analysis of clinical studies on major depression and BDNF levels: Implications for the role of neuroplasticity in depression. Int. J. Neuropsychopharmacol. 2008;11:1169-80. [ Links ]
39. Lang UE, Bajbouj M, Gallinat J, et al. Brain-derived neurotrophic factor serum concentrations in depressive patients during vagus nerve stimulation and repetitive transcranial magnetic stimulation. Psychopharmacology. 2006;187:56-9. [ Links ]
40. Godbout JP, Moreau M, Lestage J, et al. Aging exacerbates depresssion-like behavior in mice in response to activation of the peripheral innate inmune system. Neuropsychopharmacology. 2008;33:2341-51. [ Links ]
41. Grassi-Oliveira R, Brietzke E, Pezzi JC, et al. Increased soluble tumor necrosis factor-alpha receptors in patients with major depressive disorder. Psychiatry Clin Neurosci. 2009;63:202-8. [ Links ]
42. Maes M, Meltzer HY, Bosmans E, et al. Increased plasma concentrations of interleukin-6, soluble interleukin-6, soluble interleukin-2 and transferrin receptor in major depression. J Affect Disord. 1995;34:301-9. [ Links ]
43. Maes M. Major depression and activation of the inflammatory response syndrome. Adv Exp Med Biol. 1999;461:25-46. [ Links ]
44. Domenici E, Willé DR, Tozzi F, et al. Plasma protein biomarkers for depression and schizophrenia by multi analyte profiling of case-control collections. Plos One. 2010;5:1-12. [ Links ]
45. Kiecolt-Glaser JK, McGuire L, Robles TR, et al. Emotions, morbidity, and mortality: new perspectives from psychoneuroimmunology. Annu Rev Psychol. 2002;53:83-107. [ Links ]
46. Rothermundt M, Arolt V, Peters M, et al. Inflammatory markers in major depression and melancholia. J Affect Disord. 2001;63:93-102. [ Links ]
47. Schlatter J, Ortuño F, Pla J, et al. Parámetros de inmunidad natural como marcadores biológicos de la depresión. Psiquiatría Biológica. 2006;13:158-66. [ Links ]
48. Yu Y W-Y, Chen T-J, Hong C-J, et al. Association study of the interleukin-1beta (C-511T) genetic polymorphism with major depressive disorder, associated symptomatology, and antidepressant response. Neuropsychopharmacology. 2003;28:1182-5. [ Links ]
49. Thomas AJ, Davis S, Morris C, et al. Increase in interleukin-1b in latelife depression. Am J Psychiatry. 2005;162:175-7. [ Links ]
50. Lanquillon S, Krieg JC, Bening-Abu-Shach U, et al. Cytokine production and treatment response in major depressive disorder. Neuropsychopharmacology. 2000;22:370-9. [ Links ]
51. Schmidt HD, Duman RS. Peripheral BDNF produces antidepressant-like effects in cellular and behavioral models. Neuropsychopharmacology. 2010;10:1-14. [ Links ]