Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.41 no.2 Bogotá Apr./June 2012
Artículos originales
Ana Victoria Valencia Duarte2
Ana Lucía Páez Vila3
Bárbara Kremeyer4
María Patricia Arbeláez Montoya5
Andrés Ruiz Linares6
Carlos Alberto Palacio Acosta7
Jorge Ospina Duque8
Gabriel Bedoya Berrío9
* Este trabajo fue financiado por Colciencias (código 111545921538) y por el CODI-Universidad de Antioquia (código: CIM-E01242). Este artículo se basa en la tesis académica para obtener el título de Doctorado en Epidemiología, 2010, Universidad de Antioquia.
1 Médica psiquiatra, MSc Epidemiología, PhD Epidemiología, profesora del Departamento de Psiquiatría, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
2 Bióloga, MSc Genética, Aspirante PhD en Biología con énfasis en Genética, profesora de la Facultad de Medicina, Universidad Pontificia Bolivariana, Medellín, Colombia.
3 Bióloga, estudiante de MSc en Biología con énfasis en Genética, Laboratorio de Genética Molecular, Universidad de Antioquia, Medellín, Colombia.
4 Bióloga, PhD Genética, Department of Genetics, Evolution and Environment, University College of London.
5 Médica MSc Salud Pública, PhD Epidemiología, profesora del Departamento de Ciencias Básicas, Facultad Nacional de Salud Pública, Universidad de Antioquia, Medellín, Colombia.
6 Médico, PhD Genética, profesor, University College of London.
7 Médico psiquiatra, MSc Epidemiología, profesor del Departamento de Psiquiatría, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
8 Médico Psiquiatra, MSc Epidemiología, profesor del Departamento de Psiquiatría, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia.
9 Biólogo, MSc Bioquímica, profesor, coordinador del Laboratorio de Genética Molecular de la Universidad de Antioquia, Medellín, Colombia.
Correspondencia
Jenny García Valencia
Departamento de Psiquiatría, Facultad de Medicina
Universidad de Antioquia
Calle 64 No. 51D-38
Medellín, Colombia
jennygarcia@medicina.udea.edu.co
Conflictos de interés: Los autores manifiestan que no tienen conflictos de interés en este artículo.
Recibido para evaluación: 23 de enero de 2012 Aceptado para publicación: 15 de mayo de 2012
Resumen
Introducción: El gen NOS1AP codifica para la proteína adaptadora de óxido nítrico sintasa neuronal 1, que posiblemente está implicada en la etiopatogénesis de la esquizofrenia. Objetivos: Determinar si existe asociación de variantes en el gen NOS1AP con esquizofrenia y si estas variantes tienen relación con las dimensiones clínicas del trastorno en población colombiana. Metodología: Es un estudio de casos y controles, con 255 sujetos por grupo. Se tipificaron marcadores dentro del gen NOS1AP y otros informativos de origen genético, con el fin de ajustar por estratificación de la población. Se hizo un análisis factorial de componentes principales de cada uno de los ítems de las escalas de evaluación de síntomas negativos (SANS) y de síntomas positivos (SAPS) para determinar las dimensiones clínicas. Posteriormente, se evaluó la asociación de las variantes genéticas con la esquizofrenia y con cada una de las dimensiones. Resultados: Se encontró asociación entre el genotipo C/C del marcador rs945713 con esquizofrenia (OR = 1,79, IC95%: 1,13-2,84). El genotipo C/C de rs945713 se asoció con puntuaciones más altas en la dimensión "aplanamiento afectivo y alogia" y el genotipo A/A del marcador rs4657181 se relacionó con puntuaciones más bajas en esa misma dimensión. Conclusiones: Se encontró asociación significativa de marcadores dentro de NOS1AP con esquizofrenia y la dimensión clínica "aplanamiento afectivo y alogia". Estos resultados son consistentes con estudios previos y apoyan la posibilidad de que NOS1AP influya en la susceptibilidad a esquizofrenia y que sea un modificador de sus características clínicas.
Palabras clave: Esquizofrenia, NOS1AP, genética.
Abstract
Introduction: The nitric oxide synthase 1 adaptor protein (NOS1AP) gene is possibly implicated in schizophrenia etiopathogenesis. Objective: To determine the association of NOS1AP gene variants with schizophrenia and the relationship of variants with the clinical dimensions of the disorder in the Colombian population. Methodology: It is a case-control study with 255 subjects per group. Markers within the NOS1AP gene were typified as well as other informative material of genetic origin so as to adjust by population stratification. A factorial analysis of the main components for each item in the Scales for Evaluating Negative Symptoms (SENS) together with the Scales for Evaluating Positive Symptoms (SEPS) to determine clinical dimensions. Results: Association between the C/C genotype of the rs945713 marker with schizophrenia (OR = 1.79, 95% CI: 1.13 - 2.84) was found. The C/C genotype of the rs945713 was related to higher scores in the "affective fattening and alogia" dimension; and the A/A genotype of the rs4657181 marker was associated to lower scores in the same dimension. Conclusions: Significant associations of markers inside the NOS1AP gene with schizophrenia and the "affective fattening and alogia" clinical dimension were found. These results are consistent with previous studies and support the possibility that NOS1AP influences schizophrenia susceptibility. Furthermore, NOS1AP might be a modifier of schizophrenia clinical characteristics.
Key words: Schizophrenia, NOS1AP, genetics.
Introducción
La esquizofrenia es un síndrome caracterizado por: 1. distorsiones del pensamiento inferencial (ideas delirantes); 2. alteraciones en la percepción (alucinaciones); 3. lenguaje desorganizado; 4. comportamiento desordenado o catatónico; y 5. restricciones de la intensidad de la expresión emocional (aplanamiento afectivo), la fluidez y la productividad del pensamiento (alogia), o el inicio del comportamiento dirigido a un objetivo (abulia) (1,2). Generalmente, aparece en la adolescencia y la adultez temprana, por lo cual tiene un alto costo socioeconómico y compromete la calidad de vida, no solo de quienes la sufren, sino, también, de sus familiares (3).
Estudios en gemelos han establecido que la genética desempeña un papel importante como factor de riesgo para esquizofrenia (4). Por esto, en los últimos años se ha venido investigando activamente la ubicación de los genes involucrados en su etiología (5,6). Uno de los sitios del genoma que más ha tenido reportes de ligamiento y desequilibrio de ligamiento con esquizofrenia es 1q23 (7-11), el cual fue identificado inicialmente con un LOD score de 6,5, en un grupo de familias canadienses con múltiples afectados por el trastorno (12,13). Allí hay varios genes que podrían influir en la susceptibilidad a la esquizofrenia, entre los cuales está NOS1AP, que codifica para la proteína adaptadora de óxido nítrico sintasa neuronal 1, antes conocida como CAPON (C-terminal PDZ ligando de óxido nítrico sintasa neuronal) (14). Es un gen candidato con alta plausibilidad, porque NOS1AP está involucrada en varios procesos fisiopatológicos que pueden tener relación con esquizofrenia.
Primero, el extremo carboxilo terminal de NOS1AP se une con el dominio PDZ de la óxido nítrico sintasa neuronal (nNOS), que a su vez interactúa con la proteína PSD95. La PSD95 une los receptores de glutamato N-Metil-D-Aspartato (NMDA) a la nNOS, lo que lleva a la producción de óxido nítrico (NO). Los efectos del NO están íntimamente ligados con los receptores NMDA, y el NO puede, a su vez, modular estos receptores. Ha sido implicado en varias formas de plasticidad neuronal, neurotoxicidad, liberación de otros neurotransmisores, elevación de GMPc y respuesta neuronal a la hipoxia (15). NOS1AP compite con la PSD95 por la unión a la nNOS, así inhibe esta enzima y disminuye la formación de NO (16,17). Por tanto, NOS1AP está relacionada con la neurotransmisión del glutamato, el cual está involucrado en la fisiopatología de la esquizofrenia, y se ha sugerido que también en su etiopatogenia (18).
Segundo, NOS1AP también tiene su blanco de nNOS a Dexras 1, que está involucrada en la modulación de la transducción de señal, y de ese modo facilita su activación dependiente de NO (19).
Tercero, el N-terminal de NOS1AP interactúa con las sinapsinas I, II y III, a través de un dominio de fosfotirosina, y así cambia la localización subcelular de la nNOS. Las sinapsinas son de la familia de las fosfoproteínas involucradas en la sinaptogénesis y la regulación de la liberación de neurotransmisores (20). Finalmente, NOS1AP tiene un papel en la regulación de la morfología de las dendritas, y es importante en el desarrollo y la plasticidad neuronal (21).
La plausibilidad de NOS1AP como gen candidato para esquizofrenia también es apoyada por la observación de un aumento de la expresión de su forma corta en las muestras post mórtem de la corteza prefrontal dorsolateral de individuos afectados con este trastorno, en comparación con sujetos normales (22); también, por estudios de asociación de esquizofrenia en familias canadienses y chinas, que han tenido hallazgos positivos con marcadores dentro del gen (7,23). No obstante, en dos estudios realizados en el Reino Unido y China, respectivamente, no se encontró asociación (24-26).
Recientemente, se observó que alelos en ocho polimorfismos en un solo nucleótido (SNPs) dentro del gen NOS1AP, estaban sobretransmitidos en 110 sujetos con esquizofrenia de Antioquia (Colombia) (27). Con el fin de confirmar los hallazgos, se decidió hacer un estudio con un tamaño de muestra más amplio y un diseño de casos y controles clásico, en el cual se ajustara la posible estratificación poblacional empleando marcadores informativos de origen genético. Por consiguiente, el objetivo del presente estudio es determinar si existe asociación entre esquizofrenia y variantes en el gen NOS1AP. Adicionalmente, es importante tener en cuenta que la esquizofrenia está caracterizada por una gran heterogeneidad en su presentación clínica, lo que hace frecuente que dos pacientes con el mismo diagnóstico tengan patrones de síntomas completamente diferentes (28).
Ya que hay estudios familiares y en gemelos que han mostrado concordancia entre hermanos en patrones de síntomas, se ha pensado que la heterogeneidad clínica puede estar dada por factores genéticos (29,30). Por tal razón, también se tratará de establecer si variantes en NOS1AP están asociadas con dicha heterogeneidad. Para esto se emplearán dimensiones clínicas, que son grupos de síntomas que generalmente ocurren juntos y varían cuantitativamente entre los individuos afectados (31). Es probable que cada dimensión refleje distintos procesos etiopatogénicos (32). Generalmente, las dimensiones se establecen por medio de análisis de signos y síntomas tomados de escalas o cuestionarios clínicos (31). Para lograr que las dimensiones den cuenta de una amplia gama de manifestaciones clínicas, se emplearán las escalas de evaluación de síntomas negativos (SANS) y de síntomas positivos (SAPS) (33,34), que tienen la ventaja sobre otras de explorar de forma muy exhaustiva la fenomenología del trastorno (31,35).
Métodos
Es un estudio de casos y controles. Los casos fueron sujetos mayores de 18 años con diagnóstico de esquizofrenia según criterios del DSM-IV-TR (1), que eran atendidos de forma ambulatoria entre 2003 y 2009 en las siguientes instituciones de Antioquia (Colombia): Hospital Universitario San Vicente de Paúl, Hospital Mental de Antioquia y Clínica Samein. Los controles se tomaron a partir de una muestra aleatoria de la población perteneciente al área de influencia de las instituciones hospitalarias de donde se tomaron los casos. Se excluyeron los sujetos que tuvieran retardo mental, epilepsia, antecedentes de trauma encefalocraneano grave, tumores cerebrales o enfermedades neurodegenerativas. Además, los sujetos pertenecientes al grupo control no debían tener antecedente personal ni familiar de trastornos psicóticos. El protocolo de investigación fue aprobado por los comités de ética de todas las instituciones participantes.
Procedimientos clínicos
Selección de casos
Los sujetos que de acuerdo con los registros institucionales tenían diagnóstico de esquizofrenia fueron invitados a participar en la investigación. Previa lectura y firma del consentimiento informado por el participante y su acudiente, un psiquiatra realizó la entrevista diagnóstica para estudios genéticos (DIGS) (36) y aplicó las escalas SAPS y SANS (33,34), y la escala de evaluación de actividad global (EEAG). La calificación en estas escalas se realizó con base en lo presentado por el sujeto durante el mes anterior a la evaluación. El diagnóstico final para determinar la inclusión del sujeto en el estudio se realizó mediante un procedimiento de mejor estimación, consistente en la revisión del DIGS y la historia clínica de cada sujeto, por dos psiquiatras expertos (diferentes a los que hicieron la entrevista). Si no se obtenía consenso diagnóstico, se llamaba a un tercer psiquiatra. Si aun así no se lograba consenso, el sujeto era excluido del estudio.
La muestra de casos consistió inicialmente en 311 sujetos, de los cuales, en el proceso de mejor estimación diagnóstica, se excluyeron 56 por las siguientes razones: comorbilidad con retardo mental en 10 y con epilepsia en 7, y 39 sujetos no llenaban criterios diagnósticos para esquizofrenia, sino para otros trastornos mentales (trastorno psicótico debido a condición médica, trastorno psicótico inducido por sustancias, trastorno bipolar I, trastorno delirante, trastorno obsesivo-compulsivo). En consecuencia, permanecieron en el estudio como casos 255 individuos con esquizofrenia.
Selección de controles
Para tomar el grupo control, se seleccionó una submuestra de 255 sujetos perteneciente a los estratos socioeconómicos bajos y medios (estratos a los que pertenecían los casos) de un estudio poblacional sobre frecuencia de variantes genéticas en Medellín, Antioquia. En dicho estudio, la población de referencia fueron todas las personas mayores de 18 años que viven en la zona urbana de Medellín. El muestreo fue probabilístico, estratificado por conglomerados polietápico. Se estratificó por nivel socioeconómico y se consideraron las manzanas como unidad primaria de muestreo. En la primera etapa se seleccionaron aleatoriamente las manzanas según estrato socioeconómico, en la segunda se seleccionaron sistemáticamente las viviendas de cada manzana y luego al azar a una persona mayor de 18 años de edad. Una vez identificado el sujeto candidato para participar en la investigación, se entregó el consentimiento informado para que fuera leído y firmado. Posteriormente, se aplicó un cuestionario para obtener datos sociodemográficos y de antecedentes psicopatológicos personales y familiares.
Instrumentos para recolección de información
Entrevista diagnóstica para estudios genéticos (DIGS)
Fue desarrollada por el National Institute of Mental Health (NIMH), de Estados Unidos, para estudios genéticos de esquizofrenia y trastornos del estado de ánimo. Proporciona una evaluación detallada de psicosis, trastornos del estado de ánimo y relacionados con sustancias para un diagnóstico diferencial confable. Además, permite registrar minuciosamente información sobre la fenomenología de los trastornos (36). Fue traducida y validada para Colombia y tiene alta confiabilidad prueba-reprueba e interevaluador (37).
Escalas de evaluación de síntomas positivos y síntomas negativos (SAPS y SANS)
Estos son instrumentos complementarios desarrollados por Andreasen y colaboradores para la evaluación de la esquizofrenia, cuyos puntajes se asignan de acuerdo con una entrevista clínica, la revisión del material clínico y la información proporcionada por la familia y los cuidadores del paciente (33,34). La SANS y la SAPS están validadas en Colombia y tienen alta consistencia interna, con un α de Cronbach de la SAPS de 0,81 y de la SANS de 0,94. Además, los altos valores de coeficiente de correlación intraclase (CCI) muestran que tienen alta reproducibilidad interevaluador (CCI de SANS = 0,90; CCI de SAPS = 0,82) y prueba-reprueba (CCI de SANS = 0,95; CCI de SAPS = 0,82) (38).
Escala de evaluación de la actividad global
Evalúa el funcionamiento global de los individuos a lo largo de un continuum entre salud y enfermedad. Consta de una puntuación entre 1 y 100, donde el 1 es el extremo de baja funcionalidad, porque "hay peligro persistente de lesionar gravemente a otro o a sí mismo", y en el 100 hay "una actividad satisfactoria en una amplia gama de actividades, nunca parece superado por los problemas de su vida y es valorado por los demás a causa de sus abundantes cualidades positivas". Fue diseñada por Luborsky en 1962. Una versión modificada está incluida en el DSM-IV-TR, y hace parte del eje V, donde se incluye la opinión del clínico acerca del nivel de funcionamiento de los pacientes (1).
Procedimientos de laboratorio
Tanto en casos como en controles, se tomó una muestra de 8 ml de sangre. Dichas muestras fueron almacenadas posteriormente a 4 ºC, y a partir de estas se extrajo ADN genómico, utilizando el método de fenol-cloroformo (39).
Se tipificaron los siguientes SNPs dentro del gen NOS1AP rs4657181, rs945713, rs4592244, rs108000405 y rs4145621. Todos ellos se encontraron asociados con esquizofrenia en el estudio que hicimos anteriormente con familias nucleares de Antioquia, Colombia (27). Se amplificaron por reacción en cadena de polimerasa (PCR) las regiones de loci NOS1AP que contienen los polimorfismos por evaluar mediante los cebadores correspondientes. Los productos de amplificación se sometieron a digestión con las enzimas pertinentes y los genotipos fueron resueltos en electroforesis en geles de agarosa al 2,5% teñida con bromuro de etidio.
Debido a que se debe hacer corrección por origen genético, se genotipificaron 48 marcadores bialélicos, informativos de origen genético (AIMs; d > 45%), localizados en diferentes cromosomas. La genotipificación de estos marcadores se hizo por el método SNPlex™ Genotyping System, los primeros específicos y las sondas para su detección fueron diseñadas por los proveedores Applied Biosystems. Se estandarizó la genotipificación en 20 muestras controles. Los genotipos fueron resueltos en un analizador genético ABI 3730, y la lectura de los genotipos se realizó utilizando el programa Gene Mapper. Se repitieron el 5% de los genotipos para cada uno de los marcadores en muestras seleccionadas al azar para verificar la reproducibilidad.
Procesamiento de los datos y análisis estadístico
Dos personas diferentes introdujeron por separado, en una base de datos en SPSS versión 15.0, los datos obtenidos de cada evaluación, previa verificación de que los formatos estuvieran completamente diligenciados. Si se encontraba alguna inconsistencia o algún dato incompleto, se hacía la corrección pertinente. Se realizó limpieza de los datos con la evaluación de frecuencias, promedios y distribución en gráficas.
Para describir a los sujetos participantes en el estudio, se utilizaron medidas de tendencia central y de dispersión para variables cuantitativas, y frecuencia y porcentajes para las cualitativas.
Se determinaron las frecuencias alélicas y genotípicas tanto de SNPs en NOS1AP como de los marcadores informativos de origen genético con el programa PLINK, y con el mismo programa se determinó si estaban en equilibrio de Hardy-Weinbergy si había desequilibrio de ligamiento entre marcadores en NOS1AP.
La asociación de esquizofrenia según DSM-IV con los diferentes alelos y genotipos de cada loci se evaluó con χ2, y se calcularon odds ratio (OR) con sus respectivos intervalos de confianza. Se evaluó la posible confusión dada por edad, sexo y origen genético, mediante regresión logística binaria. Previo a la regresión logística, se realizó un análisis de componentes principales con los genotipos de los marcadores informativos de origen genético, con el fin de determinar los dominios dados por estos. Se calcularon puntuaciones factoriales por el método de regresión para el primer dominio, y este se introdujo como covariable en el análisis de regresión logística binaria, tal como es recomendado por Zhang(40).
Para determinar la asociación entre las variantes en NOS1AP y las dimensiones de esquizofrenia, se realizó un análisis factorial de componentes principales, tomando todos los ítems de las escalas SANS y SAPS, las cuales se aplicaron únicamente en el grupo de casos. Se evaluó la pertinencia del análisis factorial mediante inspección visual de la matriz de correlación y la prueba de Kaiser Meyer Olkin. Para la selección de los factores se tuvo en cuenta el criterio gráfico y el de Kaiser (valor propio > 1). Se hizo rotación varimax y se determinaron las variables que cargaban en cada factor con el criterio de Stevens.
Para establecer si el modelo obtenido con el análisis factorial se ajustaba adecuadamente a los datos, se realizó análisis factorial confirmatorio, empleando el software estadístico AMOS versión 6.0. Se utilizaron como índices de bondad de ajuste: el Goodness of Fit Index (GFI), el Comparative Fit Index (CFI) y el Root Mean Square Error of Aproximation (RMSEA). Cuando se estableció el modelo que mejor se ajustaba a los datos, se calcularon las puntuaciones factoriales por el método de regresión. Las puntuaciones factoriales obtenidas para cada dimensión clínica fueron usadas como variables dependientes en un análisis de regresión lineal múltiple. Ya que, de acuerdo con la prueba de Kolmogorov-Smirnov, no tenían distribución normal, se realizó una transformación a percentiles y luego estos se transformaron a valores Z. La variable independiente fue el alelo de cada SNP y se ajustó por duración del trastorno y el tipo y dosis de tratamiento antipsicótico. El tipo de antipsicótico se dividió en típico y atípico, y la dosis se consideró en las categorías "dentro del rango recomendado" y "por debajo de la dosis mínima terapéutica". El punto de corte para la dosis mínima terapéutica se tomó de las recomendaciones publicadas por Woods en 2003 (41). Se hicieron análisis similares para genotipos y para modelar los efectos de dominancia y recesividad de cada locus. Estos análisis se hicieron con el paquete estadístico SPSS 15,0. Para todas las pruebas se utilizó un nivel de significación de 0,05.
Resultados
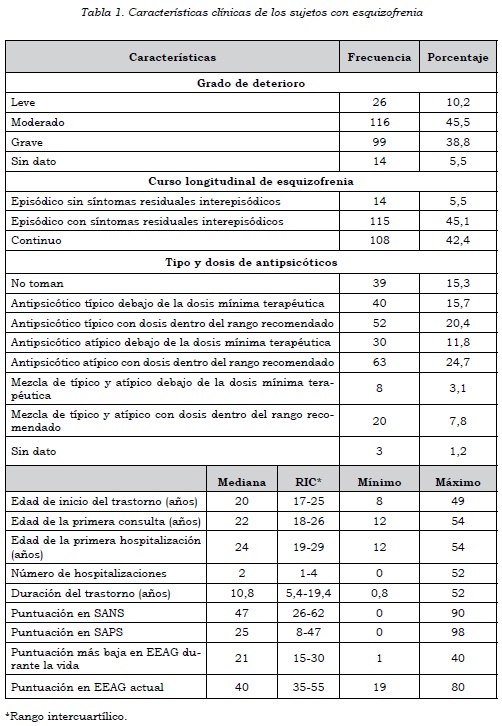
Se tomaron 255 casos y 255 controles. Había diferencias significativas en edad y sexo entre ambos grupos. En los casos había un 77,3% de sujetos de sexo masculino, en comparación con los controles, donde solamente había un 34,9% (p < 0,0001), y la mediana de edad en los casos fue de 33,6 años (rango intercuartílico = 25,2-43,8) y en los controles de 41 años (rango intercuartílico = 30-52) (p < 0,0001). Las características clínicas de los sujetos con esquizofrenia pueden verse en la tabla 1.
De los cinco marcadores ubicados en NOS1AP, únicamente rs945713 y rs4657181 estaban en equilibrio de Hardy-Weinberg, tanto en la muestra total, como en los grupos de caso y control. Ante la falta de equilibrio en los tres marcadores restantes, se decidió que estos fueran excluidos del resto de los análisis. Además, se excluyeron nueve de los 48 marcadores informativos de origen genético por la misma razón.
Análisis de desequilibrio de ligamiento
El desequilibrio de ligamiento entre los marcadores rs945713 y rs4657181 fue bajo, con un D' = 0,26.
Las frecuencias entre los cuatro posibles haplotipos fueron similares (TT = 0,25, CT = 0,16, TA = 0,22 y CA = 0,38). Teniendo en cuenta el bajo desequilibrio de ligamiento entre los dos marcadores, no se hizo análisis de haplotipos.
Pruebas de asociación a esquizofrenia
Se encontró asociación entre el genotipo C/C de rs945713 con esquizofrenia (OR = 1,79, IC 95%: 1,13-2,84). Al ajustar por edad y sexo, el valor del OR no cambió sustancial-mente, lo cual indica que a pesar de las diferencias entre casos y controles en edad y sexo, estas dos variables no fueron de confusión. La asociación siguió siendo significativa después de ajustar por origen genético, empleando las puntuaciones factoriales obtenidas en el análisis de componentes principales. No se encontró asociación entre esquizofrenia y los genotipos del marcador rs4657181. Tampoco se observó asociación del trastorno con cada uno de los alelos en los dos marcadores en NOS1AP (tabla 2).
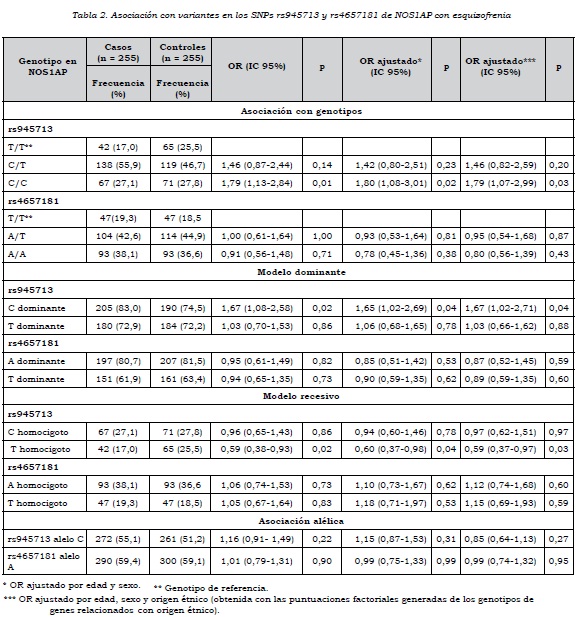
Al evaluar el modelo dominante se observó que la presencia del alelo C en rs945713 como homocigoto o heterocigoto aumenta el riesgo de esquizofrenia, aun después de ajustar por origen genético (tabla 2).
Pruebas de asociación a dimensiones clínicas en sujetos con esquizofrenia
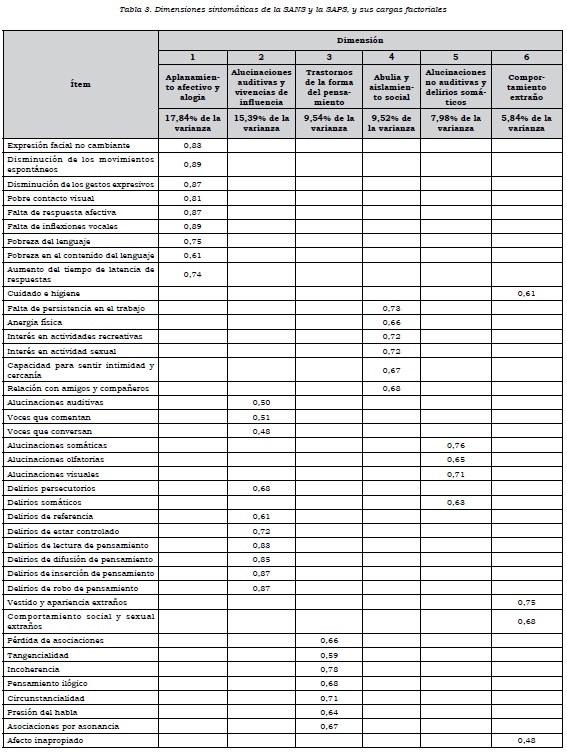
En el análisis factorial de componentes principales se obtuvo un modelo de once dimensiones que explicaba el 71,9% de la varianza, tomando el criterio de un valor propio mayor que 1. En este modelo, las cuatro últimas dimensiones estaban conformadas por un solo ítem: delirios celotípicos, delirios de culpa y pecado, delirios de grandeza y delirios religiosos. Además, varios ítems cargaban en dos o más factores. En el análisis factorial confirmatorio, este modelo de 11 dimensiones no mostró ajuste a los datos. Por ese motivo, se decidió excluir los ítems que estaban aislados en una dimensión y los que cargaban en varias dimensiones, que fueron: bloqueos, inatención social, inatención durante las pruebas del estado mental, delirios celotípicos, delirios de culpa o pecado, delirios de grandeza, delirios religiosos, comportamiento agresivo, comportamiento repetitivo y facilidad de distracción. Al correr el nuevo modelo, se obtuvieron seis dimensiones que explicaron el 66,11% de la varianza, y en el análisis factorial confirmatorio se observó un mejor ajuste, con un GFI de 0,73, un CFI de 0,85 y un RMSEA de 0,08. Las dimensiones fueron:
1. aplanamiento afectivo y alogia, 2.alucinaciones auditivas y vivencias de influencia, 3. trastornos en la forma del pensamiento, 4. abulia y aislamiento social, 5. alucinaciones no auditivas y delirios somáticos, y 6. comportamiento extraño. Los ítems que hacen parte de cada dimensión y sus cargas factoriales pueden verse en la tabla 3.
La duración del trastorno tenía correlación significativa con las puntuaciones factoriales en las dimensiones 1 (r = -0,16, p = 0,01), 3 (r = 0,18, p = 0,005), 4 (r = 0,22, p = 0,001) y 5 (r = 0,14, p = 0,02). Además, se observaron diferencias significativas en las puntuaciones factoriales de la SANS (p = 0,04), la SAPS (p = 0,006) y la dimensión 6 (p = 0,02), dependiendo del tipo y dosis de antipsicótico. Por esta razón, en los análisis de asociación entre las variantes de NOS1AP y las dimensiones, se ajustó por duración del trastorno y el tipo y dosis de antipsicótico.
Se observó que había asociación alélica de rs4657181 con la dimensión "aplanamiento afectivo y alogia", los que presentaban el alelo T tenían una puntuación mayor (p = 0,02) y, por ende, mayor severidad en estos síntomas. No había asociación de las dimensiones con los alelos de rs945713 (tabla 4).
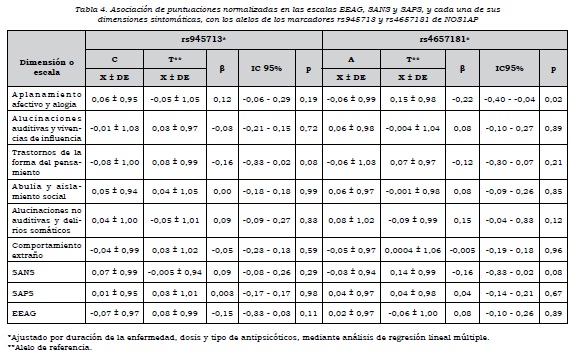
Respecto al análisis por genotipos, se encontró que aquellos que tenían los genotipos C/C y CT de rs945713 tenían un mayor puntaje en la dimensión "aplanamiento afectivo y alogia", en comparación con los que tenían el genotipo T/T. El genotipo CC no alcanzó el nivel de significación estadística, pero el C/T sí, de manera que tener el genotipo C/T en comparación con el T/T aumenta la puntuación normalizada en esta dimensión. Se observó algo similar con la escala SANS, en la cual el heterocigoto tenía mayor puntuación en síntomas negativos que el homocigoto T/T. En cuanto al funcionamiento global de los sujetos, los que tenían los genotipos C/C y CT presentaban un nivel significativamente más bajo en comparación con el genotipo T/T (tabla 5). Por otra parte, el genotipo A/A de rs4657181 se asociaba con una puntuación significativamente menor en la dimensión "aplanamiento afectivo y alogia" (tabla 6).
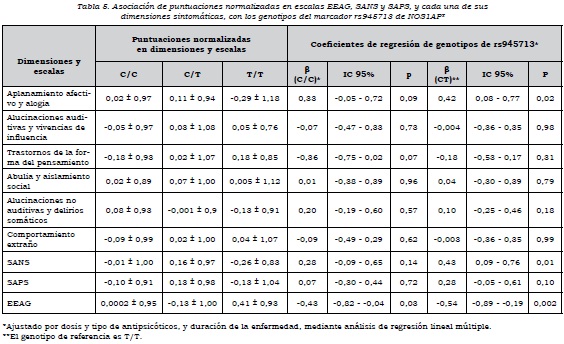
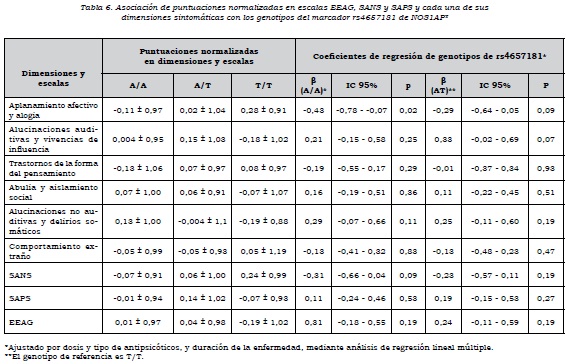
Al analizar el efecto de dominancia sobre las dimensiones, para el marcador rs945713 se encontró asociación del alelo C como dominante con la dimensión "aplanamiento afectivo y alogia" y la escala SANS. Había una mayor puntuación cuando el alelo C estaba presente como homocigoto o heterocigoto, en comparación con el T/T. Además, el alelo C como dominante se asoció con un menor nivel de funcionamiento medido con la escala EEAG (β = 0,39, IC 95%: 0,06-0,73, p = 0,02). Para el marcador rs4657181, el alelo A como dominante estaba asociado con una puntuación significativamente más baja en la dimensión "aplanamiento afectivo y alogia" (β= -0,36, IC 95%: -0,03 a -0,68, p = 0,03).
Discusión
En el presente trabajo se encontró asociación entre el marcador rs945713 con esquizofrenia. Esta asociación es consistente con los hallazgos del estudio que se hizo también en población antioqueña, pero con familias nucleares, en el cual se observó asociación al mismo marcador (27). Sin embargo, no se reprodujo la asociación a rs4657181 que se reportaba en el mismo bloque 1 de desequilibrio de ligamiento, lo cual puede ser explicado por emplear un diseño distinto con un mayor tamaño de muestra. De todos modos, nuestra observación de asociación junto con los reportes en otras poblaciones, el aumento de la expresión del gen en el cerebro de esquizofrénicos y las funciones de la proteína NOS1AP en la neurotransmisión glutamatérgica y el desarrollo dendrítico refuerza este gen como posible implicado en la susceptibilidad a esquizofrenia (7,14,21-23,27).
El SNP rs945713 está localizado en una región no codificante del gen NOS1AP, exactamente en el intrón 2. Esto excluye la posibilidad de que alguna de sus variantes lleve a un cambio de aminoácidos o a una mutación en la proteína. Este SNP podría ejercer su efecto al ser un punto crucial en una región reguladora, de tal manera que una mutación puede causar alteraciones en la expresión de genes. Las alteraciones en la expresión del gen, tanto por sobreexpresión como por la producción de proteína disfuncional, tienen la potencialidad de alterar la producción de NO y las vías de transmisión glutamatérgica, que están involucradas en la fisiopatología de la esquizofrenia (16-18). Otra posibilidad implica que los marcadores estudiados estén en desequilibrio de ligamiento con variantes de susceptibilidad no identificadas, por ejemplo, elementos exónicos o reguladores del gen NOS1AP. Hasta el momento, la única variante funcional reportada en el gen es el alelo A del SNP rs12742393, que es de riesgo para esquizofrenia y causa un aumento significativo en la expresión del gen NOS1AP (42). Es necesario determinar si esa variante funcional confiere riesgo en población colombiana y en otras poblaciones diferentes. Además, ya que NOS1AP es un gen grande, el alelo A del SNP rs12742393 probablemente no es el único polimorfismo funcional dentro de la región. Deben realizarse estudios con un mayor número de marcadores.
Es probable no sea este gen, sino otros genes cercanos que están en desequilibrio de ligamiento con los SNPs utilizados, los que aumenten la susceptibilidad al trastorno. En esta región hay varios genes candidatos, plausibles tanto para esquizofrenia como para sus dimensiones clínicas, como UHMK1, RGS4, MPZ, HSD17BS y SH21B (26,43,44). Además, posiblemente secuencias asociadas con el trastorno en un gen puedan estar alterando la expresión de otro diferente o tales secuencias podrían modificar la expresión de múltiples genes en la región que estén contribuyendo a la susceptibilidad al trastorno (14). Por ello, son necesarios estudios funcionales con estos genes.
Además de que NOS1AP parece ser un gen de susceptibilidad para el síndrome esquizofrénico, nuestros hallazgos sugieren que puede modificar su presentación clínica. Los dos marcadores estudiados se asociaron con la dimensión "aplanamiento afectivo y alogia". Para rs945713, la presencia del alelo C en su forma homo o heterocigota, que también confirió riesgo para la categoría esquizofrenia, se asocia con una mayor puntuación en esa dimensión. Esto es consistente con el puntaje más alto en la totalidad de la escala SANS y el menor funcionamiento global en los que tenían estas variantes. Se sabe que el aplanamiento afectivo y la alogia son parte de los síntomas negativos, y quienes tienen la pobreza de pensamiento que caracteriza la alogia, pueden mostrar un muy bajo desempeño en todas las áreas.
Se ha sugerido que tanto la alo-gia como las dificultades en la expresión del estado de ánimo tienen bases fisiopatológicas relacionadas con alteración en la función de la corteza prefrontal ventrolateral (45). Para el SNP rs4657181, los que presentaban el genotipo A/A tenían una puntuación más baja en "aplanamiento afectivo y alogia", pero, como ya se mencionó, no se encontró asociación de este marcador con la esquizofrenia como categoría. Esto haría pensar que las variantes en este SNP son modificadoras puras, pero no son de susceptibilidad a la esquizofrenia.
Es de resaltar que el análisis factorial separó los síntomas negativos en dos dimensiones: "aplanamiento afectivo y alogia" y "abulia y aislamiento social". Esto ha sido reportado en otros estudios en los que se han analizado la SANS y la SAPS en el nivel de los ítems, y podría sugerir que las bases fisio-patológicas de ambos fenómenos son distintas (35,46). De hecho, en una investigación en la que se compararon pacientes esquizofrénicos provenientes de familias con múltiples afectados con aquellos sin antecedente familiar del trastorno, se observó que los sujetos sin antecedente familiar de esquizofrenia tenían menos síntomas en la dimensión "aplanamiento afectivo y alogia", sin diferencias en la de "anhedonia y disfunción social" (47).
La teoría de una fisiopatogenia diferente para ambas dimensiones podría ser apoyada por el hallazgo del presente estudio de asociación de los dos marcadores estudiados con el "aplanamiento afectivo y alogia", pero no con "abulia y aislamiento social". No obstante, en el estudio anterior con familias nucleares de Antioquia, alelos que fueron sobretransmitidos a los sujetos con esquizofrenia de los marcadores rs6680461 y rs10800405 se asociaban con aumento en la severidad de la dimensión 4: "abulia y aislamiento social" (27). Así, es posible que distintas variantes en NOS1AP modifiquen la presentación de las dos dimensiones de síntomas negativos.
En el estudio se evaluaron los sujetos para determinar las dimensiones clínicas y los niveles de síntomas de forma transversal; se calificaron las escalas con base en el último mes. Esto constituye una limitación, porque se sabe que los niveles de síntomas cambian en el tiempo y hay un efecto de los medicamentos (29). Sin embargo, se trató de controlar haciendo ajustes por la duración del trastorno y el tipo y dosis de antipsicótico. Otra alternativa hubiese sido usar evaluaciones que tuvieran en cuenta la presentación de los síntomas a lo largo de la vida, pero no se hizo de esa manera por la dificultad para cuantificar la severidad con base en lo narrado por el paciente o su familiar.
Es importante anotar que no se puede pensar que en el análisis de dimensiones clínicas se hayan cubierto todos los aspectos sintomáticos del síndrome esquizofrénico; los resultados del análisis factorial dependen del contenido de las escalas que se utilicen, y las dimensiones que empleamos surgieron de la SANS y la SAPS (48). Además, al interpretar los hallazgos de este y otros estudios en los que se empleen dimensiones de síntomas, debe recordarse que los análisis factoriales de características clínicas son útiles para determinar cuáles se presentan concurrentemente, pero eso no prueba que tengan una etiología común.
Conclusión
Se encontró asociación significativa de marcadores dentro de NOS1AP con esquizofrenia y la dimensión clínica "aplanamiento afectivo y alogia". Estos resultados son consistentes con estudios previos y apoyan la posibilidad de que NOS1AP influya en la susceptibilidad a esquizofrenia, y que sea un modificador de sus características clínicas.
Agradecimientos
Agradecemos a todos los pacientes y familiares que participaron en este estudio, al Hospital Universitario San Vicente de Paúl, el Hospital Mental de Antioquia, la Clínica Sameín, la Clínica INSAM y el Centro de Salud Mental de Envigado.
Referencias
1. American Psychiatric Association. Manual diagnóstico y estadístico de trastornos mentales: texto revisado. Washington: Masson; 2000. [ Links ]
2. Organización Mundial de la Salud. CIE-10. Trastornos mentales y del comportamiento. Descripciones clínicas y pautas para el diagnóstico. Madrid: Meditor; 1992. [ Links ]
3. World Health Organization (WHO). The World Health Report 2001. Mental health: new understanding, new hope. Geneva: WHO; 2001. [ Links ]
4. Sullivan PF, Kendler KS, Neale MC. Schizophrenia as a complex trait: evidence from a meta-analysis of twin studies. Arch Gen Psychiatry. 2003;60:1187-92. [ Links ]
5. Gejman PV, Sanders AR, Kendler KS. Genetics of schizophrenia: new findings and challenges. Annu Rev Genomics Hum Genet. 2011;12:121-44. [ Links ]
6. Nothen MM, Nieratschker V, Cichon S, et al. New findings in the genetics of major psychoses. Dialogues Clin Neurosci. 2010;12:85-93. [ Links ]
7. Brzustowicz LM, Simone J, Mohseni Fi, et al. Linkage disequilibrium mapping of schizophrenia susceptibility to the CAPON region of chromosome 1q22. Am J Hum Genet. 2004;74:1057-63. [ Links ]
8. Miranda A, García J, López C, et al. Putative association of the carboxy-terminal PDZ ligand of neuronal nitric oxide synthase gene (CAPON) with schizophrenia in a Colombian popularon. Schizophr Res. 2006;82:283-5. [ Links ]
9. Rosa A, Fananas L, Cuesta MJ, et al. 1q21-q22 locus is associated with susceptibility to the reality-distortion syndrome of schizophrenia spectrum disorders. Am J Med Genet. 2002;114:516-8. [ Links ]
10. Lewis CM, Levinson DF, Wise LH, et al. Genome sean meta-analysis of schizophrenia and bipolar disorder, part II: Schizophrenia. Am J Hum Genet. 2003;73:34-48. [ Links ]
11. Gurling HM, Kalsi G, Brynjolfson J, et al. Genomewide genetic linkage analysis confirms the presence of susceptibility loci for schizophrenia, on chromosomes 1q32.2, 5q33.2, and 8p21-22 and provides support for linkage to schizophrenia, on chromosomes 11q23.3-24 and 20q12.1-11.23. Am J Hum Genet. 2001;68:661-73. [ Links ]
12. Brzustowicz LM, Hayter JE, Hodgkinson KA, et al. Fine mapping of the schizophrenia susceptibility locus on chromosome 1q22. Hum Hered. 2002;54:199-209. [ Links ]
13. Brzustowicz LM, Hodgkinson KA, Chow EW, et al. Location of a major susceptibility locus for familial schizophrenia on chromosome 1q21-q22. Science. 2000;288:678-82. [ Links ]
14. Brzustowicz LM. NOS1AP in schizophrenia. Curr Psychiatry Rep. 2008;10:158-63. [ Links ]
15. Ledo A, Frade J, Barbosa RM, et al. Nitric oxide in brain: diffusion, targets and concentration dynamics in hippo-campal subregions. Mol Asp Med. 2004;25:75-89. [ Links ]
16. Che YH, Tamatani M, Tohyama M. Changes in mRNA for post-synaptic density-95PSD-95/and carboxy-terminal PDZ ligand of neuronal nitric oxide synthase following facial nerve transection. Mol Brain Res. 2000;76:325-35. [ Links ]
17. Jaffrey SR, Snowman AM, Eliasson MJ, et al. CAPON: a protein associated with neuronal nitric oxide synthase that regulates its interactions with PSD95. Neuron. 1998;20:115-24. [ Links ]
18. Bennett M. Positive and negative symptoms in schizophrenia: the NMDA receptor hypofunction hypothesis, neuregulin/ErbB4 and synapse regression. Aust N Z J Psychiatry. 2009;43:711-21. [ Links ]
19. Graham TE, Prossnitz ER, Dorin RI. Dexras1/AGS-1inhibitssignaltransduction from the Gi-coupled formyl peptide receptorto Erk-1/2 MAP kinases. J Biol Chem. 2002;277:10876-82. [ Links ]
20. Chen Q, He G, Wang XY, et al. Positive association between synapsin II and schizophrenia. Biol Psychiatry. 2004;56:177-81. [ Links ]
21. Carrel D, Du X, Komlos D, et al. NO-S1AP regulates dendrite patterning of hippocampal neurons through a carboxypeptidase E-mediated pathway. J Neurosci. 2009;29:8248-58. [ Links ]
22. Xu B, Wratten N, Charych El, et al. Increased expression in dorsolateral prefrontal cortex of CAPON in schizophrenia and bipolar disorder. PLoS Med. 2005;2:e263. [ Links ]
23. ZhengX Li H, Qin W, et al. Association of the carboxyl-terminal PDZ ligand of neuronal nitric oxide synthase gene with schizophrenia in the Chinese Han population. Biochem Biophys Res Commun. 2005;328:809-15. [ Links ]
24. Fang C, Tang W, Tang RQ, et al. Family-based association studies of CAPON and schizophrenia in the Chinese Han population. Prog Neuropsychopharmacol Biol Psychiatry. 2008;32:1210-3. [ Links ]
25. Puri V, McQuillin A, Thirumalai S, et al. Failure to confirm allelic association between markers at the CAPON gene locus and schizophrenia in a British sample. Biol Psychiatry. 2006;59:195-7. [ Links ]
26. Puri V, McQuillin A, Datta S, et al. Confirmation of the genetic association between the U2AF homology motif (UHM) kinase 1 (UHMK1) gene and schizophrenia on chromosome 1 q23.3. Eur J Hum Genet. 2008;16:1275-82. [ Links ]
27. Kremeyer B, García J, Kymalainen H, et al. Evidence for a role of the NOS1AP (CAPON) gene in schizophrenia and its clinical dimensions: an association study in a South American population isolate. Hum Hered. 2009;67:163-73. [ Links ]
28. Tsuang MT, Stone WS, Faraone SV. Toward reformulating the diagnosis of schizophrenia. Am J Psychiatry. 2000;157:1041-50. [ Links ]
29. Fanous AH, Kendler KS. Genetic heterogeneity, modifier genes, and quantitative phenotypes in psychiatric illness: searching for a framework. Mol Psychiatry. 2005;10:6-13. [ Links ]
30. Derosse R, Lencz T, Burdick KE, et al. The genetics of symptom-based phenotypes: toward a molecular classification of schizophrenia. Schizophr Bull. 2008;34:1047-53. [ Links ]
31. Peralta V, Cuesta MJ. How many and which are the psychopathological dimensions in schizophrenia? Issues influencing their ascertainment. Schizophr Res. 2001;49:269-85. [ Links ]
32. Tandon R, Nasrallah HA, Keshavan MS. Schizophrenia, "just the facts" 4. Clinical features and conceptualization. Schizophr Res. 2009;110:1-23. [ Links ]
33. Andreasen NC. Scale for the assessment of positive symptoms (SAPS). lowa: University of lowa; 1984. [ Links ]
34. Andreasen NC. The Scale for the Assessment of Negative Symtoms (SANS): a conceptual and theorical foundations. Br J Psychiatry. 1989;(Suppl):49-58. [ Links ]
35. Peralta V, Cuesta MJ. Dimensional structure of psychotic symptoms: an item-level analysis of SAPS and SANS symptoms in psychotic disorders. Schizophr Res. 1999;38:13-26. [ Links ]
36. Nurnberger Jl, Blehar MC, Kaufmann C, et al. Diagnostic Interview for Genetic Studies: rationales, unique features and training. Arch Gen Psychiatry. 1994;51:849-59. [ Links ]
37. Palacio CA, García J, Arbeláez MR, et al. Validación de la entrevista diagnóstica para estudios genéticos (DIGS) en Colombia. Biomédica. 2004;24:56-62. [ Links ]
38. García J, Palacio CA, Garcés I, et al. Inferencias fenomenológicas y nosológicas en la esquizofrenia a partir de la validación de las escalas de síntomas positivos (SAPS) y de síntomas negativos (SANS) en Colombia. Rev Neuro-Psiquiatría. 2003;66:195-214. [ Links ]
39. Kawasaki ES. Sample preparation from blood, cells and other fluids. En: Innis MA, Gelfand DH, Sninsky JJ, et al. Editors. PCR protocols: A guide to methods and applications. San Diego, CA: Academic Press; 1990. p. 146-52. [ Links ]
40. Zhang S, Zhu X, Zhao H. On a semi-parametric test to detect associations between quantitative traits and candidate genes using unrelated individuals. Gen Epidemiol. 2003;24:44-56. [ Links ]
41. Woods SW. Chlorpromazine equivalent doses for the newer atypical antipsychotics. J Clin Psychiatry. 2003;64:663-7. [ Links ]
42. Wratten NS, Memoli H, Huang Y, et al. Identification of a schizophrenia-associated functional noncoding variant in NOS1AR. Am J Psychiatry. 2009;166:434-41. [ Links ]
43. Puri V, McQuillin A, Choudhury K, et al. Fine mapping by genetic association implicates the chromosome 1q23.3 gene UHMK1, encoding a serme/threonine protein kinase, as a novel schizophrenia susceptibility gene. Biol Psychiatry. 2007;61:873-9. [ Links ]
44. Talkowski ME, Seltman H, Bassett AS, et al. Evaluation of a susceptibility gene for schizophrenia: genotype based meta-analysis of RGS4 polymorphisms from thirteen independent samples. Biol Psychiatry. 2006;60:152-62. [ Links ]
45. Goghari VM, Sponheim SR, Macdonald AW, III. The functional neuroanatomy of symptom dimensions in schizophrenia: a qualitative and quantitative review of a persistent question. Neurosci Biobehav Rev 2010;34:468-86. [ Links ]
46. Toomey R, Kremen WS, Simpson JC, et al. Revisiting the factor structure for positive and negative symptoms: evidence from a large heterogeneous group of psychiatric patients. Am J Psychiatry. 1997;154:371-7. [ Links ]
47. Arajarvi R, Varilo T, Haukka J, et al. Affective flattening and alogia associate with the familial form of schizophrenia. Psychiatry Res. 2006;141:161-72. [ Links ]
48. Jablensky A. Subtyping schizophrenia: implications for genetic research. Mol Psychiatry. 2006;11:815-36. [ Links ]













