Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Psiquiatría
Print version ISSN 0034-7450
rev.colomb.psiquiatr. vol.43 no.2 Bogotá Apr./June 2014
Artículo de revisión
Factores asociados con el declive cognitivo en población menor de 65 años. Una revisión sistemática
Factors Associated with Cognitive Decline in a Population Less than 65 Years Old. A Systematic Review
Daniel Camilo Aguirre-Acevedoa,*, Eliana Henaoa, Victoria Tiradoa, Claudia Muñoza, Diana Giraldo Arangob, Francisco Lopera Restrepoa,c y Fabián Jaimes Barragánc
aGrupo de Neurociencias de Antioquia, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
bFacultad de Psicología, Universidad de San Buenaventura, Medellín, Colombia
cGrupo Académico de Epidemiología Clínica y Departamento de Medicina Interna, Facultad de Medicina, Universidad de Antioquia; Unidad de Investigaciones, Hospital Pablo Tobón Uribe, Medellín, Colombia
*Author para correspondencia. Correo electrónico: agua.dc@gmail.com (D.C. Aguirre-Acevedo). http://dx.doi.org/10.1016/j.rcp.2014.02.009.
Historia del artículo: Recibido el 23 de diciembre de 2013 Aceptado el 24 de febrero de 2014 On-line el 29 de mayo de 2014
Resumen
Introducción: Se ha señalado antes del diagna que el deterioro cognitivo comienza 20 años antes del diagnóstico de la demencia. Además de la edad, diversos factores médicos, socioeconómicos y conductuales pueden estar asociados al declive cognitivo. El objetivo de esta revisión sistemática es resumir la evidencia de factores de riesgo o protectores relacionados con el declive cognitivo en población menor de 65 años.
Métodos: Se realizó una revisión sistemática mediante una estrategia de búsqueda en bases de datos MEDLINE y Embase, incluyendo estudios con diseño longitudinal que analizaran el efecto de factores protectores o de riesgo en el declive cognitivo de población adulta menor de 65 años.
Resultados: Se incluyeron 22 estudios en la presente revisión. Factores como diabetes mellitus, hiperinsulinemia, sobrepeso u obesidad, síndrome metabólico, nivel educativo, actividad física, estimulación cognitiva, estado civil y calidad de la dieta podrían estar relacionados con el declive cognitivo antes de los 65 años.
Conclusiones: Factores de riesgo cardiovasculares y de estilos de vida pueden estar asociados al declive cognitivo en menores de 65 años. Sin embargo, la calidad de la evidencia es baja.
Palabras clave: Deterioro cognitivo, Factores de riesgo, Demencia, Revisión sistemática.
Abstract
Introduction: Cognitive decline could begin 20 years before the diagnosis of dementia. Besides age, several factors related to medical, socioeconomic, and behavioral and genetic condition may be associated with cognitive decline. The aim of this systematic review was to summarize evidence on the risk and protective factors for cognitive decline in people under 65 years old.
Methods: A systematic review was conducted using a search strategy in MEDLINE and Embase, including longitudinal studies to analyze the effect of protective or risk factors on cognitive decline in a population under 65 years old.
Results: A total of 22 studies were included in this review. Factors such as diabetes, hyperinsulinemia, overweight or obesity, metabolic syndrome, education, physical activity, cognitive stimulation, marital status and diet, could be related to cognitive decline before 65 years of age.
Conclusions: Cardiovascular risk factors and lifestyle conditions may be associated with cognitive decline before 65 years of age. However, the quality of the evidence was low.
Keywords: Cognitive decline, Risk factors, Dementia, Systematic review.
Introducción
Se ha señalado que el declive cognitivo comienza 20 años antes del diagnóstico de la demencia1,2. Los individuos con declive cognitivo, a su vez, tienen mayor riesgo de demencia3. Se ha sugerido que factores de riesgo cardiovascular presentes antes de los 65 años estarían asociados con mayor riesgo de demencia4. Más allá del efecto de la edad, la evidencia acerca de la relación entre otros factores de riesgo y el declive cognitivo no es consistente y la calidad de los estudios es escasa5. Por otro lado, estudios transversales6,7 y longitudinales8-11 han indicado que factores cardiovasculares y genéticos podrían estar relacionados con el declive cognitivo antes de los 65 años. Esto es importante, dado que cerca de la mitad de los casos de enfermedad de Alzheimer (EA) podrían ser atribuibles a factores de riesgo cardiovascular presentes varios años antes del diagnóstico12, y se podrían modificar con cambios en los estilos de vida o nuevas terapias preventivas. Aún no existe un tratamiento efectivo que disminuya el declive cognitivo; por esta razón, los estudios sobre factores asociados a dicho declive en población menor de 65 años son importantes por la oportunidad de desarrollar o implementar intervenciones preventivas farmacológicas o no farmacológicas13. No se han reportado revisiones sistemáticas de estudios sobre factores asociados al declive cognitivo en poblaciones diferentes de adultos mayores. Por lo tanto, esta revisión sistemática tiene como objetivo determinar qué factores médicos, sociales o conductuales y genéticos están relacionados con el declive cognitivo en población menor de 65 años.
Material y métodos
Criterios de elegibilidad
Se diseñó un protocolo siguiendo las guías de Cochrane para revisiones sistemáticas y se utilizó la guía de PRISMA14 para el actual reporte de resultados.
Se incluyeron estudios longitudinales realizados en población menor de 65 años que evaluaran las siguientes exposiciones, siguiendo la clasificación propuesta por Plassman en 20103: a) médicos: diabetes mellitus (DM), síndrome metabólico (SM), hipertensión arterial (HTA), accidente cerebrovascular (ACV), hiperlipemia, homocisteína, trastornos del sueño, obesidad/índice de masa corporal (IMC), traumatismo craneoencefálico (TEC), depresión, ansiedad y resiliencia; b) socioeconómicos y del comportamiento: factores en la infancia (residencia rural/urbana y factores ambientales), nivel educativo, ocupación, coeficiente intelectual (CI), tabaquismo, alcohol, apoyo y redes sociales, estado civil y actividad física; c) exposiciones a agentes tóxicos como pesticidas o polución; d) genéticos: APOEε4 y otros potenciales identificados en la búsqueda; e) nutricionales y dietarios: vitamina B, folato, otras vitaminas potenciales identificadas en la búsqueda, gingko-biloba, omega 3, consumo de frutas y vegetales, calorías, hidratos de carbono, grasas y proteínas, y f) medicamentos: estatinas, antihipertensivos, antiinflamatorios, esteroides gonadales, inhibidores de la colinesterasa y memantina.
Se incluyeron estudios en humanos menores de 65 años, de cohortes prospectiva o retrospectiva y que evaluaran como desenlace la medición de una función cognitiva específica o general.
Se excluyeron los estudios realizados en pacientes con condiciones específicas como DM, enfermedad renal, esquizofrenia, síndrome de Down, trastornos psicóticos relacionados con abuso de sustancias, epilepsia y Parkinson, diseños de estudios transversales, desenlaces diferentes de las mediciones cognitivas y resúmenes de congresos donde no se pudiera tener información completa y detallada de las características del estudio.
Fuentes de información y estrategia de búsqueda
Se realizaron búsquedas en bases de datos hasta octubre de 2013; en MEDLINE desde 1966 y en EMBASE desde 1974. La estrategia de búsqueda utilizada fue: cogni* AND (Decline OR impairment) AND Cohort study NOT ((schizophrenia[mesh] OR schizophrenia[all fields] OR "down syndrome"[mesh] OR "down syndrome"[all fields] OR "psychotic disorders"[mesh] OR "psychosis"[all fields] OR "substance-related disorders"[MeSH Terms] OR "substance abuse"[all fields] OR epilepsy[mesh] OR epilepsy[all fields] OR "seizure disorder"[all fields] OR "Parkinson disease"[mesh] OR "Parkinson disease"[all fields]) AND Limits: Humans, Adult: 19-44 years, Middle Aged: 4564 years. En EMBASE la estrategia de búsqueda fue: cogni* AND ('decline'/de OR impairment) AND (cohort OR longitudinal) NOT ('schizophrenia'/de OR Parkinson) AND [adult]/lim AND [humans]/lim.
Procedimientos de selección
La selección y el análisis de los estudios las realizaron en tres etapas cuatro revisores con formación en Neuropsicología (VT, CM, EH, DG) y un bioestadístico con formación en Epidemiología (DC). En la primera etapa, se revisaron los títulos y los resúmenes; en la segunda, los artículos completos y en la tercera, se realizaron la extracción de los datos y la evaluación de la calidad de los artículos elegidos. Llevaron a cabo todas las etapas al menos dos revisores de manera independiente y se verificaron los resultados de cada etapa en reuniones de conjunto. Las discrepancias se resolvieron por consenso y/o por un revisor adicional.
Procedimientos de recolección de la información
Los siguientes datos de los estudios se extrajeron a un formulario prediseñado: número de identificación MED-LINE/Embase, primer año, localización geográfica, diseño, número de participantes, criterios de inclusión/exclusión, edad, sexo, nivel educativo, estado cognitivo basal, factor de riesgo estudiado, desenlace, tiempo desde la evaluación de la exposición hasta la medición final del desenlace, control de variables de confusión, porcentaje de datos perdidos durante el seguimiento y resultados principales/secundarios.
Riesgo de sesgo en los estudios individuales
Dada la heterogeneidad de criterios para evaluar artículos observacionales con diseños longitudinales, y ante la carencia de guías claras sobre estudios de deterioro cognitivo, se adaptó la guía utilizada en la revisión de Plassman3.
Medidas de resumen y síntesis de los datos
Los estudios sobre deterioro cognitivo son heterogéneos con relación a las poblaciones estudiadas, la medición de las exposiciones y los desenlaces que pueden ser categóricos (p. ej., DCL o demencia o estar por encima o por debajo de un punto de corte en la prueba neuropsicológica específica) o continuos usando las puntuaciones brutas o estandarizadas (puntuaciones z). Además, los estudios son heterogéneos con relación a si se midió una función cognitiva específica o en general y con relación a los instrumentos de medición. Por tal razón, en este trabajo no se intentó realizar una síntesis cuantitativa de los resultados.
Resultados
Selección artículos
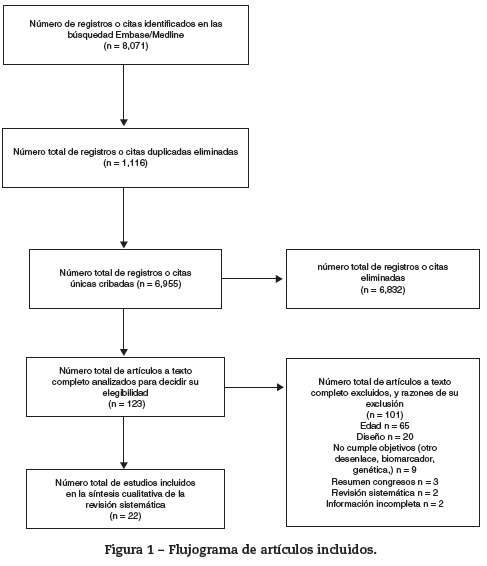
Se identificaron 8.071 registros, 4.163 en MEDLINE y 3.908 en Embase, de los que 1.116 estaban duplicados. Se hizo lectura completa de 123 estudios y, de estos, se inclueron 22 en la revisión (fig. 1).
Características de los estudios
Localización y tiempo de seguimiento
Todos los estudios tenían un diseño longitudinal con al menos dos mediciones de las funciones cognitivas. Los países de origen de las investigaciones son Estados Unidos8,11,15-18, Países Bajos9,10,19-24, Reino Unido25-29 y Australia30,31. La mediana de seguimiento desde la primera hasta la última evaluación cognitiva fue 6 (2-20) años.
Participantes
La mediana de participantes por estudio fue de 2.214 (18011.380). Todos los estudios excepto uno16 provenían de cohortes ensambladas previamente: cuatro estudios de la cohorte ARIC8,11,17,18; cuatro de la Cohorte Whitehall II9,10,23,24; tres del Doetinchem Cohort Study19,21,22; dos del Maastricht Aging Study (MAAS)20,31; dos de la cohorte VISAT28,29; dos de la British 1946 Birth Cohort25,26, uno del Longitudinal Assessment of Ageing in Women30; uno del Study of Women's Health Across the Nation (SWAN)15, y uno de The Medical Research Council National Survey of Health and Development (NSHD)27. La mediana de los promedios de edad en los estudios fue 49,5 (35-60) años; la mediana del porcentaje de mujeres incluidas fue del 51% (23%-61%) y la del porcentaje de escolaridad alta fue del 33,4% (19,4%-58%).
Exposiciones
Se encontraron 12 estudios que evaluaron factores de tipo médico: DM8,18,22, hiperinsulinemia17,HTA8,18, hiperlipemia8, IMC24,28,ACV18, riesgo de ACV9,SM9,18,24, migrña31 y terapia de remplazo hormonal30, y un estudio evaluó el estado de salud general y su interacción con la educación20.Delos factores sociales, económicos o conductuales, los estudios evaluaron el efecto de la educación20, tabaquismo8,18,19,25,27, estado cognitivo en la adolescencia26, actividad laboral en horas laboradas23 y estimulación cognitiva en el trabajo29, estatus socioeconómico10, actividad física21,27 y dieta27.En los factores genéticos, tres estudios evaluaron el efecto de APOE11,16,18.
Desenlaces
Los estudios fueron heterogéneos en cuanto a las pruebas utilizadas para la medición de las funciones cognitivas. Un estudio utilizó el Examen Mental Mínimo (MMSE) como medida general30 y cuatro utilizaron puntuaciones compuestas19,21,22,24. También se utilizaron pruebas que evaluaron memoria verbal32,33, memoria episódica, memoria visual34,35, lenguaje34,36-40, velocidad de procesamiento41,42, velocidad perceptual43, atención44-46, función ejecutiva46-48, habilidades espaciales41,49 y perceptuales50,51 e inteligencia verbal52 y no verbal53.
Riesgo de sesgos en los estudios
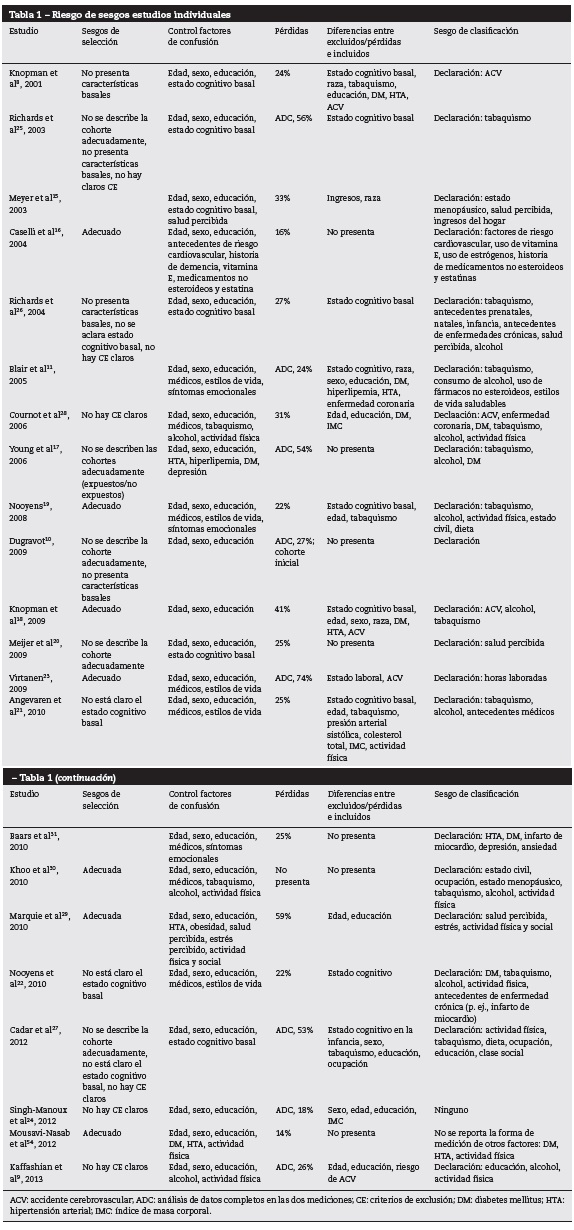
Se encontró potencial riesgo de sesgos de selección en seis estudios9,24-28 y control incompleto de variables de confusión en 178-11,17,19-28,30,31. La mediana de la pérdida de seguimiento fue del 25% (16%-74%) y nueve estudios incluyeron solo a los participantes con información completa en las dos mediciones (basal/final)9-11,17,23-25,27,30.También se presentaron sesgos de clasificación en las exposiciones medidas por declaración espontánea8-11,15-23,25-31,54 (tabla 1).
Medidas de resumen
Los estudios presentan heterogeneidad en la presentación del resultado del declive cognitivo: diferencia de medias absoluta8,11,17,23,27,54, estandarizada19,21,22,26, medición final ajustada por la medición basal20,25, pérdida anual en puntos9,16,18,24,29,31 y de manera categórica como aparición de desenlaces mediante puntos de corte predefinidos10,11,28,30.
Resultados de los estudios individuales
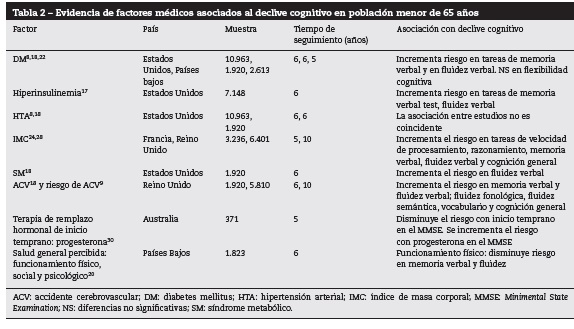
La tabla 2 presenta los resultados generales de la asociación de los factores médicos y el declive cognitivo. Factores como DM8,18,22, hiperinsulinemia17, IMC24,28 ySM9,18 mostraron asociación con el declive en tareas de memoria verbal y lenguaje (fluidez verbal, fluidez fonológica, fluidez semántica y vocabulario). El inicio temprano de la terapia de remplazo30 yun adecuado funcionamiento físico20 tendrían un efecto protector contra el declive cognitivo.
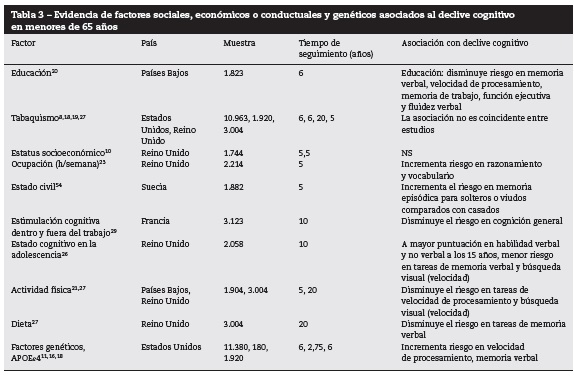
La tabla 3 presenta los resultados generales de la asociación de los factores sociales, económicos o conductuales y el declive cognitivo. Mayor nivel educativo20, mejor nivel cognitivo en la adolescencia26, actividad física21,27, estimulación cognitiva dentro y fuera del trabajo29, estado civil (casado)54 y dieta27 tendrían un efecto protector contra el declive en tareas de memoria verbal, lenguaje, velocidad de procesamiento y función ejecutiva. La APOEε411,16,18 estaría asociada con el declive cognitivo en tareas de memoria verbal, lenguaje, habilidades espaciales y perceptuales y función ejecutiva.
No se encontraron estudios que evaluaran el efecto de los siguientes factores: homocisteína, depresión/ansiedad, TCE, trastornos del sueño, resiliencia, residencia rural/urbana, apoyo y redes sociales, alcohol o exposición a agentes tóxicos.
Discusión
La evidencia sobre factores asociados al declive cognitivo en población menor de 65 años es insuficiente. Hay pocos estudios que concluyan en la relación de factores de riesgo cardiovascular, factores sociales, económicos o comporta-mentales con el declive cognitivo en esta población. Algunas condiciones y antecedentes como la DM, la hiperinsulinemia, la obesidad, el SM, la enfermedad cerebrovascular, la educación, la ocupación, el estado civil y la presencia del polimorfismo APOEε4 estarían asociados con un mayor declive cognitivo en tareas de memoria verbal, velocidad de procesamiento, función ejecutiva, atención, razonamiento y fluidez semántica y fonológica. Otros factores como la terapia de remplazo hormonal, la estimulación cognitiva, la salud física percibida, la actividad física y la calidad de la dieta podrían tener un efecto protector. No se encontraron estudios que evaluaran el efecto en el declive cognitivo antes de los 65 años de otros factores como homocisteína, depresión/ansiedad, TCE, trastornos del sueño, resiliencia, residencia rural/urbana, apoyo y redes sociales, alcohol o exposición a agentes tóxicos. La evidencia sobre el efecto de estos factores en otras poblaciones de estudio de más edad tampoco ha sido concluyente5.
A pesar de la escasa evidencia en población menor de 65 años, estudios recientes han mostrado la relación entre factores de riesgo cardiovascular evaluados en la etapa adulta joven o de mediana edad y el deterioro cognitivo
o la demencia presentes en la etapa de adultos mayores (>65 años). Estos estudios muestran que factores de riesgo como DM55,56, obesidad24,55-57, HTA55,58, altas concentraciones de colesterol56,58, escasa actividad física55 y tabaquismo58 aumentan el riesgo de declive cognitivo o demencia. Hay varias razones potenciales de que la evidencia del declive cognitivo en población menor de 65 años sea escasa o no concluyente; algunas de ellas se han discutido previamente en el contexto metodológico de la investigación sobre factores de riesgo en esta condición59-61. Las características reales de la población en riesgo, o los sesgos de selección, estaban presentes o no se pudo evaluarlas en algunos estudios debido a la falta de claridad en los criterios de exclusión, la inadecuada descripción de las cohortes y la carencia de información acerca del estado cognitivo inicial y otras características basales. El sesgo de supervivencia también pudo darse en numerosos estudios, dado que las pérdidas de seguimiento estuvieron en entre el 14 y el 74%. Este efecto del «desgaste» de la cohorte presente en los estudios de declive cognitivo se ha estudiado anteriormente62-66 y se constituye en una importante debilidad metodológica; dado que se ha demostrado que los participantes que se retiran del estudio tienen un nivel cognitivo menor, menos educación, peor estado de salud (mayor frecuencia de factores de riesgo cardiovasculares), mayor frecuencia de tabaquismo y menos actividad física que los que terminan67-69, lo que subestimaría el declive cognitivo observado en la cohorte. Del mismo modo, se reportan estudios cuyos análisis fueron realizados únicamente con los participantes con información completa en las dos mediciones (basal/final) y que igualmente tenían mejor desempeño cognitivo basal o mejor estado de salud que los que no fueron incluidos. Los métodos de selección de los participantes también pueden estar asociados con las características demográficas y el nivel cognitivo basal, como apunta un estudio reciente70, en el que los participantes provenientes de una muestra seleccionada por conveniencia tenían mejor rendimiento cognitivo, más educación, mayor probabilidad de estar casado y menor probabilidad de historia familiar de demencia que aquellos cuya selección fue probabilística.
Por otro lado, la medición de la función cognitiva es un proceso complejo y con múltiples miradas potenciales. Algunos estudios utilizan medidas compuestas y otros, medidas de funciones cognitivas específicas, con variables continuas o categóricas. Las pruebas neuropsicológicas empleadas para el diagnóstico, la clasificación y el seguimiento de la demencia presentan efectos piso y techo en los extremos de menor y mayor expresión de manifestaciones clínicas y pueden no ser sensibles al declive cognitivo, es decir, ser incapaces de detectarlo, en periodos preclínicos. La utilización de puntuaciones compuestas59 puede ser útil para reducir los problemas de efecto piso o techo y el efecto del aprendizaje71. Sin embargo, la construcción de estas puntuaciones no es simple y pueden existir varias versiones o modelos; por ejemplo, en algunos casos se utiliza la suma ponderada o no ponderada de las pruebas que conforman la batería neuropsicológica.
Esta revisión tiene varias limitaciones: nuestro objetivo era establecer un declive cognitivo y sus factores asociados antes de los 65 años. Por lo tanto, no se incluyeron estudios que midieran la exposición antes de los 65 años, pero los desenlaces se midieron hasta la etapa adulta mayor. Dichos estudios muestran que la exposición a factores relacionados con estilos de vida, factores de riesgo cardiovascular o APOEε4 incrementan el riesgo de declive cognitivo, deterioro cognitivo leve o demencia después de los 65 años. Estos estudios se habrían podido incluir si se asume que la pérdida cognitiva es lineal, es decir, constante a través de los años. Sin embargo, hay alguna evidencia de que dicha pérdida no es constante72,73 y que la velocidad del deterioro cognitivo puede cambiar años antes de presentarse los síntomas claros de demencia. Otra limitación estaría relacionada con un posible sesgo de publicación al no consultar otras fuentes como literatura gris, trabajos presentados en eventos o contacto con los autores.
Conclusiones
Algunos factores de riesgo relacionados con la salud cardiovascular y los estilos de vida pueden estar asociados al declive cognitivo en menores de 65 años. Sin embargo, se encontraron pocos estudios con diseño y conducción adecuados para sustentar la evidencia de cada uno de los factores reportados en la literatura. Entender cómo estos factores influyen en el riesgo de declive cognitivo es importante para intentar reducir el riesgo de demencia en la etapa adulta. Los estudios futuros se deben realizar considerando las limitaciones metodológicas que no permiten estimar el efecto subyacente de los factores protectores o de riesgo del declive cognitivo en la población general.
Financiación
Este estudio fue financiado por el comité para el desarrollo de la investigación. CODI-Proyecto: Tasa de pérdida cognitiva en la enfermedad de Alzheimer familiar por mutación E280A en PS1: Estudio longitudinal 1995-2013 Antioquia. Colombia, mediana Cuantía 2011-Universidad de Antioquia acta 609, Agosto de 2011. Beca programa doctorados nacionales No. 528 año 2011, Departamento Administrativo de Ciencia, Tecnología e Innovación, Colciencias.
Conflicto de intereses
Los autores manifiestan que no tienen conflictos de intereses en este artículo.
Bibliografía
1. Elias MF, Beiser A, Wolf PA, Au R, White RF, D'Agostino RB. The preclinical phase of alzheimer disease: A 22-year prospective study of the Framingham Cohort. Arch Neurol. 2000;57:808-13. [ Links ]
2. Singh-Manoux A, Kivimaki M, Glymour MM, Elbaz A, Berr C, Ebmeier KP, et al. Timing of onset of cognitive decline: results from Whitehall II prospective cohort study. BMJ. 2012;344:d7622. [ Links ]
3. Williams JW, Plassman BL, Burke J, Benjamin S. Preventing Alzheimer's disease and cognitive decline. Evid Rep Technol Assess (Full Rep). 2010;193:1-727. [ Links ]
4. Whitmer RA, Sidney S, Selby J, Johnston SC, Yaffe K. Midlife cardiovascular risk factors and risk of dementia in late life. Neurology. 2005;64:277-81. [ Links ]
5. Plassman BL, Williams JW, Burke JR, Holsinger T, Benjamin S. Systematic review: factors associated with risk for and possible prevention of cognitive decline in later life. Ann Intern Med. 2010;153:182-93. [ Links ]
6. Joosten H, Van Eersel ME, Gansevoort RT, Bilo HJ, Slaets JP, Izaks GJ. Cardiovascular risk profile and cognitive function in young, middle-aged, and elderly subjects. Stroke. 2013;44:1543-9. [ Links ]
7. Sabia S, Kivimaki M, Shipley MJ, Marmot MG, Singh-Manoux A. Body mass index over the adult life course and cognition in late midlife: the Whitehall II Cohort Study. Am J Clin Nutr. 2009;89:601-7. [ Links ]
8. Knopman D, Boland LL, Mosley T, Howard G, Liao D, Szklo M, et al. Cardiovascular risk factors and cognitive decline in middle-aged adults. Neurology. 2001;56:42-8. [ Links ]
9. Kaffashian S, Dugravot A, Brunner EJ, Sabia S, Ankri J, Kivimaki M, et al. Midlife stroke risk and cognitive decline: A 10-year follow-up of the Whitehall II cohort study. Alzheimers Dement. 2013;9:572-9. [ Links ]
10. Dugravot A, Gueguen A, Kivimaki M, Vahtera J, Shipley M, Marmot MG, et al. Socioeconomic position and cognitive decline using data from two waves: what is the role of the wave 1 cognitive measure. J Epidemiol Community Health. 2009;63:675-80. [ Links ]
11. Blair CK, Folsom AR, Knopman DS, Bray MS, Mosley TH, Boerwinkle E, et al. APOE genotype and cognitive decline in a middle-aged cohort. Neurology. 2005;64:268-76. [ Links ]
12. Barnes DE, Yaffe K. The projected effect of risk factor reduction on Alzheimer's disease prevalence. Lancet Neurol. 2011;10:819-28. [ Links ]
13. Gorelick PB, Scuteri A, Black SE, Decarli C, Greenberg SM, Iadecola C, et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 2011;42:2672-713. [ Links ]
14. Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gotzsche PC, Ioannidis JP, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. Ann Intern Med. 2009;151:W65-94. [ Links ]
15. Meyer PM, Powell LH, Wilson RS, Everson-Rose SA, Kravitz HM, Luborsky JL, et al. A population-based longitudinal study of cognitive functioning in the menopausal transition. Neurology. 2003;61:801-6. [ Links ]
16. Caselli RJ, Reiman EM, Osborne D, Hentz JG, Baxter LC, Hernandez JL, et al. Longitudinal changes in cognition and behavior in asymptomatic carriers of the APOE e4 allele. Neurology. 2004;62:1990-5. [ Links ]
17. Young SE, Mainous 3rd AG, Carnemolla M. Hyperinsulinemia and cognitive decline in a middle-aged cohort. Diabetes Care. 2006;29:2688-93. [ Links ]
18. Knopman DS, Mosley TH, Catellier DJ, Coker LH. Fourteen-year longitudinal study of vascular risk factors, APOE genotype, and cognition: the ARIC MRI Study. Alzheimers Dement. 2009;5:207-14. [ Links ]
19. Nooyens AC, Van Gelder BM, Verschuren WM. Smoking and cognitive decline among middle-aged men and women: the Doetinchem Cohort Study. Am J Public Health. 2008;98:2244-50. [ Links ]
20. Meijer WA, Van Boxtel MP, Van Gerven PW, Van Hooren SA, Jolles J. Interaction effects of education and health status on cognitive change: a 6-year follow-up of the Maastricht Aging Study. Aging Ment Health. 2009;13:521-9. [ Links ]
21. Angevaren M, Vanhees L, Nooyens AC, Wendel-Vos CG, Verschuren WM. Physical activity and 5-year cognitive decline in the Doetinchem cohort study. Ann Epidemiol. 2010;20:473-9. [ Links ]
22. Nooyens AC, Baan CA, Spijkerman AM. Verschuren WM. Type 2 diabetes and cognitive decline in middle-aged men and women: the Doetinchem Cohort Study. Diabetes Care. 2010;33:1964-9. [ Links ]
23. Virtanen M, Singh-Manoux A, Ferrie JE, Gimeno D, Marmot MG, Elovainio M, et al. Long working hours and cognitive function: the Whitehall II Study. Am J Epidemiol. 2009;169:596-605. [ Links ]
24. Singh-Manoux A, Czernichow S, Elbaz A, Dugravot A, Sabia S, Hagger-Johnson G, et al. Obesity phenotypes in midlife and cognition in early old age: the Whitehall II cohort study. Neurology. 2012;79:755-62. [ Links ]
25. Richards M, Jarvis MJ, Thompson N, Wadsworth ME. Cigarette smoking and cognitive decline in midlife: evidence from a prospective birth cohort study. Am J Public Health. 2003;93:994-8. [ Links ]
26. Richards M, Shipley B, Fuhrer R, Wadsworth ME. Cognitive ability in childhood and cognitive decline in mid-life: longitudinal birth cohort study. BMJ. 2004;328: 552. [ Links ]
27. Cadar D, Pikhart H, Mishra G, Stephen A, Kuh D, Richards M. The role of lifestyle behaviors on 20-year cognitive decline. J Aging Res. 2012;2012:304014. [ Links ]
28. Cournot M, Marquie JC, Ansiau D, Martinaud C, Fonds H, Ferrieres J, et al. Relation between body mass index and cognitive function in healthy middle-aged men and women. Neurology. 2006;67:1208-14. [ Links ]
29. Marquie JC, Duarte LR, Bessieres P, Dalm C, Gentil C, Ruidavets JB. Higher mental stimulation at work is associated with improved cognitive functioning in both young and older workers. Ergonomics. 2010;53:1287-301. [ Links ]
30. Khoo SK, O'Neill S, Byrne G, King R, Travers C, Tripcony L. Postmenopausal hormone therapy and cognition: effects of timing and treatment type. Climacteric. 2010;13:259-64. [ Links ]
31. Baars MA, Van Boxtel MP, Jolles J. Migraine does not affect cognitive decline: results from the Maastricht aging study. Headache. 2010;50:176-84. [ Links ]
32. Knopman DS, Ryberg S. A verbal memory test with high predictive accuracy for dementia of the Alzheimer type. Arch Neurol. 1989;46:141-5. [ Links ]
33. Van der Elst W, Van Boxtel MP, Van Breukelen GJ, Jolles J. Rey's verbal learning test: normative data for 1855 healthy participants aged 24-81 years and the influence of age, sex, education, and mode of presentation. J Int Neuropsychol Soc. 2005;11:290-302. [ Links ]
34. Lezak MD. Neuropsychological assessment. Oxford: Oxford University Press; 1995. [ Links ]
35. Sivan AB. Benton visual retention test. New York: Psychological Corporation; 1992. [ Links ]
36. Grober E, Buschke H. Genuine memory deficits in dementia. Developmental Neuropsychology. 1987;3:13-36. [ Links ]
37. Kaplan E, Goodglass H, Weintraub S, Segal O, Van Loon-Vervoorn A. Boston naming test. Boston: Pro-ed; 2001. [ Links ]
38. Benton AL, Hamsher KD, Sivan AB. Multilingual aphasia examination: manual of instructions. Washington: AJA; 1994. [ Links ]
39. De Renzi A, Vignolo LA. Token test: A sensitive test to detect receptive disturbances in aphasics. Brain. 1962. [ Links ]
40. Borkowski JG, Benton AL, Spreen O. Word fluency and brain damage. Neuropsychologia. 1967;5:135-40. [ Links ]
41. Wechsler D. Wechsler adult intelligence scale-revised. New York: Psychological Corporation; 1981. [ Links ]
42. Vink M, Jolles J. A new version of the Trail-Making Test as an information processing task. J Clin Neuropsychol. 1985;7:162. [ Links ]
43. Smith A. Symbol Digit Modalities Test: Manual. Western Psychological Services;. 1995. [ Links ]
44. Van der Elst W, Van Boxtel MP, Van Breukelen GJ, Jolles J. The Stroop color-word test: influence of age, sex, and education; and normative data for a large sample across the adult age range. Assessment. 2006;13:62-79. [ Links ]
45. Van der Elst W, Van Boxtel MP, Van Breukelen GJ, Jolles J. The Letter Digit Substitution Test: normative data for 1,858 healthy participants aged 24-81 from the Maastricht Aging Study (MAAS): influence of age, education, and sex. J Clin Exp Neuropsychol. 2006;28:998-1009. [ Links ]
46. Stroop JR. Studies of interference in serial verbal reactions. J Exper Psychol. 1935;18:643. [ Links ]
47. Heaton RK. Wisconsin Card Sorting Test manual. Odessa: Psychological Assessment Resources; 1993. [ Links ]
48. Gronwall D. Paced auditory serial-addition task: a measure of recovery from concussion. Perceptual and Motor Skills. 1977;44:367-73. [ Links ]
49. Osterrieth PA. Le test de copie d'une figure complexe; contribution a l'etude de la perception et de la memoire. Archives de Psychologie. 1944. [ Links ]
50. Benton A, Van Allen M. Impairment in facial recognition in patients with cerebral disease. Cortex. 1968;4:344-51. [ Links ]
51. Benton AL, Varney NR, Hamsher KD. Visuospatial judgment: A clinical test. Arch Neurol. 1978;35:364. [ Links ]
52. Raven JC. Guide to using the Mill Hill Vocabulary Scale with the Progressive Matrices Scales. 1958. [ Links ]
53. Heim A. The AH4 group test of intelligence. Windsor: NFER-Nelson; 1970. [ Links ]
54. Mousavi-Nasab SM, Kormi-Nouri R, Sundstrom A, Nilsson LG. The effects of marital status on episodic and semantic memory in healthy middle-aged and old individuals. Scand J Psychol. 2012;53:1-8. [ Links ]
55. Virta JJ, Heikkila K, Perola M, Koskenvuo M, Raiha I, Rinne JO, et al. Midlife cardiovascular risk factors and late cognitive impairment. Eur J Epidemiol. 2013;28:405-16. [ Links ]
56. Strand BH, Langballe EM, Hjellvik V, Handal M, Naess O, Knudsen GP, et al. Midlife vascular risk factors and their association with dementia deaths: results from a Norwegian prospective study followed up for 35 years. J Neurol Sci. 2013;324:124-30. [ Links ]
57. Dahl AK, Hassing LB, Fransson EI, Gatz M, Reynolds CA, Pedersen NL. Body mass index across midlife and cognitive change in late life. Int J Obes (Lond). 2013;37:296-302. [ Links ]
58. Alonso A, Jacobs Jr DR, Menotti A, Nissinen A, Dontas A, Kafatos A, et al. Cardiovascular risk factors and dementia mortality: 40 years of follow-up in the Seven Countries Study. J Neurol Sci. 2009;280:79-83. [ Links ]
59. Morris MC, Evans DA, Hebert LE, Bienias JL. Methodological issues in the study of cognitive decline. Am J Epidemiol. 1999;149:789-93. [ Links ]
60. Coley N, Andrieu S, Gardette V, Gillette-Guyonnet S, Sanz C, Vellas B, et al. Dementia prevention: methodological explanations for inconsistent results. Epidemiol Rev. 2008;30:35-66. [ Links ]
61. Qiu C, Winblad B, Fratiglioni L. The age-dependent relation of blood pressure to cognitive function and dementia. Lancet Neurol. 2005;4:487-99. [ Links ]
62. Palmer RF, Royall DR. Missing data? Plan on it! J Am Geriatr Soc. 2010;58 Suppl 2:S343-8. [ Links ]
63. Hardy SE, Allore H, Studenski SA. Missing data: a special challenge in aging research. J Am Geriatr Soc. 2009;57:722-9. [ Links ]
64. Di Bari M, Williamson J, Pahor M. Missing-data in epidemiological studies of age-associated cognitive decline. J Am Geriatr Soc. 1999;47:1380-1. [ Links ]
65. Chatfield MD, Brayne CE, Matthews FE. A systematic literature review of attrition between waves in longitudinal studies in the elderly shows a consistent pattern of dropout between differing studies. J Clin Epidemiol. 2005;58:13-9. [ Links ]
66. Jacova C, Hsiung GY, Feldman HH. Dropouts and refusals in observational studies: lessons for prevention trials. Neurology. 2006;67 9 Suppl 3:S17-20. [ Links ]
67. Van Beijsterveldt CE, Van Boxtel MP, Bosma H, Houx PJ, Buntinx F, Jolles J. Predictors of attrition in a longitudinal cognitive aging study: the Maastricht Aging Study (MAAS). J Clin Epidemiol. 2002;55:216-23. [ Links ]
68. Salthouse TA. Selectivity of attrition in longitudinal studies of cognitive functioning. J Gerontol B Psychol Sci Soc Sci. 2013 [Epub ahead of print] [ Links ].
69. Weuve J, Tchetgen Tchetgen EJ, Glymour MM, Beck TL, Aggarwal NT, Wilson RS, et al. Accounting for bias due to selective attrition: the example of smoking and cognitive decline. Epidemiology. 2012;23:119-28. [ Links ]
70. Brodaty H, Mothakunnel A, De Vel-Palumbo M, Ames D, Ellis KA, Reppermund S, et al. Influence of population versus convenience sampling on sample characteristics in studies of cognitive aging. Ann Epidemiol. 2014;24:63-71. [ Links ]
71. Duff K, Callister C, Dennett K, Tometich D. Practice effects: a unique cognitive variable. Clin Neuropsychol. 2012;26:1117-27. [ Links ]
72. Hall CB, Lipton RB, Sliwinski M, Stewart WF. A change point model for estimating the onset of cognitive decline in preclinical Alzheimer's disease. Stat Med. 2000;19: 1555-66. [ Links ]
73. Terrera GM, Matthews F, Brayne C. A comparison of parametric models for the investigation of the shape of cognitive change in the older population. BMC Neurol. 2008;8:16. [ Links ]