Introducción
El carbonato de litio sigue siendo un fármaco de elección para el trastorno bipolar. La investigación ha demostrado su utilidad para el tratamiento agudo y de mantenimiento de episodios maniacos, y como agente potenciador para las manifestaciones depresivas1, independientemente de su utilización en otro tipo de alteraciones psiquiátricas2. El término litio deriva del griego y significa «piedra», fue descubierto en un mineral, tiene asignado el número atómico 3 y su densidad es menor que la del agua. Es un elemento químico con el símbolo Li, pertenece al grupo de los metales alcalinos, es univalente y muy reactivo y se encuentra catalogado dentro del grupo Ia de la tabla periódica de los elementos. En forma de polvo, comparte características químicas con el sodio y el potasio3.
En 1949 se reportó su efecto antimaniaco, pero hasta 1970 no lo aprobó la Food and Drugs Administration de Estados Unidos; 4 años después, se autorizó su uso para la prevención de las recaídas de este trastorno4-6. Según algunos estudios, aproximadamente el 30 y el 60% de los pacientes presentarán, respectivamente, una respuesta al litio completa o parcial7-9.
En un metanalisis publicado en 200510, se documentó que la incidencia anual de la prescripción de litio a pacientes con trastornos del estado de ánimo era del orden de 0,1/1.000, similar a lo encontrado en 1999 por Timmer11 y en 2001 por Manji12; sin embargo, una publicación de 200813 establece que la incidencia anual de prescripción en Países Bajos fue de 0,2/1.000 pacientes psiquiátricos, pero los autores no especifican las causas de la administración. Cerca del 90% de los pacientes sufrirán efectos secundarios del tratamiento14. Considerando la relevancia de este tema en la práctica psiquiátrica cotidiana, se consideró importante revisar este tópico.
El objetivo central de este trabajo es documentar las alteraciones endocrinas más frecuentemente asociadas a la prescripción y sus bases fisiopatológicas. Para cumplir con este objetivo, se dividió este trabajo en 3 apartados. El primero aborda aspectos muy generales referentes a la farmacocinética y la farmacodinámica de este producto, ejercicio que no se considera innecesario, ya que estos aspectos han permitido entender algunos de los efectos adversos y favorables de este producto.
En segundo término, se establece una aproximación a los efectos adversos endocrinos, punto central de este trabajo, haciendo énfasis en las enfermedades que están más documentadas en la literatura y abordando los aspectos fisiopatológicos subyacentes.
Como tercer aspecto, y con el propósito de ir más allá de una descripción, se proponen, con base en la evidencia científica, los estudios de laboratorio y gabinete que idealmente se debe solicitar a través de una línea de tiempo, con la finalidad de identificar oportunamente alguna alteración endocrina derivada de la prescripción.
En ese mismo apartado se describen brevemente algunas recomendaciones farmacológicas hechas por expertos que se pudo documentar, ante la evidencia de alteraciones endocrinas secundarias. Los autores de este proyecto estiman pertinente comentar que el tercer apartado del objetivo central no pretende constituirse como un algoritmo de tratamiento. Tampoco es un objetivo de este proyecto abordar temas como usos clínicos u otras reacciones adversas, como tampoco las contraindicaciones.
Metodología de búsqueda
Según la práctica basada en evidencias, se efectuó una búsqueda computarizada de información utilizando la estrategia PICO. Se describieron todos los componentes relacionados con el problema identificado y se estructuró la pregunta de investigación: ¿Cuáles son las alteraciones endocrinas más sobresalientes que se producen por el uso de litio y cuáles son las bases fisiopatológicas propuestas hasta el momento, tomando en cuenta los órganos blanco involucrados?
Las bases de datos electrónicas utilizadas son Science index, PubMed y EMBASE, aunque también se empleó PsycInfo y Scopus, y se manejaron los operadores boleanos AND, NOT, OR con los que se realizaron combinaciones de palabras con términos acordes con el Medical Subject Headings. Los descriptores empleados fueron litio, carbonato de litio, efectos adversos, enfermedades del sistema endocrino, fisiopatología, farmacocinética, farmacodinamia, prescripción. Los criterios de carácter cualitativo para seleccionar el material fueron: a) editoriales, artículos originales, revisiones, revisiones sistemáticas y metanálisis publicados de 1980 a 2014 o años anteriores; b) idioma inglés o español, y c) trabajos con metodología científica y editoriales con aportaciones concretas. Se excluyeron trabajos que repetían información o con evidentes sesgos metodológicos. Se seleccionaron finalmente 102 referencias, en función de su relevancia y aportación teórica o práctica. Artículos de las décadas anteriores a 1980 se consideraron solamente si eran contribuciones que continuaban siendo citadas, y que se apegaban igualmente a los criterios establecidos.
Farmacocinética y farmacodinámica
El litio tiende a alcanzar concentraciones homogéneas en los diferentes espacios de distribución, a excepción del líquido cefalorraquídeo. No se une a proteínas plasmáticas, presenta una vida media de 20 h en el adulto, logra el equilibrio tras 5-7 días de su consumo regular, y cuando la administración cesa, su eliminación es rápida y la concentración plasmática desciende en las 12-24 h posteriores a la última toma de medicamento15.
Su eliminación es principalmente renal, aunque se filtra en el glomérulo, con una reabsorción del 80% en los túbulos contorneados proximales; su excreción depende de la tasa de filtrado glomerular y cerca del 95% de la dosis se excreta en la orina sin sufrir biotransformación15,16. No hay evidencia de metabolitos activos.
Se sabe que en las células el litio altera el transporte de sodio en la membrana neuronal y en el miocito, disminuye la concentración, el almacenamiento y la liberación de catecolaminas endógenas y produce aumento en la síntesis de serotonina17. A pesar de estas evidencias empíricas, el mecanismo exacto por el cual el litio funciona como estabilizador del estado de ánimo se desconoce3,17.
Durante varias décadas se ha planteado que el litio inhibe la enzima adenilato ciclasa, pero actualmente se postula que el bloqueo del reciclaje de inositol fosfato es el probable mecanismo de acción. Se ha documentado que este bloqueo inhabilita la capacidad de las neuronas para generar segundos mensajeros postsinápticos18.
Alteraciones endocrinas
En primer término se destaca la diabetes insípida nefrogénica, la cual se estima en un 25-50% de los casos tratados con este fármaco19,20; se habla también de la aparición de hipotiroidismo, en un 20-30% de los pacientes, e hiperparatiroidismo, con un 5-10% de los casos21-24. Afecciones del eje hipotálamo-hipófiso-adrenal25-27 y el páncreas también son frecuentes28-33.
Diabetes insípida nefrogénica
La función del riñón es eliminar residuos metabólicos y regular el volumen y la composición de los líquidos corporales34-36. El litio produce una disminución de la hormona vasopresina mediante la inhibición de la respuesta de la adenilato ciclasa renal sensible a esta hormona; esta inhibición induce al mismo tiempo la traslocación de la acuaporina 2 (AQP2) presente en la membrana apical del túbulo colector37, lo cual se traduce en la aparición de diabetes insípida.
Esta enfermedad se caracteriza por la producción de volúmenes anormalmente altos de orina diluida, con un volumen de hasta 50 ml/kg en 24 h y con osmolaridad < 300 mOsm/l. Clínicamente se presenta poliuria o polaquiuria y nicturia35,36. La disminución en la expresión de las acuaporinas afecta a la filtración y la reabsorción renales de líquidos. La presencia de diabetes insípida nefrogénica en los pacientes tratados con litio generalmente es reversible al suspender el tratamiento, aunque hay evidencia que tras el uso prolongado algunos pacientes pueden sufrir nefropatía crónica intersticial y dan o renal irreversible38,39.
Mecanismo propuesto de desarrollo de la alteración
Para algunos autores, estos mecanismos, aunque identificados, aún no están comprendidos en su totalidad y probablemente no expliquen todo el problema40. En 1994, Unwin et al.41 describieron la disminución en la expresión de acuaporina 2 en el tejido renal de rata por el tratamiento con litio. Un trabajo reciente de Kortenoeven et al. 40 demostró que el litio disminuye el ARN mensajero que interviene en la síntesis de la acuaporina 2, al tiempo que reduce la expresión de la enzima cinasa glucógeno sintetasa beta (GSQ0). Rao y et al. 42, con base en su investigación, proponen que la disminución en la expresión de la GSQ0 induce reducciones del monofosfato cíclico de adenosina (AMPC) en respuesta a la arginina-vasopresina, con lo que se origina una disminución total o parcial de la acuaporina 2. Por el momento solo se tiene evidencia de que la desregulación de esta proteína transmembrana es el efecto demostrable y clave por el uso de litio43.
Hipotiroidismo
La glándula tiroides produce hormonas tiroideas que son cruciales para la diferenciación celular, y con ello para el desarrollo y el crecimiento del niño y el adolescente. Asimismo participan en la homeostasis termogénica y metabólica del adulto. En 1968, Schou et al.6 reportaron una prevalencia de bocio del 3,6% y una incidencia anual del 4% entre los pacientes en tratamiento continuo con litio, en comparación con el 1% de la población general de esa época, libre de tratamiento. Actualmente se señala que el hipotiroidismo y el bocio que se producen por esta causa se presentan generalmente en los primeros 2 años de tratamiento, con incidencias del 20-30% y el 50% respectivamente16. Hay reportes de que la disminución de la secreción tiroidea es más frecuente en pacientes con tratamientos prolongados, y que incluso el riesgo aumenta si se vive en zonas con deficiencia de yodo16,21, en individuos con alto riesgo de enfermedad tiroidea de carácter autoinmunitario o quien tenga antecedentes familiares de enfermedad tiroidea44.
En un estudio retrospectivo con 718 pacientes, Johnston et al.45 encontraron una prevalencia de hipotiroidismo clínico del 10,4% de la mujeres con tratamiento prolongado con litio. Kirov et al.46 publicaron que el riesgo de hipotiroidismo se incrementaba en mujeres mayores de 50 años. También se ha establecido que el 30% de los pacientes tratados crónicamente con litio sufren un aumento de tirotropina (TSH) que produce un hipotiroidismo subclínico que al final progresa a hipotiroidismo con o sin bocio47,48.
Mecanismos propuestos de la afección tiroidea
Se destacan la modificación de la actividad de la adenilato ciclasa tiroidea sensible a TSH. También hay evidencia de que el litio causa una modificación funcional de las proteínas G, prolongando su estado inactivo49. Al evitar la activación de las moléculas, el litio favorece la disminución de la producción de hormonas tiroideas, lo que incrementa en consecuencia la secreción hipofisaria de TSH. Este efecto se ha encontrado que es fundamental para que se produzcan hipotiroidismo y bocio49,50.
Experimentalmente se ha podido corroborar que, con altas concentraciones de litio, el proceso de organificación de yodo se ve disminuido51. Algunos autores han señalado como posible mecanismo tóxico del litio su acumulación en el tejido tiroideo a través de su incorporación intracelular mediante transporte activo, además de la reducción de la absorción de yodo por la glándula52,53. Estudios realizados en animales y en humanos han demostrado que el litio puede conducir a un aumento de la respuesta de TSH en la prueba con tiroliberina (TRH)54. Para Bocchetta et al.49,50,55 lo más destacado es que el litio enlentece la tasa de degradación de tiroxina (T4), aunque para esos autores no se reduce la producción extratiroidea de triyodotironina (T3). La evidencia actual apunta a que sí se afecta la conversión periférica de T4 a T356.
Otros hallazgos
Se destaca que la inhibición de la liberación de hormonas tiroideas afecta predominantemente al sexo femenino y a pacientes en que es posible detectar anticuerpos antitiroideos al inicio del tratamiento con litio16.
Otro dato significativo es que las tasas anuales de hipotiroidismo más altas se encuentran en sujetos con anticuerpos positivos, seguidas las de aquellos con anticuerpos negativos o sexo femenino49. Un dato relevante más es la presencia de tiroiditis autoinmunitaria, que parece predisponer a hipotiroidismo y bocio durante el tratamiento con litio55; sin embargo, el papel exacto de la autoinmunidad en la insuficiencia tiroidea inducida por el fármaco sigue siendo incierto57.
El litio afecta a muchos aspectos de la inmunidad celular y humoral, lo cual se ha evidenciado in vitro e in vivo, aunque el punto en controversia es si el litio por sí solo puede inducir autoinmunidad tiroidea49. En cuanto a la presencia de anticuerpos antitiroideos y el papel del litio en el desarrollo de la enfermedad, los estudios realizados en la década de los ochenta58-60 no detectaron diferencias en la presencia de anticuerpos antes y después del tratamiento. Hallazgos más recientes han mostrado el desarrollo de anticuerpos antitiroideos en pacientes jóvenes de ambos sexos a los pocos años de exposición al litio50.
Actualmente hay reportes de casos sobre la aparición de encefalopatía de Hashimoto desencadenada por litio, con títulos de anticuerpos antimicrosomales aumentados en el líquido cefalorraquídeo61. Finalmente, es importante destacar que la autoinmunidad en la glándula tiroides se ha asociado a trastornos afectivos independientemente del tratamiento62-64. La tabla 1 recapitula los posibles mecanismos subyacentes23,50,52.
Hiperparatiroidismo e hipercalcemia
Las glándulas paratiroides son las encargadas de la secreción de hormona paratiroidea (HPT)24, la cual es la principal reguladora de la fisiología del calcio34. El hiperparatiroidismo se caracteriza por una producción excesiva de HPT, lo que es causa frecuente de hipercalcemia 35,36. En 198965 se demostró la relación causal entre el tratamiento crónico con litio y esta alteración, lo cual se ha reproducido en diversos trabajos posteriores44,66,,67.
El litio se asocia con hipercalcemia leve, pero en algunos casos se genera hiperparatiroidismo por mecanismos no del todo claros68. Se ha propuesto que estos fenómenos podrían además estar relacionados etiológicamente con una función renal disminuida en sujetos tratados crónicamente con litio67. Los expertos señalan que en ocasiones no es posible excluir la posibilidad de hiperparatiroidismo previo, debido a que en la mayoría de los casos no se dispone de una valoración basal16.
Mecanismo propuesto de la afección paratiroidea
Experimentos in vivo revelan que el litio incrementa el umbral del receptor sensible al calcio69-71, mientras que estudios experimentales in vitro en células paratiroides de bovinos señalan que incrementa su cantidad, lo que inhibe la secreción de HPT72,73. El litio también promueve una excreción urinaria de calcio reducida, debido al aumento de la reabsorción renal secundaria al aumento de HPT74. Se ha postulado como posible mecanismo de acción la inhibición de la enzima adenilato ciclasa sensible a HPT75.
La interferencia con la generación de AMPc en diferentes tejidos forma parte de las bases moleculares para explicar los efectos del medicamento9. Ensayos clínicos79 han mostrado que, tras la administración de 600 mg de litio al día a voluntarios sanos, se produce un aumento de la calcemia sin que esto llegue a afectar a las concentraciones de HPT, lo que demuestra que el control o regulación de la dinámica paratiroidea se ve alterada de forma aguda aun con litemias en intervalo terapéutico, pero el dano real es a largo plazo9.
Se ha publicado que los pacientes presentan características metabólicas propias, tales como una excreción urinaria de calcio disminuida, ausencia de nefrolitiasis, excreción normal de AMPc urinario y concentración sérica normal de fosfato inorgánico. Ha habido hallazgos muy similares en la hipercalcemia hipocalciúrica familiar9. Es interesante notar que la propia hipercalcemia parece dificultar el control de síntomas afectivos77.
Eje hipotálamo-hipófiso-adrenal
Mecanismo propuesto de la afección de esta vía
Existe evidencia de que los pacientes tratados con litio presentan una activación del eje hipotálamo-hipófiso-adrenal. Estudios realizados en Europa demuestran como posible mecanismo el aumento de la actividad del núcleo paraventricular, por el incremento en la expresión de c-Fos (proteína codificada en humanos por el gen fos)25,78. La expresión de c-Fos funciona como un marcador de actividad neuronal durante un potencial de acción79. Si el ARNm de c-Fos se activa en una neurona, esto indica que ha habido actividad reciente80.
Estudios in vitro demuestran que el litio puede inhibir o reducir la producción de hormonas catecolaminérgicas en células cromafines de tejidos tumorales (feocromocitomas) mediante la inhibición de la cinasa glucógeno sintetasa 3(GSK-3) en la línea celular PC-12, lo que evidencia el efecto en el sistema catecolaminérgico en respuesta a la administración de sales de litio26.
La reducción en la concentración de catecolaminas podría explicar los hallazgos de Cappeliez et al.27 en 1981, en relación con que una deficiencia de estas hormonas influye en la actividad locomotora. Algunos trabajos demuestran de forma directa que los efectos de litio se reducen sustancialmente tras la realización de adrenalectomías26.
Páncreas
Es un órgano exocrino y endocrino; produce hormonas como insulina, glucagón y somatostatina, por citar solo algunas. En condiciones fisiológicas normales, la glucosa es la fuente más importante de energía utilizada por el cerebro. El litio, al alterar la liberación de insulina, conduce al deterioro de la tolerancia a la glucosa28,29
Mecanismo propuesto de la afección de la glándula
Aparentemente el efecto en la regulación de la glucosa se encuentra mediado por la estimulación de adrenorreceptores. Estudios en ratas han mostrado que la infusión intravenosa de litio conduce a hiperglucemia, así como al aumento de glucagón y a una respuesta disminuida a la acción de la insulina29. El efecto directo del litio en las células pancreáticas alfa-2 y los receptores betaadrenérgicos induce la reducción de la secreción de insulina y aumento de glucagón30.
El estudio realizado por Fontela et al.31 confirma que el litio in vitro tiene un efecto inhibidor de la segunda fase de liberación de la insulina. El litio periférico se ha asociado con un efecto similar a la insulina en el metabolismo de la glucosa en el músculo esquelético y los adipocitos32. Estudios en modelos animales han mostrado que el litio promueve una mayor captación de glucosa por los miocitos, así como una mayor síntesis de glucógeno, lo que implica aumento de la fosforilación de adenosina trifosfato (ATP), la inhibición de la enzima GSK-3 y el aumento de la proteína activadora de mitógeno cinasa 38 (P38 MAPK)33.
Propuesta para la evaluación basal y el seguimiento de los pacientes tratados con litio
En la figura 1 49,50,79,81 se señalan los estudios y las valoraciones de laboratorio y/o gabinete que idealmente deben practicarse basal y periódicamente a los pacientes en tratamiento con carbonato de litio. Esta propuesta se elaboró en consenso entre los autores de este trabajo y se apoya en evidencia científica. Se decidió incluir las litemias que, como sabemos, son fundamentales. Es importante destacar que la presencia de anormalidades clínicas o paraclínicas en cualquier momento del seguimiento justifica la evaluación del médico endocrinólogo.
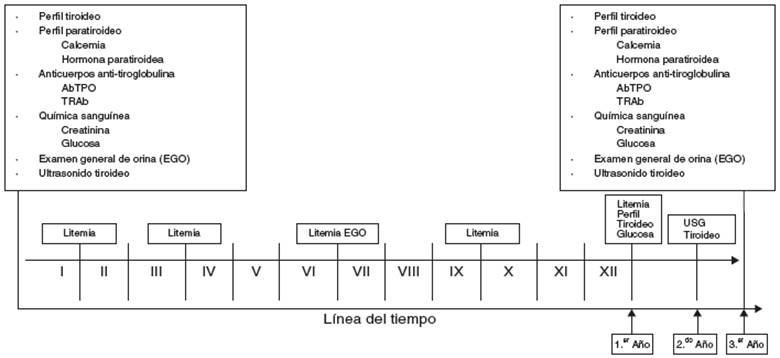
Figura 1 Línea del tiempo para estudios de laboratorio y gabinete49,50,79,81. Litemia: 1.a al mes y trimestralmente las siguientes. A partir de 1.er año, semestrales. Estudios de laboratorio y gabinete: protocolos completos en cuadros superiores. 1.er año: perfil tiroideo y glucosa. 2.° año: ultrasonido tiroideo. 3.er año: protocolo similar al basal. En cualquier momento, realizar los estudios que sean necesarios en correlación con hallazgos clínicos. *Los números romanos corresponden a los meses del año.
Opciones de tratamiento para algunas de las alteraciones endocrinas derivadas del uso de carbonato de litio
Diabetes insípida nefrogénica
Se ha propuesto el uso de amilorida como el medicamento de elección a dosis de 2-5 mg/día82-85. Otras opciones incluyen la hidroclorotiazida (HCTZ) a dosis de 50-100 mg/día86,87.
Hiperparatiroidismo e hipercalcemia
Las alternativas pueden ser clínicas o quirúrgicas88,89. Recientemente se ha propuesto el uso de un producto llamado cinacalcet, que tiene un efecto calciomimético89-92. Las dosis requeridas, según Gregoor91, mostraron que un promedio de 30-120 mg/día resulta eficaz.
Hipotiroidismo
La guía de práctica clínica de Nueva Zelanda93 es pionera en el tratamiento del hipotiroidismo de pacientes bipolares tratados con litio.
Esta guía, cuya última actualización es de 2004, establece que el hipotiroidismo responde bien al tratamiento con levo-tiroxina. Una revisión publicada en 2006 por Bocchetta et al.49 concluyó que el 2,1% de las mujeres y el 0,3% de los varones requirieron tratamiento con levotiroxina sin suspender el litio. En pacientes menores de 60 años y sin datos clínicos de cardiopatía, se puede comenzar el tratamiento con 50-100 μg/día. La dosis se ajusta en incrementos o decrementos de 12,5-25 μg/día según respuesta clínica y concentración de TSH.
Conclusiones
El carbonato de litio ha sido fundamental en el tratamiento de los trastornos del estado de ánimo y con un efecto terapéutico indiscutible; por desgracia, ha mostrado un abanico de efectos adversos que sitúan al clínico en la disyuntiva de prescribirlo o no, con todo y el advenimiento de otros moduladores del estado de ánimo. La decisión es sin lugar a dudas difícil, pues no es infrecuente que haya pacientes que solamente se beneficiarán con este fármaco86.
A pesar de la abundante información existente en la literatura sobre los eventos adversos por el uso de carbonato de litio, específicamente los que se refieren a las alteraciones endocrinas, sigue habiendo más preguntas que respuestas sobre los mecanismos subyacentes a estas eventualidades clínicas 94. Estas condiciones van de la mano con otro hecho de realidad: el mecanismo de acción de este producto es todavía incierto39.95,98.
La prescripción de un fármaco implica retos, ya que muchas veces representa más riesgos que la enfermedad misma. Las alteraciones endocrinas son una clara muestra de estos riesgos, ya que, aunque la literatura señala que con la suspensión del medicamento remiten, algunas pueden generar danos o afecciones irreversibles99,100. No existe hasta el momento una guía que permita orientarnos sobre cómo enfrentar estas circunstancias adversas, y aunque es cierto que la primera consideración o impulso, por decirlo así, es retirar la prescripción, esto no siempre es posible. La recomendación es entonces evaluar de manera integral al paciente y favorecer una atención multidisciplinaria para la toma de decisiones.
La propuesta que planteamos para monitorizar la administración de carbonato de litio, en esta oportunidad, es una aproximación a lo que idealmente debiera hacerse con base en la evidencia encontrada considerando el ángulo de afecciones endocrinas49,50,79-81. Los que nos desempeñamos en el ámbito clínico sabemos que lo ideal no siempre es lo factible o conducente. En este último sentido, la alternativa puede ser entonces solicitar los estudios estrictamente necesarios para beneficio del paciente.
















