Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.53 no.1 Bogotá Jan. 2005
ACTUALIZACIÓN REVISIONES
Carlos Andrés Gómez Álvarez1, Aura Lucía Leal Castro2María de Jesús Pérez de Gonzalez3, Myriam Lucía Navarrete Jiménez4
1.Estudiante VII semestre, Línea de Profundización Resistencia Antimicrobiana, Facultad de Medicina, Universidad Nacional de Colombia Bogotá.
2.Profesora Asistente, Departamento de Microbiologia, Facultad de Medicina, Universidad Nacional de Colombia Bogotá
3.Profesora Asistente, Departamento de Microbiologia, Facultad de Medicina, Universidad Nacional de Colombia Bogotá
4.Profesora Asistente, Departamento de Microbiologia, Facultad de Medicina, Universidad Nacional de Colombia Bogotá
Correspondenciaallealc@unal.edu.co
Resumen
Pseudomonas aeruginosa es un bacilo Gram negativo no fermentador, ampliamente relacionado con la infección nosocomial. Este tipo de infecciones se presentan en pacientes severamente comprometidos, hospitalizados especialmente en unidades de cuidado intensivo, donde existe una alta presión de selección de resistencia por parte de los antibióticos. Estas infecciones nosocomiales tienen implicaciones en el pronóstico del paciente, los costos del tratamiento, la estancia hospitalaria, la morbilidad y la mortalidad. Es importante que en cada institución hospitalaria se mantenga una estrecha vigilancia de los perfiles de resistencia de esta bacteria, con el fin de reconocer sus mecanismos de resistencia, su evolución y la forma de transferencia. En este sentido, un concepto como "la lectura interpretativa del antibiograma" se impone y ayuda al clínico a inferir los posibles mecanismos de resistencia que exhibe la bacteria para de esta manera orientar el uso de la terapia antibiótica y avanzar en el gran desafío que implica enfrentar las consecuencias de la infección por P. aeruginosa.
Palabras claves: Pseudomonas aeruginosa, mecanismos de resistencia, bombas de expulsión, porinas, β-lactamasas, antibióticos mecanismo de defensa.
Summary
Pseudomonas aeruginosa is a Gram-negative fermentative bacilli related with nosocomial infections. This kind of infections is more frequent in critical ill patients, specially in intensive care units, where a high pressure selection is ejerxed. Nosocomial infections are associated with poor prognosis, increased treatment cost, cubed length, morbidity and mortality. Each health care institution might establish antimicrobial resistance surveillance in order to recognize antimicrobial resistance mechanisms, and transference of resistance of this pathogen.
In the other hand, concepts as "interpretative reading" help the clinician to infer the possible mechanisms involved and in this way guide the antimicrobial therapy in order to boarding the challenge of this kind of infections.
Key words: pseudomonas aeruginosa, resistance mechanisms, expulsion pumps, porines, β-lactamases, antibiotics, defense mechanisms.
Introducción
Pseudomonas aeruginosa es un bacilo Gram negativo, no fermentador, que se comporta básicamente como un patógeno nosocomial oportunista. Sus mínimos requerimientos nutricionales, su tolerancia a una amplia variedad de condiciones físicas y su resistencia intrínseca a un gran número de antibióticos, explican su papel ecológico como un importante y eficaz patógeno intrahospitalario (1). Aunque se ha detectado como parte de la flora normal corporal, rara vez causa enfermedad en individuos sanos.
En la mayoría de los casos, la infección comienza con alguna alteración de los mecanismos de defensa del huésped; esto puede involucrar la disrupción en la integridad de barreras físicas como catéteres urinarios, catéteres intravenosos, quemaduras extensas de piel o tubos endotraqueales que facilitan la colonización bacteriana. Por otro lado, hay otras situaciones especificas del huésped que comprometen los mecanismos de defensa específicos, tales como la neutropenia, la inmunosupresión iatrogénica o adquirida y las patologías que cursan con deterioro del sistema inmunológico como cáncer, desnutrición y diabetes, que también son factores de riesgo para la infección. Definitivamente, la estancia hospitalaria prolongada, especialmente en unidades de cuidado intensivo (UCI) y la presión de selección de los antibióticos (AB) son los factores que favorecen la aparición de cepas multirresistentes. Este hecho, convierte a la infección por P.aeruginosa en un verdadero problema de salud pública que afecta no sólo el curso de la evolución del paciente sino que aumenta la estancia hospitalaria, el uso de antibióticos y los costos de los servicios de salud.
Hay un limitado número de antibióticos activos contra P. aeruginosa. Por tanto, en los patrones de resistencia en cada hospital la vigilancia estricta, se hace necesaria; además de familiarizándose con los mecanismos por los cuales este microorganismo se hace resistente. De esta manera a partir del antibiograma se puede inferir cuales son los mecanismos que median la resistencia en cualquier aislamiento. El propósito de este articulo, es revisar los mecanismos de resistencia de P. aeruginosa, con el fin de familiarizar al clínico y al estudiante con estos conceptos y ayudarlo a orientar una adecuada terapia antibiótica.
Mecanismos de resistencia
Pseudomonas aeruginosa es resistente, tanto de manera natural como adquirida, a un gran núemro de AB, como cefalosporinas de primera y segunda generación, tetraciclinas, cloranfenicol y macrólidos (2). Esto se debe a las características de su membrana celular que tiene propiedades excepcionales de impermeabilidad. La resistencia a los AB usualmente activos sucede en el medio hospitalario. Las cepas pueden transmitirse entre ellas el material genético que media la resistencia, incluso a partir de otras bacterias Gram negativas como las enterobacterias. Otro factor preocupante es la capacidad de P. aeruginosa de tornarse resistente en el curso del tratamiento antibiótico. Los mismos AB son capaces de inducir los mecanismos de resistencia que un aislamiento tiene latentes. Otras sustancias como el zinc, componente de una clase de catéteres urinarios, también inducen cambios moleculares que activan la resistencia a imipenem (3). Se ha evidenciado que en 10.2% de los tratamientos para P.aeruginosa emerge una cepa resistente que antes del tratamiento era sensible. Esta inducción de resistencia varía dependiendo de cada antibiótico. Por ejemplo, ceftazidima, una cefalosporina de tercera generación con actividad antipseudomonas, tiene el más bajo riesgo de inducir resistencia en bacterias previamente sensibles a ceftazidima; en contraste, imipenem presenta la más alta tasa de emergencia de resistencia después del tratamiento (4).
Lo preocupante, son las pocas opciones que quedan para el efectivo tratamiento de las infecciones por microorganismos multirresistentes. Los AB que se consideran con buena actividad son: las penicilinas antipseudomonas (piperacilina, ticarcilina, carbenicilina, azlocilina) asociadas a inhibidores de b-lactamasas, ceftazidima, cefepime, monobactámicos como aztreonam, carbapenémicos (imipenem y meropenem), quinolonas especialmente ciprofloxacina y aminoglicósidos. Sin embargo, ante el surgimiento de aislamientos multirresistentes a veces es necesario acudir a antibióticos que se consideraban fuera de uso por su alta toxicidad como las polimixinas.
Los principales mecanismos de resistencia en P. aeruginosa comprenden: presencia de b-lactamasas y alteraciones de la permeabilidad de membrana dadas por la presencia de bombas de expulsión y las mutaciones de las porinas transmembranales.
β-lactamasas
Las β-lactamasas son enzimas que hidrolizan el anillo β-lactámico de los antibióticos, de esta manera destruyen el sitio activo del AB e impiden su actividad. Las β-lactamasas se caracterizan por su capacidad de inhibir determinados subgrupos de β-lactámicos, es por esto que algunas subclasificaciones las denominan, penicilinasas, cefalosporinasas o carbapenemasas, dependiendo de la familia de β-lactámicos que tenga mayor suceptibilidad a ser atacadas por la enzima. Así mismo, estas enzimas son susceptibles de ser inhibidas por los inhibidores de β-lactamasas como el clavulanato, el sulbactam y el tazobactam, aunque no todas son suceptibles ni responden de igual forma a esta inhibición.
P. aeruginosa posee dos clases de β-lactamasas: Amp-C y las β-lactamasas de espectro extendido (BLEE). Amp-C, está codificada en el cromosoma de la bacteria y tiene la capacidad de ser inducida por los propios β-lactámicos, especialmente cefalotina y ampicilina. Cuando esto sucede, hay resistencia a penicilinas y cefalosporinas (ceftazidime, cefepime); el grado de resistencia, depende del grado de represión de la Amp-C.
El problema radica en que esta enzima, es inducida en cuestión de días, por tanto, antes del tratamiento, los β- lactámicos parecen servir, pero clínicamente el paciente no mejora y se descubre posteriormente la inducción completa de la enzima.
Las BLEE son codificadas por plásmidos, se adquieren mediante transporte de DNA extracromosomal y se manifiestan también por resistencia a penicilinas y a cefalosporinas. En un tipo de enzimas llamadas carbapenemasas se evidencia resistencia a carbapenémicos.
Las β-lactamasas más frecuentemente adquiridas por plásmidos son la PSE-1 y la PSE-4. Otras BLEE incluyen la PER-1 que confiere franca resistencia a ceftazidima pero que pierde su poder al adicionar clavulanato. TEM, SHV y OXA, son BLEE que generan resistencia a monobactámicos, penicilinas, cefalosporinas, pero respetan carbapenémicos. Existen metalo β-lactamasas que tienen la capacidad de hidrolizar las penicilinas, cefalosporinas y carbapenémicos pero no el aztreonam; estas son IMP y VIM recientemente descritas en Japón y Europa (8).
La resistencia mediada por este mecanismo se debe sospechar ante un antibiograma que revele resistencia a todas las penicilinas y cefalosporinas anti-pseudomonas (5). La opción terapéutica en este caso son los carbapenémicos, siempre que no se trate de una carbapenemasa (Tabla 1).

Bombas de expulsión
Las bombas de expulsión son complejos enzimáticos de membrana, que expulsan de la célula detergentes y sustancias anfipáticas que de otra manera destruirían la bacteria. Antes de la era de los antibióticos, P. aeruginosa ya poseía estos complejos enzimáticos. Este complejo llamado MexAB- OprM, se compone de una proteína bomba en la membrana citoplasmática, una proteína ligadora en el espacio periplásmico y un canal de salida en la membrana externa (Figura1). Tiene la capacidad de expulsar al exterior de la bacteria y contra un gradiente de concentración, β-lactámicos, cloranfenicol, quinolonas, macrólidos, novobiocina, sulfonamidas, tetraciclinas y trimetoprim (9). Estos sistemas de expulsión son los responsables de la "impermeabilidad" a la mayoría de los antibióticos.
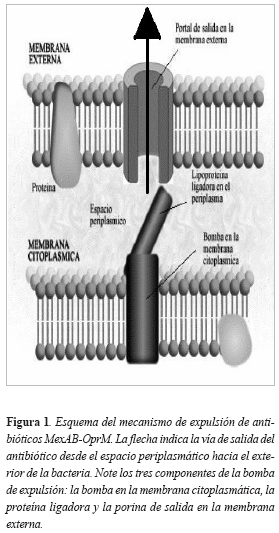
Las bombas de expulsión, tienen también la capacidad de ser inducidas por antibióticos, especialmente ciprofloxacina (9); además, los cambios mutacionales, incluso de una sóla base nucleotídica en el ADN cromosómico de la bacteria, pueden sobreexpresar estas bombas. La sobreexpresión de MexAB-OprM, compromete la accion de quinolonas, penicilinas, cefalosporinas e incluso meropenem pero no imipenem.
La sobreexpresión de otra bomba de expulsión, MexEF-OprN, confiere resistencia a quinolonas y algunos β-lactámicos, que incluyen meropenem e imipenem. ésta última bomba tiene una importante particularidad debido a que su expresión está estrechamente relacionada con el gen Mex T, que también está involucrado en la mutación que origina la pérdida de la porina OprD como se verá mas adelante. La sobreexpresión de MexXY-OprM afecta a los β-lactámicos, las quinolonas, el meropenem y los aminoglicósidos sin afectar la acción del imipenem (6,7).
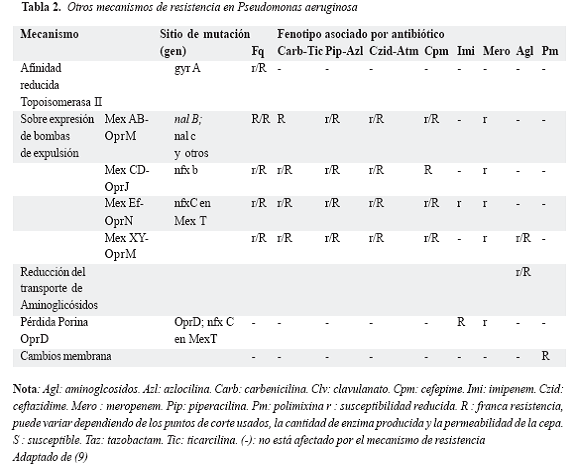
La resistencia mediada por bombas de expulsión se sospecha por un antibiograma que demuestra resistencia a las penicilinas y cefalosporinas antipseudomonas, que también afecta la susceptibilidad a meropenem, imipenem o aminoglicósidos dependiendo de la clase de bomba (Tabla 2).
Porinas de membrana
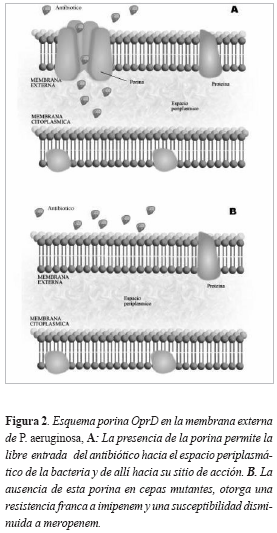
Las porinas son proteínas transmembranales que se ubican en la membrana externa de las bacterias y cumplen diversas funciones. OprD es una porina de membrana presente en Pseudomonas aeruginosa. Su papel primitivo es permitir la captación pasiva de aminoácidos básicos a través de la membrana externa (Figura 2). Se sabe además, que es capaz de permitir la entrada de carbapenémicos, aunque no de otros β-lactámicos. La afinidad y la capacidad de difusión de imipenem a través de esta porina es casi 70 veces más alta que la de meropenem. El imipenem tiene la capacidad de seleccionar durante el tratamiento cepas que muestran mutaciones en la porina OprD, que demuestran disminución de la afinidad y el transporte de este antibiótico a través de esta proteína. Estas cepas mutantes muestran un aumento de la concentración inhibitoria mínima (CIM) para imipenem, lo que las hace francamente resistentes a este carbapenémico. Con respecto a meropenem, estas cepas mutantes también han demostrado un aumento de la CIM a valores, que si bien no demuestran resistencia, si revelan disminución de la susceptibilidad. La resistencia franca a meropenem exige dos mecanismos de resistencia ya mencionados: la mutación del gen que codifica la porina OprD y la activación de bombas de expulsión que toman a meropenem como sustrato. La mutación del gen OprD se sospecha ante una cepa francamente resistente a imipenem con susceptibilidad reducida o preservada a meropenem y sin afectar a otros β-lactámicos, a menos que estén presentes otros mecanismos de resistencia (10,11) (Tabla 2).
Otros mecanismos de resistencia
Mecanismos de resistencia menos frecuentemente documentados incluyen la resistencia a quinolonas asociadas a mutaciones de los sitios blanco. La mutación de la topoisomerasa tipo II, sitio blanco de ciprofloxacina, confiere una resistencia aislada a esta quinolona (13). Desde el punto de vista epidemiológico este mecanismo se considera menos importante, debido a que en el medio hospitalario el aumento de la resistencia a ciprofloxacina, está asociado con mayor frecuencia a bombas de expulsión que tienen como sustrato a este antibiótico (14).
Lectura interpretativa del antibiograma
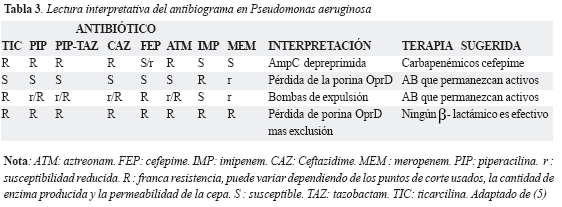
La importancia del antibiograma en el manejo de infecciones intrahospitalarias causadas por P. aeruginosa sobrepasa el simple deseo de saber a qué antibióticos es susceptible el aislamiento. Un concepto relativamente nuevo se impone en este sentido; consiste en la lectura interpretativa del antibiograma. Si se hace una apropiada identificación del género y la especie del germen y se selecciona un adecuado perfil de antibióticos en el antibiograma, es posible inferir a partir del mismo, los mecanismos de resistencia subyacentes en un aislamiento particular (Tabla 3). Lo anterior permite, no sólo orientar el tratamiento antibiótico, sino predecir cuales AB no serían apropiados, teniendo en cuenta el mecanismo subyacente más probable. Otra ventaja es poder indicar antibióticos que se sabe no son substratos de los mecanismos deresistencia que se sospechan (15). Estos mecanismos deberían ser confirmados por técnicas de tipificación molecular, para acercarnos de una manera mas fiable al perfil genético de los a islamientos, analizar como se están transmitiendo y perpetuando dichos mecanismos y tomar medidas adecuadas que impidan la diseminación de la resistencia (16).
Conclusiones
La infección nosocomial por P. aeruginosa representa un gran reto para el clínico y un grave problema de salud pública. Los mecanismos por los cuales P. aeruginosa es multirresistente son bastante complejos. Tienen la capacidad de ser inducidos por los mismos antibióticos y otras sustancias, se activan en cuestión de días y pueden confluir en un mismo aislamiento haciéndolo prácticamente resistente a todos los antibióticos disponibles. Conceptos como "la lectura interpretativa del antibiograma", pueden ser útiles en el momento de orientar la terapia antibiótica frente a este microorganismo de alto impacto en la infección nosocomial.
Agradecimientos
A Diego Andrés Rodríguez, estudiante Medicina VII semestre, por el diseño y elaboración de las figuras que aparecen en este artículo.
Referencias
1. Pollack M. Pseudomonas aeruginosa. En: Mandell, Douglas, Bennet eds. Enfermedades Infecciosas: Principios y Prácticas. 5ª Ed. Buenos Aires: Editorial Médica Panamericana SA 2002;2802-2834. [ Links ]
2. Restrepo A, Robledo J, Leiderman E, Restrepo M, Botero D, Bedoya VI eds. Enfermedades Infecciosas. Medellin: CIB; 2003: 460-462. [ Links ]
3. Conejo MC, Garcia I, Martínez L, Picabea L, Pascual A.. Zinc Eluted from Siliconized Latex Urinary Catheters Decreases Oprd Expression, Causing Carbapenem Resistance in Pseudomonas aeruginosa. Antimicrobl Agents Chemother 2003; 7: 2313-2315. [ Links ]
4. Carmeli Y, Troillet N, Eliopoulos GM, Samore M. Emergence of Antibiotic- Resistant Pseudomonas aeruginosa: Comparison of Risk Associated with Different Antipseudomonal Agent. Antimicrol Agents Chemother 1999; 43: 1379-1382. [ Links ]
5. Arias C, Panesso D, Zuñiga M. Guías para el uso racional de antibióticos b-lactámicos: mecanismos de resistencia y su interpretación clínica. Biomédica 2003;23:134-40. [ Links ]
6. Poole K, Tetro K, Zhao Q, Neshat S, Heinrichs D, Blanco N. Expression of the Multidrug Resistance Operon mex A- mexB- OprM in Pseudomonas aeruginosa: mex R Encodes a Regulator of Operon Expression. Antimicrob Agents Chemother 1996; 40: 2021-2028. [ Links ]
7. Poole K, Srikumar R, Paul C. Influence of Mutations in mexR Repressor Gene on Expression of the Mex A-MexB-OprM Multidrug Efflux System of Pseudomonas aeruginosa. J Bacteriol 2000;182: 1410-1414. [ Links ]
8. Livermore DM, Woodford N. Carbapenemases: a problem in Waiting? Curr Opinion Microbiol. 2000; 3: 489-495. [ Links ]
9. Livermore DM. Multiple mechanisms of Antimicrobial Resistance in Pseudomonas aeruginosa: Our worst Nightmare? Clin Infect Dis 2002; 34: 634-640. [ Links ]
10. Livermore D. Of Pseudomonas, porins, pumps and Carbapenems. J Antimicrob Chemother.2001;47: 247-250. [ Links ]
11. Ochis M, McCusker M, Bains M, Hancock R. Negative Regulation of the Pseudomonas aeruginosa Outer membrane Porin OprD Selective for Imipenem and Basic Amino Acids. Antimicrob Agents Chemother 1999; 43: 1085-1090. [ Links ]
12. Köhler T, Hamzehpour MM, Simone F, Pechere JC.Carbapenem Activities against Pseudomonas aeruginosa: Respective Contributions of OprD and Efflux Systems. Antimicrob Agents Chemother 1999; 43: 424-427. [ Links ]
13. Mouneimné H, Robert J, Jarlier V, Cambau E. Type II Topoisomerase Mutation in Ciprofloxacin-Resistant Strain of Pseudomonas aeruginosa. Antimicrob Agents Chemother 1999; 43: 62-66. [ Links ]
14. Karlowsky J, Draghi D, Jones M, Thornsberry, Fridland IR, Sahm D. Surveillance for Antimicrobial Susceptibility among Clinical Isolates of Pseudomonas aeruginosa and Acinetobacter baumannii from Hospitalized Patients in the United States, 1998 to 2001. Antimicrob Agents Chemother 2003; 47: 1681-1688. [ Links ]
15. Livermore DM, Winstanley TG, Shannon KP. Interpretative reading: Recognizing the inusual and inferring resistance mechanisms from resistance phenotypes.J Antimicrob Chemother 2001; 48: 87-102. [ Links ]
16. Gales AC, Jones RN, Turnidge J, Rennie R, Ramphal R. Characterization of Pseudomonas aeruginosa Isolates: Occurrence Rates, Antimicrobial Susceptibility Patterns, and Molecular Typing in the Global SENTRY Antimicrobial Surveillance Program, 1997-1999. Clin Infect Dis 2001; 32: 146-155. [ Links ]













