Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.53 no.4 Bogotá Oct. 2005
Actualización
Carlos Mauricio Hurtado Clavijo1, Myriam Gutiérrez de Salazar2
1.MD, Especialista en Epidemiología, Candidato a Magister en Toxicología, Facultad de Medicina, Universidad Nacional de Colombia Bogotá.
2.MD, MSc, Profesora Asistente, Directora Departamento de Toxicología, Facultad de Medicina, Universidad Nacional de Colombia Bogotá.
Correspondencia: hmauro0223@gmail.com
Resumen
Un gran número de insecticidas organofosforados se usan en todo el mundo a diario. Las intoxicaciones ocurren generalmente de forma accidental por exposición laboral, o intencional, con fines suicidas. Los organofosforados producen sus efectos tóxicos a través de la inhibición de la acetilcolinesterasa, la enzima responsable de la hidrólisis del neurotransmisor acetilcolina, produciendo ácido acético y colina, productos químicamente inertes. La unión entre los organofosforados y la acetilcolina es una unión irreversible espontáneamente, sin embargo, puede ser reversible con el uso de antídotos específico llamados oximas. La administración temprana de pralidoxima es crucial y muy útil si se inicia en las primeras seis horas luego de la intoxicación aguda. La atropina produce un beneficio clínico dramático para los síntomas muscarínicos del síndrome colinérgico. Pueden ocurrir complicaciones importantes en los pacientes por intoxicación con organofosforados, como hipotensión, arritmias cardíacas fatales, síndrome intermedio, distres respiratorio, neumonía y aún disfunción cerebral severa.
Palabras clave: intoxicación (envenenamiento), sustancias tóxicas, oximas, hidrólisis, compuestos de pralidoxima.
Summary
Every day more organic phosphorus insecticides, are used in the entire world. Intoxications happen generally accidentally for exhibition work, or intentional as suicides. Organic phosphorus compounds, produces toxic effects, through the inhibition of the acetylcholinesterase, the enzyme responsible for the hydrolisys of the acetylcholine, neurotransmisor producing acetic acid and colina, chemically inert products. The binding between the organic phosphorus compounds and the acetylcholine is spontaneously and irreversible, however, it can be reversible with the use of an antidote specific called oximas. The early administration of pralidoxima is crucial, great benefits are obtained if it begins in the first six hours after the acute intoxication. Atropine produces a dramatic clinical benefit for the symptoms muscarinic of the syndrome cholinergic. Important complications happen in the patients with organic phosphorus compounds poisoning, such as hypotension, fatal heart arrhythmias, intermediate syndrome of breathing distress and pneumonia are frequent and severe brain dysfunction.
Key words: poisoning, toxic substances, oximas, hidrolysis, pralidoxime compounds.
Introducción
A la lucha contra las distintas plagas que amenazan los alimentos y otros productos agrícolas, se suma la emprendida contra los insectos y otros animales vectores de enfermedades transmisibles. Ambas han adquirido características especiales con el formidable progreso de la industria química en el siglo XX. Este progreso ha desarrollado gran cantidad de sustancias químicas de alta agresividad contra los organismos dañinos pero cuyos efectos sobre el hombre y equilibrio del ecosistema continúan siendo debatidos (1-3).
Según la definición dada por la FAO, plaguicida es "una sustancia o mezcla de substancias destinadas a prevenir, destruir o controlar cualquier plaga, incluyendo vectores de enfermedad humana o animal, especies indeseadas de plantas o animales capaces de causar daños o interferir de cualquier otra forma con la producción, procesamiento, almacenamiento, transporte o mercado de los alimentos, otros productos agrícolas, madera y sus derivados o alimentos animales, o que pueden ser administrados a los animales para el control de insectos, arácnidos u otras plagas en sus organismos" (2-3).
Las intoxicaciones causadas por plaguicidas representan un importante problema en salud pública, dada por la diversidad de químicos que los constituyen, el elevado número de principios activos y las múltiples aplicaciones en prácticamente todas las actividades de la vida diaria. Las intoxicaciones agudas (IA) por organofosforado (OF), son especialmente frecuentes en las zonas agrícolas, donde estos tóxicos se usan de forma habitual; siendo causa importante de toxicidad la exposición ocupacional (3).
Los esteres de ácido fosfórico y sus homólogos, se denominan pesticidas tipo organofosforado (OF); estos esteres producen inhibición de la enzima colinesterasa, actuando principalmente en la colinesterasa eritrocítica y plasmática. Este efecto produce un acumulo de acetilcolina que producen clínicamente tres grandes síndromes clínicos: muscarínico, nicotínico y neurológico. Las vías de absorción de los organofosforado son oral, dérmica, conjuntival, parenteral, rectal e inhalatoria. La intoxicación por organofosforados (IOF) es una condición seria que necesita diagnóstico y tratamiento rápido. El tratamiento oportuno con oximas, como antídoto de la intoxicación por organofosforados (IOF), reversa la inhibición de la acetilcolinesterasa (ACE) y evita la fosforilación enzimática, que es irreversible, en la intoxicación por organofosforados. Las oximas, tienen un efecto principalmente sobre los síntomas nicotínicos; en cambio, con los síntomas muscarínicos, su efecto es pobre; el cual puede ser muy bien cont rolado con el uso de colinérgicos tipo atropina. Desde 1987, Senanayake y Karalliedde, describieron un síndrome característico de la intoxicación por organofosforados denominado "Síndrome Intermedio", que consiste en parálisis progresiva de los músculos respiratorios, lengua, faringe y algunos pares craneanos (principalmente afecta VI par), asociado a efectos nicotínicos. El colapso respiratorio es la mayor causa de mortalidad, por lo que se debe supervisar cuidadosamente al paciente y hacer reconocimiento temprano de la complicación para disminuir la proporción de mortalidad entre estos pacientes (4).
Epidemiología
Un estudio realizado en Centroamérica, estimó que 3% de los trabajadores agrícolas expuestos sufren cada año una intoxicación aguda por plaguicidas (IAP). Más del 50% de las intoxicaciones agudas por estas sustancias se presenta en los países menos desarrollados. La tasa de incidencia para las IAP en la subregión Centroamericana ha mostrado un progresivo aumento del riesgo para el período, pasando de tasas de 6,3 por cien mil habitantes en 1992 a 19,5 en el año 2000. De acuerdo con los datos obtenidos a través del Sistema de Vigilancia Epidemiológica en Centroamérica, los doce plaguicidas responsables del mayor número de intoxicaciones agudas son: paraquat, fosfato de aluminio, metil-paratión, metamidofos, monocrotofós, clorpirofós, terbufós, etoprofós, endosulfan, carbofurán, metomil y aldicarb. Las tasas de mortalidad también registran una tendencia al ascenso en el período, pasando de un riesgo de muerte de 0,3 por 100.000 habitantes en 1992 a 2,10 en el año 2000, circunstancias que, al igual que la mo rbilidad, puede estar relacionada con mayor vigilancia y sospecha de esta patología entre el personal médico (5).
La intoxicación por pesticidas es uno de los métodos más frecuentes de intento de suicidio en el tercer mundo. En Sri Lanka se producen aproximadamente 13.000 intoxicaciones/año por estos productos, siendo de intencionalidad autolítica 73% y de ellos fallecen unos 1.000 pacientes/año. En Japón, la intoxicación por plaguicidas es frecuente, se estima que anualmente fallecen alrededor de 1.300 personas, casi todas por ingestión suicida (1).
Colombia es el tercer país, después de Brasil y México, en el consumo de plaguicidas en América Latina. En Colombia la agricultura ocupa el 40% de la fuerza laboral y representa el 50% de las divisas. El uso de plaguicidas en nuestro país superó los 28 millones de kilogramos de los cuales el 97% correspondieron a insecticidas (organofosforados y carbamatos principalmente), herbicidas y fungicidas. El Decreto 1843, expedido en agosto 1991 es el marco legal con el cual se reglamenta los plaguicidas de uso doméstico y pecuario, en los aspectos relacionados con uso, manejo, experimentación, producción, registro, almacenamiento, distribución, venta, aplicación, formulación, manejo de desechos y residuos, vigilancia epidemiológica, rotulado, etiquetado y envases. Los plaguicidas químicos de uso agrícola se rigen actualmente por la Decisión 436 "Norma Andina para Registro y Control de Plaguicidas Químicos de uso agrícola del 2002" en los mismos aspectos (6,7).
La producción y venta de plaguicidas en Colombia en el año de 2001 y lo correspondiente a organofosforados se puede apreciar en las tablas 1 y 2, lo cual representa cantidades muy importantes en kilogramos y litros para los productos sólidos y líquidos respectivamente: (8)
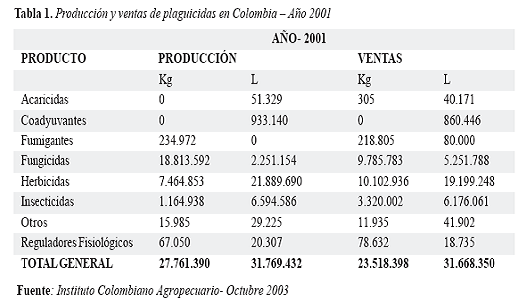
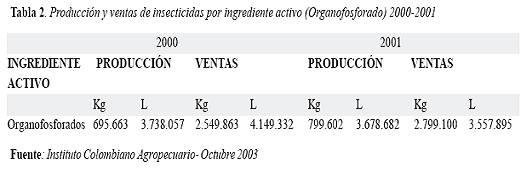
Dado el enorme interés epidemiológico y clínico de las intoxicaciones por productos agrícolas y su impacto en salud pública, es necesario el trabajo interdisciplinario entre los profesionales de salud desde médicos rurales, especialistas de todas las áreas, enfermeras, paramédicos, etc. y profesionales de las áreas agrícola, pecuaria, ambiental como veterinarios, agrónomos, ingenieros, promotores de saneamiento ambiental, epidemiólogos, etc, llevando a cabo la implementación de la notificación obligatoria de los casos atendidos tanto en los servicios de urgencias hospitalarios y extrahospitalarios como los casos de accidentes laborales y ambientales registrados por las autoridades competentes y fortificar así el Sistema de Vigilancia Epidemiológica de Plaguicidas que viene adelantando el Instituto Nacional de Salud de Colombia y algunas Seccionales de Salud interesadas en el tema como la Dirección Seccional de Salud de Antioquia con el fin de disminuír el subregistro y obtener estadísticas nacionales con fiables que permitan promover medidas de prevención y promoción en salud que lleven a disminuir al máximo los factores de riesgo de contaminación a todo nivel y por ende minimizar el número de casos de intoxicación por estas sustancias (9).
Generalidades de los organofosforados
Los organofosforado (OF) son plaguicidas clasificados junto con los carbamatos como inhibidores de la enzima colinesterasa. Son ésteres del ácido fosfórico y sus homólogos; son biodegradables, se hidrolizan fácilmente en medio húmedo y pH alcalino. Se absorben por todas las vías: oral, dérmica, conjuntival, parenteral, rectal e inhalatoria. Inhiben las colinesterasas y otras enzimas como la fosfatasa ácida, lipasa, tripsina, quimotripsina, etc. Su principal acción es sobre la acetilcolinesterasa (colinesterasa eritrocítica) y la colinesterasa plasmática (butirilcolinesterasa). Producen una unión muy estable "irreversible", por fosforilación enzimática, produciendo inhibición de acetilcolinesterasa (ACE) (7).
Los carbamatos, plaguicidas derivados del ácido carbámico, son sustancias biodegradables y no acumulables. Son inhibidores de la colinesterasa en forma reversible por carbamilación enzimática. La sintomatología por intoxicación con carbamatos es corta y menos severa que con compuestos organofosforados (OF) excepto en casos de carbofuran y aldibarb los cuales se comportan de manera muy severa (10,12).
Categorías tóxicas según DL50
Es la clasificación exclusiva para sustancias de tipo plaguicida, determinada por el Ministerio de la Protección Social definida en el Decreto 1843 de 1991; la cual tomó en cuenta los siguientes criterios (8):
a. Dosis letal media oral y dérmica, concentración letal inhalatoria para ratas
b. Estudios de toxicidad crónica
c. Efectos potenciales carcinogénicos, mutagénicos y teratogénicos
d. Presentación y formulación
e. Formas y dosis de aplicación
f. Persistencia y degradabilidad
g. Acción tóxica aguda, subaguda y crónica en humanos y animales
h. Factibilidad de diagnóstico médico y tratamiento con recuperación total
i. Efectos ambientales a corto plazo.
Internacionalmente está establecido que los envases y empaques de plaguicidas deben llevar una banda del color que identifique la categoría toxicológica del contenido (Tabla 3).

Fisiopatología
Los organofosforados envenenan a insectos y mamíferos principalmente por la fosforilación de la enzima acetilcolinesterasa (ACE) en las terminaciones nerviosas. El neurotranmisor acetilcolina es degradado continuamente por la acetilcolinesterasa. La excesiva estimulación de los receptores de acetilcolina ocurre como resultado de una inhibición de la colinesterasa o por estimulación directa de los receptores de acetilcolina.
La acetilcolina es el mediador químico responsable de la transmisión fisiológica del impulso nervioso de:
a. Las neuronas pre-ganglionares a las postganglionares en los sistemas parasimpáticos y simpáticos (receptores nicotínicos).
b. Las fibras post-ganglionares parasimpáticas a los órganos efectores y de las fibras post ganglionares simpáticas a las glándulas sudoríparas (receptores muscarínicos).
c. Los nervios motores al músculo esquelético.
d. Algunas terminaciones nerviosas en el SNC (13).
Existen dos tipos de receptores para este neurotransmisor: el receptor muscarínico, (receptor vinculado a proteínas G) y el receptor nicotínico (que contiene canales de sodio). Inmediatamente, tras ser liberada del receptor, la acetilcolina es hidrolizada por la colinesterasa, lo que produce la brevedad y unidad de cada impulso propagado (Figura 1). Los organofosforados (OF) reaccionan con la zona esterásica de la colinesterasa formando una unión estable que, si no se rompe mediante el tratamiento, envejece y se hace irreversible, quedando la enzima inhabilitada para su función normal. La acetilcolina se acumula entonces en la hendidura sináptica. Una pequeña acumulación da lugar a gran estimulación, mientras que un exceso superior tiene el efecto contrario (11,13).
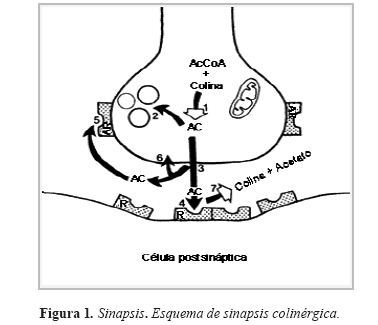
El resultado es la pérdida de la actividad o funcionalidad de la enzima acetilcolinesterasa, por lo cual el órgano efector es sobre-estimulado, por la acetilcolina excesiva, en las terminaciones nerviosas. La enzima es imprescindible para el control normal de la transmisión de los impulsos nerviosos, que van desde las fibras nerviosas hasta las células musculares, glandulares, células nerviosas en los ganglios autónomos y sistema nervioso central (SNC). Cuando la dosis tóxica es suficientemente alta, la pérdida de la función enzimática permite la acumulación de acetilcolina (AC) en las uniones colinérgicas neuroefectoras (efectos muscarínicos), en las uniones mioneurales del esqueleto y los ganglios autónomos (efectos nicotínicos) y en el sistema nervioso central (SNC). (14,15). (Figura 2). Los plaguicidas tipo carbamatos son derivados del ácido carbámico, son inhibidores de la colinesterasa en forma reversible, produciendo carbamilación enzimática, en general son de menor toxicidad que los OF, exceptuán dose el aldicarb, el carbofurán, el metomil y el nudrín.(10,16)
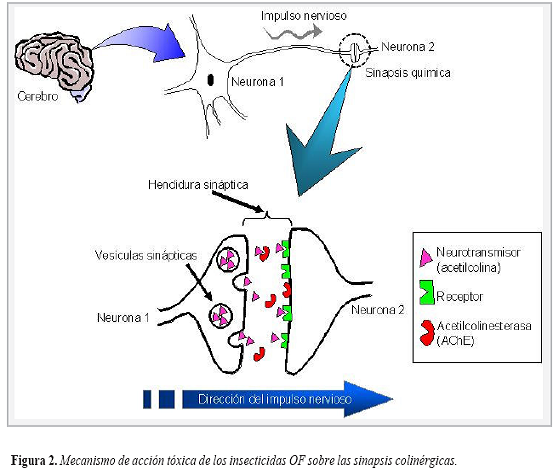
Una concentración alta de acetilcolina en las uniones colinérgicas nerviosas con el músculo liso y las células glandulares puede causar contracción del músculo y secreción, respectivamente. En las uniones músculo-esqueléticas, el exceso de acetilcolina puede ser excitatorio (causa espasmos musculares). Altas concentraciones de acetilcolina en el sistema nervioso central causan alteraciones sensoriales y del comportamiento, incoordinación, depresión de la función motora y depresión respiratoria. El aumento en las secreciones pulmonares y la depresión respiratoria son las causas usuales de muerte en el envenenamiento por organofosforados (11,13,14). Además se ha descrito la asociación entre la exposición a pesticidas y el desarrollo de asma mediada por IgE, al igual que un efecto potencialmente relevante en la inducción y complicación de la crisis asmática. Entre los pesticidas más involucrados con esta patología respiratoria encontramos tres OF: malathion, parathion y chlorpyrifos, el paraquat y un ditioca rbamato (el EPTC). (17,18)
El mecanismo por el cual, los organofosforados (OF) y los carbamatos, inducen cardiotoxicidad es incierto. Se han descrito tres fases fisiopatológicas de cardiotoxicidad, después de intoxicación aguda por organofosforados (OF): un período breve, de aumento en el tono simpático; un período de actividad del sistema parasimpático y un período de alteración electrocardiográfica con prolongación de Q-T, seguido por "torsade del pointes", taquicardia ventricular y fibrilación ventricular. La mayoría ocurre durante las primeras horas después de la exposición. La hipoxemia, la acidosis y la descompensación electrolítica son los mayores factores predisponentes para el desarrollo de éstas complicaciones. Una vez esta condición se reconoce, el paciente debe ser inmediatamente transferido a un cuidado intensivo o coronario, para monitoreo y vigilancia permanente (4,19).
Cuadro clínico
Síndrome colinérgico
Es el síndrome clínico que resulta de la excesiva estimulación de los receptores de acetilcolina. Se caracteriza por cambios en el estado de conciencia, debilidad muscular y excesiva actividad secretora. El síndrome colinérgico se manifiesta con efectos muscarínicos, nicotínicos y en el sistema nervioso central. (14,20,21) (Tabla 4.)
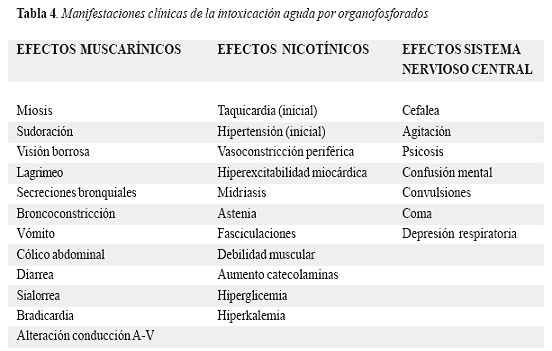
Alteración conducción A-V
La neurotoxicidad de los OF, se explica especialmente por las denominadas reacciones colinérgicas, que ocurren de dos formas:
a. Las que ocurren al poco tiempo de haber ocurrido la exposición al plaguicida y que corresponden a una hiperexcitación de los receptores muscarínicos postsinápticos en la unión neuromuscular por parte de la acetilcolina, conocidas como reacciones colinérgicas "Tipo I".
b. Las que aparcen en forma tardía, luego de 48 a 96 horas de la intoxicación y ocurren por hiperestimulación de los receptores nicotínicos postsinápticos de la unión neuromuscular, las cuales se denominan reacciones colinérgicas "Tipo II" (o síndrome intermedio) (26,37,48).
Síndrome intermedio
El término "síndrome intermediario" se aplica al cuadro caracterizado por recaída clínica, con gran debilidad muscular que aparece 24 a 96 horas después de la exposición. Puede estar asociado a una terapia insuficiente con oximas (4). Este síndrome aparece generalmente, luego de 4-5 días de iniciado el episodio agudo tóxico; se caracteriza por parálisis respiratoria aguda, debilidad de músculos flexores de la nuca, lengua y faringe, músculos proximales de las extremidades y músculos del tórax, con compromiso de la función respiratoria, ausencia o disminución de los reflejos osteotendinosos, debilidad en el territorio de nervios craneales motores principalmente el sexto (oftalmoparesia externa), asociado a síntomas nicotínicos el tratamiento con atropina y oximas no influencia el curso clínico del síndrome intermedio (10). En un estudio prospectivo sobre síndrome intermedio en intoxicación por organofosforados realizado por Bleecker, Neucker y Colardyn en 1993, se demostró que el síndrome intermedio sólo ocurre en pacientes con inhibición prolongada de la acetilcolinesterasa y la presencia del síndrome no depende del tipo de agente tóxico involucrado. También se encontró que las alteraciones de pares craneanos y la depresión de los reflejos tendinosos fue lo que primero se recuperó; la debilidad de músculos de la nuca y la depresión respiratoria lo último en recuperarse (10,13,14,26).
Síndrome neurotóxico tardío
Los organofosforados fosforilan otras enzimas: fosfatasa ácida, aliesterasas, lipasas, tripsina, quimotripsina, succino-oxidasa, oxidasa-ácido ascórbico, deshidrogenasas, enzimas sulfhidrilo. Algunos pacientes, presentan una neurotoxicidad tardía, que se presenta entre la primera y tercera semana de evolución de la infección aguda por organofosforados, producida a través de la inhibición de la actividad de una proteína de la célula nerviosa a la que se ha dado el nombre de esterasa neurotóxica o esterasa diana de neurotoxicidad (NET), lo cual lleva a degeneración axonal en grandes neuronas distales. El cuadro clínico se caracteriza por parestesias en pies y manos, dolor en las pantorrillas, debilidad progresiva y ascendente, arreflexia generalizada, que suele iniciar con compromiso del reflejo aquiliano. Estudios electromiográficos y de conducción nerviosa son útiles para diferenciarla de síndrome de Guillan- Barré, ya que esta última es una lesión desmielinizante y no siempre axonal, como ocurre en la in toxicación por organofosforados (IOF) (20,22,23). Actualmente se ha asociado la exposición crónica a organofosforados con síntomas extrapiramidales y psiquiátricos como psicosis, ansiedad, depresión, alucinaciones, agresividad, e incluso se ha asociado como una de las causas de la enfermedad de Parkinson y Alzheimer (24,26). En niños se ha demostrado además que la intoxicación por organofosforados puede producir trastornos del desarrollo psicomotor, con alteración de pruebas neuroconductuales como se observa en intoxicación por algunos metales como plomo o mercurio (27).
Determinación de actividad colinesterásica
Se puede determinar como biomarcador de exposición o de efecto, en la intoxicación por organofosforados, la inhibición de la actividad de acetilcolinesterasa en eritrocitos, la actividad de la pseudocolinesterasa (butirilcolinesterasa) o de colinesterasas totales. Existen cuatro tipos de métodos para detección de la actividad de la colinesterasa: electrométrico, colorimétrico, cinético y tintométrico (8,28).
Lo ideal es medir la actividad de la colinesterasa eritrocitaria, por el método electrométrico de Michel. Este método mide el ácido producido por la acción de la acetilcolinesterasa sobre la acetilcolina en términos de cambio de pH en una solución tampón estándar en una hora. Se realiza en sangre heparinizada. Los valores normales de colinesterasa en sangre total, por este método se han determinado entre 91-64 opH/hora (28,29).
Como biomarcador de exposición, la inhibición de la actividad de ACE en intoxicación aguda por OF, se han determinado los valores presentados en la tabla 5 para establecer el nivel de intoxicación en leve, moderado o severo y los síntomas asociados a dichos valores (14,20,29-31).
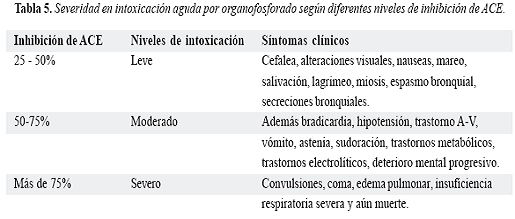
Un descenso en la actividad de la colinesterasa por debajo del 25%, en caso de exposición crónica, indica signos de intoxicación y debe retirarse la persona de la exposición en caso de contacto laboral (30). Algunos autores afirman que los síntomas de intoxicación por organofosforados aparecen cuando la actividad de la ACH ha disminuído en más de un 50% (14,20,30,31). Se debe tener en cuenta al evaluar un paciente o un trabajador que hay diversas patologías que pueden descender los niveles de acetilcolinesterasas como la desnutrición, enfermedades hepáticas, neoplasias, infecciones y en estados fisiológicos como el período menstrual, el embarazo y aún en período postprandial.
Se deberán tomar muestras sanguíneas seriadas para medir la actividad colinesterásica plasmática y los niveles de ACE en los glóbulos rojos, esto con el fin de determinar la efectividad del tratamiento. La depresión de la enzima plasmática persiste generalmente durante varios días a pocas semanas. Se ha tratado de determinar una relación entre los niveles séricos de colinesterasa y severidad de la intoxicación por organofosforados. Las conclusiones es que no tienen ningún valor pronóstico. La falla respiratoria y el síndrome intermedio, se desarrollan casi exclusivamente en pacientes clasificados con intoxicación moderada o severa. La necesidad de asistencia ventilatoria es un indicador de severidad de la intoxicación, pero no se pudo relacionar su indicación con niveles séricos de colinesterasa, al igual que los requerimientos de atropina, tampoco están relacionados con los niveles séricos de colinesterasa (32).
Tratamiento
La descontaminación apropiada deberá ser realizada, de acuerdo a la vía de entrada, con baño corporal frecuente con agua y jabón, uso de shampoo para lavado del cabello, retirar ropa contaminada, uso de carbón activado y catártico. Se debe realizar decontaminación dérmica, ocular y gastrointestinal. La persona que atiende el paciente debe tomar todas las medidas de precaución para evitar pasar a ser otra víctima de la intoxicación por organofosforados, ya que puede haber absorción cutánea al contacto con piel, ropa, vómito o diarrea (31,33).
Hay que asegurarse que las vías aéreas estén despejadas. Intubar al paciente y aspirar las secreciones con un tubo de succión de diámetro grande, de ser necesario. Adminístrele oxígeno, antes de administrar la atropina, para minimizar así el riesgo de fibrilación ventricular. En casos de envenenamiento severo, podría ser necesario apoyar la ventilación pulmonar mecánicamente durante varios días (31,33).
Obtener al menos una vía venosa y en caso de convulsiones tratar con diazepam intravenoso (0.1-0.2 mg/k en niños o 2-10 mg en adultos), lo cual mejora la sobrevida del paciente y disminuye los efectos adversos producido por las convulsiones. En caso de presentar convulsiones trasladar inmediatamente a UCI para continuar manejo del paciente (14,20,33).
La atropina, amina terciaria, agente parasimpaticolítico, es el antídoto específico de los efectos muscarínicos, por competición a nivel de receptores, con la acetilcolina; debe ser administrada inmediatamente se sospecha el diagnóstico y se encuentre el cuadro clínico colinérgico establecido. No tiene efecto sobre los receptores nicotínicos (33). La dosis inicial es de 1 a 5 mg (0.01-0,02 mg/kg en niños) por vía endovenosa, diluído en solución salina; repetir cada 5 o 10 minutos hasta lograr disminuir las secreciones respiratorias, piel caliente (atropinización), vigilando taquicardia, angina, palpitaciones, excitación de origen central (visión borrosa, delirio, alucinaciones), retención urinaria. En los casos severos pueden requerirse dosis grandes de atropina (más de 100 mg). La administración excesiva de atropina se manifestará por agitación y taquicardia, por lo que el paciente debe permanecer bajo vigilancia clínica estricta y las dosis de atropina se administrarán a demanda. Mientras que la vía ve nosa no esté disponible, la atropina será administrada por vía intramuscular, subcutánea, endotraqueal o intraósea (niños). La dosis podrá disminuirse cuando los síntomas se mantengan estables durante por lo menos seis horas. Su eliminación se realiza entre 2-4 horas principalmente por vía renal (35-38).
En casos severos de síndrome colinérgico debido a intoxicación por plaguicidas organofosforados o agentes de guerra, deberá administrarse (si está disponible) un reactivador de la acetilcolinesterasa. Tanto la pralidoxima (Protopam, 2-PAM), como la obidoxima son efectivas. La dosis de pralidoxima es de 1-2 gr (20-40 mg/Kg) por vía intravenosa, lento (en 15-30 minutos), seguida de infusión continua de 8 mg/Kg/hora hasta la recuperación clínica y por el término de 24 horas por lo menos. Otra alternativa es la administración de pralidoxima por vía intravenosa o intramuscular a dosis de 1-2 gr (20-40 mg/Kg) cada cuatro horas. La dosis de obidoxima es de 4 mg/Kg por vía intravenosa seguida de infusión continua de 0.5 mg/Kg/hora hasta observación de recuperación clínica y por lo menos durante 24 horas. La presión sanguínea deberá medirse durante la administración debido a la posibilidad de que ocurra una crisis hipertensiva, vigilar efectos adversos como náuseas, cefalea, mareo, diplopía, hipertensión arterial , hiperventilación, taquicardia, laringoespasmo o rigidez muscular. La terapia temprana con oximas, durante las 24 horas de la infección aguda por organofosforados (OF), ha demostrado una disminución en la incidencia de síndrome intermedio y una recuperación más rápida de los efectos en el sistema nervioso central producido en la infección aguda por organofosforados (35,39). El tratamiento combinado con atropina y 2-PAM ha mostrado mejor respuesta tanto en su uso profiláctico como terapéutico. (37,38,41-43).
Todos los pacientes deberán permanecer bajo observación estricta después de cesar la terapia con oximas. En caso de recaída de las manifestaciones clínicas indicaría la necesidad de proseguir la terapia con oximas (25,37).
El uso de difenhidramina a dosis de 50 mg IV en adultos (1mg/Kg en niños) una sola dosis, o 50 mg (1mg/Kg) VO c/8 hr por SNG se ha recomendado como coadyudante en el tratamiento de la intoxicación aguda por organofosforados. Su mecanismo de acción no es claro, al parecer por la similitud en su estructura química con la acetilcolina, exista un mecanismo competitivo entre ambas sustancias, por los receptores colinérgicos nicotínicos principalmente. Las ventajas observadas en su uso son: reduce las cantidades de atropina a utilizar en la intoxicación por organofosforados (IOF), disminuye los síntomas miastemiformes y disminuye el riesgo de desarrollar síndrome intermedio (5).
El glicopirolato se ha estudiado como una alternativa terapéutica para la atropina; se ha encontrado un resultado similar en la utilización de infusión continua. Al parecer presenta como ventaja aparente con respecto al uso de atropina una menor incidencia de infecciones respiratorias. Esto podría representar una alternativa cuando existe la preocupación de infecciones respiratorias debido a secreciones excesivas y difíciles de controlar y ante la presencia de un nivel alterado de conciencia, donde la distinción entre la toxicidad por atropina o una recaída al envenenamiento por organofosforados es incierta (33,44).
En el tratamiento del paciente con intoxicación por organofosforados (IOF) están contraindicados los medicamentos que se mencionan a continuación, probablemente en casi todos los casos de envenenamientos por organofosforados: morfina, succinilcolina, teofilina, fenotiazinas y reserpina. Las aminas adrenérgicas deben administrarse sólo si existe indicación específica, por ejemplo, una hipotensión marcada (4,34,35).
Recientemente se ha postulado la hemoperfusión como un procedimiento efectivo en el tratamiento de la intoxicación por organofosforados (IOF), lo cual ayudaría a reducir la morbi-mortalidad producida por intoxicación por organofosforados. Sin embargo se demostró en un estudio clínico que es mínima la cantidad de pesticida removida, luego de la hemoperfusión y no se producen cambios significativos en los síntomas, curso clínico, ni en las complicaciones en los pacientes luego del procedimiento (45).
Otros medicamentos que se han tratado de utilizar en la intoxicación aguda por organofosforados son el bicarbonato de sodio y la clonidina, sin que hasta el momento exista suficiente nivel de evidencia médica de los beneficios que puede generar en este tratamiento (33). El sulfato de magnesio a dosis de 4 g/día IV, se ha venido utilizando para manejo de la hipertensión y algunos tipos de arritmias que se pueden presentar durante la intoxicación aguda por organofosforado como la torsión de puntas o las contracciones ventriculares prematuras; también se ha observado disminución en el número de días de hospitalización y en la mortalidad cuando se instaura el sulfato de magnesio en forma temprana en el tratamiento (38,46-50).
Conclusiones
La intoxicación por organofosforados (IOF) ocurre en todo el mundo, principalmente en países agrícolas y en vías de desarrollo. La exposición ocupacional y los intentos de suicidio son las principales causas de intoxicación por plaguicidas. Estos compuestos químicos son de uso diario y frecuente, principalmente en países en vía de desarrollo y de economía agrícola-pecuaria como Colombia. Es importante que el personal de los servicios de salud reconozca la clínica de la intoxicación, tanto de los casos leves como severos, estén preparados en forma óptima para el manejo de personas con intoxicación por organofosforados y de esta manera garantizar manejo clínico rápido y efectivo, que lleve a disminuir las complicaciones y secuelas producidas.
Es muy importante realizar estrategias a nivel nacional, departamental, municipal, tanto en el ámbito oficial como privado, con el objetivo disminuir el número de casos de intoxicación por plaguicidas. Estas medidas pueden ser:
1. Fomentar las medidas de prevención y promoción en salud por parte del personal de médico y paramédico, encaminadas a prevenir intoxicaciones agudas y crónicas a través de educación en cuidado de salud a la comunidad.
2. Realizar programas efectivos y confiables de Vigilancia Epidemiológica, para saber con certeza la magnitud del problema y poder tomar políticas adecuadas de intervención.
3. Capacitar de manera adecuada al personal que produce, transporta, comercializa y utiliza los plaguicidas sobre la forma adecuada de manejo y uso de elementos de protección personal que siempre se deben usar al tener contacto con estos químicos, incluyendo el manejo seguro de envases y residuos de plaguicidas.
4. Desarrollar prácticas de manejo integral de plagas (MIP) por parte de agrónomos y profesionales del agro que permitan utilizar dosis mínimas efectivas de plaguicidas y así brindar ambientes seguros en las áreas de trabajo.
5. Insistir en la protección de poblaciones vulnerables como la infantil para evitar que tengan contacto con estos productos y ocurran accidentes especialmente a nivel doméstico.
6. Identificar personas con depresión mayor o riesgo alto de suicidio, para realizar asesoría familiar, incluirlos en programas de salud mental y evitar además el fácil acceso a estos sustancias, ya que son utilizadas en forma frecuente con fines suicidas y homicidas.
En Colombia con el decreto 1562, de junio de 1984, se establecen los Sistemas de Vigilancia Epidemiológica, como un proceso regular y continuo de observación e investigación de las principales características y componentes de morbilidad, mortalidad y otros eventos en salud en una comunidad, basada en la recolección y divulgación de la información epidemiológica. Desarrollando esto podemos iniciar un conjunto de actividades o medidas tendientes a evitar la presencia de la intoxicación por plaguicidas, como evento epidemiológico y al observar el comportamiento del mismo en un futuro, evaluar las medidas de intervención a implementar. Las fichas de notificación individual obligatoria, de caso de intoxicación por plaguicidas establecidas por el Sistema de Salud Colombiano deben ser diligenciadas a nivel nacional para poder tener una base de datos confiable y adecuada. En esto debemos colaborar todos los médicos y personal de salud para lograr implementar modelos de Vigilancia Epidemiológica Simplificada, Cor riente o Clínica e intensificada en los distintos niveles contribuyendo así a mejorar la situación actual del país en este aspecto.
Referencias
1. Fernández F., Putze, M. Rodríguez G. et al. Intoxicaciones por productos Agrícolas: Anticolinesterásicos Y Paraquat. Anales. 2003; 26 (1). [ Links ]
2. http://www.fao.org. Guidelines for Legislation on the Control of Pesticidas. Food and Agricultura Organization of the United Nations. 1989. [ Links ]
3. WHO. Public Health impact of Pesticides Used in Agriculture. Ginebra: WHO 1990. [ Links ]
4. Murat S, Muhammed G. Intensive care management of organophosphate insecticide poisoning. Critical Care 2001; 5: 211- 215. [ Links ]
5. OPS. Situación Epidemiológica de las Intoxicaciones Agudas por Plaguicidas en el Istmo Centroamericano, 1992-2000. Boletín Epidemiológico 2002; 23(3). [ Links ]
6. FAO. 1998. Publicación Internacional para las Américas. [ Links ]
7. Comunidad Andina. Secretaria General. Decisión 436. Norma Andina para registro y control de plaguicidas químicos de uso agrícola. Junio 2002. [ Links ]
8. Ministerio de Agricultura y Desarrollo Rural. Subgerencia de Protección y Regulación Agrícola. Octubre 2003. Comercialización en Plaguicidas. [ Links ]
9. Tabares J.W., Galeano L., Bolívar J. Identificación de Factores de riesgo por el uso y manejo de Plaguicidas en las Cuencas que abastecen los acueductos de las cabeceras municipales, Antioquia. 1999 - 2001. Revista Epidemiológica de Antioquia. Vol. 26 (3-4) Julio-diciembre 2001. [ Links ]
10. Córdoba D, Cadavid I, Ramos J. Inhibidores de colinesterasas. En: Córdoba D. Toxicología. 4ta. Edición. Manual Moderno. Bogotá; 2001: 127-141. [ Links ]
11. Repetto M, Martínez D, Sanz P. Actualización de la toxicología de los plaguicidas. En: Repetto M. Toxicología avanzada. Editorial Díaz Santos. Madrid; 1995: 557-600. [ Links ]
12. Chang-Yao Tsao, Juang. LAN, et al.: Respiratory failure of acute organophosphate and carbamate poisoning. CHEST. 1990. 98 (3): 631-636. [ Links ]
13. Bradberry SM, Vale JA. Organophosphorus and Carbamate Insecticides. In: Brent J, Wallece K, Burkhart K, Phillips S, Donovan JW. Critical Care Toxicology: Diagnosis and Manegement of the Critically Poisined Patient. 1ra Edición. Ed. Elsevier Mosby. Philadelphia; 2005: 937-946. [ Links ]
14. Baer A, Kirk M, Holstege C. Organophosphates, Carbamates, Pesticides and Herbicides. In: Erickson T, Ahrens W, Ask S, Baum C, Ling L. Pediatric Toxicoloogy. Diagnosis & Management of the Poisoned Child. 1rt. Edition. Editorial McGraw-Hill. New York; 2005: 352-356. [ Links ]
15. Chambers JE, Oppenheimer SF. Organophosphates, Serine Esterase Inhibition, and Modeling of Organophosphate Toxicity. Toxicological Sciences 2004; 77: 185-187. [ Links ]
16. Perkins E, Schlenk D. Acetylcholinesterase Inhibition, Metabolism, and Toxicokinetics of Aldicarb in Channel Catfish: Role of Biotransformation in Acute Toxicity. Toxicological Sciences 2000; 53: 308-315. [ Links ]
17. Pierre E. Pesticide Exposure and Asthma. American Journal of Respiratory and Critical Care Medicine 2002; 165: 563-564. [ Links ]
18. Hoppin J, Umbach D, London S, Alavanja M, Sandler D. Chemical Predictors of Wheeze among Farmer Pesticida Applicators in the Agricultural Health Study. American Journal of Respiratory and Critical Care Medicine 2002; 165: 684-689. [ Links ]
19. Saadeh A, Farsakh N, Al-Ali M. Cardiac manifestations of acute carbamate and organophosphate poisoning. Heart 1997; 77: 461-464. [ Links ]
20. Clark R. Insecticides: Organophosphates and Carbamates. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS, editors. Goldfrank´s Toxicologic Emergencies, 7th edition. New York. Stamford: Appleton and Lange, 2002: 1347-1359. [ Links ]
21. Klaassen CD, Watkins J. Efectos tóxicos de plaguicidas. En: Cassaret LJ, Klaassen CD, Watkins J, Doull J. et all. Casarett and Doull´s Toxicollogy: The basic science of poisons. 6th Edición. Editorial McGraw-Hill. New York; 2001: 763-784. [ Links ]
22. Steeland K, Jenkins B. et al. Chronic Neurological Sequelae to Organophosphate Pesticida Poisoning. American Journal of Public Health 1994; 84 (5): 731-736. [ Links ]
23. Senanayake N, Karalliedde L. Neurotoxic effects of organophosphorus insecticidas. An intermediate syndrome. New England Journal of Medicine 1987; 316: 761-763. [ Links ]
24. Salvi R, Lara D, Ghisolfi E, Portela L, Dias R, Souza D. Neuropsychiatric Evaluation in Subjects Chronically Exponed to Organophosphate Pesticidas. Toxicological Sciences 2003; 72: 267-271. [ Links ]
25. Leon-s- Fidas E, Pradilla G. Neurological effects of organophosphorous pesticides. British Medical Journal 1996; 313: 690-691. [ Links ]
26. Angelo Moretto and Marcello Lotti. Poisoning by organophosphorus insecticides and sensory neuropathy. J Neurol. Neurosurg. Psychiatry 1998; 64:463-468. [ Links ]
27. Weiss B, Amler Sh, Amler R. Pesticidas. Pediatrics 2004; 113(4): 1030-1036. [ Links ]
28. Aprea C, Colosio C, Mammone T, Mimosa C, Maroni M. Biological monitoring of pesticida exposure: a review of analytical methods. Journal of Chromatography B. 2002; 769: 191-219. [ Links ]
29. Maroni M. Organophosphorous pesticidas. Toxicology. 2000; 142: 9-37. [ Links ]
30. Fillmore C, Messenger J. A cholinesterase testing program for pesticida applicators. Journal Occupational of Medicine. 1993; 35 (1): 61-70. [ Links ]
31. Dreisbach RH, Robertson W. Manual de Toxicología Clínica. 6ta edición. Editorial Manual Moderno. Bogotá; 1988: 95-104. [ Links ]
32. Nouira, Abroug, Elatrous, et al. Prognostic Value of Serum Cholinesterase in Organophosphate Poisoning. CHEST.1994; 106(6): 1811-1814. [ Links ]
33. Eddleston M, Singh S, Buckley N. Organophosphorus poisoning (acute). British Medical Journal. Clinical Evidence 2004;12: 1-3. [ Links ]
34. Eddleston M, Roberts D., Buckley N. Management of severe organophosphorus pesticide poisoning. Critical Care 2002; 6: 259. [ Links ]
35. Al Khod, Muscat, Oman .Potential therapeutic agents in the management of organophosphorus poisoning. Critical Care 2002; 6 (3): 260-261. [ Links ]
36. Taylor P. Anticholinesterase agents. En: Hardman JG, Limbird LE, Molinoff PB, editors. Goodmann and Gilman´s: The pharmacological basis of therapeutics, 9ª edición. New York: Macmillan, 1996: 161-176. [ Links ]
37. Sungur M, Güven M. Intensive care management of organophosphate insecticida poisoning. Critical Care 2001; 5 (4): 211-215. [ Links ]
38. Eddleston M, Darren Roberts D, Buckley N. Management of severe organophosphorus pesticide poisoning. Critical Care 2002; 6: 259. [ Links ]
39. Miller MA. Organophosphorus and Carbamate Insecticides. In: Olson K. Poisson & Drug Overdose. 4th edition. McGraw-Hill. New York; 2004: 291-295. [ Links ]
40. Petrikovics I, Papahadjopoulos D, Hong K, Cheng C, Bassin S, Jiang J et al. Comparing Therapeutic and Prophylactic Protection against the Lethal Effect of Paraoxon. Toxicological Sciences 2004; 77: 258-262. [ Links ]
41. DeSilva HJ, Wijewickrema R, Senanayake N. Does pralidoxime affect outcome of management in acute organophosphorous poisoning? Lancet 1992; 339: 1136-1138. [ Links ]
42. Johnson M, Vale J, Marrs T. Pralidoxime for organophosphorous poisoning. Lancet 1992; 340: 64. [ Links ]
43. Howland MA, Aaron CK. Antidotes in Depth. Pralidoxime. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS, editors. Goldfrank´s Toxicologic Emergencies, 6ª edición. Stamford: Appleton and Lange, 1998: 1445-1449. [ Links ]
44. Bradin, Stephan, Eeden. Organophosphate poisoning: Grading the severity and comparing treatment between atropine and glicopyrrolate. Critical Care 1990; 18 (9): 956-960. [ Links ]
45. Martínez, Chuecos, Jurado, Gimenez, et al. Experience with hemoperfusion for organophosphate poisoning. Critical Care. 1992; 20(11): 1538-1543. [ Links ]
46. Pajoumand A, Shadnia Sh, Rezaie A, Abdi M, Abdollahi M. Benefits of magnesium sulfate in the management of acute human poisoning by organophosphorus insecticidas. Human & Experimental Toxicology 2004; 23: 565-/569. [ Links ]
47. Bleecker JD, Neucker K, Colardyn F. Intermediate syndrome in organophosphorus poisoning: A prospective study. Critical Care Medicine 1993; 21(11): 1706-1711. [ Links ]
48. Silva H.J. Wijewickrema R, Senanayake, N. Does pralidoxime affect outcome of management in acute organophosphorus poisoning?. Lancet 1992; 339: 1136-1138. [ Links ]
49. Uribe M. G. Neurotoxicología. Asociación Colombia na de Neurología. Primera Edición. 2001: 117-135. [ Links ]
50. Ritz B, Yu F. Parkinson´s disease mortality and pesticida exposure in California 1984-1994. Internacional Journal of Epidemiology 2000; 29: 323-329. [ Links ]
51. Singh S, Sharma N. Neurological syndromes following organophosphate poisoning. Neurology India 2000; 48: 308-13. [ Links ]
52. Geller RJ. Atropine and Glycopyrrolate. In: Olson K. Poisson & Drug Overdose. 4th edition. McGraw-Hill. New York; 2004: 412-413. [ Links ]
53. Smulders Ch, Bueters T, Vailati S, Kleef R, Vijverberg H. Block of Neuronal Nicotinic Acetylcholine Receptors by Organophosphate Insecticidas. Toxicological Sciences 2004; 82: 545-554. [ Links ]













