Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.54 no.3 Bogotá July 2006
INVESTIGACION ORIGINAL
SE SOBREEXPRESA EN OSTEOBLASTOS SOMETIDOS A CENTRIFUGACIÓN
SUBMITED TO CENTRIFUGAL FORCES
Carlos A.Guerrero F. 1 , Constanza Martínez 2, Jairo Sarmiento 3 , Carmen A. Cardozo 4
1. MSc, PhD. Profesor Asociado, Laboratorio de Biología Molecular y Celular de virus, Unidad de Bioquímica, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá.
Correspondencia:guerra039@yahoo.com
2.Investigadora Grupo de Reactivos Biológicos, Instituto de Biotecnología, Universidad Nacional de Colombia, Bogotá.
3. Investigador Grupo de Reactivos Biológicos, Instituto de Biotecnología, Universidad Nacional de Colombia, Bogotá.
4.Profesora. Facultad de Odontología, Universidad Nacional de Colombia, Bogotá.
Resumen
Antecedentes. El osteoblasto tiene la capacidad de estimular la neoformación del tejido óseo, mediante la síntesis de proteínas tales como las proteínas morfogenéticas, factores de crecimiento y proteínas colágenas y no colágenas. A su vez, indirectamente controla los procesos de reabsorción sintetizando otra serie de proteínas estimuladoras de la actividad osteoclastogénica.
Objetivo. El propósito de este trabajo de investigación fue analizar la expresión de la proteína de choque térmico HSC70 en un cultivo primario de osteoblastos, después de someterlo a una fuerza tensil mediante centrifugación, determinando el patrón de proteínas mediante análisis electroforético.
Material y métodos. A partir de cráneos de ratones lactantes ICR se obtuvieron cultivos de células con características morfológicas tipo fibroblastoide, con prolongaciones alargadas y citoplasmas ligeramente cuboidales que sugiere un cultivo enriquecido de osteoblastos; los cuales fueron sometidos a centrifugación y se analizó por inmunocitoquímica, electroforesis y Western blot la expresión diferencial de la proteína HSC70.
Resultados.La técnica de electroforesis SDS-PAGE unidimensional no permitió determinar diferencias en el patrón de corrido entre osteoblastos tratados respecto a los no tratados con la fuerza tensil. Sin embargo, la proteína HSC70 se sobre-expresa en osteoblastos sometidos a centrifugación analizada mediante la técnica de Western blot e inmunohistoquímica.
Conclusión.Aunque la electroforesis no determinó diferencias en el patrón de corrido, la proteína de estrés HSC70 se sobre-expresó en osteoblastos sometidos a centrifugación analizada mediante la técnica de Western blot e inmunocitoquímica, sugiriendo que es importante en este tipo de estrés.
Palabras clave: proteínas, proteínas de choque térmico HSC70, osteoblastos, electroforesis, inmunocitoquínica, western blotting.
Summary
Background. Osteoblasts can stimulate new bone formation by protein synthesis, such as, bone morphogenetic proteins, growth factors and collagen and non-collagenous proteins. As well, they controls reabsortion processes, because they can synthesize proteins to promote osteoclastogenic activity, when necessary.
Objetive. The objetive of this work was analyze the expression of the heat shock cognate protein HSC70 in a primary culture of murine osteoblasts, after putting under a tensil force by centrifugation and determining the protein pattern by electrophoretic analysis.
Materials and methods. From skulls of newborn mice ICR, cultures of cells were obtained with morphologic characteristics fibroblasts-like type, extended prolongations and cytoplasms slightly cuboidal and plump, it suggests an enriched culture of osteoblasts.
Results. The technique of unidimensional electroforesis SDS-PAGE did not allow determine differences in the run pattern between osteoblasts treated with tensil force and control cells. Nevertheless, protein HSC70 overexpresion in osteoblasts was confirmed by Western blot and inmunocytochemistry on-are expressed.
Conclusions. Electroforesis did not determine differences between control cell and cell submited to centrifugation. Stress protein HSC70 was expressed in osteoblasts submitted to centrifugación analyzed by Western's blot technology suggesting a important roll of this stres type.
Key words: proteins, HSC70 heat-shock proteins, osteoblasts, electrophoresis, immunohistochemistry, blotting, Western.
Introducción
Al elaborar el diagnóstico y plan para el tratamiento en los pacientes que se someten a tratamientos de ortodoncia, se analizan todas las fuerzas que se ejercen sobre los dientes y tejidos de soporte para asegurar el éxito del tratamiento (1-5). Sin embargo, a pesar de que las fuerzas mecánicas son el fundamento del mismo, no se ha reportado en la literatura el análisis de las proteínas sintetizadas por las células después de estímulos mecánicos que están relacionados con los procesos de resorción ósea fisiológica y patológica. Los osteoblastos expresan marcadores fenotípicos como fosfatasa alcalina, colágeno tipo I y osteocalcina, entre otros (6-8) y el osteoclasto es la célula efectora de la reabsorción ósea, su función es regulada por células del linaje osteoblástico probablemente a través de diversos mecanismos inter-relacionados, por ejemplo, el RANKL (9-12) y otros factores de crecimiento que actúan sobre los componentes de la matriz ósea (13).
La relación entre fuerzas mecánicas y remodelado óseo se utiliza en ortodoncia donde las fuerzas mecánicas ejercidas sobre las raíces de los dientes, posibilitan su movimiento a través del alvéolo. Surge entonces una pregunta de cómo responden las células óseas a un estímulo mecánico. Se sabe que un estrés mecánico activa la cascada de transducción intracelular (14) y que el remodelado óseo es una secuencia coordinada de eventos de células mediadoras (15). Un estimulo mecánico genera proliferación de células óseas. Sin embargo, el mecanismo bioquímico involucrado en la conversión de estímulos de señales en osteoblastos no se ha dilucidado en su totalidad (16,17).
Sandy y colaboradores encontraron un incremento en el cAMP y del fosfatidil inositol cuando se deformaron mecánicamente células durante 30 minutos (18). Carvalho y Scott aplicaron fuerzas mecánicas a osteoblastos cultivados en discos flexibles de Petri utilizando el Flexercell Strain unit Sistem, por períodos entre seis y 24 horas. En estos trabajos los resultados se midieron con técnicas de inmunohistoquímica para receptores alfa 1, alfa 2, alfa 3 e integrina B1 (19, 20). La cuantificación de la síntesis de estas proteínas fue hecha por inmunoprecipitación. Los resultados mostraron que las fuerzas mecánicas incrementaban significativamente la síntesis de integrinas y también afectaban la distribución de todas las proteínas involucradas (19).
La respuesta de las células osteoblásticas a las fuerzas mecánicas demuestran que la adaptación del citoesqueleto está en asociación con una síntesis aumentada de integrinas sugiriendo que las integrinas y las proteínas relacionadas con el citoesqueleto aportan una posible vía a través de la cual la fuerza mecánica es transmitida a las células. Igualmente, los organismos vivos responden a estímulos estresantes aumentando la síntesis de un grupo de proteínas colectivamente llamadas proteínas de estrés (21). La proteína "heat shock cognate" HSC70 pertenece a la familla de las proteínas de choque térmico de 70 kDa (hsp's70) y se identificó primero en células sometidas a estrés, aunque posteriormente se encontró también en células no estresadas. La familla HSP70 se clasifica según la expresión de la proteína en la célula, como proteínas de expresión constitutiva que incluyen la HSC 70, grp75 mitocondrial, grp78 o BIP de retículo endoplásmico y en proteína de expresión inducible como la "heat shock protein" HSP70 y la HSP 72 (21-26).
La proteína HSC70 se asocia transitoriamente a cadenas polipeptídicas nacientes, previniendo plegamientos prematuros o agregaciones durante la síntesis protéica; así mismo, se requiere para el traslado de polipéptidos precursores a través de las membranas de la mitocondria, del retículo endoplásmico y de lisosomas (27,28). Además, se ha encontrado que las HSP están involucradas en la disociación de complejos protéicos, de manera dependiente de ATP (29,30). También, por citometría de flujo e inmunofluorescencia, se ha encontrado que la proteína HSC70 está en la superficie de la membrana citoplasmática (31-37).
En este trabajo, nos propusimos investigar la expresión de la proteína HSC70 en un cultivo primario de osteoblastos, en las células sometidas a fuerza tensil por centrifugación.
Material y métodos
Obtención de osteoblastos. Los ratones de la cepa ICR de 5-7 días de edad obtenidos de la sala de experimentación del laboratorio de Biomiméticos del Instituto de Biotecnología, se sacrificaron por decapitación dentro de los parámetros internacionalmente aceptados de eutanasia y sus cráneos se disecaron retirando el tejido blando, posteriormente se lavaron con PBS que contenía calcio y magnesio por 10 minutos. Luego se sometieron a digestión enzimática con colagenasa (Sigma) y tripsina (Sigma) a una concentración de 1 mg/ ml por tres veces durante 30 minutos.
Las células liberadas con la última digestión se cultivaron en frascos T25, mantenidas en DMEM suplementado con suero fetal bovino al 10 por ciento, 100 U/ml de penicilina, 100ug/ml de estreptomicina, 0,25 ug/ml de anfotericina B, beta-glicerofosfato 10mM, L-ácido ascórbico 2 fosfato 100 uM y dexametasona 100 nM (medio osteogénico). El medio se cambió cada tercer día y los cultivos se mantenieron en un ambiente de 37 °C 95 por ciento de aire y 5 por ciento de CO 2 .
Se hizo conteo celular y prueba de viabilidad con azul de tripan. Los osteoblastos empleados para las diferentes pruebas descritas en este trabajo fueron células obtenidas durante los primeros 15 días de cultivo. Sin embargo, el cultivo se mantuvo en óptimas condiciones hasta por 30 días.
Inmunocitoquimica. Se utilizaron anticuerpos para identificar marcadores característicos de los osteoblastos: osteopontina (OPN), osteonectina (ON), Cbfa1, osteoprotegerina (OPG) o para evaluar la expresión de la proteína HSC70 (Todos de Santacruz Biotechnology). Se hizo la estandarización necesaria para detectar la concentración ideal de anticuerpo primario en cada caso, dando como resultando (todos los anticuerpos fueron de Santacruz Biotechnology): osteonectina 1:100, osteopontina 1:300, osteoprotegerina 1:200, Cbfa1 1:50 y HSC70 1:100. Igualmente se detectó la capacidad proliferativa de dichas células con el anticuerpo anti-PCNA con una dilución de 1:1000. Sobre laminillas cubreobjetos, con un número aproximado de 100.000 células/laminilla, se fijaron con paraformaldehido al 4 por ciento, durante una hora. Luego se permeabilizó con triton X100 al 0.1 por ciento en PBS por 30 minutos. Posteriormente, se inactivó la peroxidasa endógena con peróxido de hidrógeno al 0.3 por ciento en metanol, durante 30 minutos a temperatura ambiente. Luego las células se bloquearon con albúmina al 1 por ciento, durante 30 minutos. Se incubaron con el anticuerpo primario una hora a 37 °C o toda la noche a 4 °C 1:100 (SC1059 Santa Cruz). Luego de tres lavados se incubaron con el anticuerpo secundario biotinilado (1:400) de VECTOR, durante una hora a temperatura ambiente; luego la avidina–peroxidasa de VECTOR se incubó por 1 hora a temperatura ambiente. El revelado se hizo con diaminobenzidina al 0.1 por ciento y se contra-coloreó con hematoxilina de Mayer. El montaje de las láminas se hizo con permount previa deshidratación de las mismas.
Para analizar la expresión de la proteína HSC70 no se utilizó un control positivo porque esta proteína se expresa constitutivamente en todas las células. Además el anticuerpo ya se había utilizado en la misma técnica en la línea celular MA104.
Estímulos mecánicos. Se sembraron osteo-blastos sobre laminillas cubreobjetos (1cm de diámetro) en cajas de 24 pozos (aproximadamente 50.000 células /pozo) y se dejaron proliferar durante dos días antes de aplicar el estimulo. Posteriormente las laminillas, sin medio de cultivo, con las células adheridas se colocaron dentro de tubos Falcon de 15 ml y se centrifugaron (1000 o 2000 rpm) en una centrífuga clínica (DINAC, Becton Dickinson) durante cinco o 10 minutos. Como control se utilizaron osteoblastos los cuales no se centrifugaron y permanecieron sin medio el mismo tiempo que las células sometidas a centrifugación. Las laminillas con las células se recuperaron y se utilizaron para tres técnicas: inmunocitoquímica, electroforesis SDS-PAGE y Western blot.
Electroforesis SDS-PAGE. Aplicadas las fuerzas tensiles, las células se lisaron con buffer RIPA ( 150 mM NaCl, 1% NP-40, 0,5% DOC, 0.1% SDS, 50 mM Tris, pH 8). El lisado celular se resuspendió en buffer de disociación (Tris HCl 0,065 M , pH 6,8; SDS 2% p/v; 2 b-mercaptoetanol 5% v/v; EDTA 2mM y glicerol 10% v/v) y se hirvió por tres minutos. Las muestras se agitaron en vortex y se centrifugaron a 10000 Xg por 10 segundos. La electroforesis se condujo a 20 mA por lámina de gel (8 X 5 cm y 0.75 de grosor) y se detuvo cuando el marcador azul de bromofenol alcanzó el extremo del gel. Los geles se tiñeron con nitrato de plata de acuerdo con las metodologías descritas por Blum (38) y Acosta y Mayo (39) o con azul de Coomassie.
Western Blot. Finalizada la electroforesis SDS-PAGE la transferencia se hizo en condiciones semisecas siguiendo el protocolo del fabricante (Sigma-Aldrich). El gel que se transfirió se tiñó con nitrato de plata y la membrana se reveló (40). El anticuerpo primario con dilución 1:1000 (SC1059 Santa Cruz) se incubó en PBS y azida de sodio al 0.02 por ciento durante toda la noche a 4°C . El anticuerpo (Santacruz Biotechnology) secundario conjugado con proteína peroxidasa (1:2500) se incubó durante hora y media a temperatura ambiente en PBS. La banda correspondiente se visualizó mediante la técnica de Luminol o la membrana se reveló con solución reveladora que contenía 6 mg de 3,3-Diaminobenzidina por cada 10 ml del buffer de revelado, junto con 3 mg de cloruro de cobalto y 100 μ l de H 2 O 2 al 3 por ciento y la reacción se detuvo cuando se visualizó la banda correspondiente.
Resultados
Se obtuvieron células a partir de cráneos de ratones lactantes ICR con características morfológicas tipo fibroblastoide con prolongaciones alargadas y citoplasmas ligeramente cuboidales. Dichas células presentaron su confluencia total en frascos de 35 mm 2 entre cinco y ocho días después de sembrados. Se realizó subcultivo cada ocho días conservando una alta capacidad proliferativa durante un mes demostrada mediante la expresión del antígeno de proliferación celular nuclear (PCNA). PCNA es un marcador de proliferación comúnmente utilizado. Se encontró que durante los 30 días que se mantuvo el cultivo celular, aproximadamente el 80 por ciento de las células eran positivas para el PCNA, sugiriendo que el cultivo se mantuvo viable y con buena actividad proliferativa Figura 1 y Figura 2. Este control es muy importante cuando se realizan cultivos primarios porque puede disminuirse la capacidad proliferativa, envejecer el cultivo y los resultados se tornan de difícil interpretación.
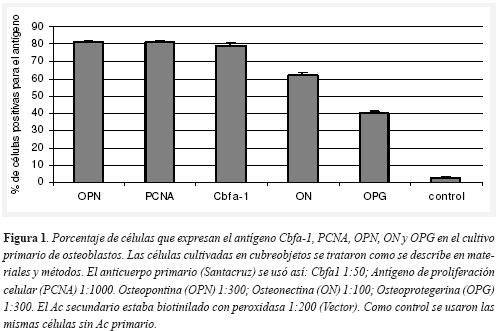

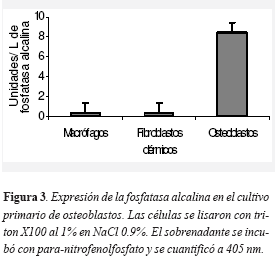
Igualmente, se corroboró que el cultivo estaba enriquecido con osteoblastos. Para esto se analizó el porcentaje de células del cultivo que presentaran marcadores "específicos" de osteoblastos. Los resultados indican que aproximadamente el 80 por ciento de las células expresaron Cbfa-1 y OPN, el 60 por ciento ON y el 50 por ciento OPG (Figura 1). Igualmente el cultivo presentó actividad de fosfatasa alcalina, medida por colorimetría (Figura 3). En esta técnica como control se utilizaron macrófagos pleurales humanos de la linea U937A y fibroblastos dérmicos. En conjunto, estas técnicas determinaron que se tenía un cultivo primario enriquecido de osteoblastos.
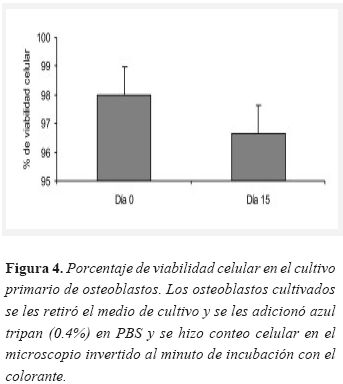
El cultivo se mantuvo en óptimas condiciones hasta por 30 días, aunque los osteoblastos empleados para las diferentes pruebas descritas en este trabajo tenían 15 días de cultivo. La viabilidad se examinó con azul tripan encontrándose valores de 98 por ciento el día cero y 97 por ciento el día 15 (Figura 4).
Para determinar si existían cambios en la expresión de proteínas en los osteoblastos luego de someterlos a la fuerza centrífuga, las células se lisaron para analizar su patrón electroforético. La electroforesis SDS-PAGE unidimensional revelada con tinción de Coomassie o con nitrato de plata (Figura 5) no permitió establecer diferencias en el patrón de corrido entre osteoblastos tratados respecto a los no tratados. Con estos resultados se determinó no realizar electroforesis bidimensional dado que posiblemente no cambien los resultados o los cambios sutiles sean de difícil interpretación. Se prefirió analizar si la proteína de estrés conocida como HSC70 (Heat Shock Cognate) se sobreexpresaba luego de someter las células a la fuerza tensil que se genera al centrifugar.
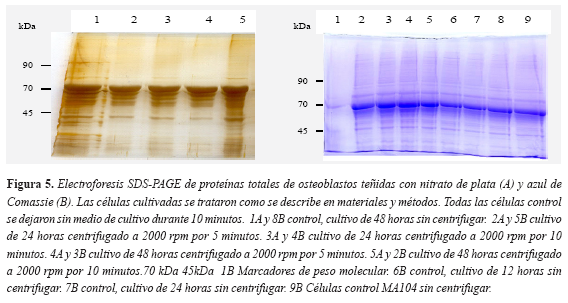
Para determinar si existían cambios en la expresión de la proteína de estrés HSC70 en los osteoblastos luego de someterlos a la fuerza centrífuga, las células se lisaron y se estandarizaron las concentraciones equivalentes de proteína procedente de las células sometidas a los diferentes tratamientos y de las células control (Figura 5). El Western blot de los diferentes tratamientos y los controles sugieren que la proteína de estrés HSC70 aumenta su expresión en todas las células sometidas a la fuerza tensíl con respecto a las células control. No se encontraron diferencias evidentes, con esta técnica, entre las células a las que se les aplicó la fuerza durante cinco o diez minutos (Figura 6). No se aplicó más tiempo de centrifugación porque había desprendimiento de algunas células y porque pueden entrar en estrés por falta de alimento, aunque por experiencia en nuestro laboratorio sabemos que las células en cultivo pueden tolerar hasta 15 minutos el no estar con medio de cultivo, sin sufrir cambios evidentes que afecten la proliferación y duplicación posterior.
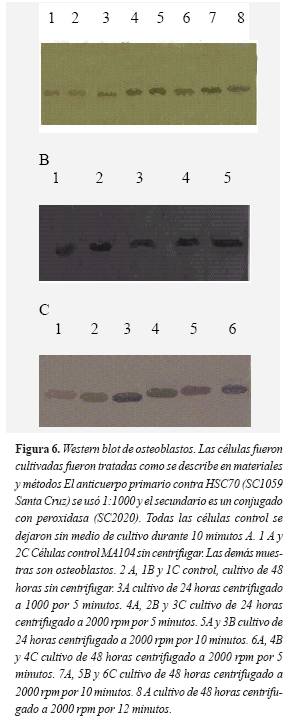
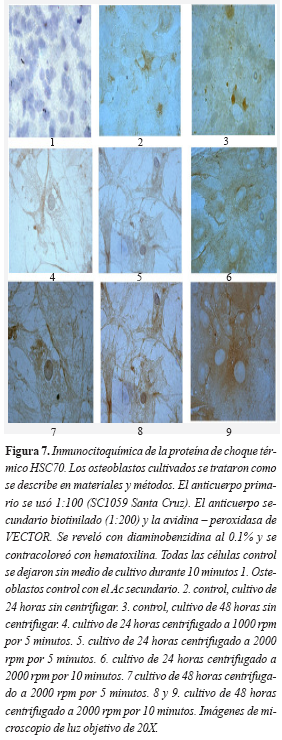
Igualmente, luego de aplicar la fuerza tensil, las células se fijaron con paraformaldehido al 4 por ciento y se permeabilizaron con triton X100 para incubarlas con el anticuerpo contra HSC70 y evaluar su expresión. Los resultados sugieren que la proteína de estrés aumenta su expresión en las células sometidas al estrés respecto a las células control. No se apreciaron diferencias entre los distintos tiempos de cultivo (24 ó 48 horas), ni el tiempo de aplicación de la fuerza (cinco o diez minutos).
La detección de la HSC 70 se hizo simultáneamente en todas las laminillas de los distintos tratamientos. Al aplicar 1000 rpm la tinción parece ser más débil que al aplicar 2000 rpm. Aunque el dato es reproducible es de difícil interpretación pues en este caso interpretar la intensidad de la tinción es subjetiva. En cambio si existen marcadas diferencias entre las células control, a las cuales no se les aplicó la fuerza y permanecieron sin medio de cultivo durante diez minutos, y las que recibieron el tratamiento (Figura 7).
Discusión
La técnica aquí descrita permitió obtener un cultivo enriquecido de osteoblastos a juzgar por sus características morfológicas, inmunocitoquímicas y por la expresión de la enzima fosfatasa alcalina. La viabilidad y el crecimiento celular fueron adecuados durante el mes de cultivo de los osteoblastos. Esto se determinó por la expresión del antígeno de proliferación celular nuclear (PCNA) y por la viabilidad con azul tripan. El porcentaje de células con marcadores "característicos" de osteoblastos (80% de las células expresaron Cbfa-1 y OPN, el 60% ON y el 50% OPG) no alcanzó el 100 por ciento ni fue homogéneo, sugiriendo que en el cultivo pueden existir un porcentaje de células que no son osteoblastos o que la expresión de tales antígenos varía dependiendo del momento del ciclo celular en que se encuentre la célula.
La técnica de electroforesis SDS-PAGE unidimensional, revelada con azul de Coomassie o nitrato de plata, no permitió determinar diferencias en el patrón de corrido entre osteoblastos tratados respecto a los no tratados con la fuerza tensil. Esto sugiere que no hay expresión diferencial evidente en el número de proteínas implicadas en el estrés por tensión respecto al control. Si las hubiese, tales diferencias no pueden ser detectadas por este método. Las diferencias en cantidad tampoco son fácilmente detectadas por este sistema. Por esta misma razón se determinó no realizar electroforesis bidimensional dado que posiblemente no cambien los resultados o los cambios sutiles sean de difícil interpretación. Al aplicar una fuerza tensil a la célula, en este caso como gravedades, genera estrés, por esta razón se determinó analizar si la proteína de estrés HSC70 (Heat Schock Cognate) se sobreexpresa luego de centrifugar las células.
Las técnicas de inmunocitoquímica y de Western blot indican que la proteína HSC70 aumenta su expresión en todas las células que se sometieron a la fuerza tensíl con respecto a las células control. Esto permite especular que al aplicar la fuerza probablemente se desestabilizan las uniones existentes entre las macromoléculas de la matriz extracelular, las de membranas citoplasmáticas y el citoesqueleto produciendo en la célula un estrés bioquímico. Probablemente la célula aumenta todas las proteínas de estrés, incluida la HSC 70, intentando estabilizar las proteínas que interrumpen su unión y pudieran asociarse de manera anómala produciendo interacciones inespecíficas. Llama la atención que haya una fuerte tinción en las prolongaciones donde establecen contacto las células. Esta zona quizá sufre una fuerte tensión, al igual que el citoesqueleto. La proteína HSC70 está muy ligada con el citoesqueleto y con la membrana citoplasmática, específicamente con actina. Por esto, no sorprende que aumente su expresión en esta zona de estrés generada por la fuerza de gravedad aplicada a la célula. La técnica no permite distinguir diferencias de expresión entre las células a las que se les aplicó la fuerza durante cinco o diez minutos (Figuras 6 y 7). Si hubiese diferencias probablemente solo se detecten al examinar la HSC 70 mediante la técnica de citometría de flujo (FACS).
Se decidió utilizar la fuerza de gravedad para representar la fuerza mecánica producida en ortodoncia porque solamente se requiere de una centrífuga de células, el tratamiento se aplica en corto tiempo y ésta se distribuye homogénea mente en todas las células de la laminilla, además se manejan todas las células de un mismo tratamiento simultáneamente.
No se ha determinado la expresión genética implicada en el movimiento dental, ni cómo responden las células óseas a un estímulo mecánico. Se conoce que las fuerzas mecánicas ejercidas sobre las raíces de los dientes, posibilitan el movimiento del diente a través del alvéolo. Se sabe que un estrés mecánico activa la cascada de transducción intracelular (16) y el remodelado óseo es una secuencia coordinada de eventos de células mediadoras. Para un adecuado tratamiento en ortodoncia es importante conocer el manejo de las fuerzas que se aplican a los dientes para corregir una posición o llevar el diente a una posición deseada. Es importante considerar el largo de la raíz dental, el tamaño de la raíz, el ancho de la raíz, la anatomía y si son varias raíces.
La conversión de una señal extracelular a intracelular como proliferación celular se denomina "transducción de señal". Sin embargo, el mecanismo bioquímico involucrado en la conversión de las señales que generan la fuerza aplicada a las células no se conoce. Ante esta carencia se han tomado como modelo los mecanismos de activación celular frente a cualquier estímulo y no específicamente ante estímulos mecánicos. Por esta razón, aplicar la fuerza de gravedad a las células permite aproximarnos a entender, en parte, los cambios bioquímicos que operan en una célula sometida a una fuerza mecánica como la que se aplica en ortodoncia.
Aunque en este caso la fuerza de gravedad aplicada a las células es una fuerza transitoria y la aplicada en ortodoncia es "constante", es interesante conocer que las proteínas de estrés celular se sobre-expresen. No sorprendería que una fuerza exagerada aplicada sobre un diente altere completamente la "organización bioquímica" y sobrepase la capacidad que tienen las proteínas de estrés de mantener las proteínas en su estado conformacional adecuado. Cuando esto sucede probablemente se inducen los mecanismos de apoptosis llevando a la pérdida de adherencia celular y del diente con las consecuencias desastrosas ya conocidas.
Sería interesante, determinar si las diferencias halladas por las técnicas aquí descritas se corroboran mediante la técnica de citometría de flujo (FACS) o si cambian los niveles del RNAm que codifica para HSC70. Igualmente, sería interesante evaluar la expresión de otras proteínas de estrés celular en células implicadas en el anclaje dental luego de someterlas a fuerza tensil y determinar si hay sobre-expresión de las proteínas de estrés celular en el tejido implicado en el anclaje dental durante el tratamiento de ortodoncia.
Agradecimientos
Este proyecto de investigación fue llevado a cabo gracias a la financiación de la División de Investigaciones de la sede de Bogotá (DIB) de la Universidad Nacional de Colombia.
Conflictos de intereses
Los autores declaran que no existe conflicto de intereses en esta publicación.
Referencias
1. Roberts-Harry D, Sandy J. Orthodontics. Part 4: Treatment planning.British Dental. 2003 Dec. 20;195:683-5. [ Links ]
2. Burger EH, Klein-Nulen J. Responses of bone cells to biomechanical forces in vitro. Adv Dent Res 1999; 13:93-8. [ Links ]
3. Mullender M, El Haj AJ, Yang Y, Van Duin MA, Burger EH, Klein-Nulen J. Mechanotransduction of bone cells in vitro: mechanobiology of bone tissue. Med Biol Eng Comput 2004:14-21. [ Links ]
4. Kerrigan JJ, Mansell JP, Sandy JR. Matrix Turnover J. Orthodontics 2000; 27:227-33. [ Links ]
5. Lindauer SJ, Rebellato J. Biomechanical considerations for orthodontic treatment of adults. Dent Clin North Am 1996; 40:811-36. [ Links ]
6. Ducy P, Geoffroy V, Ridall A, Karsenty G. Osf2/Cbfa1: A Trascriptional Activator of Osteoblast Differentiation. Cell 1997; 89: 747-754. [ Links ]
7. Harada S, Rodan G. Control of osteoblast function and regulation of bone mass. Nature 2003; 423: 349-355. [ Links ]
8. Nefussi J, Brami G, Modrowski D, Oboeuf M, Forest N. Sequential Expression of Bone Matrix Proteins During Rat Calvaria Osteoblast Differentiation and Bone Nodule Formation in vitro . J Histochem Cytochem. 1997; 45: 493-503. [ Links ]
9. Boyle W, Simonet S, Lacey D. Osteoclast differentiation and activation. Nature 2003; 423: 337-342. [ Links ]
10. Ma YL, Cain RL, Halladay DL, Yang X, Zeng Q, Miles RR, Chandrasekhar S, Martin TJ, Onyia JE. Catabolic effects of continuous human PTH (1-38) in vivo is associated with sustained stimulation of RANKL and inhibition of osteoprotegerin and gene-associated bone formation.Endocrinology. 2001 Sep;142:4047-54. [ Links ]
11. Suda T, Takahashi N, Udagawa N, Iimi E, Gillespie MT, Martin TJ. Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligands families. Endocr Rev 1999;20: 345-357. [ Links ]
12. Lerner UH . New molecules in the tumor necrosis factor ligand and receptor superfamilies with importance for physiological and pathological bone resorption Crit Rev Oral Biol Med 2004;15:64-81. [ Links ]
13. Gorski JP. Is all bone the same? Distinctive Distributions and Properties of Non-Collagenous Matrix Proteins in Lamellar vs. Woven Bone Imply the Existence of Different Underlying Osteogenic Mechanisms. Crit Rev in Oral Biol Med 1998; 9:201-223. [ Links ]
14. Hatton JP, Pooran M, Li CF, Luzzio C, Hughes-Fulford M. A short pulse of mechanical force induces gene expression and growth in MC3T3-E1 osteoblasts via an ERK 1/2 pathway. J Bone Miner Res 2003;18:58-66. [ Links ]
15. Tang LL, Wang YL, Pan J, Cai SX. The effect of step-wise increased stretching on rat calvarial osteoblast collagen production. J Biomech. 2004; 37:157-61. [ Links ]
16. Turner CH, Owan I, Takano Y. Mechanotransduction in bone: role of strain rate. Am J Physiol 1995;269 ( 3 Pt 1),438-42. [ Links ]
17. Brighton CT, Fisher JR JR, Levine SE, Corsetti JR, Reilly T, Landsman AS, Williams JL, Thibault LE. The biochemical pathway mediating the proliferative response of bone cells to a mechanical stimulus. J Bone Joint Surg Am 1996; 78:1337-47. [ Links ]
18. Iqbal J, Zaidi M. Molecular regulation of mechanotransduction. Biochem Biophys Res Commun. 2005;18;328:751-5. [ Links ]
19. Burr DB, Schaffler MB, Yang KH, Wu DD, Lukoschek M, Kandzari D, Sivaneri N, Blaha JD, Radin EL. The effects of altered strain environments on bone tissue kinetics. Bone. 1989;10:215-21. [ Links ]
20. Carvalho RS, Scott JE, Suga DM, Yen EH. Stimulation of signal transduction pathways in osteoblasts by mechanical strain potentiated by parathyroid hormone. J Bone Miner Res 1999:999-1011. [ Links ]
21. Lindquist S. The heat shock proteins. Annu Rev Genet 1998; 22:631-677. [ Links ]
22. Flaherty KM, McKay DB, Kabsch W, Holmes KC . Similarity of the three-dimensional structures of actin and the ATPase fragment of a 70-kDa heat shock cognate protein. PNAS 1991; 88:5041-5045. [ Links ]
23. Flaherty KM, Deluca-Flaherty M. Nature 1990;346:623-628. [ Links ]
24. Hurley JH. The sugar/kinase heat shock protein 70/actin superfamily: implications of conserved structure for mechanism. Annu Rev Biophys Biomol.Strtuc 1996; 25: 137-162. [ Links ]
25. Kaufmann SH. Heat shock proteins and the immune response. Immunol Today 1990:129-36. [ Links ]
26. Suto R. Srivasta PK. A mechanism for the specific immunogenicity of heat shock protein-cahperoned peptides. Science 1995;269:1585-1588. [ Links ]
27. Frydman, Harti FU. Molecular chaperone functions of hsp70 and hsp60 in protein folding. The Biology of Heat Shock Proteins and Molecular Chaperones. Cold Sring Harbor Laboratory Press; 1994. 251-283. [ Links ]
28. Gething M, Sambrook J. Protein folding in the cell. Nature 1992; 355:13-45. [ Links ]
29. Chappell-Schlossman DM, Palter KB, Schelesinger MS, Rithman JE. Uncoating ATPases is a member of the 70kDa family of stress proteins. Cell 1986;45:3-13. [ Links ]
30. Haus U, Trommeler FP, Hartmann H, Lottspeich F, Noegel F. The heat shock cognate protein from Dictyostelium affect actin polimerization through interaction with the actin-binding protein cap32/34. The EMBO journal. 1993;12:3763-3771. [ Links ]
31. Hirai I, Sato N, Ohtani S, Torigoe T, Kikuchi K. Localization of pNT22 70kDa heat shock cognate protein in the plasma membrane. Cell Structure and Function 1998;23:153-158. [ Links ]
32. Multhoff G, Hightower LE. Cell surface edpression of heat shcok proteins and the immune response. Cell Stress & chaperones 1996;1:167-176. [ Links ]
33. Chouchane F. Lofti S, Swasdikosol R. Heat shock proteins expressed on the surface of human T cell leukaemia virus type-I-infected cell lines induce autoantibodies in rabbits. J Infect Dis 1994;169: 253-259. [ Links ]
34. Botzler C, Li G, Issels RD , Multhoff G. Definition of extracellular localized epitopes of Hsp70 involved in an NK immune response.Cell Stress Chaperones. 1998;3:6-11. [ Links ]
35. Mamelak D, Clifford L. Expression and sulfogalactolipid binding specificity of the recombinant testis-specific cognate heat shock protein 70. Glycoconjugate J 1997;14:715-722. [ Links ]
36. Rocchi G, Ferrari PA, Bolchi A, Manara GC. A new insight into the suggestion of a possible antigenic role a member of the 70 kDa heat shock proteins. Cell Biol Inter 1993;17:83-92. [ Links ]
37. Guerrero CA, Bouyssounade D, Zarate S, Isa P, Lopez T, Espinosa R, Romero P, Méndez E, López S, Arias CF. Heat Shock Cognate Protein 70 is Involved in Rotavirus Cell Entry. J Virol 2002;76:4096-102. [ Links ]
38. Blum H. Improved silver staining of plant proteins, RNA and DNA in polyacrilamide gel. Electroforesis 1987;8: 93-99. [ Links ]
39. Acosta O, Mayo MA. Unusual electrophoretic properties of the coat protein of raspberry ringspot nepovirus. Intervirology. 1990;31:31-7. [ Links ]
40. Harlow E, Lane D. Antibodies A Laboratory Manual. Cold spring Harbor Laboratory; 1998. p. 62. [ Links ]













