Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.54 no.3 Bogotá July 2006
ACTUALIZACION
Manuel Antonio Ballén 1 , Andrés Jagua Gualdrón 2 Deisy Lorena Álvarez 2 , Alejandro Rincón 2
1. MD. Cirujano de cabeza y cuello, Profesor del Departamento de Morfología, Facultad de Medicina Universidad Nacional de Colombia, Bogotá.
2. Estudiante de Tercer Semestre de Medicina, Universidad Nacional de Colombia, Bogotá
Correspondencia: maballenv@unal.edu.co
Resumen
Antecedentes. El consumo de cigarrillo, según cálculos de la Organización Mundial de la Salud (OMS), es la causa de por lo menos cuatro millones de muertes al año. Las consecuencias de fumar cigarrillo van desde cambios fisiopatológicos en los sistemas respiratorio, cardiovascular y digestivo, hasta trastornos mentales asociados a la dependencia a la nicotina.
Objetivo. Realizar una revisión narrativa de la literatura médica mostrando los efectos del consumo de cigarrillo sobre la salud física y mental en los fumadores activos y pasivos.
Material y métodos. El artículo se basa en la revisión de artículos a través de la base de datos del MEDLINE y de la biblioteca Virtual de la OMS. Se emplearon en la búsqueda las palabras clave "Cigarette Smoke", "Cancer AND smoke", "COPD AND smoke", "Nicotine Dependence". Se escogieron artículos y libros publicados en idioma inglés entre los años 1994 y 2006, realizando una lectura crítica (análisis de posibles conflictos de interés y errores de diseño).
Conclusión. El humo del cigarrillo contiene partículas potencialmente peligrosas para la salud de quien está expuesto a ellas. De este modo, fumar cigarrillo se convierte en un factor etiológico común a muchos tipos de cáncer. Además los componentes del cigarrillo están relacionados con el desarrollo de otros estados patológicos (enfermedad cardiovascular y enfermedad pulmonar obstructiva crónica). La nicotina, uno de sus componentes, es un potente agente adictivo. Todo esto en su conjunto hace del cigarrillo un importante problema de salud pública.
Palabras clave : contaminación por humo de tabaco, nicotina, humo, lesión por inhalación de humo, EPOC (enfermedad pulmonar obstructiva crónica), cáncer (neoplasias pulmonares), pulmón, neumopatías, nitrosaminas.
Summary
Background. According to World Health Organization (WHO), cigarette smoke causes four million deaths each year. The consequences of cigarette smoke are phatophysiological changes in pulmonary cardiovascular and digestive systems, and mental dysfunctions associated to nicotine dependence.
Objective. To show the effects of cigarette smoke in active and passive smokers.
Materials and methods. This article is based on search of MEDLINE and WHO library for the terms "Cigarette Smoke", "Cancer AND smoke", "COPD AND smoke", "Nicotine Dependence". All relevant English-language papers published between 1994 and 2006 were retrieved in full.
Conclusions. Cigarette smoke contains particles potentially dangerous for health of active and passive smokers. Cigarette smoke becomes a common etiologic factor to many cancer types. The cigarette's components are also related with the development of other pathological states (Cardiovascular illness and Chronic Obstructive Pulmonary disease). The nicotine, a smoke's component, is a potent addictive agent. All facts make the cigarette an important problem of public health.
Key words : tobacco smoke pullution, nicotine, smoke, smoke inhalation injury, pulmonary disease, chronic obstructive, lung neoplasms, lung, lung diseases, nitrosamines.
Introducción
El cigarrillo es, muy probablemente, la fuente más importante de compuestos químicos tóxicos causante de enfermedades humanas (1). Según datos de la OMS , el cigarrillo es causante de por lo menos cuatro millones de muertes cada año, esta cifra podría duplicarse para el año 2020 (2). En el año 2000 se calculaba que anualmente en el mundo se consumían unos 5.7 billones de cigarrillos, en América 845337 millones de cigarrillos y en Colombia 17171 millones de cigarrillos; el consumo registrado en Colombia es mucho menor que el observado en el año 1970 (21004 millones de cigarrillo) pero mayor que el de los años 1990 (13647 millones de cigarrillos) y 1997 (14193 millones de cigarrillos) (3). En el mundo existen aproximadamente un billón de fumadores de tabaco; a su vez, un alto número de estos fumadores son adictos a la nicotina, sustancia liberada con el humo del cigarrillo (4).
El cigarrillo se vende como un símbolo de éxito y victoria atrayendo a las nuevas generaciones a su consumo (5). La publicidad agresiva de las tabacaleras sumada a los pocos esfuerzos en salud pública dificulta las labores de prevención de las enfermedades de los fumadores (6). En los últimos años se promocionan los cigarrillos libres de nitrosaminas (un carcinógeno presente en el humo del cigarrillo) en Australia, Canadá y los Estados Unidos. Llama la atención que estos cigarrillos se anuncian como "saludables" para los consumidores; aunque si bien es un esfuerzo, remover un carcinógeno no hace un cigarrillo no-cancerígeno ni tampoco ayuda a reducir la mortalidad por enfermedad cardiovascular asociada al consumo de cigarrillo (7).
Adicionalmente algunos estudios muestran que el fumador subestima el riesgo de llegar a padecer de cáncer u otra complicación médica. Henningfiel y sus colaboradores encontraron que tan sólo el 8.7 por ciento de sus sujetos de estudio creen tener un alto riesgo de desarrollar algún tipo de cáncer (8).
El cigarrillo no es más que un rollo de tabaco envuelto en una tira de material que no contiene tabaco (a diferencia del cigarro que esta envuelto en tabaco) (5).
El tabaco contiene cerca de 4000 partículas, tras su combustión se detectan 6000 de las cuales 65 son posibles carcinógenos y 11 son agentes cancerígenos ya comprobados (9).
El humo del cigarrillo presenta dos fases (particulada y gaseosa) y dos corrientes (principal y secundaria). La corriente principal es la que atraviesa el cigarrillo y llega hasta los pulmones del fumador; la corriente secundaria es la corriente de humo generada desde el extremo incandescente del cigarrillo (9). La tabla 1 muestra las concentraciones de los componentes de las dos fases en la corriente directa.
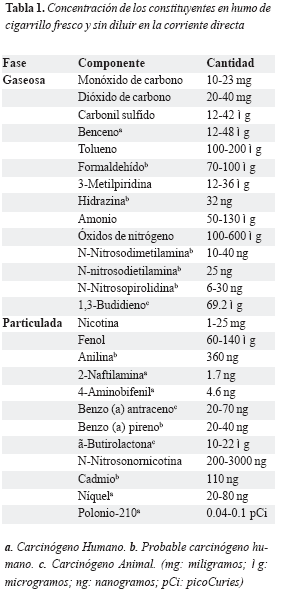
Se llama fumador a quien consume cigarrillo de manera periódica o esporádica; no existe aun consenso en la definición de fumador severo, moderado y leve, sin embargo muchos trabajos de investigación mencionan como severo a quien fuma más de 20 cigarrillo diarios, de 10 a 20 moderado y menos de 10 leve. El fumador pasivo es la persona que sin fumar inhala humo del cigarrillo.
Los costos del consumo del cigarrillo sobre la calidad de vida de quienes se exponen a él son incalculables. El cigarrillo se ha asociado a múltiples tipos de cáncer (pulmón, páncreas, laringe, faringe, senos paranasales, estómago, esófago, riñón), enfermedad pulmonar crónica, enfermedad cardiovascular y trastornos mentales. A continuación retomaremos los efectos del cigarrillo en los fumadores activos y pasivos.
Efectos en los fumadores activos
El fumador activo se encuentra expuesto, no sólo a los agentes tóxicos de las corrientes de humo, sino que también ingiere algunos de ellos disueltos en la saliva y el moco. El pH del humo, adicionalmente, favorece el intercambio de nicotina entre el humo y los tejidos del fumador (5). En esta sección trataremos las principales enfermedades padecidas por los fumadores activos: el cáncer, la enfermedad pulmonar obstructiva crónica y la enfermedad cardiovascular.
El cáncer
Desde la década de los 50 (1950) se sabe de la relación entre fumar tabaco y cáncer de pulmón. Para 1986 se conocía que el fumador de tabaco podía padecer no sólo cáncer de pulmón sino que se incluía un amplio espectro: pelvis, tracto digestivo (boca, laringe, faringe y esófago) y páncreas. Hoy, la evidencia epidemiológica reciente confirma las investigaciones del pasado e ilustra nuevos horizontes en la epidemiología del cáncer.
Los carcinógenos del humo del cigarrillo
El humo del cigarrillo contiene cantidades importantes de agentes cancerigenos conocidos, de posibles carcinógenos y de probables carcinógenos humanos (1). En la larga lista de agentes carcinogénicos presentes en el humo del cigarrillo deben nombrarse en el grupo de: los hidrocarbonos aromáticos policíclicos, N-nitrosaminas, aminas aromáticas y metales.
Entre los principales carcinógenos se cuentan los hidrocarburos policíclicos aromáticos (como el benzopireno), nitrosaminas (aminas aromáticas), aldehídos y componentes inorgánicos como el níquel, plomo y polonio 10. Los hidrocarburos policíclicos aromáticos (HPA) se forman tras la combustión incompleta de materia orgánica. El compuesto más conocido de este tipo es el benzo (a) pireno; los HPA causan cáncer de pulmón, traquea, cavidad bucal, laringe y tracto digestivo cuando son administrados a animales de laboratorio (11). Las N-nitrosaminas están presentes en el humo del cigarrillo de forma volátil y relacionada con la nicotina y otros alcaloides del tabaco (12). Muchas de las N-nitrosaminas son carcinógenos específicos para órganos como el pulmón y el esófago (13). Las aminas aromáticas fueron los primeros carcinógenos comprobados por su presencia en ambientes industrializados. El formaldehído y el acetaldehído son también carcinógenos comprobados por experimentos en laboratorios. Los hidrocarbonos volátiles como el benceno causan leucemia en humanos; el niquel y el cadmio (metales) son también carcinógenos humanos comprobados (12).
Estos compuestos causan apoptosis celular y daños en el ADN celular. En principio los mecanismos reparadores logran recuperar la información genética dañada, sin embargo, la exposición crónica a los carcinógenos causa mutaciones en genes de control de la división, proliferación y crecimiento celulares.
Cáncer de pulmón
Fumar cigarrillo es el mayor factor de riesgo para desarrollar cáncer de pulmón. Los agentes tóxicos presentes en el humo del cigarrillo (tanto en la fase gaseosa como en la particulada) causan daños importantes en el epitelio pulmonar (14). Generalmente, la integridad del epitelio se mantiene por un proceso regenerativo, sin embargo, con el daño repetido ocurre un importante acortamiento de los telómeros (senescencia replicativa) que puede dar lugar a cambios metaplásicos en las células escamosas (15). La senescencia celular es un estado de crecimiento irreversible de la célula inducida por el acortamiento de los telómeros o por señales dependientes de estos telómeros debido a daños en el ADN y estrés oxidativo (senescencia inducida por estrés) (16). Los compuestos carcinogénicos presentes en el humo del tabaco producen mutaciones en el gen p53 que está relacionado con el crecimiento y proliferación celulares (17). Los hidrocarburos aromáticos policíclicos presentes en el humo del cigarrillo son convertidos por el complejo de la citocromo oxidasa P4501A1 (Productos del gen CyP1A1) de sustancias pre- carcinogénicas a carcinogénicas. El benzo (a) pireno es convertido en diol epóxido (metabolito carcinogénico) que se une a secuencias de nucleótidos mutables de los oncogenes supresores tumorales K-ras y p53 (18).
La nicotina se une a receptores específicos en las células epiteliales del tracto respiratorio. Su acción está acoplada a la cascada de señalización que induce a un estado anti apoptosis, creando un escenario propicio para la carcinogénesis. Si bien en condiciones de no consumo de nicotina, la ruta dirigida a la apoptosis se daría, cuando el daño genético acumulado sea grande, la activación de la ruta anti apoptosis la impide (19). La nicotina promueve también la angiogénesis asociada al crecimiento tumoral y la migración celular (20).
Un importante número de estudios epidemiológicos permite establecer la relación entre los distintos tipos histológicos de cáncer de pulmón y fumar cigarrillo. De ellos los cuatro tipos histológicos de mayor incidencia son: carcinoma de células escamosas, carcinoma de células pequeñas, carcinoma de célula larga indiferenciada y adenocarcinoma. El incremento en el número de casos de cáncer de pulmón en los últimos años se produce junto con el aumento de los fumadores. El riesgo de desarrollarlo aumenta proporcionalmente con la cantidad de cigarrillos consumidos por día y con una edad menor de inicio del consumo de cigarrillo (7,21).
Otros tipos de cáncer asociados al consumo del cigarrillo
Desde la mitad del siglo pasado un importante trabajo se ha centrado en establecer que tipos de cáncer se relacionan con el cigarrillo.
El consumo de cigarrillo es un importante factor de riesgo para el desarrollo de cambios patológicos dirigidos al cáncer de las vías aerodigestivas. El incremento en el riesgo de desarrollar cáncer de senos paranasales, cavidad nasal y nasofaringe se ha demostrado en muchos estudios de casos-controles, con una relación importante entre cantidad y duración del consumo de cigarrillo; entre estos, el tipo histológico mas común es el carcinoma de células escamosas (22).
La evidencia epidemiológica disponible muestra un riesgo de contraer cáncer de estomago notablemente aumentado en los fumadores comparado con los no fumadores. La asociación del consumo de cigarrillo con el de alcohol podría suponer un mayor riesgo. A su vez, la infección crónica por Helicobacter pylori puede también aumentar el riesgo en fumadores. Se calcula que un 11 por ciento de los casos de cáncer gástrico en hombres y 4 por ciento en mujeres de países desarrollados y un 17 por ciento en hombres y 11 por ciento en mujeres de países en vía de desarrollo son atribuibles al consumo de cigarrillo (17).
También se observa un mayor riesgo de desarrollar cáncer de hígado en los fumadores comparados con los no fumadores. Esto en parte se explica por la relación existente entre el consumo de cigarrillo y el de alcohol. El consumo de alcohol sigue siendo el mayor factor de riesgo para desarrollar cáncer de hígado. Sin embargo, algunos estudios demuestran un riesgo elevado en fumadores que no consumen alcohol de contraer cáncer de hígado comparados con individuos que no consumen ni alcohol ni tabaco (23-24).
Adicionalmente, consumir cigarrillo es el factor de riesgo más importante para desarrollar cáncer de páncreas (25). Muchos de los efectos patogénicos del cigarrillo son debidos a la nicotina. Las nitrosaminas se derivadan también del metabolismo de la nicotina en el páncreas. Allí se forman otras moléculas que tienen el poder de modificar enlaces covalentes en el ADN y las proteinas (26). In vitro , se han comprobado marcadores de daño pancreático en animales expuestos al humo del cigarrillo: vacuolación citoplasmática, edema intersticial y necrosis celular (27). La nicotina afecta los receptores colinérgicos del sistema nervioso central (SNC).
La activación del receptor nicotínico se dirige a la entrada de calcio a la célula acinar. El aumento del calcio intracelular promueve la citotoxicidad; activa una cascada de señalización mediada por inositol trifosfato (afecta la secreción celular); y modifica la expresión genética normal de las células con la sobre expresión de protooncogenes, aumento en la expresión de la proteína p21 Ras mutante y del gen H-Ras en células del páncreas (28). Las proteínas Ras (codificadas por los genes RAS) juegan un papel importante en las señales de transducción de los factores mitogénicos de crecimiento dirigidos a la regulación del ciclo celular (27).
El cáncer de pelvis renal y el adenocarcinoma del parénquima renal están relacionados también con el consumo de cigarrillo. Para personas que fumen 20 o más cigarrillos diarios el riesgo de padecer estos tipos de cáncer es de 1.5 a dos veces más alto comparado con no fumadores (29).
Muchos estudios han asociado el fumar cigarrillo y el cáncer de cuello uterino. El análisis de la causalidad del cigarrillo en la génesis de este tipo de cáncer se complica por la presencia del virus del papiloma humano (VPH). Algunos laboratorios han diseñado métodos de análisis que permiten identificar a las mujeres VPH-positivas y VPH-negativas. Así han logrado establecer que el riesgo relativo de las mujeres VPH-negativas fumadoras comparadas con las no fumadoras es de 2.17 (CI=1.4-3.22) (30).
El riesgo de desarrollar leucemia mieloide es mayor en fumadores comparado con no fumadores. El benceno es un potente agente leucemógeno; los niveles de esta sustancia en fumadores se encuentra considerablemente aumentados. El riesgo de los fumadores es de 1.6 con relación proporcional entre el número de cigarrillos consumidos por día y el riesgo (31), incluso se ha reportado relación de causalidad (19).
Enfermedad pulmonar obstructiva crónica (EPOC)
Fumar cigarrillo es el mayor factor de riesgo para desarrollar EPOC. La EPOC se define como un conjunto de trastornos en el sistema respiratorio caracterizados por la disminución en el flujo expiratorio máximo y el lento vaciamiento de los sacos alveolares debido a una combinación de enfermedades de las vías respiratorias y enfisema (32). Esta definición, sin embargo, no da cuenta de los llamados efectos sistémicos de la EPOC que nuevas investigaciones han sacado a la luz. Dichos efectos que serán tratados en esta sección incluyen un estado inflamatorio sistémico, anormalidades nutricionales y pérdida de peso, efectos cardiovasculares, efectos sobre el sistema nervioso y efectos osteoesqueleticos y disfunción del músculo esquelético.
Inflamación sistémica
La excesiva respuesta inflamatoria dentro de los pulmones a los agentes tóxicos del humo del cigarrillo es el mecanismo patogénico de la EPOC ; las anormalidades incluyen el incremento en el número de linfocitos T (con predominio de los LTCD8+), macrófagos y neutrófilos, concentraciones aumentadas de citoquinas proinflamatorias y evidencia de estrés oxidativo. Los cambios proinflamatorios se han observado también en la circulación sistémica además del tejido pulmonar (33).
Los neutrófilos y linfocitos de pacientes con EPOC muestran un aumento en la quimiotaxis y la proteólisis extracelular; los neutrófilos también producen más ROS (especies de oxígeno reactivo). El incremento en la expresión de la CD 11b en los neutrófilos de enfermos con EPOC y las anormalidades en la transducción de esta señal, el aumento en la expresión de proteínas de adhesión celular y el aumento en el transporte vesicular hacen suponer una respuesta exagerada de los neutrófilos en la EPOC (34).
La proporción linfocitos T (LT) CD4+/CD8+ es característica de un estado inflamatorio en la EPOC ; ocurre un importante aumento en el número de LT CD8+ y un decrecimiento en el número de LT CD4+. Incluso han reportado el aumento del número de linfocitos T "activados" circulantes en la sangre de los fumadores (35). Los niveles de citoquinas y proteínas de fase aguda presentan niveles elevados: el factor de necrosis tumoral (TNF-a) y su receptor, las interleucinas (IL)-6, IL-8, la proteína C-reactiva, la proteína de unión a lipopolisacárido, el Fas y su ligando Fas, la IL-1B , el GM-CSF (Factor estimulante de colonias granulocitos-macrófago), todos ellos son marcadores del estado inflamatorio y están asociados además a la enfermedad cardiovascular.
Anormalidad nutricional y pérdida de peso
Las anormalidades nutricionales descritas en pacientes con EPOC incluyen alteraciones en el metabolismo de calorías, la velocidad metabólica basal y la composición del cuerpo. En aproximadamente el 50 por ciento de los pacientes se observa una inexplicable pérdida de peso (35). El aumento de la velocidad metabólica no va a la par con la ingesta de calorías; esto puede deberse o bien a los fármacos indicados en la EPOC (agonistas ß 2 adrenérgicos), a la respuesta inflamatoria propia de la EPOC y a la relación entre la descomposición metabólica y el aumento de los niveles de citocinas proinflamatorias, y a la hipoxia tisular y sus complicaciones (falla cardíaca congestiva) (33). Existe además una relación directa entre la actividad de la citocromo oxidasa y el grado de hipoxia presente en la EPOC. La pérdida de peso es un factor importante en el pronóstico y tratamiento de los pacientes con EPOC.
Disfunción del músculo esquelético
Los pacientes con EPOC avanzada presentan intolerancia al ejercicio y disnea. Poco a poco, el paciente con EPOC asume un estilo de vida sedentario como consecuencia de la disminución de su función respiratoria, disminuyendo la resistencia a la fatiga del músculo esquelético (37). El ejercicio en estos pacientes incrementa la liberación de alanina y glutamina desde el músculo esquelético, esto sugiere la existencia de anormalidades en el metabolismo dentro de los miocitos (38). La hipoxia crónica a la que se expone el tejido muscular en la EPOC causa alteraciones en el metabolismo de las proteínas en el tejido muscular (síntesis de miosina) y pérdida de masa muscular. La inflamación sistémica propia de la EPOC tiene efectos patogénicos importantes sobre el músculo. El factor de necrosis tumoral (TNF) induce la expresión de varios genes relacionados con una mayor respuesta inflamatoria; el TNF también activa al FN-kß (Factor nuclear kB) y degrada cadenas pesadas de miosina (39). Algunos casos avanzados de EPOC evidencian la presencia de estrés oxidativo que causa fatiga muscular y proteólisis. El óxido nítrico, un radical libre que es producido en condiciones normales en el músculo, puede jugar un rol importante en el daño tisular: las citocinas incrementan la producción del oxido nítrico y el número de vasos sanguíneos es mas bajo del normal, también puede causar fallas en la contracción del músculo (40,41).
Otros efectos
La función endotelial es anormal en los pulmones, en el corazón y en los riñones. La enfermedad de las arterias coronarias no es rara en pacientes con EPOC (42).
El metabolismo bioenergético del cerebro se encuentra alterado, se cree que puede deberse a la adaptación a la hipoxia, o bien a otro efecto sistémico de la EPOC o a un mecanismo no conocido aún (43). Se han reportado muchos casos de depresión en quienes padecen esta enfermedad, el desencadenamiento de este estado se debe en parte a un efecto psicológico por el debilitamiento causado por la enfermedad y por la presencia de los mediadores del estado inflamatorio (citocinas). Los niveles séricos de leptina se encuentran también disminuidos con respecto a personas sanas lo que podría significar el comienzo de desajustes en el ritmo circadiano (33,44).
Los casos de osteoporosis reportados vinculan un número importante de personas con EPOC. La osteoporosis se da como resultado de los otros efectos sistémicos de la EPOC (estado inflamatorio, disfunción del músculo esquelético, hipoxia, sedentarismo) (33).
Enfermedad cardiovascular
La enfermedad cardiovascular es una de las principales causas de muerte en el mundo. El humo del cigarrillo ha aumentado considerablemente su prevalencia en la población de todo el mundo. El estrés oxidativo es el mecanismo a través del cual se producen lesiones del endotelio vascular y la aterogénesis. Precisamente en la actualidad, se asume que la aterosclerosis es una enfermedad inflamatoria en donde ocurre la oxidación de las LDL (Lipoproteínas de baja densidad), hipertensión e hipertrigliceridemia (45).
El humo del cigarrillo genera dentro del organismo humano cantidades considerables de ROS que juegan un rol importante en la aterogénesis promoviendo la oxidación de las lipoproteínas circulantes por el torrente sanguíneo. Las ROS también favorecen la adherencia de los fagocitos en el endotelio vascular. Las ROS suprimen la actividad del oxido nítrico en el endotelio vascular, oxida LDL, es aterogénico y activa factores de unión al DNA, como la proteína activadora 1 y el Factor Nuclear k , que promueven la expresión de genes que codifican proteínas proinflamatorias (46).
Los marcadores de la inflamación (niveles sanguíneos de proteína c reactiva, fibrinógeno, linfocitos y leucocitos), así como el numero de plaquetas, se encuentran en concentraciones elevadas en fumadores en comparación con no fumadores o personas que han dejado de fumar, estos a su vez tienen un riesgo de sufrir una trombosis (47).
Efectos en fumadores pasivos
Las personas que sin fumar, se exponen al humo del cigarrillo fumadores pasivos, tienen el riesgo de adquirir enfermedades relacionadas con el cigarrillo; en niños y recién nacidos se ha asociado con bajo peso al nacer, síndrome de muerte súbita, infección del oído medio, asma, bronquitis y neumonía; en adultos enfermedad cardiovascular, cáncer de pulmón y cáncer de la cavidad nasal; adicionalmente se estudia la relación entre ser fumador pasivo y el riesgo de aborto espontáneo, problemas de desarrollo y aprendizaje en niños, infecciones por meningococos, leucemia en niños, exacerbación del asma en adultos, exacerbación de fibrosis quística, decremento de la función pulmonar y cáncer de cervix.
A continuación abordaremos estos temas.
Recién nacidos, niños y embarazadas como fumadores pasivos
La exposición al humo de cigarrillo de mujeres embarazadas y niños trae consecuencias negativas para su salud.
Fumar cigarrillo está asociado en mujeres embarazadas a una cantidad importante de complicaciones obstétricas: aborto espontáneo, embarazos ectópicos, nacimiento prematuro, desprendimiento de la placenta y ruptura prematura de membranas. Así mismo, la exposición a ambientes saturados de los contaminantes del humo del cigarrillo, puede causar nacimiento prematuro (48).
Experimentos realizados en animales han mostrado que la exposición al humo del cigarrillo durante el embarazo disminuye los movimientos del feto, estos son a su vez importantes para el desarrollo de los pulmones. En humanos se ha observado que los movimientos de los fetos de mujeres que se exponen al humo del cigarrillo son menores que los de las mujeres que no se exponen. Los pulmones de los niños cuyas madres tuvieron esa exposición son hipoplásicos y afectarán su función en la adultez ya que durante el periodo embrionario ocurre la "programación" de la función pulmonar (49,50).
La exposición del feto a los tóxicos del cigarrillo aumenta el riesgo de bajo peso al nacer, sin embargo, se han reportado variaciones genéticas al respecto. EL bajo peso al nacer incrementa a futuro la incidencia de enfermedad coronaria, hipertensión, diabetes mellitus tipo II, resistencia a la insulina, dislipidemia y muerte prematura. En países en vías de desarrollo estas asociaciones son más estrechas (50). El riesgo de sepsis neonatal, neunomía neonatal y otras infecciones también se encuentra aumentado (51).
La exposición al humo del cigarrillo durante la infancia es el mayor factor de riesgo para el síndrome de muerte prematura infantil. Si bien la posición al dormir y el estrato económico son factores de riesgo importantes, el hecho que la mama fume hace doblar el riesgo del síndrome (52). Las explicaciones posibles son anormalidades en el desarrollo cerebral con tendencia a la apnea y mecanismos de control respiratorio anormales (reducida ventilación en respuesta a la hipoxia); otra explicación posible es el desarrollo de enfermedades respiratorias como consecuencia de la exposición al humo del cigarrillo (50). En los primeros años de vida, ser fumador pasivo se asocia con una gran incidencia de infecciones respiratorias, también se incluyen mayor riesgo para desarrollar tuberculosis e infección por meningococos (esto debido a la disminución de la respuesta inmunitaria humoral y una mayor adherencia de las bacterias al tejido pulmonar) (53). El riesgo para infecciones del oído medio es también mayor para niños cuyos padres fuman (50).
La exposición prenatal al humo del cigarrillo incrementa el riesgo de desarrollar asma en los primeros años de vida; aunque el riesgo también es alto para quienes comienzan a ser fumadores pasivos luego del nacimiento, esto se relaciona más con casos de bronquitis (50). Los niveles de inmunoglobulina E (IgE) son mayores en los hijos de madres fumadores, así es posible que estos niños desarrollen alergias con mayor facilidad.
Los niños expuestos al humo del cigarrillo desarrollan con más facilidad síndrome de déficit de atención y pueden llegar a presentar patrones de comportamiento antisocial. En animales se ha observado que la nicotina afecta la proliferación y diferenciación celular y produce patrones anormales en la formación de sinapsis, posiblemente estas anormalidades ocurran también en los humanos (54).
La incidencia de casos de cáncer en niños expuestos al humo del cigarrillo no es clara. Si bien se ha reportado un riesgo mayor para ciertos tumores cerebrales y leucemia, esto podría ser efecto de otros factores distractores.
Efectos en adultos
Los escenarios de exposición a los tóxicos del cigarrillo para un adulto son numerosos: desde el mismo lugar de trabajo hasta los sitios de reunión. Esto dificulta la intervención y es necesario dirigir esfuerzos hacia la educación de los potenciales fumadores pasivos para que se alejen de los sitios en donde se fuma.
La literatura médica disponible (reciente y antigua) corrobora las suposiciones sobre el riesgo de desarrollar cáncer de pulmón para los fumadores pasivos, presentándose una relación directa nivel de exposición-mayor riesgo (55); la relación es causal, es decir, ser fumador pasivo causa cáncer de pulmón. El riesgo de desarrollar cáncer de vías aéreas es también mayor en los fumadores pasivos comparados con los no fumadores sin exposición al humo del cigarrillo (56).
En los últimos 20 años han sido presentados los resultados de por lo menos 14 estudios que avalan la relación entre ser fumador pasivo y un mayor riesgo cardiovascular, el riesgo de morir por enfermedad coronaria es del 20 por ciento (RR, 1.2; 95% CI, 1.1 a 1.4). Recientemente se ha demostrado que tanto fumadores activos como pasivos tienen riesgo de desarrollar aterosclerosis (57).
Implicaciones para la salud pública
Demostrados ya los efectos negativos sobre la salud de todas las personas expuestas periódicamente a ambientes con los tóxicos del cigarrillo, sale a la luz la inmensa necesidad de limitar los sitios públicos en donde pueda fumarse. Deben garantizarse sitios libres de humo para las personas que no fuman en todos los lugares públicos (restaurantes, parques, oficinas, etc.). Es importante también mencionar la necesidad de educar a los padres que fuman, para que lo hagan lejos de sus hijos y evitar así las complicaciones que traerá esta exposición para la salud de aquellos.
Si bien ya en Colombia han comenzado a hacerse avances en este sentido, queda mucho por trabajar: no es difícil encontrarse con un fumador en cualquier lugar, ni ver a padres enseñando los cigarrillos a sus hijos, ni ver médicos fumado delante de sus pacientes y alumnos.
Dependencia a la nicotina
La nicotina es tal vez el compuesto químico presente en el cigarrillo más famoso. La nicotina es un agente muy adictivo: la nicotina es en realidad una droga aceptada socialmente. El riesgo de llegar a desarrollar la adicción a esta sustancia es la conjugación de factores farmacológicos, genéticos, psicológicos y socioeconómicos; el comportamiento de estos adictos es similar al de los adictos a otras drogas.
Los criterios utilizados para definir y diagnosticar la dependencia a la nicotina pueden agruparse en dos: un grupo que tiene en cuenta los signos y síntomas de la tolerancia y abstinencia; el otro grupo en el que se incluyen los comportamientos relacionados con la continuación del consumo de la nicotina.
La tolerancia se define como la necesidad de recurrir cada vez a una mayor cantidad de nicotina para alcanzar el efecto fisiológico o psicológico deseado. Cuando se interrumpe el consumo de la sustancia de manera abrupta aparecen unos síntomas relacionados. Puede aparecer también en los consumidores la llamada "conducta de búsqueda de la sustancia". La dependencia a la sustancia se hace evidente tras el consumo compulsivo de la misma.
Genética
Los genes que influyen en el metabolismo de la nicotina y la posterior tolerancia a esta sustancia juegan un papel importante en la determinación individual de la dependencia. Las personas que poseen alelos de genes mas eficientes (es decir, que no sienten los efectos agudos adversos de fumar como nauseas y dolor de cabeza) tienen un mayor riesgo de desarrollar dependencia a la nicotina. Los genes CYP2A6 y CYP2D6 codifican proteínas que participan en el metabolismo de la nicotina; algunos individuos muestran alelos menos activos de estos genes, ellos han mostrado fumar menos que las personas con genes más activos (58).
Ciertos alelos polimórficos de genes para el receptor de dopamina D2 están también implicados en el desarrollo de la dependencia. La nicotina actúa sobre el sistema reticular dopaminérgico en el cerebro, allí activa receptores para nicotina que a su vez estimulan la liberación de dopamina a través de todo este sistema. El receptor de dopamina en el hombre es polimórfico, con dos alelos menores denominados alelo TaqIA (A 1 y A 2 ) y el alelo TaqIB (B 1 y B 2 ). Los individuos homocigotos o heterocigotos para el alelo A (A 1 A 1 o A 1 A 2 ) comparados con los homocigotos para el alelo mas común en este locus (A 2 A 2 ) tienen un número menor de receptores para dopamina en el cerebro; estos individuos pueden encontrar en la nicotina una forma de compensar esta deficiencia (59,60). Otro estudio en pacientes con cáncer de pulmón encontró que el genotipo B 1 B 2 era más común en los fumadores que en los no fumadores. Los fumadores con los alelos comunes A 1 o B 1 tienden a comenzar a fumar más jóvenes y han intentado pocas veces dejar de fumar comparados con los sujetos con los alelos DRD2 más comunes (61).
Otro polimorfismo funcional se encuentra en la región del gen para el transportador de serotonina (5-HHT), que consiste en dos versiones de promotor: una larga y otra corta. La variante corta resulta en menor trascripción del transportador; los individuos homocigotos para este polimorfismo presentan menores niveles de reabsorción de serotonina. La menor reabsorción de serotonina se relaciona con comportamiento agresivo e impulsivo, a su vez, las personas con este tipo de comportamiento neurótico poseen una personalidad ansiosa, depresiva, impulsiva y con un mayor riesgo de llegar a ser dependiente a la nicotina. Ciertos polimorfismos del gen para el 5-HHT son responsables del comportamiento del fumador y la dependencia a la nicotina (62).
Neurofarmacología y neuroendocrinología
La nicotina es un estimulante psicomotor. Los niveles plasmáticos normales de nicotina presentes en el fumador son de entre 10 y 60 ng/mL, un límite pequeño que puede disparar fácilmente efectos compensatorios. La nicotina dentro del sistema nervioso central refuerza (aumenta) la función de los mecanismos neuroreguladores mediados por dopamina, noradrenalina,
ß-endorfina; facilita la accion mediada por acetilcolina y noradrenalina y mejora la formación de la memoria mediada por acetilcolina, noradrenalina y arginina vasopresina. Reduce la ansiedad y la tensión (por incremento de las - ß - endorfinas), deprime la presión arterial y la función respiratoria por accion sobre las catecolaminas; también puede mediar en la anti nocicepción y actuar sobre el sistema reticular (directamente a través de las rutas dopaminérgicas). La nicotina tiene efectos muy importantes sobre las hormonas del estrés: incrementa la liberación de CRF (factor liberador de corticotropina) y ACTH (Hormona adrenocorticotropa), también incrementa la liberación de corticosteroides. Los efectos regulatorios consecuencia de la exposición a la nicotina se dan casi de inmediato; su metabolismo es también relativamente rápido (unas dos horas) (63).
El manejo del paciente dependiente a la nicotina
En la actualidad existen varios métodos indicados para el manejo del paciente que depende de la nicotina. El síndrome de abstinencia caracterizado por un estado de ánimo depresivo, insomnio, irritabilidad, ansiedad, dificultad de concentración, inquietud, disminución de la frecuencia cardíaca y un aumento de peso se presenta cuando se supende el cigarrillo de manera súbita (64).
Las ayudas de las que se dispone para la intervención son: charlas con el médico, consejería individual, consejería de grupo, consejería por teléfono, autoayudas, terapias de reemplazo de la nicotina (parches, goma de mascar, inhaladores, spray nasal), antidepresivos, ansiolíticos, acupuntura y ejercicio, entre otras (65).
Hacia la prevención de las enfermedades asociadas con el consumo de cigarrillo
Se han ilustrado los efectos nocivos del consumo del cigarrillo sobre la salud. Indudablemente, el cigarrillo es un gran problema de salud pública. Las leyes deberían impedir a toda costa el consumo de cigarrillo en sitios públicos o en donde se afecte la salud de aquellos que no fuman. Así mismo, deberían impedir el expendio de cualquier forma de tabaco a los menores de edad. La literatura médica informa sobre el potente efecto que tienen las propagandas de cigarrillos sobre la decisión de comenzar a fumar y sobre la decisión de mantener el consumo de cigarrillo. Aunque desde las altas esferas del poder deben nacer propuestas para reducir el consumo, los médicos y otros profesionales de la salud y los estudiantes de ciencias de la salud pueden y deben jugar un papel importante en la sensibilización de la población, principalmente en la prevención del consumo del cigarrillo en adolescentes y niños.
La falta de incentivos puede ser la causa de que los médicos eviten inmiscuirse en los programas de prevención del tabaquismo. Sin embargo, el médico puede de manera sencilla comenzar la sensibilización: a través de afiches en las paredes de sus consultorios, entregando pequeños plegables con información sobre los efectos nocivos, haciendo una pequeña charla sobre las enfermedades relacionadas al cigarrillo, haciendo analogías sobre las ocupaciones del paciente y los tóxicos del humo del cigarrillo (por ejemplo que el humo contiene formaldehído y que esta sustancia se emplea en la conservación de cadáveres o cianida que se empleo en las cámaras de ejecución durante la segunda guerra mundial). Hacer llegar un mensaje individualizado tiene mejores efectos sobre el paciente; así mismo cuidar de no herir susceptibilidades en los fumadores. Motivar al individuo a dejar poco a poco de fumar (demorando el consumo del cigarrillo en principio unos minutos y así sucesivamente).
La intervención en los adolescentes es de vital importancia y requiere especial atención. En este grupo están los potenciales fumadores y por tanto, los focos de intervención de las empresas tabacaleras.
Conclusión
El cigarrillo contiene sustancias nocivas para la salud, entre ellas se cuentan numerosos carcinógenos conocidos. Estos tóxicos causan cáncer de pulmón, de vías aerodigestivas, de esófago, estómago, de senos paranasales, de cuello uterino, adenocarcinoma del parénquima renal, carcinoma de pelvis renal, leucemia, cáncer de páncreas y cáncer de hígado. El humo del cigarrillo también puede desencadenar la destrucción del tejido pulmonar dando como resultado la aparición de la enfermedad pulmonar obstructiva crónica que disminuye la calidad de vida de quienes la adquieren. Los eventos cardiovasculares y la mayor incidencia de infecciones respiratorias son también consecuencia de fumar cigarrillo.
Lamentablemente estos efectos no se limitan a los fumadores sino que afectan a quienes se exponen periódicamente al humo (fumadores pasivos), ellos muestran riesgos elevados de adquirir las "enfermedades del tabaquismo".
Ante este panorama todos aquellos que trabajan en el área de la salud deben jugar un papel activo en la prevención del consumo del cigarrillo haciendo uso de la presión política, pero también construyendo desde sus oficios.
Referencias
1. Fowles J, Dybing E. Application of toxicological risk assessment principles to the chemical constituents of cigarette smoke. Tob Control 2003; 12:424-430 [ Links ]
2. World Health Organization, Tobacco Free Initiative. Oslo , Norway : WHO workshop on advancing knowledge on regulating tobacco CCO products, February 2000 [ Links ]
3. World Health Organization. The world health report 2002. Reducing Risk, Promoting Healthy Life. Geneba , Switzerland , 2002 [ Links ]
4. Gray N, Boyle P. The case of the disappearing nitrosamines: a potentially global phenomenon. Tob Control 2004; 13: 13-16 [ Links ]
5. Baker F, Ainoworth SR, Dye JT, Crammer C, Thun MJ, Hoffmann D, et al. Health Risk Associated with cigar smoking. JAMA 2000; 284: 735-740 [ Links ]
6. Frazier AL , Fisher L, Camargo CA, Tomes C, Colditz G. Association of adolescent cigar use with other high-risk behavior. J Adolesc Health 1998; 23: 289-296 [ Links ]
7. Gray N, Zatonski W, Boyle P. Regulation of Carcinogens in cigarettes. Lancet 1999;354: 1036 [ Links ]
8. Henningfield JE, Fant RV, Radvius A, Frost S. Nicotine Concentration, smoke pH, and whole tobacco aqueous pH of some cigar brands and types popular in the United States . Nicotine Tobacco Res 1999; 1: 163-181 [ Links ]
9. US Environmental Protection Agency. Respiratory Health Effects of passive smoking: lung cancer and other disorders. National Institutes of Health, National Cancer Institute, 1993. [ Links ]
10. Hoffmann D, Hoffman I, El Bayoumy K. The less harmful cigarette: a controversial issue. A tribute to Ernst L wynder. Chem Res Toxicol 2001; 14: 167-790. [ Links ]
11. Culp SJ, Gaylor DW, Sheldon WG, Goldstein LS, Beland FA. A comparison of the tumors induced by coal tar and benzo (a) pyrene in a two-year bioassay. Carcinogenesis 1998; 19:117-124. [ Links ]
12. Hecht SS. Carcinogen derived biomarkers: applications in studies of human exposure to secondhand tobacco smoke. Tob Control 2003; 13: 148-156. [ Links ]
13. Hecht SS. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem Res Toxicol 1998; 11: 559-603. [ Links ]
14. MacNee W, Rahman L. Is oxidative stress central to the patogénesis of chronic obstructive pulmonary disease? Trends Mol Med 2001; 7: 55-62. [ Links ]
15. Luppi F, Aarboiou J, VanWetering S, Rahman I, de Boer WI, Rabe KF, et al. Effects of cigarette smoke condensate on proliferation and wound closure of bronchial epithelial cells in Vitro: role of glutathione respiratory research 2005; 6: 140 [ Links ]
16. Tsuji T, Aoshiba K, Nagai A. Cigarette smoke induces senescence in alveolar epithelial cells. Am J Resp Cell Mol Biol 2004; 31: 643-649. [ Links ]
17. Vineis P, Alavanja M, Buffeler P, Fontham E, Franceschi S, Bao YT, et al. Tobacco and cancer: Recent epidemiological Evidence. J Natl Cancer Inst. 2004; 96: 99-106. [ Links ]
18. Melamede R. Cannabis and tobacco smoke are not equally carcinogenic. Harm Reduct J 2005; 2: 21. [ Links ]
19. Minna JD. Nicotine exposure and bronchial epithelial cell nicotinic acetylcholine receptor expression in the pathogenesis fo lung cancer. J Clin Invest 2003; 111: 31-33. [ Links ]
20. Heeschen C, Jang JJ, Wers M, Pathak A, Kaki S, Hur S, et al. Nicotina stimulates angiogenesis and promotes tumor growth and atherosclerosis. Nat Med 2001; 7: 833-839. [ Links ]
21. Bach PB, Kattan MW, Thornquist MP, Kris MG, Tate RC, Barnett MJ, et al. Variations in lung cancer risk among smokers. J Natl Cancer Inst. 2003; 95: 470-478. [ Links ]
22. Vaughan TL, Shapiro JA, Buró RD, Swanson GM, Berwick M, Lynch CF, et al. Masopharyngeal cancer in a low-risk population: defining risk factors by histological type. Cancer Epidemiol Biomarkers Prev 1996; 5: 587-593. [ Links ]
23. Chen CJ, Liang KY, Chang AS, Chang YC, Lu SN, Liaw YF, et al. Effects of hepatitis B virus, alcohol drinking, cigarette smoking and familial tendency on hepatocelular carcinoma. Hepatology 1991; 13: 398-406. [ Links ]
24. Tsukuma H, Hiyama T, Tanaka S, Nakao M, Yabuuchi T, Kitamura A, et al. Risk factors for hepatocellular carninoma among patients with chronic liver disease. N Eng J Med 1993; 328: 1797-1801. [ Links ]
25. Gold EB, Goldin SB. Epidemiology of and risk factors for pancreatic cancer. Surg Oncol Clin North Am 1998; 7: 67-91. [ Links ]
26. Chowdhury P, Hosotani R, Chang LW, Rayford PL. Metabolic and pathologic effects of nicotine on the gastrointestinal tract and pancreas of rats. Pancreas 1990; 5: 22-229. [ Links ]
27. Chowdhury P, Macleand S, Ubupa KB, Rayford PL. Pathophysiological effects of nicotine on the pancreas: An update. Exp Biol Med 2002; 227: 445-454. [ Links ]
28. Calvo E, Dusseti N, Cardenas MB , Dagorn JC, Tovanna JL. Changes in gene expression during pancreatic regeneration: activation of c-myc and H-ras oncogenes in the rat pancreas. Pancreas 1991; 6: 150-156. [ Links ]
29. Chow WH, Grindley G, Fraumeni JF Jr, Jarvholm B. Obesity, hipertensión and the risk of kidney in men. N Eng J Med. 2000; 343: 1305-1311. [ Links ]
30. Deacon JM, Evans CD, Yule R, Desai M, Binns W, Taylor C, et al. Sexual behaviour and smoking ans determinants fo cervical HPV infection and of C in 3 study nested within the Manchester cohort. Br J Cancer 2000; 83: 1565-1572. [ Links ]
31. Doll R. Cancer weakly related to smoking. Br Med Bul 1996; 52: 35-49. [ Links ]
32. Siafakas NM, Vermeire P, Pride NB, Paoletti P, Gibson J, Howard P, et al. Optimal assesment and management of chronic obstructive pulmonary disease (COPD). European Respiratory Society Consensus Statement. Eur Respir J 1995; 8: 1398-1420. [ Links ]
33. Agustí AGN, Noguera A, Saveda J, Sala E, Pons J, Busquets X. Systemic effects of chronic obstructive pulmonary disease. Eur Respir J. 2003; 21: 347-360. [ Links ]
34. Noguera A, Batle S, Miralles C, Iglesias J, Busquets X, MacNee W, et al. Enhanced neutrophil response in chronic obstructive pulmonary disease. Thorax 2001; 56: 432-437. [ Links ]
35. Casio MG, Guerassimov A. Chronic Obstructive pulmonary disease. Inflammation of small airways and Lugo parenchyma. Am J Respir Crit Care Med 1999; 160: 521-525. [ Links ]
36. Schols AM. Nutrition in chronic obstructive pulmonary disease. Curr Opin Pulm Med 2000; 6: 110-115 [ Links ]
37. Barnes PJ. Chronic obstructive pulmonary disease. N Engl J Med 2000; 343: 269-280. [ Links ]
38. Engelen MP, Wouters EF, Deutz NE , Does JD, Schols AM. Effects of exercise on amino acid metabolism in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 163: 859-864. [ Links ]
39. Li YP, Schwartz RJ, Waddell ID, Holloway BR, Reid MB. Skeletal muscle myocytes undergo protein loss and reactive oxygen-mediated NF-kB activation in response to tumor necrosis factor ±. FASEB J 1998; 12: 871-880. [ Links ]
40. Moncada S, Higgs A. The L-arguinine-nitric oxide pathway. N Engl J Med 1993; 329: 2002-2012. [ Links ]
41. Brüne B, Von Knethen A, Sandau KB. Nitric oxide and its role in apoptosis. Eur J Pharmacol 1998; 351: 261-272. [ Links ]
42. Agusti AGN, Cotes J, Wagner PD. Responses to exercise in lung diseases. Eur Respir Mon 1997; 2: 32-50 [ Links ]
43. Mathur R, Cox IJ, Oatridge A, Shephard DT, Shaw RJ, Taylor-Robinson SD. Cerebral bioenergetics in stable chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1999; 160: 1994-1999. [ Links ]
44. Holden RJ, Pakula IS, Mooney PA. An immunological model connecting the patogénesis of stress, depression and carcinoma. Med Hypotheses 1998; 51: 309-314. [ Links ]
45. Esen AM, Borutch I, Acar M, Pegirmenci B, Kaya D, Torkmen M, et al. Effects of smoking on endothelial function and wall thickness of brachial artery. Cir J 2004; 85: 753-766. [ Links ]
46. Kunsch C, Medford RM. Oxidative stress as a regulator of gene expression in the vasculature. Circ Res 1999; 85: 753-766. [ Links ]
47. Yasue H, Hirai N, Mizuno Y, Harada E, Itoh T, Yoshimura M, et al. Low-grade inflammation, thrombogenicity, and atherogenic lipid profile in cigarette smokers. Cir J 2006; 70: 8-13. [ Links ]
48. Andres RL, Day MC. Perinatal complications associated with maternal tobacco use. Semin Neonatol 2000; 5: 231-241. [ Links ]
49. Stein CE, Kumaran K, Fall CH, Shaheen SO, Osmond C, Barker DJ. Relation of fetal growth to adult lung function in south India . Thorax 1997; 53: 895-899. [ Links ]
50. Hofhuis W, de Jongste JC, Merkus PJF. Adverse health effects of prenatal and postnatal tobacco smoke exposure on children. Arc Dis Child 2003; 88: 1086-1090. [ Links ]
51. Benitz WE, Gould JB, Druzin ML. Risk factors for early-onset group B streptococcal sepsis: estimation of odds ratios by critical literature review. Pediatrics 1999; 103: e77. [ Links ]
52. Anderson HR, Cook DG. Passive smoking and sudden infant death syndrome: review of the epidemiological evidence. Thorax 1997; 52: 1003-1009. [ Links ]
53. Kris P, Bobak M, Kriz B. Parental smoking, socioeconomic factors, and risk of invasive meningococcal disease in children: a population based case-control study. Arch Dis Child 2000; 83: 117-121. [ Links ]
54. Eskenazi B, Castorina R. Association of prenatal maternal or postnatal child environmental tobacco smoke exposure and neurodevelopmental and behavioural problems in children. Environ Health Perspect 1999; 107: 991-1000. [ Links ]
55. California Environmental Protection Agency. Health effects of exposure to environmental tobacco smoke. The report of the California environmental agency. Smoking and Tobacco control monograph 10, National Cancer institute, 1999. [ Links ]
56. US Environmental Protection agency. Respiratory health effects of passive smoking: lung cancer and other disordes. The report of the US environmental protection agency. Monograph 4, 1993. [ Links ]
57. Glantz SA, Parmley WW. Passive and Active Smoking a problem for adults. Circulation 1996;94:596-598. [ Links ]
58. Zabetian CP, Gelernter J, Cubells JF. Functional variants at CYP2A6: new genotyping methods, population genetics, and relevance to studies of tobacco dependence. Am J Medical Genet 2000; 96: 638-645. [ Links ]
59. Pontieri FE, Passarelli F, Calo L, Caronti B. Functional correlates of the nicotine administration: similarity with drugs of abuse. J Mol Med 1998;76:193-201. [ Links ]
60. Pohjalainen T, Rinnie JO, Nagren K, Lehikoinen P, Anttila K, Syvalahti EK, Hietala J. The A1 allele if the human D2 receptor gene predicts low D2 receptor availability in healthy volunteers. Mol Psych 1998; 3: 256-260. [ Links ]
61. Spitz MR, Shi H, Yang F, Hudmon KS, Jiang H, Chamberlain RM, et al. Case-control study of the D2 dopamine receptor gene and smoking status in lung cancer patients. J Natl Cancer Inst 1998; 90: 358-363. [ Links ]
62. Lerman C, Caporaso NE, Audrain J, Main D, Boyd NR, Shields PG. Interacting effects of the serotonin transporter gene and neuroticism in smoking practices and nicotine dependence. Mol Psych 2000; 5: 189-192. [ Links ]
63. Greden JF, Pomerleau O. Nicotine-Related Disorders in Kaplan H ed Comprehnsive Textbook of psychiatry/IV. Baltimore: Williams and Wilkins, 6 th , 1995: 799-810. [ Links ]
64. Fauman MA. Trastornos relacionados con sustancias EN DSM-IV-TR, guía de estudio. Barcelona : Masson; 2003: 101-139. [ Links ]
65. Marlow SP, Stoller JK. Smoking Cessation. Respir Care 2003; 48: 1238-1254. [ Links ]
66. Blum A. Prevención de los cánceres relacionados con el tabaco en cáncer. Devita VT, Hellman S, Rosenberg SA eds. Madrid : Panamerica ed. 5 a Ed. Vol I, 2000: 545-555. [ Links ]













