Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.56 no.3 Bogotá July/Sep. 2008
ACTUALIZACIÓN
USO DE ANTIBIÓTICOS EN ENDOFTALMITIS INFECCIOSA
Antibiotics use in infectious endophthalmitis
Jorge Alberto Cortés 1 , Carlos Fernando Cortés-Luna 2 ,
1. MD,DTMH, Profesor Asistente, Especialista en Medicina Interna e Infectología, Departamento de Medicina y Grupo de Investigación en Enfermedades Infecciosas, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá Correspondencia: jorgecortes@yahoo.com
2. MD, Especialista en Oftalmología, Clínica de Ojos, Bogotá, Colombia. Subespecialista en Retina y Vítreo, Universidad Nacional Autónoma de México
Resumen
La endoftalmitis bacteriana es una complicación infrecuente pero con desenlaces adversos desde el punto de vista de morbilidad y resultado funcional visual. Se discute la penetración de los antimicrobianos a las cámaras intraoculares y sus posibles implicaciones clínicas. Se presentan los factores de riesgo para endoftalmitis post-operatoria, post-traumática y endógena, y el papel que juegan los antimicrobianos en los diferentes escenarios clínicos para la prevención y el manejo de estas entidades.
Palabras clave: endoftalmitis, epidemiología, microbiología, prevención y control, terapia
Summary
Bacterial endophthalmitis is an uncommon but serious complication with unfortunate outcomes in terms of morbidity and visual function. In the present review, penetration of antimicrobials to intraocular chambers is shown with the possible clinical implications.
Risk factors for exogenous and endogenous endophthalmitis are reviewed as well as the roll for antimicrobials in each condition.
Key words: endophthalmitis, epidemiology, microbiology, prevention and control, therapy.
Introducción
La endoftalmitis es la inflamación severa del segmento anterior y posterior del globo ocular secundario a un proceso infeccioso. Según su origen se clasifica en postoperatoria, traumática o endógena. La más frecuente de las formas de endoftalmitis es la postoperatoria a cirugía de catarata, dada su frecuencia, ya que es uno de los procedimientos oftalmológicos más frecuentemente realizados. Adicionalmente, en los últimos años, la introducción de la facoemulsificación ha ampliado las posibilidades técnicas y las indicaciones para la cirugía de cristalino. Otras formas de endoftalmitis postoperatoria son la asociada a cirugía filtrante para glaucoma o la asociada a transplantes cornéales. Con menor frecuencia se puede asociar a cirugía vitreoretiniana, cirugía de estrabismo o pterigio.
La infección quirúrgica posterior a la cirugía de catarata es una de las complicaciones más temidas por sus devastadoras consecuencias a nivel del resultado funcional y anatómico final. La endoftalmitis se clasifica como aguda si se presenta durante las seis primeras semanas después de la cirugía de catarata, o crónica, si lo hace posteriormente. La incidencia ha variado en los últimos años, aumentando especialmente con el incremento de las técnicas transcorneales sin suturas (1-3).
Las manifestaciones clínicas incluyen dolor, pérdida visual, quemosis y al examen clínico se puede observar disminución marcada de la agudeza visual, congestión y edema conjuntival y palpebral, edema corneal y presencia de células y turbidez en la cámara anterior, así como la presencia de hipopión de grado variable en la cámara anterior. Si el segmento posterior es valorable, se puede encontrar en fases tempranas la presencia de envainamiento e infiltración perivasculares. En los exámenes complementarios, el ultrasonido puede mostrar zonas de condensaciones vítreas consistentes con áreas de vitreitis y organización de membranas vítreas en los casos más avanzados.
Se revisan a continuación los aspectos farmacológicos de la penetración de los antibióticos a las cámaras intraoculares, los factores de riesgo, el tratamiento y la profilaxis de las endoftalmitis exógenas y endógenas.
Penetración ocular de los antibióticos
Una de las limitaciones importantes para el manejo de esta patología está relacionada con el hecho de que el humor vítreo y el humor acuoso tienen barreras a la difusión de un número importante de antibióticos. Algunos estudios muestran niveles apropiados en humor acuoso, pero muy pocos en humor vítreo o ambos. En la tabla 1 se muestran las concentraciones de distintos antimicrobianos medidas en humor acuoso o vítreo. La concentración microbiológicamente activa se alcanza cuando las concentraciones medidas se encuentran por arriba de la concentración mínima inhibitoria de los microorganismos encontrados en endoftalmitis.
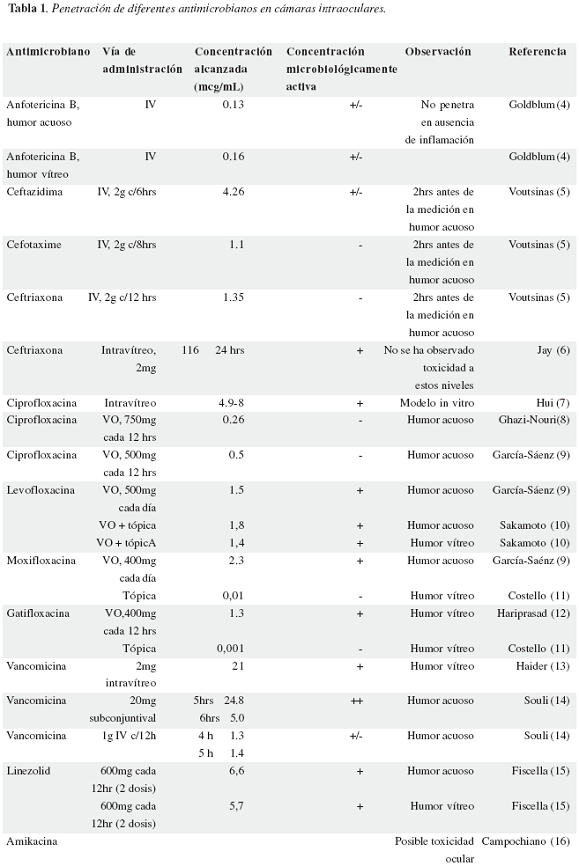
Desafortunadamente, se dispone de muy pocos estudios que hagan una evaluación farmacocinética de estos medicamentos y que permitieran una mejor aproximación a la posibilidad de control adecuado de los microorganismos. Uno de estos pocos estudios, publicado por Kampougeris y sus colaboradores muestra que individuos sanos, la moxifloxacina lograría dosis apropiadas en humor acuoso durante varias horas (17). Adicionalmente, como sugiere el estudio de Voutsinas y sus colaboradores (5), la administración de ciertos medicamentos, como por ejemplo la acetazolamida, puede incrementar los niveles de ceftazidime y cefotaxime al afectar la eliminación intraocular del antibiótico.
Como se puede apreciar en la tabla 1, en general, es posible obtener niveles de algunos antibióticos en humor acuoso a partir de inoculación tópica o subconjuntival. La penetración a humor vítreo no se logra en niveles apropiados, exceptuando quizás la utilización de algunas quinolonas, específicamente levofloxacina y moxifloxacina por vía sistémica (oral o intravenosa). Sin embargo, no encontramos estudios clínicos que validen la utilidad de las quinolonas en el tratamiento de las endoftalmitis.
La única forma de garantizar los niveles de un antibótico en forma apropiada en el humor vítreo es a través de la inoculación directa. En algunos modelos animales se ha estudiado el cambio en la vida media de los antibóticos en las cámaras intraoculares, sin embargo la aplicabilidad de estos datos a seres humanos no es clara. Por otro lado la inoculación directa de antimicrobianos debe sopesarse con la posibilidad de llevar a toxicidad retiniana (16,18,19). De ahí la importancia de conocer la vida media intraocular de estos medicamentos y de conocer los efectos tóxicos de los antibióticos al tejido retiniano, pero especialmente de disponer de estudios clínicos que validen los hallazgos farmacológicos.
Endoftalmitis post-operatoria
La endoftalmitis post-operatoria es una complicación infrecuente de las cirugías oftalmológicas. Ocurre principalmente después de cirugía de catarata. La incidencia esperada con las técnicas actuales es alrededor del 0,1 por ciento (20).
Uno de los estudios más grandes realizados para identificar los factores de riesgo asociados al desarrollo de endoftalmitis fue desarrollado en Australia (21). Este estudio identificó en una base de datos australiana 117.083 procedimientos realizados en un período de 20 años entre 1980 y 2000. En esta misma base de datos se identificaron los casos de endoftalmitis, todos los cuales habían sido enviados a hospitales de referencia. Este estudio identificó los siguientes factores de riesgo:
· Edad mayor a 80 años
· Cirugía en hospital privado (vs. hospital público)
· Cirugía ambulatoria (vs. paciente hospitalizado)
· Cirugía durante el invierno
· Cirugía simultánea (en el mismo acto quirúrgico) de lacrimal o párpado.
De forma relevante este estudio encontró que la cirugía extracapsular y la facoemulsificación tenían tasas similares de infección. En la figura 1 se ilustra la tendencia de infección de acuerdo al tipo de cirugía entre 1980 y 2000.
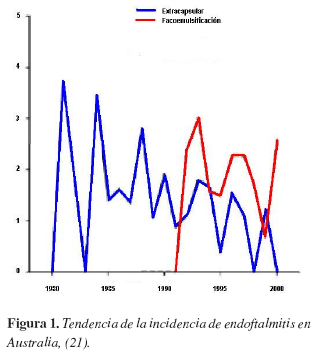
Otros estudios han apuntado hacia un aumento en la frecuencia de endoftalmitis asociado con la realización de incisiones corneales (vs. incisiones esclerales) (20). La teoría propuesta para explicar este aumento en la tasa de infecciones aduce que en estas incisiones hay un mal sellamiento y los cambios de presión intraocular favorecen la entrada de bacterias (22,23). Un estudio aleatorizado realizado en India, mostró que la hidratación del estroma de la incisión disminuía la filtración producida en las incisiones corneales (24). El impacto de esta intervención a nivel clínico no es conocido.
También se ha sugerido que la implantación de lentes intraoculares con pinzas (vs. lentes implantados mediante un inyector) (25) aumenta la posibilidad de infección. La mayor posibilidad de contaminación de estos lentes durante el procedimiento explicaría este hallazgo. Un estudio realizado en Suecia encontró que los lentes hechos en polimetilmetacrilato se asociaban con una mayor tasa de endoftalmitis (vs. lentes en acrílico) (26).
Los pacientes presentan usualmente pérdida de agudeza visual, dolor e inflamación severa de la superficie ocular. Al examen clínico se determina la pérdida de agudeza visual, presencia de quemosis y edema palpebral acompañado o no de secreción conjuntival. Al examen en lámpara de hendidura puede observarse edema corneal, presencia de células, turbidez o signo de tyndall en la cámara anterior e hipopión de magnitud variable. Si la transparencia del segmento anterior permite la valoración de la retina se puede observar infiltración perivascular como manifestación temprana de la enfermedad.
Microbiología
La tabla 2 muestra los microorganismos más frecuentemente identificados a partir de pacientes con endoftalmitis postoperatoria. Los cocos Gram positivos corresponden a un poco más de la mitad de los aislamientos, seguido de especies de Pseudomonas y hongos. El estudio de vitrectomía en endoftalmitis (EVS) encontró que los microorganimos menos virulentos (las especies de Staphylococcus diferentes a S. aureus ) tenían un mejor pronóstico (27). Aunque los hongos no son los microorganismos más frecuentes, no están cubiertos por los esquemas antibióticos más frecuentemente utilizados y la única forma de hacer el diagnóstico es mediante el cultivo. La especie más frecuentemente identificada es Aspergillus (28).

Uso de antibióticos y antisépticos en endoftalmitis post-operatoria
Profilaxis
Yodo-povidona
Este antiséptico ha sido utilizado para la prevención de endoftalmitis post-operatoria. Su uso se basa en un estudio no aleatorizado paralelo que mostró una disminución de la frecuencia de endoftalmitis en comparación con el uso de una solución con plata (30). Su uso en 3.489 pacientes no se asoció a ningún efecto adverso.
Un estudio de antes y después mostró que el riesgo de endoftalmitis se redujo de forma no significativa al usar yodo-povidona en forma tópica (31). La irritación local se presentó en 6,6 por ciento de los pacientes, pero ninguna en grado severo.
No se encontraron estudios clínicos aleatorizados que intentaran demostrar el efecto de la yodo-povidona.
Antibióticos sistémicos
El uso de antibióticos sistémicos ha sido debatido ampliamente debido a la pobre penetración de la mayoría de estos medicamentos a los humores intraoculares. El EVS demostró la inutilidad del uso de antibióticos sistémicos para el tratamiento de la endoftalmitis (32). Recientemente, algunas publicaciones han mostrado que la penetración de algunas quinolonas, específicamente moxifloxacina y gatifloxacina puede ser la apropiada para cubrir adecuadamente los microorganismos más frecuentemente identificados en esta patología (33,34). Sin embargo, no se encontraron estudios clínicos que evaluaran la efectividad de esta estrategia, y más recientemente se han hecho reportes de series de casos de endoftalmitis en pacientes que habían recibido estos medicamentos en forma profiláctica (35).
Antibióticos conjuntivales y subconjuntivales
Estas han sido estrategias ampliamente estudiadas. La intención de esta estrategia es reducir la carga bacteriana en el área quirúrgica y, para el caso de los antibióticos subconjuntivales, lograr penetración del medicamento en humor acuoso. Los medicamentos utilizados incluyen quinolonas, donde de nuevo la moxifloxacina y la gatifloxacina tuvieron mayor efectividad que la ciprofloxacina (36). A nivel subconjuntival se han utilizado la vancomicina y la cefuroxima. No se encontraron estudios clínicos aleatorizados que demostraran la prevención de la endoftalmitis mediante alguna de estas estrategias.
Irrigación y uso de antibióticos intracamerales
Su uso propone una disminución de la carga bacteriana en el sitio de cirugía. Algunos estudios han mostrado la disminución de los aislamientos en cámara anterior con el uso de vancomicina en irrigaciones (37). Sin embargo, la limitación de esta estrategia es la alta frecuencia de efectos adversos en pacientes expuestos intraocularmente a vancomicina, en los que se identificó una mayor frecuencia de edema macular cistoide (tanto clínica como angiográficamente identificado) (38). En ausencia de estudios clínicos que demuestren su eficacia, su uso puede no ser seguro.
La Sociedad Europea de Cirugía de Catarata y Refractiva (ESCRS, por sus siglas en inglés) adelantó y publicó recientemente uno de los estudios más grandes al respecto (39). Con una rigurosa metodología aleatorizó más de 16.000 pacientes en 24 centros en nueve países de Europa. Los grupos de aleatorización incluían: 1) No administración de antibiótico en ninguna forma; 2) Administración intracameral de cefuroxima al final de la cirugía (1mg en 0,1ml de solución salina normal); 3) Administración de gotas tópicas de levofloxacina 0,5 por ciento iniciando 1 hora antes del procedimiento hasta cerca de 15 minutos después del procedimiento; y 4) Administración intracameral de cefuroxima y gotas tópicas de levofloxacina. El estudio discriminó los casos de endoftalmitis probados y aquellos posibles e incluyó un análisis de regresión logística de los factores de riesgo. Los resultados de este estudio muestran una disminución estadísticamente signficativa de los casos de endoftalmitis en los grupos que recibieron cefuroxime (tasa de 0,074% de endoftalmitis posible y 0,05% en los casos de endoftalmitis probada vs. 0,345% y 0,247%, respectivamente, en el grupo control). Adicionalmente, el estudio de los factores de riesgo demostró que el uso de incisiones corneales, las complicaciones intraoperatorias, los lentes de silicona (en contraposición a acrílico u otro material) y los cirujanos experimentados (vs. menos experimentados) tiene un mayor riesgo de desarrollo de endoftalmitis.
Tratamiento
La administración intravítrea de antibióticos es un componente fundamental del tratamiento de la endoftalmitis. Los niveles de antibióticos necesarios para cubrir los microorganismos involucrados se puede alcanzar rápidamente de esta manera y pueden permanecer un tiempo adecuado en el espacio intravítreo. Los antibióticos más frecuentemente utilizados son la vancomicina, la ceftazidima y la amikacina. Sin embargo los aminoglucósidos han sido asociados con toxicidad retiniana importante, por lo que su uso ha disminuido.
El EVS demostró que la vitrectomía inmediata favorece el desenlace de los pacientes con endoftalmitis postoperatoria (32). Este efecto fue aún más claro en el subgrupo de pacientes diabéticos, en los que hasta el 57 por ciento alcanzaron una agudeza visual de 20/40 cuando fueron tratados con vitrectomía, en comparación al 40 por ciento que lo hizo sin este procedimiento (40).
El EVS mostró que un predictor del desenlace visual del paciente era la agudeza visual en el momento de la presentación inicial (27). En pacientes con peor agudeza visual en su presentación, tuvieron un peor desenlace (agudeza visual <20/100), independientemente del germen identificado. La vitrectomía, junto con la toma de cultivos de humor vítreo, está altamente recomendada en esta situación.
Otro de los aportes importantes de este estudio, fue que demostró que el uso de antibióticos por vía sistémica no afectó el desenlace final (32). Los antibióticos utilizados en este estudio fueron la ceftazidima y la amikacina, ambos antibióticos que han tenido una disminución drástica en su uso debido a la posibilidad de inducción de resistencia, en el primer caso, y a la toxicidad, en el segundo caso. Una de las limitaciones principales del EVS es que excluía pacientes en los que la agudeza visual era de no percepción de luz y con opacidades de segmento anterior que impedían la realización de vitrectomía por lo que la efectividad de la inyección intravítrea en los casos mas graves no es posible determinarla.
Endoftalmitis post-traumática
La endoftalmitis es una complicación frecuente de los traumas con globo ocular abierto (2% a 11% de los casos). El trauma que ocurre en el área rural y aquel con cuerpo extraño tienen una mayor probabilidad de desarrollar infección (30% y 15%, respectivamente). También se aumenta la probabilidad de infección con el trauma sucio (41) y la ruptura del cristalino (41-44). Adicionalmente, el tiempo entre el trauma y el retiro del cuerpo extraño es fundamental para prevenir el desarrollo de la infección; a mayor tiempo, mayor posibilidad de infección (41). El pronóstico visual no es bueno, pero además se deteriora cuando los cultivos son positivos o cuando en ellos se encuentran microorganismos virulentos (como especies de Bacillus ) (45).
Hallazgos clínicos
Los pacientes con endoftalmitis post-traumática suelen presentarse con disminución de la agudeza visual y dolor ocular creciente. A la evaluación es posible encontrar celularidad aumentada en cámara anterior, hipopión, vitreitis, quemosis y edema palpebral, úlceras corneales y pus.
Microbiología
La tabla 3 muestra los microorganismos aislados en pacientes con endoftalmitis post-traumática. Los microorganismos de piel son muy frecuentes. En algunas series los hongos pueden ser muy frecuentes y con desenlaces visuales malos.
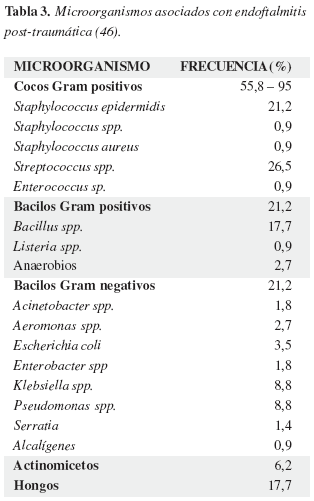
De forma similar a como sucede con la cirugía de catarata, la presencia de microorganismos en el momento del trauma no predice el riesgo de endoftalmitis (42).
Uso de antibióticos en endoftalmitis postraumática
Profilaxis
Un estudio realizado en India comparó las tasas de endoftalmitis en grupos asignados al azar que recibían o no antibióticos intravítreos. El estudio mostró una reducción no significativa (6,2% en el grupo que recibió vancomicina y ceftazidima y 18,4% en los que no recibieron tratamiento)(47). Otro estudio realizado en Irán, que aleatorizó los pacientes a recibir gentamicina más clindamicina intraocularmente no fue capaz de demostrar una diferencia significativa en la disminución de endoftalmitis en los pacientes con trauma ocular penetrante (48). Sin embargo, los mismos autores concluyeron recientemente un informe con un número mayor de pacientes. Con un total de 346 pacientes aleatorizados, las diferencias fueron de 0,3 por ciento de endoftalmitis en el grupo de intervención y 2,3 por ciento en el grupo de placebo. Esta diferencia si fue estadísticamente significativa. En el análisis de los subgrupos es evidente que el beneficio del uso profiláctico de los antibióticos se extiende únicamente al grupo de pacientes con un cuerpo extraño intraocular (49).
Tratamiento
El tratamiento de la endoftalmitis incluye la vitrectomía y la colocación intravítrea de antibióticos. De acuerdo con un estudio aleatorizado en cerca de 60 ojos mostró que hay un beneficio inicial en el uso de esteroides intravítreos, colocados al momento de hacer la vitrectomía, por su capacidad de reducir la inflamación. Sin embargo, a las 12 semanas el resultado visual fue igual en los 2 grupos de tratamiento (esteroides y control) (50).
Endoftalmitis endógena
La endoftalmitis endógena resulta de la introducción de microorganismos en el segmento posterior del ojo como resultado de una diseminación hematógena a partir de un foco de infección distante. Para llegar a producir la endoftalmitis, los microorganismos tienen que cruzar las barreras hemáticas presentes en el ojo. Esta vía de infección intraocular es responsable del 2 al 8 por ciento de todas las endoftalmitis (51). Uno de los estudios clásicos en esta patología es el de Jackson y sus colaboradores (52). En el hospital St. Thomas, en Londres, estos autores encontraron que 0,4 por ciento de las bacteriemias adquiridas en la comunidad y 0,06 por ciento de aquellas adquiridas en el hospital se asociaron con endoftalmitis bacteriana endógena. En la revisión de la literatura que acompaña este excelente artículo, 56 por ciento de los 267 pacientes con endoftalmitis endógena tenían una enfermedad inmunosupresora subyacente, especialmente diabetes mellitus y 67 por ciento tenían otro foco infeccioso identificable, principalmente, abscesos hepáticos, seguido de neumonía, endocarditis, infecciones de tejidos blandos, infección urinaria, meningitis, artritis séptica y celulitis orbitaria.
Microbiología
En el estudio citado (52), 56% de los microorganismos eran bacilos Gram negativos, K. penumoniae era el más frecuente, y 40 por ciento por cocos Gram positivos ( Streptococci y Staphylococcus aureus eran los más frecuentes). De forma interesante, los informes asiáticos suelen asociarse con mayor frecuencia a Klebsiella, y ésta a absceso hepático y complicaciones oculares. En Taiwán, se ha identificado un genotipo de Klebsiella , el K1, que muestra una mayor virulencia y una mayor probabilidad de desarrollar endoftalmitis (53). En el mundo occidental la frecuencia de Gram negativos suele ser más baja. Dependiendo de la institución y la frecuencia de neutropenia o transplante, los hongos pueden tener una mayor frecuencia, alcanzando hasta el 60 por ciento en una serie de casos (54). La causa más frecuente de endoftalmitis es Candida spp . Un estudio prospectivo sugiere que hasta el 25 por ciento de los pacientes con candidemia desarrollan compromiso retiniano, con mayor frecuencia en las dos primeras semanas (55). Al parecer Candida spp . tiene una mayor probabilidad de desarrollar compromiso vítreo mientras que Aspergillus spp. puede generar coriorretinitis por la mayor tendencia a invadir las estructuras vasculares (56).
Tratamiento
El tratamiento de base de la endoftalmitis se hace mediante antibióticos sistémicos en conjunto con el manejo ocular. Los cultivos sistémicos y la identificación del foco inicial son esenciales para dirigir la terapia. Los cultivos de humor acuoso o de vítreo son importantes para determinar la microbiología y la mejor alternativa de manejo antimicrobiano. La toma de cultivos intraoculares y la inoculación directa de antibióticos se han propuesto en pacientes como manejo en pacientes con esta patología.
La anfotericina B ha sido utilizada con éxito para el tratamiento de la endoftalmitis por Candida . El fluconazol por vía intravenosa y por vía oral es una alternativa para el tratamiento de la endoftalmitis (57). Todos los pacientes con candidemia deben ser examinados por un oftalmólogo con el fin de realizar un examen de retina bajo dilatación pupilar. Si el examen es negativo, este se debe repetir en las dos primeras semanas de aparición de la candidemia. El tratamiento de la endoftalmitis por Candida se hace con anfotericina B a dosis máximas toleradas (usualmente 1mg/K/día en una infusión de cuatro horas) por seis a 12 semanas, con atención a los niveles de potasio y la función renal.
Conclusiones
La endoftamitis infecciosa es una complicación de gran severidad y que implica un mal pronóstico visual. El uso de antibióticos en la prevención y el manejo de la endoftalmitis presentan aún varios puntos controversiales. Sin embargo, gracias al ensayo del grupo de estudio de endoftalmitis (39) se ha demostrado un beneficio del uso de cefuroxime intraocular para la profilaxis de la endoftalmitis post-operatoria. El ensayo clínico de Soheilian (48) y sus colaboradores sugiere que hay beneficio en el uso de clindamicina y gentamicina para la prevención de la endoftalmitis en los pacientes con trauma ocular penetrante y cuerpo extraño. Otras medidas preventivas no farmacológicas incluyen el uso de yodopovidona y el aislamiento de las pestañas.
El manejo de la endoftalmitis debe hacerse mediante la toma de muestras intraoculares para cultivo y la utilización de antibióticos en cámara vítrea para lograr niveles terapéuticos. El uso de antibióticos sistémicos es inútil (32) en ausencia de un foco extra-ocular. En las endoftalmitis endógenas el tratamiento inicial se hace con antibióticos sistémicos pero debe evaluarse la necesidad del cultivo y el tratamiento intraocular. El manejo conjunto y urgente de los pacientes entre oftalmólogos e infectólogos, junto con los datos de laboratorio son indispensables para disminuir la posibilidad de desenlaces adversos de estos pacientes.
Referencias
1. Fahmy JA. Endophthalmitis following cataract extraction: a study of 24 cases in 4,498 operations. Acta Ophthalmol Scand. 1975; 53:522-536. [ Links ]
2. Schmitz S, Dick HB, Krummenauer F, Pfeiffer N. Endophthalmitis in cataract surgery: results of a German survey. Ophthalmology. 1999;106:1869-1877. [ Links ]
3. Fisch A, Salvanet A, Prazuck T, Forestier F, Gerbaud L, Coscas G, et al. Epidemiology of infective endophthalmitis in France: the French Collaborative Study Group on Endophthalmitis. Lancet. 1991;338:1373-1376. [ Links ]
4. Goldblum D, Rohrer K, Frueh BE, Theurillat R,Thormann W, Zimmerli S. Ocular distribution of intravenously administered lipid formulations of amphotericin B in a rabbit model. Antimicrob Agents Chemother. 2002; 46: 3719-23. [ Links ]
5. Voutsinas P, Kavouklis E, Voutsinas D, Kontoghiorgi K, Giamarellou H. The effect of acetazolamide on the kinetics of four newer beta-lactams in the aqueous humor. Clin Microbiol Infect. 2001; 7: 70-4. [ Links ]
6. Jay WM, Aziz MZ, Rissing JP, Shockley RK. Pharmacokinetic analysis of intravitreal ceftriaxone in monkeys. Arch Ophthalmol. 1985; 103: 121-3. [ Links ]
7. Hui M, Kwok AK, Pang CP, Cheung SW, Chan RC, Lam DS, et al. An in vitro study on the compatibility and precipitation of a combination of ciprofloxacin and vancomycin in human vitreous. Br J Ophthalmol 2004; 88: 218-22. [ Links ]
8. Ghazi-Nouri SM, Lochhead J, Mearza AA, Qureshi MA, Thompson GM, Cowdrey G, et al. Penetration of oral and topical ciprofloxacin into the aqueous humour. Clin Experiment Ophthalmol 2003; 31: 40-3. [ Links ]
9. García-Sáenz MC, Arias-Puente A, Fresnadillo-Martinez MJ, Carrasco-Font C. Human aqueous humor levels of oral ciprofloxacin, levofloxacin, and moxifloxacin. J Cataract Refract Surg 2001; 27: 1969-74. [ Links ]
10. Sakamoto H, Sakamoto M, Hata Y, Kubota T, Ishibashi T. Aqueous and vitreous penetration of levofloxacin after topical and/or oral administration. Eur J Ophthalmol 2007; 17: 372-6. [ Links ]
11. Costello P, Bakri SJ, Beer PM, Singh RJ, Falk NS , Peters GB, Melendez JA. Vitreous penetration of topical moxifloxacin and gatifloxacin in humans. Retina. 2006; 26: 191-5. [ Links ]
12. Hariprasad SM, Mieler WF, Holz ER. Vitreous and aqueous penetration of orally administered gatifloxacin in humans. Arch Ophthalmol 2003; 121: 345-50. [ Links ]
13. Haider SA, Hassett P, Bron AJ. Intraocular vancomycin levels after intravitreal injection in post cataract extraction endophthalmitis. Retina. 2001; 21: 210-3. [ Links ]
14. Souli M, Kopsinis G, Kavouklis E, Gabriel L, Giamarellou H. Vancomycin levels in human aqueous humour after intravenous and subconjunctival administration. Int J Antimicrob Agents 2001; 18: 239-43. [ Links ]
15. Fiscella RG, Lai WW, Buerk B, Khan M, Rodvold KA, Pulido JS, Labib S, Shapiro MJ, Blair NP. Aqueous and vitreous penetration of linezolid (Zyvox) after oral administration. Ophthalmology. 2004;111:1191-5. [ Links ]
16. Campochiano PA, Lim JI. Aminoglycoside toxicity in the treatment of endophthalmitis. The aminoglycoside Toxicity Study Group. Arch Ophthalmol. 1994; 112:48-53. [ Links ]
17. Kampougeris G,Antoniadou A, Kavouklis E, Chryssouli C, Giamarellou H. humour after oral administration Penetration of moxifloxacin into the human aqueous. Br J Ophthalmol. 2005; 89: 628-31 [ Links ]
18. Campochiano Pa, Green WR. Toxicity of intravitreous ceftazidime in primate retina. Arch Ophthalmol. 1992; 10: 1625-9. [ Links ]
19. Cannon JO, Fiscella R, Pattharachayakul S, Garey KW, De Alba F, Piscitelli S, et al. Comparative toxicity and concentrations of intravitreal amphotericin B formulations in a rabbit model. Invest Ophthalmol Vis Sci. 2003; 44:2112-7. [ Links ]
20. Taban M, Behrens A, Newcomb RL, Nobe MY, Sacdi G, Sweet PM, et al. Acute endophthalmitis following cataract surgery: a systematic review of the literature. Arch Ophthalmol. 2005; 123:613-20. [ Links ]
21. Li J, Morlet N, Ng J, Semmens JB, Knuiman MW, EPSWA. Significan nonsurgical Risk Factors for Endophthalmitis after Cataract Surgery: EPSWA Fourth Report. Invest Ophthalmol Vis Sci. 2004; 45:1321–28. [ Links ]
22. McDonnell PJ, Taban M, Sarayba M, Rao B, Zhang J, Schiffman R, et al. Dynamic morphology of clear corneal cataract incisions. Ophthalmology. 2003; 110:2342-8. [ Links ]
23. Taban M, Saryba, Ignacio TS, Behrens A, McDonnell PJ. Ingress of India Ink into anterior chamber through sutureless clear corneal caataract wounds. Arch Ophthalmol. 2005; 123:643-8. [ Links ]
24. Vasavada AR, Praveen MR, Pandita D, Gajjar DU, Vasavada VA , Vasavada VA , et al. Effect of stromal hydration of clear corneal incisions: quantifying ingress of trypan blue into the anterior chamber after phacoemulsification. J Cataract Refract Surg. 2007; 33:623-7 [ Links ]
25. Mayer E, Cadman D, Ewings P, Twomey JM, Gray RM, Claridge KG, et al. A 10 year retrospective survey of cataract surgery and endophthalmitis in a single eye unit: injectable lenses lower the incidence of endophthalmitis. Br J Ophthalmol. 2003; 87: 867-9. [ Links ]
26. Montan P, Lundström M, Stenevi U, Thorburn W. Endophtalmitis following cataract surgery in Sweden. The 1998 national prospective survey. Acta Ophthalmol Scand. 2002; 80: 258-61. [ Links ]
27. Microbiologic factors and visual outcome in the endophthalmitis vitrectomy study. Am J Ophthalmol 1996; 122: 830-46. [ Links ]
28. Narang S, Gupta A, Gupta V, Dogra MR, Ram J, Pandav SS, et al. Fungal endophthalmitis following cataract surgery: clinical presentation, microbiological spectrum, and outcome. Am J Ophthalmol. 2001; 132: 609-17. [ Links ]
29. Kunimoto DY,Das T, Sharma S, Jalali S, Majji AB , Gopinathan U, et al. Microbiologic spectrum and susceptibility of isolates: part I. Postoperative endophthalmitis. Endophthalmitis Research Group. Am J Ophthalmol. 1999; 128: 240-2. [ Links ]
30. Speaker MG, Menikoff JA. Prophylaxis of endophthalmitis with topical povidone-iodine. Ophthalmologty. 1991; 98: 1769-75. [ Links ]
31. Trinavarat A, Atchaneeyasakul LO, Nopmaneejumruslers C, Inson K. Reduction of endophthalmitis rate after cataract surgery with preoperative 5% povidone-iodine. Dermatology 2006; 212 (suppl 1):35-40. [ Links ]
32. Results of the Endophthalmitis Vitrectomy Study. A randomized trial of immediate vitrectomy and of intravenous antibiotics for the treatment of postoperative bacterial endophthalmitis. Endophthalmitis Vitrectomy Study Group. Arch Ophthalmol. 1995; 113: 1479-96. [ Links ]
33. Hariprasad SM, Mieler WF, Holz ER. Vitreous and Aqeous Penetration of Orally Administered Gatifloxacin in Humans. Arch Ophthalmol. 2003; 121:345-50. [ Links ]
34. García-Sáenz MC, Arias-Puente A, Fresnadillo- Martínez MJ, Carrasco-Font C . Human aqueous humor levels of oral ciprofloxacin, levofloxacin, and moxifloxacin. J Cataract Refract Surg. 2001; 27:1969-74. [ Links ]
35. Deramo VA, Fastenberg DM, Udell IJ. Acute Endophthalmitis in Eyes Treated Prophylactically with Gatifloxacin and Moxifloxacin. Am J Ophthalmol. 2006; 142: 721-5. [ Links ]
36. Solomon R, Donnenfeld ED, Perry HD, Snyder RW, Nedrud C, Stein J, et al. Penetration of topically applied gatifloxacin 0.3%, moxifloxacin 0.5%, and ciprofloxacin 0.3% into the aqueous humor. Ophthalmology. 2005; 112: 466-469. [ Links ]
37. Beigi B, Westlake W, Chang B, Marsh C, Jacob J, Riordan T. The effect of intracameral, per-operative antibiotics on microbial contamination of anterior chamber aspirates during phacoemulsification. Eye 1998; 12 (Pt 3a): 390-4. [ Links ]
38. Axer-Siegel R, Stiebel-Kalish H, Rosenblatt I, Strassmann E, Yassur Y, Weinberger D. Cystoid macular edema after cataract surgery with intraocular vancomycin. Ophthalmology. 1999; 106; 1660-64. [ Links ]
39. ESCRS Endophthalmitis Study Group. Prophylaxis of posoperative endophthalmitis following cataract surery. Results of the ESCRS multicenter study and identification of risk factors. J Caract Refract Surg. 2007; 33: 978-88. [ Links ]
40. Cooper BA, Holekamp NM, Bohigian G, Thompson PA. Case-control study of endophthalmitis after cataract surgery comparing scleral tunnel and clear corneal wounds. Am J Ophthalmol. 2003; 136: 300-5. [ Links ]
41. Essex RW, Yi Q, Charles PG, Allen PJ. Post-traumatic endophthalmitis. Ophthalmology. 2004; 111:2015–22. [ Links ]
42. Ariyasu RG, Kumar S, LaBree LD, Wagner DG, Smith RE. Microorganisms cultured from the anterior chamber of ruptured globes at the time of repair. Am J Ophthalmol. 1995; 119:181-188. [ Links ]
43. Rubsamen PE, Cousins SW, Martinez JA. Impact of cultures on management decisions following surgical repair of penetrating ocular trauma. Ophthalmic Surg Lasers. 1997; 28:43–49. [ Links ]
44. Thompson WS, Rubsamen PE , Flynn HW Jr, Schiffman J, Cousins SW. Endophthalmitis after penetrating trauma. Risk factors and visual acuity outcomes. Ophthalmology. 1995;102:1696-1701. [ Links ]
45. Lieb DF, Scott IU, Flynn HW Jr,Miller J, Feuer WJ. Open globe injuries with positive intraocular cultures: factors influencing final visual acuity outcomes. Ophthalmology. 2003;110:1560-6. [ Links ]
46. Kunimoto DY, Das T, Sharma S, Jalali S, Majji AB, Gopinathan U, et al. Microbiologic Spectrum and Susceptibility of Isolates: Part II. Posttraumatic Endophthalmitis. Am J Ophthalmol. 1999;128: 242-4. [ Links ]
47. Narang S, Gupta V, Gupta A, Dogra MR, Pandav SS, Das S. Role of prophylactic intravitreal antibiotics in open globe injuries. Indian J Ophthalmol. 2003;51:39-44. [ Links ]
48. Soheilian M, Rafati N, Peyman GA. Prophylaxis of acute posttraumatic bacterial endophthalmitis with or without combined intraocular antibiotics: a prospective, double-masked randomized pilot study. Int Ophthalmol. 2001; 24: 323-30. [ Links ]
49. Soheilian M, Rafati N, Mohebbi MR, Yazdani S, Habibabadi HF, Feghhi M, et al. Prophylaxis of acute posttraumatic bacterial endophthalmitis: a multicenter, randomized clinical trial of intraocular antibiotic injection, report 2. Arch Ophthalmol. 2007;125:460-5. [ Links ]
50. Das T, Jalali S, Gothwal VK, Sharma S, Naduvilath TJ. Intravitreal dexamethasone in exogenous bacterial endophthalmitis: results of a prospective randomised study. Br J Ophthalmol. 1999; 83(9):1050-5. [ Links ]
51. Shrader SK, Band JD, Lauter CB, Murphy P. The clinical spectrum of endophthalmitis: incidence, predisposing factors, and features influencing outcome. J Infect Dis. 1990; 162:115–120. [ Links ]
52. Jackson TL, Eykyn SJ, Graham EM, Stanford MR . Endogenous bacterial endophthalmitis: a 17-year prospective series and review of 267 reported cases. Surv Ophthalmol. 2003; 48: 403-23. [ Links ]
53. Fang CT, Lai SY, Yi WC, Hsuel PR, Liu KL, Chang SC. Klebsiella pneumoniae Genotype K1: An Emerging Pathogen That Causes Septic Ocular or Central Nervous System Complications from Pyogenic Liver Abscess. Clin Infect Dis. 2007; 45:284-93. [ Links ]
54. Schiedler V, Scott IU, Flynn HW, Davis JL, Benz MS, Miller D. Culture-proven endogenous endophthalmitis: clinical features and visual acuity outcomes. Am J Ophthalmol. 2004; 137: 725-31. [ Links ]
55. Krishna R, Amuh D, Lowder CY, Gordon SM, Adal KM, Hall G. Should all patients with candidaemia have an ophthalmic examination to rule out ocular candidiasis?. Eye. 2000; 14(Pt 1): 30-4. [ Links ]
56. Rao NA, Hidayat AA. Endogenous mycotic endophthalmitis: variations in clinical and histopathologic changes in candidiasis compared with aspergillosis. Am J Ophthalmol 2001; 132: 244-51. [ Links ]
57. Pappas PG, Rex JH, Karchmer AW, Sobel J, Edwards JE, Hadley S, et al. Guidelines for treatment of candidiasis. Clin Infect Dis 2004; 38: 161-89.58. [ Links ]













