Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.56 no.4 Bogotá Oct./Dec. 2008
INVESTIGACIÓN ORIGINAL
ADMINISTRACIÓN DE INSULINA POR VÍA INTRANASAL Y MEMORIA DECLARATIVA. REVISIÓN SISTEMÁTICA DE LA LITERATURA
Intranasal insulin administration and declarative memory. A systematic review
Andrés Jagua Gualdrón1, Vladimir Ávila Ávila2,3.
1. Estudiante de octavo Semestre de Medicina, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá.
Correspondencia: ajaguag@unal.edu.co
2. Médico Cirujano, Universidad Nacional de Colombia. Candidato a la Maestría en Fisiología, Universidad Nacional de Colombia.
3. Profesor, Departamento de Morfofisiología, Universidad de la Sabana.
Resumen
Antecedentes. La insulina participa de los procesos de formación de la memoria y los defectos en su señalización podrían estar relacionados con el déficit cognitivo y las enfermedades neurode-generativas como la enfermedad de Alzheimer.
Objetivo. Evaluar la relación entre la administración de la insulina por vía intranasal y la memoria declarativa en estudios en humanos.
Material y métodos. Se realizó una búsqueda intensiva y sistemática de estudios publicados entre enero de 1997 y diciembre del 2008 a través de las bases de datos MEDLINE, Cochrane, DynaMed y LILACS. Los estudios fueron sometidos a dos pruebas de calidad metodológica, se les realizó un análisis crítico y se aplicó estadística básica.
Resultados. Se hallaron cinco artículos que incluían 252 personas. De ellos 143 tenían diagnóstico probable de la enfermedad de Alzheimer o alteración cognitiva leve. Los estudios reportan mejoría en las tareas de la memoria a corto y largo plazo en los grupos que recibieron la insulina comparados con quienes recibieron el placebo.
Conclusión. Los estudios son pocos y difíciles de comparar. Sin embargo tras este análisis puede sugerirse que la insulina actúa durante la formación de la memoria declarativa y podría emplearse en el tratamiento de los trastornos de la memoria.
Palabras clave: insulina, memoria, administración intranasal, enfermedad de Alzheimer, MEDLARS, literatura de revisión como asunto.
Summary
Background. Insulin acts in memory formation and its signal impairment can be related with mild cognitive impairment and neurodegenerative diseases like Alzheimer's disease.
Objective. To evaluate the relationship between intranasal insulin administration and declarative memory in studies with human.
Materials and methods. A systematic search of studies published from January 1997 to december 2008 through electronic databases MEDLINE, DynaMed, Cochrane and LIlACS. Articles were evaluated with two tests for methodological validity and a basic statistical analysis was performed.
Results. We find five articles that include 252 persons. 143 have presumptive diagnosis for Alzheimer's disease or mild cognitive impairment. Studies reported improvement in short and long term memory task in people that receive insulin compared with placebo.
Conclusion. Studies are few and difficult to compare. However, analysis of the articles suggests insulin play some roles in declarative memory formation and in the future, insulin can be a treatment for cognitive disorders.
Key words: Insulin, Memory, administration intranasal , Alzheimer disease, MEDLARS, review literature as topic.
Introducción
Recientemente se han descrito acciones de la insulina en el sistema nervioso central (SNC) en actividades como el control del ciclo apetito-saciedad, la formación de la memoria, supervivencia neuronal y la regulación de la cantidad de productos potencialmente nocivos para las neuronas como el péptido amiloide-b, razón por la cual los defectos en la señal de la insulina sobre las neuronas se han relacionado con la enfermedad de Alzheimer (EA) (1).
La insulina atraviesa la barrera hematoen-cefálica por un mecanismo mediado por el receptor de insulina (RI) (2). En el SNC el RI se expresa en el hipocampo (otros sitios de expresión son el cerebelo, el bulbo olfatorio y mas discretamente la corteza frontal) la región asociada con los procesos de la memoria (3-5). El RI es similar al que se encuentra en otros tejidos pero presenta un patrón de glucosilación distinto y posiblemente pequeñas variaciones en la secuencia de aminoácidos que aún no se han explorado del todo y cuyo significado funcional es incierto (6).
Una vez unida a su receptor la insulina puede activar cascadas de señalización como la PI3K/Akt/mTor o la ruta de las MAP-proteínas activadas por mitógeno-cinasas (Raf-1/MEK/ERK) que dirigen el reclutamiento de receptores, la expresión de genes y la síntesis de proteínas (7,8); la expresión de genes es un paso necesario para la formación de memoria (9) y su consolidación a largo plazo (10). Adicionalmente la activación de la PI3K (mediada por el sustrato del receptor de la insulina) contribuye con una señal de supervivencia de la que participa la PKB/Akt que inactiva proteínas relacionadas con los inicios de la apoptosis como la BAD y la BCL-XL (11).
En animales se ha evidenciado un mejor comportamiento en tareas de memoria espacial y facilitación a largo plazo de la eficacia sináptica en los sujetos que han recibido insulina (12). Estos hallazgos y estudios sugieren que la insulina podría ser una alternativa en el tratamiento del déficit de la memoria. En la tabla 1 se resumen los resultados de los estudios en animales.
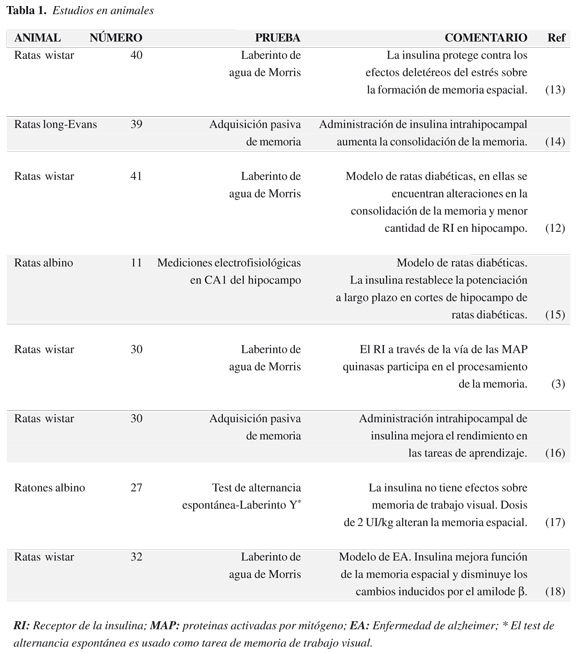
Al comienzo se utilizó la vía venosa pero el riesgo de hipoglucemia severa hizo que se descartara; lo mismo ocurrió con la administración intramuscular. Al contrario, la vía intranasal ofrece un acceso rápido al SNC con pocas variaciones de la glucemia.
La insulina administrada por la vía intranasal puede ingresar al SNC bien sea a través de transporte transcelular (endocitosis o difusión pasiva a través de la célula sustentacular del epitelio olfatorio), paracelularmente entre las células sustentaculares y entre estas y las neuronas bipolares, o puede ingresar a través de trasporte axonal retrogrado (19). Teniendo en cuenta las características de peso y lipofilidad de la insulina el mecanismo de penetración más probable es el paracelular. Tras la administración intranasal de insulina (en dosis de 40 Unidades Internacionales-UI) en hombres sanos es posible detectar insulina en el líquido cefalorraquídeo (LCR) 10 minutos después; el pico de concentración se da 30 minutos después de su administración e incluso luego de 80 minutos es posible registrar el péptido en el líquido cefalorraquídeo; dado que no existe una barrera física entre el líquido cefalorraquídeo y el parénquima cerebral una cantidad importante de esta insulina podría entrar en él y unirse a su receptor. No hay reporte de cambios en las concentraciones en sangre periférica de insulina cuando se usa esta aplicación (20).
El deterioro de la función cognitiva, propio de las enfermedades neurodegenerativas, no cuenta con tratamientos farmacológicos útiles que mejoren el estado del paciente, causa numerosas dificultades a las familias (desde el punto de vista económico y social) y al sistema de salud. Dada la relevancia que poseen los trastornos neurodegenerativos nos propusimos realizar una revisión sistemática de la literatura de estudios que evalúen el desempeño en tareas cognitivas con relación a la administración de la insulina por vía intranasal.
Material y métodos
Búsqueda de artículos
Realizamos una búsqueda sistemática de la literatura médica a través de las bases de datos electrónicas MEDLINE, DynaMed, Cochrane, y LILACs de artículos publicados en idioma inglés y español entre enero de 1997 y diciembre del 2008. En esta búsqueda intensiva empleamos las palabras clave "Insulin administration AND cognitive function", "Intranasal insulin AND cognition", "Insulin administration AND cognition", "Intranasal insulin administration AND memory", "Intranasal insulin administration AND cognition".
Los artículos incluidos en el análisis debían contemplar el uso en humanos de insulina administrada por vía intranasal y la medición de tareas relacionadas con la memoria declarativa. Dentro del análisis sólo se tuvieron en cuenta los artículos producto de investigación original. Los artículos de revisión encontrados no se analizaron pero se realizó una búsqueda de artículos primarios a través de su bibliografía. Dada la escasez de trabajos publicados en este tema incluimos en la búsqueda todo tipo de diseño para llevar a cabo una investigación: series de casos, estudios de corte transversal, estudios de cohortes, estudios de casos y controles, ensayos clínicos aleatorizados y no aleatorizados.
Criterios de inclusión
Los criterios de inclusión fueron: publicación indexada en las bases de datos anteriormente mencionadas (PUBMED, DynaMed, Cochrane, LiLACS), idioma inglés o español, fecha de publicación en los límites contemplados (1997-2008), contener tareas para evaluar la memoria declarativa, protocolo aplicado en humanos, pacientes con más de 18 años de edad, el estudio debía contener pruebas de control de niveles de glucosa e insulina periféricas y reporte de efectos adversos.
Evaluación metodológica
Los artículos originales que cumplieron con los criterios de selección fueron sometidos al análisis de su calidad metodológica mediante dos pruebas previamente estudiadas y validadas (21,22).
El primer instrumento (escala de Jadad) consta de cinco preguntas en él la alta calidad se da con tres o más puntos en una escala de cinco (Tabla 2). Por cada respuesta afirmativa en esta escala se da un punto (1), una respuesta negativa no da punto (0) (22).

El segundo instrumento (escala de Manterola) es una prueba de tres ítems; el primero hace referencia al diseño del estudio, el segundo a la población estudiada, y el tercero a la metodología que se emplea (objetivos, diseño, criterios de selección de la muestra y tamaño de la muestra). A cada ítem se asigna un valor dando al final un puntaje que puede variar entre seis y 36 siendo seis el puntaje de menor calidad y 36 el de mayor calidad. En la tabla 3 presentamos este instrumento (21).
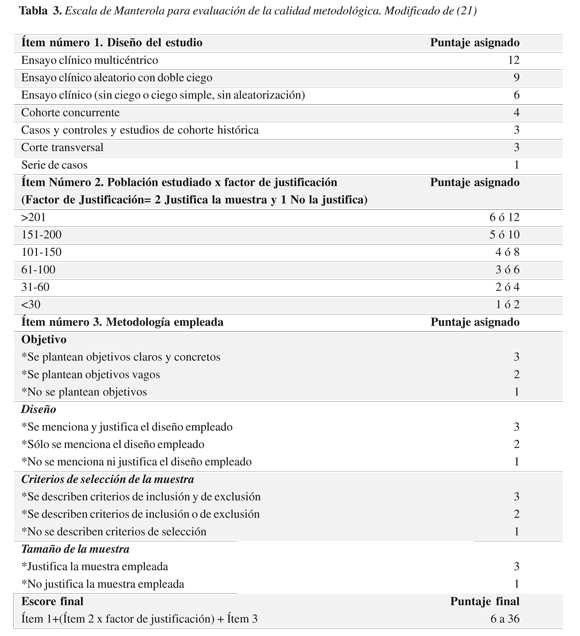
El análisis de la calidad metodológica fue llevado a cabo por los autores de manera independiente, en caso de desacuerdo en los resultados se llegó a la puntuación por consenso.
Variables de estudio
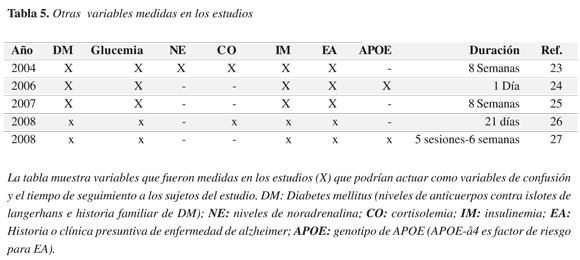
Las variables consideradas para el análisis fueron: año de publicación, número de individuos incluidos en el estudio, género, edad, dosis (en unidades internacionales), índice de masa corporal, historia de diabetes mellitus, glucemia, cortisolemia, niveles séricos de catecolaminas, tipo de tarea medida, duración del estudio, historia de enfermedad de Alzheimer y tipo de APOE expresado.
Análisis de la información
Se realizó un análisis exploratorio de los datos y se aplicó estadística descriptiva. Se realizó un examen preliminar detallado de la información recolectada documentando cada una de las variables mencionadas anteriormente.
Resultados
Con la búsqueda en las bases de datos previamente descritas se encontraron 245 artículos en inglés y español de los cuales 46 eran revisiones de tema. De estos cinco cumplían los criterios de inclusión propuestos. Ningún artículo de las referencias bibliográficas citadas en los artículos de revisión cumplía con los criterios de inclusión. De esta manera sólo cinco artículos fueron tenidos en cuenta dentro del análisis.
Presentación de los artículos
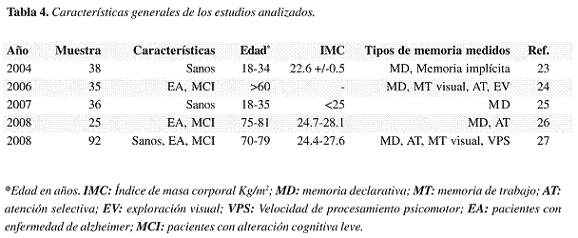
Los cinco trabajos que cumplían con los criterios de inclusión son de reciente publicación (23-27). En total se incluyen 252 personas; 143 de los individuos incluidos tenían diagnóstico presuntivo de enfermedad de Alzheimer o alteración cognitiva leve.
En uno de los estudios se tomó como muestra a 38 estudiantes de índice de masa corporal normal y sin historia de diabetes mellitus (DM), se midieron los niveles séricos de anticuerpos contra islotes de langerhans para descartar personas con posibles desórdenes en la producción de insulina. Al examen físico todos eran aparentemente normales. Las tablas 4 y 5 muestran las características generales de los estudios analizados. La muestra fue aleatoriamente dividida en dos grupos. Durante las dos primeras semanas del estudio los grupos recibieron placebo, posteriormente se realizó un seguimiento de ocho semanas en la que un grupo recibía placebo y otro insulina administrada por vía intranasal cuatro veces al día (en la mañana, al medio día, en la noche media hora antes de la comida y antes de ir a la cama); cada dosis era de 40 UI o 0.4 ml de insulina o placebo administrado en cuatro roseadas de 0.1 ml (la administración se hacia mediante spray). Al inicio del estudio, en la segunda y séptima semana se llevaron a cabo sesiones de control en las que se midieron los efectos agudos de la administración de la insulina y una semana después (es decir a la primera semana, a la tercera y a la octava semana) se midieron los efectos crónicos. Se midieron la memoria declarativa (listado de palabras), la memoria no declarativa y un test para el estado emocional. Ocho semanas después de iniciado el estudio se reportan mejoras en el comportamiento en las pruebas de memoria declarativa en quienes recibieron insulina comparado con el grupo placebo; la administración aguda se relacionaba con un mayor sentimiento de bienestar y auto confianza (23).
Otro incluyó a 35 adultos aparentemente sanos y 26 con diagnóstico probable de EA o alteración cognitiva diferenciando el genotipo de la APOE del individuo. Se midieron tareas de memoria declarativa de tipo verbal, memoria de trabajo visual, atención selectiva y exploración visual. Los individuos ayunaban desde doce horas antes del estudio; eran repartidos en tres grupos (placebo, 20 UI de insulina y 40 UI) de manera aleatoria. La administración intranasal se hizo a través de jeringas, cada 100 µL de solución correspondió a 10 UI en el caso de quienes recibían insulina. Se reportó una mejora significativa en las tareas de memoria verbal para el grupo con alteraciones de la memoria que eran APOE4 negativos a dosis de 20 UI y 40 UI, en el caso de los sujetos con alteración de la memoria APOE4 positivos a dosis de 40 UI tienen un comportamiento negativo. Se reportaron en dos casos efectos adversos durante el estudio (epistaxis y dolor en la nariz) (24).
Se estudiaron 36 hombres con edades de entre 18 y 35 años, un índice de masa corporal menor a 25 Kg/m2 y aparentemente sanos al examen físico. No se aceptaron individuos con antecedentes familiares y personales de DM. Aleatoriamente se dividieron en tres grupos (placebo, insulina humana, insulina aspartato- análogo de la insulina que en la posición B28 presenta el reemplazo de la prolina por ácido aspártico). Cada dosis era de 0.4 ml (40 UI) y se recibió en la mañana, el almuerzo, la cena y antes de ir a dormir) administrada en cuatro roseadas.
Las dos primeras semanas los tres grupos recibían placebo; al inicio del estudio, a las dos semanas y a la séptima semana se realizaron pruebas de control de los efectos agudos y en las semanas dos, cuatro y octava se midieron efectos crónicos. Se realizó una medición de la memoria declarativa (listado de palabras). Se informó una mejora significativa en los grupos que recibieron insulina humana e insulina aspart para estas tareas a las ocho semanas de iniciado el tratamiento (25).
Una publicación reciente muestra los resultados de un estudio que comparó el efecto de la insulina sobre pruebas de atención selectiva y memoria declarativa comparado con placebo luego de 21 días de intervención. Se aplicó la insulina a dosis de 20 UI dos veces al día (después del desayuno y del almuerzo). En el grupo tratado con insulina se atenúa el incremento en los niveles plasmáticos de insulina comparado con el grupo placebo lo cual se interpreta como un aumento de la sensibilidad periférica de la insulina.
El grupo tratado con insulina muestra una mejoría significativa en tareas de memoria verbal comparada con el placebo. También se reporta un mejor comportamiento en las tareas de atención selectiva que requieren inhibición de respuestas. En este estudio encuentran un aumento en los niveles en ayuno del amiloide b-40 en el grupo tratado con insulina pero sin cambios en el amiloide b-42, estos resultados se correlacionan con una disminución en las cifras de cortisol en el grupo que recibió insulina. No se reportan reacciones adversas serias (26).
En el trabajo más reciente se incluyeron 59 adultos mayores sanos (48 de ellos negativos para el genotipo µ4 de la APOE) y 33 con probable diagnostico de EA (13 individuos) o alteración cognitiva leve (20) con objeto de estudiar los efectos de diferentes dosis de insulina intranasal sobre pruebas de memoria verbal, atención selectiva, memoria de trabajo visual y velocidad de procesamiento psicomotor y sobre los niveles plasmáticos del amiloide b. Los individuos, en cinco sesiones- en ayuno- en un lapso de una y seis semanas, eran expuestos a solución salina, o a insulina intranasal en dosis de 10, 20, 40 y 60 UI.
La insulina no afectó los niveles de glucemia o insulinemia. Con la dosis de 20 UI se obtuvieron los mejores resultados en las pruebas cognitivas en los individuos enfermos sin el genotipo µ4; los sujetos µ4 positivo presentaron deterioro de su función cognitiva. En los individuos sanos no hubo cambios respecto de su desempeño antes de la intervención.
Los enfermos µ4 negativo aumentaban su nivel plasmático de amiloide b-42 con el aumento de las dosis de insulina; no hay incrementos en el caso de los µ4 positivos (27).
Evaluación de la calidad metodológica
Los estudios fueron analizados en cuanto a su calidad metodológica mediante el método de JADAD (Tabla 2) y MANTEROLA (Tabla 3).
Los puntajes obtenidos en las pruebas se muestran en la tabla 6. Todos los artículos obtuvieron más de tres puntos en la escala, lo cual los ubica en la categoría de alta calidad metodológica. Dos de los estudios (40%) obtuvieron un puntaje de tres y tres (60%) obtuvo cuatro puntos.
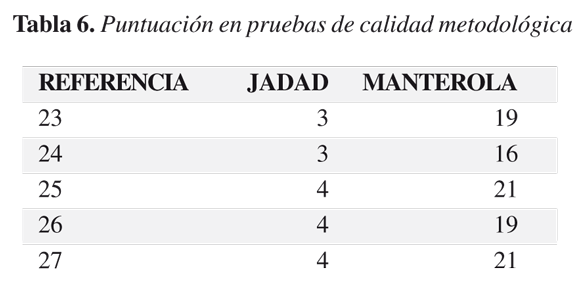
La evaluación de la calidad metodológica de los trabajos muestra puntajes de alta calidad según la escala de Jadad. Según la aproximación de Manterola se evidencia una calidad metodo-lógica aceptable.
Discusión
Calidad y validez de los estudios
Hemos realizado una revisión sistemática de la literatura en la que evaluamos críticamente los trabajos incluidos. La calidad metodológica de los estudios incluidos es en general buena; bajos puntajes obtenidos en estas pruebas podrían significar dificultades en el análisis de los resultados obtenidos en los estudios y su validez externa. Es importante señalar las diferencias en cuanto a los puntajes obtenidas según las dos pruebas empleadas. Probablemente esto se debe a que la prueba de Manterola otorga una relevancia especial al diseño del estudio y al tamaño de la muestra.
Insulina y función cognitiva: ¿existe una relación?
Todos los estudios reportaron mejoría esta-dísticamente significativa en el comportamiento de los sujetos de estudio en tareas de memoria declarativa. Una de las evidencias de las acciones de la insulina sobre la función del SNC surgió de un estudio en el que luego de administrar insulina por vía intranasal y midiendo potenciales auditivos evocados se reportó una disminución de la amplitud de N1 y P3 y una disminución significativa de su latencia (28). La onda P3 (P300) surge cuando, en el estado de atención, se discrimina entre un estímulo relevante y otro. La latencia de P3 es la medida de la rapidez con que se lleva a cabo el procesamiento cognitivo, es decir la disminución del tiempo de latencia indica que el tiempo necesario para la actualización de la memoria de trabajo es menor (29).
Los modelos en animales han constituido un interesante punto de partida para resolver esta discusión. En ratas la insulina facilita la consolidación de la memoria y la potenciación a largo plazo (12-18). Evidencia proveniente del estudio epidemiológico orienta también hacia la importancia de la señal de la insulina en los procesos cognitivos. Los pacientes diabéticos muestran un riesgo aumentado de desarrollar alteraciones cognitivas y enfermedad de Alzheimer (30). En un estudio transversal se encontró que las altas concentraciones de insulina en sangre se relacionan con un alto volumen en materia gris y blanca de individuos sanos y con enfermedad de Alzheimer. En el caso de los pacientes con demencia, la relación entre insulina y severidad de la enfermedad se encontró únicamente en los individuos ApoE4-negativos (a menor insulinemia mayor severidad) (31). El aumento en los niveles plasmáticos de insulina sin alterar la glucemia mejora el comportamiento en pruebas de memoria verbal de personas con la EA (32).
Los mecanismos de acción de la insulina
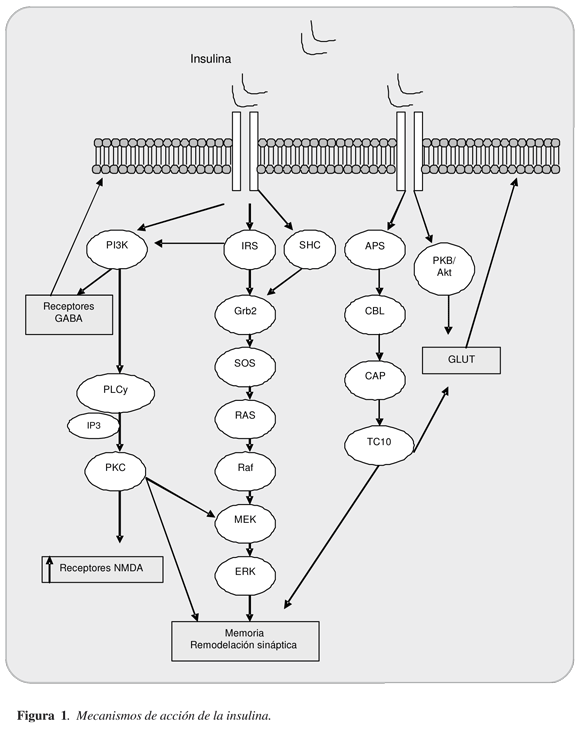
Los estudios en animales han permitido sugerir que la insulina atraviesa la barrera hematoen-cefálica (33), se une a sus receptores ubicados en el hipocampo (34), y allí participa de procesos de reclutamiento de receptores, activación de proteínas y aumento de la expresión de genes asociados con la formación y consolidación de la memoria (16,35-37). Estas acciones son posibles mediante la activación del receptor de la insulina que entonces logra activar la PI3K, al sustrato del receptor de la insulina (IRS) a la proteína Shc y la proteína cinasa C (PKC) (37,38). La PKC es esencial para la adquisición, consolidación y reconsolidación de la memoria (39). La activación de la PKC reduce la velocidad de producción del amiloide b y prolonga la vida de ratones usados en modelos de la EA (38).
Las neuronas expresan las proteínas facilitadoras del transporte de glucosa-GLUT. De ellas se ha reconocido la expresión de GLUT 4 y GLUT 8 sensibles a la insulina, estos se encuentran en el hipocampo y en el caso del GLUT 8 existe una ubicación preferencial en el soma de las neuronas.
La insulina estimula la movilización de estos dos transportadores desde la reserva citoplasmática hacia la membrana y por tanto participa de la regulación de las demandas de glucosa en las neuronas (40). Una alteración de este mecanismo podría también presentarse en estados morbosos como las enfermedades neurodegene-rativas. La figura 1 resume estas vías de señalización intracelular. Otro mecanismo probable es la modulación del eje hipotálamo-pituitario-adrenal con disminución de la hiperreactividad del eje (menor producción de cortisol) (41) y de esta forma modular la producción del amiloide b. En dos de los estudios incluidos se reportó disminución de la cortisolemia luego de iniciado el manejo con la insulina (23,26).
Insulina en el manejo de trastornos cognitivos
La señal de la insulina sobre las neuronas del SNC se ha relacionado con el deterioro cognitivo en pacientes con resistencia a la insulina y con enfermedades neurodege-nerativas como la EA, la enfermedad de Parkinson, la enfermedad de Hungtinton y la esquizofrenia (42,43). No existen en la actualidad tratamientos curativos para las enfermedades neurodegenerativas. El uso de antiinflama-torios fue sugerido con base en modelos de neuroinflamación como mecanismo fisiopatológico sin embargo no se ha podido demostrar su eficacia (44). El uso de agonistas de los receptores activados por el proliferador de peroxisomas (PPAR) fue propuesto por sus propiedades antiinflamatorias (otra posibilidad es el aumento de la sensibilidad a la insulina) (45); en una revisión sistemática llevada a cabo por nosotros (cuatro estudios sobre uso de pioglitazona y roziglitazona) no se encontró una ventaja significativa de esta terapia en parte por las limitaciones propias de los estudios, estos medicamentos podrían tener utilidad sólo si son utilizados antes de que ocurra el establecimiento de la enfermedad (información no publicada).
El uso de medicamentos antidiabéticos y de insulina en pacientes con demencia y diabetes con menor progresión de las placas neuríticas en un estudio post-mortem (46). Las acciones de la insulina sobre los procesos de la memoria en el SNC podrían aprovecharse en el tratamiento para el déficit cognitivo, sin embargo, los estudios con que actualmente se cuenta son pocos. Es necesario desarrollar más estudios de alta calidad metodológica para evaluar el beneficio potencial de su uso en pacientes con demencia.
Existen diferentes respuestas a la insulina según el genotipo de la APOE. El genotipo APOE4 es factor de riesgo para el desarrollo de EA y se asocia a la mitad de los casos de la enfermedad. Los individuos ε4-negativos responden a la terapia con insulina, los sujetos positivos poseen una curva de respuesta a la insulina distinta, con dosis mucho menores de las necesarias para los demás (20 UI da la mejor respuesta). Futuros estudios deberían tener en cuenta esta diferencia.
Limitaciones de esta revisión
Esta revisión sistemática de la literatura tiene algunas limitaciones. Por una parte a pesar de la intensiva búsqueda de artículos se encontraron pocos estudios; es posible que esto se deba a los pocos idiomas que incluimos (inglés y español) o a la dificultad de acceder a otro tipo de publicaciones no indexadas en las bases de datos que se incluyeron. Otra limitación difícil de controlar es la del sesgo de publicación que puede haber influido en los estudios que se incluyeron; según esto es posible que los estudios donde se hayan reportado resultados positivos sobre la memoria hayan sido publicados con mas facilidad y en mayor número.
Sin embargo vale la pena resaltar que todos los estudios analizados reportan mejoras en el comportamiento en tareas que miden la memoria declarativa. Futuras revisiones sistemáticas deberán intentar incluir artículos no referenciados en las bases de datos que se tuvieron en cuenta o trabajos que aparezcan en otro tipo de publicación.
Conclusión
La insulina participa de los procesos de consolidación de la memoria mediante el control de la expresión de genes, el tráfico de proteínas y la disponibilidad de glucosa en las neuronas.
La insulina administrada por vía intranasal mejora el desempeño en pruebas de memoria declarativa. Los efectos adversos reportados son pocos y podría constituir una nueva aproximación farmacológica para el tratamiento de la disminución en la función de la memoria.
En necesario que se desarrollen más estudios de alta calidad metodológica y que incluyan una muestra más grande de pacientes con déficit de la memoria para evaluar de manera más clara la relación entre administración de la insulina y beneficio para el individuo e identificar los potenciales efectos adversos de esta terapia.
En lo posible el análisis de futuros resultados debe ser abordado con un sistema que evalué el efecto del sesgo de publicación y su impacto sobre el valor predictivo de los hallazgos.
Referencias
1. Jagua A, Ávila V. Insulina y enfermedad de Alzheimer: una diabetes tipo 3? Rev Fac Med Univ Nac Colomb. 2007; 55: 66-70. [ Links ]
2. Banks WA, Jaspan JB, Kastin AJ. Selective, physiological transport of insulin across the blood-brain barrier: Novel demostration by species-specific radioinmmunoassays. Peptides. 1997;18: 1257-1262. [ Links ]
3. Zhao W, Chen H, Xu H, Moore E, Meiri N, Quon MJ, Alkon DL. Brain insulin receptors and spatial memory. Correlated changes in gene expression, tyrosine phosphorylation, and signaling molecules in the hippocampus of water maze trained rats. J Biol Chem.1999; 274: 34893-348902. [ Links ]
4. Lombroso P. Learning and memory. Rev Bras Pisquiatr. 2004; 26: 207-210. [ Links ]
5. Lynch MA. Long-term potentiation and memory. Physiol Rev. 2004; 84: 87-136. [ Links ]
6. Roth RA, Morgan DO, Beaudoin J, Sara V. Purification and characterization of the human brain insulin receptor. J Biol Chem. 1986; 261: 3753-7. [ Links ]
7. Dou JT, Chen M, Dufour F, Alkon DL, Zhao WQ. Insulin receptor signaling in long-term memory consolidation following spatial learning. Learn Mem. 2005; 12: 646-655. [ Links ]
8. Lee CC, Huang CC, Wu MY, Hsu KS. Insulin stimulates postsynaptic density-95 protein translation via the phosphoinositide 3-kinase-Akt-Mammalian target of rapamycin signaling pathway. J Biol Chem. 2005; 280: 18543-18550. [ Links ]
9. Alberini CM. Genes to remember. J Exp Biol. 1999; 202: 2887-2891. [ Links ]
10. Tronel S, Milekic MH, Alberini CM. Linking new information to a reactivated memory requires consolidation and not reconsolidation mechanisms. Plos Biol. 2005; 3: e293. [ Links ]
11. Lawlor MA, Alessi DR. PKB/Akt: a key mediator of cell proliferation, survival and insulin responses?. J Cell Sci. 2001; 114: 1142903-10. [ Links ]
12. Dou JT, Chen M, Dufour F, Alkon DL, Zhao WQ. Insulin receptor signaling in long-term memory consolidation following spatial learning. Learn mem. 2005; 12: 646-655. [ Links ]
13. Moosavi M, Naghdi N, Maghsoudi N, Aahedi Asl S. Insulin protects aginsts stress-induced impairments in water maze performance. Behav Brain Res. 2007; 176: 230-236. [ Links ]
14. Park CR, Seeley RJ, Craft S, Woods SC. Intracerebroventricular insulin enhances memory in a passive-avoidance task. Physiol Behav. 2000; 68: 509-514. [ Links ]
15. Izumi Y, Yamada KA, Matsukawa M, Zorumski CF. Effects of insulin on long-term potentiation in hippocampal slices from diabetic rats. Diabetologia. 2003; 46: 1007-1012. [ Links ]
16. Babri S, Badie HG, Khamenei S, Seyedlar MO. Intrahippocampal insulin improves memory in a passive-avoidance task in male wistar rats. Brain Cogn. 2007; 64: 86-91. [ Links ]
17. Akanmu MA, Nwabudike NL, Ilesanmi OR. Analgesic, learning and memory and anxiolytic effects of insulin in mice. Behav Brain Res. 2008. En prensa. [ Links ]
18. Jiang LH, Zhang YN, Wu XW, Song FF, Guo DY. Effect of insulin on the cognizing function and expression of hippocampal AB1-40 of rat with alzheimer disease. Chin Med J. 2008; 121: 827-831. [ Links ]
19. Illum L. Transport of drugs from the nasal cavity to the central nervous system. Eur J Pharm Sci. 2000; 11: 1-18. [ Links ]
20. Born J, Lange T, Kern W, McGregor G, Bickel U, Fehm HL. Sniffing neuropeptides: a transnasal approach to the human brain. Nat Neurosci. 2002; 5: 514-516. [ Links ]
21. Manterola C, Pineda V, Vial M, Losada H, Muñoz S. Revisión sistemática de la literatura. Propuesta metodológica para su realización. Rev Chil Cir. 2003;55: 204-208. [ Links ]
22. Jadad RA, Moore RA, Carroll D, Jenkinson C, Reynolds DJM, Gavaghan DJ, et al. Assessing the quality of reports of randomized clinical trials: Is blinding necessary? Control Clin Trial. 1996; 17: 1-12. [ Links ]
23. Benedict C, Hallschmid M, Hatke A, Schultes B, Fehm HL, Born J, et al. Intranasal insulin improves memory in humans. Psychoneuroendocrinology. 2004; 29: 1326-34. [ Links ]
24. Reger MA, Watson GS, Frey WH, Baker LD, Cholerton B, Keeling ML, et al. Effects of intranasal insulin on cognition in memory-impaired older adults: Modulation by APOE genotype. Neurobiol aging. 2006; 27: 451-458. [ Links ]
25. Benedict C, Hallschmid M, Schmitz K, Schultes B, Ratter F, Fehm HL, et al. Intranasal insulin improves memory in humans: superiority of insulin aspart. Neuropsychopharmacology. 2007; 32: 239-243. [ Links ]
26. Reger MA, Watson GS, Green PS, Wilkinson CW, Baker LD, Cholerton B, et al. Intranasal insulin improves cognition and modulates b-amyloid in early AD. Neurology. 2008; 70: 440-448. [ Links ]
27. Reger MA, Watson GS, Green PS, Baker LD, Cholerton B, Fishel MA, et al. Intranasal insulin administration dose-dependently modulates verbal memory and plasma amyloid-² in memory-impaired older adults. J Alzheimers Dis. 2008; 13: 323-331. [ Links ]
28. Kern W, Born J, Schreiber H, Fehm HL. Central nervous system effects of intranasally administered insulin during euglycemia in men. Diabetes. 1999; 48: 557-63. [ Links ]
29. DeBartoli M, Barrios P, Azpiroz R. Relaciones entre los potenciales evocados cognitivos auditivos y el test de matrices progresivas de Raven. Rev Int Psicol. Clin. 2002; 2: 327-339. [ Links ]
30. Leibson CL, Rocca WA, Hanson VA, Cha R, Kokmen E, O´brien PC, et al. Risk of dementia among persons with diabetes mellitus: a population-based cohort study. Am J Epidemiol 1997; 145: 301-308. [ Links ]
31. Burns JM, Donnelly JE, Anderson HS, Mayo MS, Spencer-Gardner BS, Thomas G, et al. Peripheral insulin and brain structure in early Alzheimer disease. Neurology. 2007; 69: 1094-1104. [ Links ]
32. Craft S, Nwecomer J, Kanne S, Daggo-Jack S, Cryer P, Sheline Y, et al. Memory improvement following induced hyperinsulinemia in Alzheimer's disease. Neurobiol aging. 1996; 17: 123-130. [ Links ]
33. Banks WA. The source of cerebral insulin. Eur J Pharmacol. 2004; 19: 490: 5-12. [ Links ]
34. Zhao W, Chen H, Xu H, Moore E, Meiri N, Quon MJ, et al. Brain insulin receptors and spatial memory. J Biol Chem. 1999; 274: 34893-34902. [ Links ]
35. Lee CC, Huang CC, Wu MY, Hsu KS. Insulin stimulates postsynaptic density-95 protein translation via the phosphoinositide 3-kinase-Akt-Mammalian target of rapamycin signaling pathway. J Biol Chem. 2005; 280: 18543-18550. [ Links ]
36. Hori K, Yasuda H, Konno D, Maruoka H, Tsumoto T, Sobue K. NMDA receptor-dependent synaptic translocation of insulin receptor substrate p53 via protein kinase C signaling. J Neurosci 2005; 25: 2670-2681. [ Links ]
37. Jagua A, Marin RA, Granados LA, Avila V. Insulina Cerebral. Colomb Med. 2008; 39: 107-116. [ Links ]
38. Nelson TJ, Sun MK, Hongpaisan J, Alkon DL. Insulin, PKC signaling pathways and synaptic remodeling during memory storage and neuronal repair. Eur J Pharmacol. 2008; 585: 76-87. [ Links ]
39. Bonini JS, Da Silva WC, Bevilaqua LR, Medina JH, Izquierdo I, Cammarota M. On the participation of hippocampal PKC in acquisition, consolidation and reconsolidation of spatial memory. Neuroscience. 2007; 147: 37-45. [ Links ]
40. McEwen BS, Reagan LP. Glucose transporter expression in the central nervous system: relationship to synaptic function. Eur J Pharmacol. 2004; 490: 13-24. [ Links ]
41. Bohringer A, Schwabe L, Richter S, Schchinger H. Intranasal insulin attenuates the hypothalamic-pituitary-adrenal axis response to psychosocial stress.Psychoneuroendocrinology 2008. En prensa. [ Links ]
42. Craft S, Watson GS. Insulin and neurodegenerative disease: shared and specific mechanisms. Lancet Neurol. 2004; 3: 169-178. [ Links ]
43. Park CR. Cognitive effects of insulin in the central nervous system. Neurosci biobehav rev. 2001; 25: 311-323. [ Links ]
44. ADAPT research group, Martin BK, Szekely C, Brandt J, Piantadosi S, Breitner JC, et al. Cognitive function over time in the Alzheimer's Disease Anti-inflammatory Prevention Trial (ADAPT): results of a randomized, controlled trial of naproxen and celecoxib. Arch Neurol. 2008; 65: 896-905. [ Links ]
45. Kummer MP, Heneka MT. PPARx in Alzheimer´s disease. PPAR Res. 2008; 2008: 403896. [ Links ]
46. Beeri MS, Schmeidler J, Silverman JM, Gandy S, Wysocki M, Hannigan CM, et al. Insulin in combination with other diabetes medication is associated with less Alzheimer neuropathology. Neurology. 2008; 71: 750-757. [ Links ]













