Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de la Facultad de Medicina
versão impressa ISSN 0120-0011
rev.fac.med. v.58 n.4 Bogotá out./dez. 2010
INVESTIGACIÓN ORIGINAL
DETECCIÓN DEL ANTÍGENO Tn EN TUMORES EPITELIALES CON LA LECTINA DE Vicia villosa isolectina B4
Using Vicia villosa lectin (B4 isolectin) for detecting Tn antigen in epithelial tumours
Catalina Limpias1 ,Gerardo Pérez 2 , Jinneth Acosta1 , Nohora Vega2 ,Orlando Ricaurte1
1Profesor Asociado. Grupo de Patología Molecular. Departamento de Patología, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá.2Grupo de Investigación en Proteínas, Departametno de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá.
Q.E.P.D. Correspondencia: oricaurteg@unal.edu.co Recibido: 20100617 Enviado a pares: 20100723 Aceptado publicación: 20100925
Resumen
Antecedentes Los epítopes T, Tn y sTn, se expresan en un alto porcentaje de tumores epiteliales y pueden detectarse con anticuerpos monoclonales y lectinas. Objetivo. Evaluar diferencias de expresión del antígeno Tn en cortes histológicos de epitelios no neoplásicos y tumores epiteliales mediante isolectina B4 de Vicia villosa.
Material y métodos. Se evaluaron semicuantitativamente localización, intensidad y porcentaje de expresión del antígeno en carcinomas in-situ e infiltrantes y epitelios no neoplásicos de cérvix, seno y urotelio, mediante isolectina B4.
Resultados La expresión de Tn en cérvix predominó en membrana de células no neoplásicas y citoplasma de células tumorales; su intensidad fue mayor en carcinomas in-situ e infiltrantes comparado con epitelio no neoplásico aunque en este el porcentaje de expresión fue mayor. En seno, la expresión de Tn fue predominantemente citoplasmática con intensidad similar, el porcentaje de expresión fué mayor en carcinomas ductales in-situ e infiltrantes. En urotelio no neoplásico y tumoral la expresión de Tn predominó en citoplasma; la intensidad y el porcentaje de expresión fueron mayores en neoplasias no invasivas de bajo y alto grado, mientras que en urotelio no neoplásico fue baja y no hubo tendencia definida en tumores infiltrantes.
Conclusiones. La detección del antígeno Tn mediante la lectina VVB4 mostró una mayor extensión de marcación en carcinomas ductales de seno en relación con el epitelio no neoplásico, pero no mostró una tendencia definida entre el tejido normal, ni diferentes etapas del desarrollo de los tumores de cérvix y urotelio. Estos hallazgos pueden atribuirse a la heterogeneidad de los procesos carcinogénicos o a que la especificidad de la lectina VVB4 no está restringida a este antígeno.
Palabras clave: antígenos, lectinas, células epiteliales, cuello utero, neoplasias del cuello uterino.
Limpias C, Pérez G, Acosta J, Vega N, Ricaurte O. Detección del antígeno Tn en tumores epiteliales con la lectina de Vicia villosa isolectina B4. rev.fac.med. 2010; 58: 293-305.
Summary
Background. T, Tn and sTn epitopes are expressed in a large percentage of epithelial tumours and may be detected with monoclonal antibodies and lectins.
Objective. Assess differences in expression of Tn antigen in histological sections of non- neoplastic epithelia and epithelial tumors by isolectin B4 from Vicia villosa
Materials and methods. The localisation, intensity and percentage of antigen expression in in-situ and infiltrant carcinomas and non-neoplasic epithelial cells from the cervix, breast and urothelium were semi-quantitatively evaluated by B4 isolectin.
Results. Tn expression in the cervix predominated in the membrane of non-neoplasic cells and the cytoplasm of tumour cells; its intensity was greater in in-situ and infiltrant carcinomas compared to non-neoplasic epithelial cells, even though such percentage of expression was greater. Tn expression in the breast was predominantly cytoplasmic (having similar intensity). The percentage of expression was greater in in-situ ductal carcinomas and infiltrates. Tn expression in non-neoplasic and tumoural urothelium predominated in the cytoplasm; the intensity and percentage of expression were greater in low and high degree non-invasive neoplasias, whilst this was low in non-neoplasic urothelium and there was no defined tendency in infiltrant tumours.
Conclusions. Tn antigen detection by lectin VVB4 showed greater expression in breast ductal carcinomas in relation to non-neoplastic epithelium, but showed on definite trend between the normal tissue and different stages of development of cervical tumors and urothelium. These findings can be related to heterogeneity of the carcinogenic processes or may be attributed to the specificity of the lectin VVB4 is not restricted to Tn antigen.
Key words: antigens, lectins, epithelial cells, cervix uteri, uterine cervical neoplasms.
Limpias C, Pérez G, Acosta J, Vega N, Ricaurte O. Using Vicia villosa lectin (B4 isolectin) for detecting Tn antigen in epithelial tumours. rev.fac.med. 2010; 58: 293- 305.
Introducción
El proceso de desarrollo de tumores malignos se asocia a modificaciones de la estructura de los carbohidratos que hacen parte de algunos antígenos de la superficie celular, relacionados con mecanismos de progresión, invasión y diseminación a distancia; estos cambios también se han demostrado en glicoproteínas de muestras de secreciones de los órganos afectados, efusiones y suero. Algunas alteraciones de las glicoproteínas de las células tumorales son específicas de ciertos tumores (1), estas características les confieren valor como factores pronóstico en oncología y potencial para su uso en diagnóstico precoz (2).
En la práctica clínica hay pruebas de laboratorio disponibles para seguimiento y evaluación de tratamiento de pacientes con diferentes tumores que utilizan anticuerpos para la identificación específica de glicoproteínas, dentro de las cuales se encuentran el anticuerpo monoclonal B72.3 empleado para detección de diferentes tipos de adenocarcinomas, el anticuerpo monoclonal CA 19.9 para adenocarcinomas pancreáticos y colorrectales, DuPan2 para adenocarcinoma pancreático, OC125 que reconoce el antígeno CA125 para carcinoma de ovario (3).
El antígeno Tn (GalNAc a-Ser/Thr), su forma sialilada (sialil-Tn) y su precursor T (Galb1,3GalNAc a-Ser/Thr) son glicopéptidos presentes en forma críptica en todas las glicoproteínas con oligosacáridos unidos Oglicosídicamente; en las proteínas poli-Oglicosiladas (glicoforinas, mucinas , leukosialinas) están presentes en baja proporción debido a la alta microheterogeneidad de la glicosilación. Inicialmente se los relacionó con una rara enfermedad hematopoyética que lleva su nombre, caracterizada por trombocitopenia, leucopenia y anemia hemolítica por la exposición en la superficie de las células sanguíneas de residuos de GalNAc, los cuales se encuentran normalmente enmascarados sobre la membrana unidos a Ser/ Thr. Posteriormente se ha identificado su expresión en varios carcinomas, aunque los eventos asociados a su exposición en estos, parecen ser diferentes de los observados en el síndrome Tn (4,5).
Se ha informado su expresión en una amplia gama de tumores sólidos que incluyen carcinomas de seno, colon, pulmón, estómago, páncreas y ovario en otros, observándose variaciones en la intensidad de expresión asociadas al grado de diferenciación del tumor, su agresividad y pronóstico (6,7); incluso su expresión se ha informado en etapas preclínicas de cáncer de seno, aspecto que le confiere potencial como posible marcador tumoral temprano: ha sido detectado en 77% de pacientes que inicialmente tenían exámenes radiológicos y biopsias negativos y que en períodos de dos meses a doce años presentaron carcinomas clínicamente demostrables. Además, se han realizado ensayos clínicos en pacientes con cáncer de seno avanzado previamente tratadas con mastectomía, quimio y radioterapia a quienes se administraron vacunas intradérmicas con antígeno T y Tn, obteniendo mejoría en la sobrevida (8). El antígeno Tn ha sido identificado en 92% de secreciones mamarias de pacientes con cáncer de seno; este aspecto plantea la posibilidad de su utilidad en diagnóstico precoz sin el uso de procedimientos diagnósticos invasivos (9-12). Otros estudios han informado potencial para definir pronóstico en cáncer gástrico (13,14), de cérvix (15) y de piel (16), al detectarlo en suero y efusiones en casos de enfermedad metastásica y carcinoma urotelial (17).
La expresión del antígeno Tn también se ha encontrado asociada al proceso de organogénesis del sistema nervioso central en ratones, en fases tempranas se expresa principalmente en corteza cerebral y cerebelo y en fases posteriores de su desarrollo su expresión se disminuye gradualmente hasta perderse, posiblemente por la elongación de la cadena de carbohidratos de las glucoproteínas (18).
Estas observaciones han generado un interés creciente por su estudio y el desarrollo de métodos para la identificación de estas moléculas: se han efectuado estudios para la detección del antígeno Tn inicialmente con anticuerpos poli y monoclonales y posteriormente con lectinas de Salvia sclarea, Vicia villosa isolectina B4 (VVB4) y Helix pomatia, (19-27).
Los anticuerpos difieren en su especificidad, presentando reactividad cruzada hacia el antígeno sialil Tn y/o el monosacárido a-GalNAc, por lo tanto detectan el determinante antigénico A y también pueden reconocer preferentemente algunas glicoproteínas Tn (20). Algunos autores han encontrado que los anticuerpos monoclonales requieren una mayor densidad de antígeno Tn que las lectinas anti-Tn para su reconocimiento (28,29). Hasta el momento se han purificado y caracterizado muy pocas lectinas capaces de reconocer el antígeno Tn (30,31) y se avanza en el estudio de sus bases estructurales; desafortunadamente muy pocas de ellas reconocen solamente la estructura Tn (32-34); la lectina VVB4 (31) ha sido la más utilizada con este propósito en líneas celulares transformadas y neoplasias (15,35,36).
Hay numerosas observaciones aisladas sobre la expresión del antígeno Tn en diversos tumores a partir de cultivos de tejidos, muestras de suero, efusiones pleurales y peritoneales y secreciones de órganos, pero los estudios que pretenden explorar sistemáticamente su expresión en las diferentes etapas de la historia natural de cada neoplasia y comparan ésta con su expresión en el tejido no neoplásico a partir del cual se desarrollaron en muestras de tejidos incluidos en parafina son muy limitados y el número de casos estudiados muy reducido. En este estudio se evalúan posibles diferencias de expresión del antígeno Tn mediante la isolectina B4 de Vicia villosa en cortes histológicos de tejidos incluidos en parafina de tumores epiteliales in-situ e infiltrantes de glándula mamaria, cérvix y urotelio y en el epitelio no neoplásico del tejido adyacente.
Materiales y métodos
Especímenes de tejidos
Se seleccionaron del archivo del Departamento de Patología de la Facultad de Medicina de la Universidad Nacional de Colombia bloques de parafina disponibles de casos de carcinoma de cérvix y seno con representación de componentes infiltrante e in-situ y epitelio no neoplásico en el tejido adyacente y de carcinoma urotelial papilar de bajo y alto grado e infiltrante, con representación de urotelio no neoplásico en el tejido adyacente, obteniéndo:
- 30 casos de carcinoma escamocelular de cuello uterino, con componente de carcinoma infiltrante en 24, lesiones escamosas intraepiteliales de alto grado en 30 y representación del epitelio no neoplásico en 24.
- 25 casos de carcinoma ductal de glándula mamaria con componente infiltrante en 25, carcinoma in-situ en 23 y representación del tejido mamario no neoplásico en 23.
- 18 casos de carcinoma papilar urotelial de bajo grado, 11 casos de carcinoma papilar urotelial de alto grado, seis de ellos con componente infiltrante. En 13 de estos casos hubo representación del componente no neoplásico.
Lectinohistoquímica
La lectina especifica para la detección del antígeno Tn (isolectina B4 Vicia villosa) se obtuvó comercialmente (Sigma Chemical Co.). Para acoplar la lectina a biotina se siguió la metodología descrita por Wu et al (37) con algunas modificaciones. La marcación se hizo en PBS pH 7.5 en una proporción lectina: biotina (Sulfo-NHS-LCBiotina) 1:2, adicionando la biotina en dos partes (cada 8 h) para aumentar la eficiencia de marcación dada la hidrólisis del éster de la biotina. La lectina biotinilada se cuantificó por el método del ácido Bicinconinico (38) y para comprobar su marcación y actividad se realizó Dot-Blot y ensayo de ELISA. Las placas se sensibilizaron con 100 ul de asialomucina submaxilar ovina (aMSO) (0,14 µg/ml) y posteriormente se hizo la detección con la VVB4- biotinilada.
1,0 mg de streptavidina (Sigma Chemical Co.) se acopló a 5,0 mg de peroxidasa (Sigma Chemical Co) siguiendo la metodología descrita por Hermanson et al (39); el conjugado fué cuantificado por el método del ácido Bicinconinico y para evaluar su marcación y actividad se realizó ensayo de ELISA empleando la lectina de Galactia lindenii biotinilada como patrón. Para bloquear sitios inespecíficos se utilizó PBS con 1% de suero fetal bovino (PBS-SFB) (Eurobio).
Procedimiento: siguiendo la metodología descrita por Vega (40), los cortes fueron desparafinados, hidratados y posteriormente permeabilizados con Triton X-100 al 0,1% en PBS durante 30 minutos a temperatura ambiente. La peroxidasa endógena fue inactivada empleando una solución de peróxido de hidrógeno al 0.3% y metanol al 10% durante 30 minutos a temperatura ambiente Luego los cortes fueron lavados tres veces con PBS-Tween (0,1%) durante cinco minutos e incubados con 200 ul de suero fetal bovino al 10% a 37oC durante una hora. La solución de bloqueo fue descartada y los cortes fueron incubados con una solución de 25 mg/ml de VVB4- biotinilada en PBS-SFB 1% durante una hora a temperatura ambiente, luego los tejidos fueron lavados tres veces con PBS-Tween (0.1%) durante cinco minutos e incubados con Streptavidina peroxidasa (1:1000) diluida en PBSSFB 1% durante una hora a temperatura ambiente. Las láminas fueron reveladas con una solución de diaminobencidina (DBA) al 1% en Tris-HCl (50mM) pH 7.3. Para revelar se agregaron 5 ul de H2O2 al 30% por cada 10 ml de solución. Para el contraste se utilizó coloración de hematoxilina. Los controles negativos fueron procesados simultáneamente.
Evaluación de la expresión del antígeno Tn
Se estableció la localización de la marcación en la membrana celular, el citoplasma y el aparato de Golgi de las células tumorales de los componentes in-situ e infiltrante y en las células de los epitelios no neoplásicos adyacentes. La intensidad de la marcación se evaluó utilizando una escala semicuantitativa con puntajes negativo 0, leve 1+, moderado 2+, intenso 3+ y por último se estimó la extensión de la marcación (porcentaje de células reactivas) en cuatro grupos: grupo 1: menos del 5%, grupo 2: entre el 5-35%, grupo 3: 35 al 65 % y grupo 4: del 65 al 100%.
Análisis estadístico
El estudio pretende evaluar posibles diferencias en el tipo de expresión del antígeno Tn (membrana, golgi, citoplasmático) y en su intensidad entre epitelio no neoplásico y neoplásico, etapas in-situ e infiltrante para cérvix y seno y entre urotelio no neoplásico y tumores uroteliales papilares de bajo y alto grado e infiltrantes.
Para el análisis estadístico se utilizó el programa STATA (Data Analysis and Statistical Sofware), se realizó un análisis univariado ANOVA y para los casos con diferencias, se realizó un test de rangos múltiples para evaluar si dichas diferencias eran significativas.
Resultados
Cuello uterino
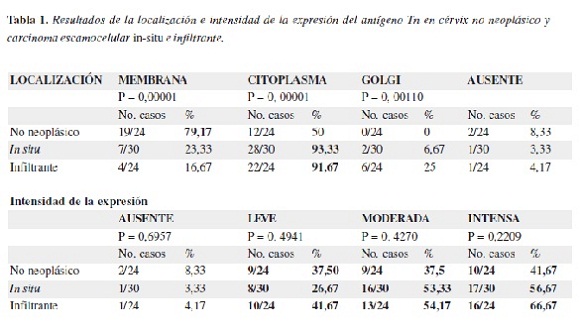
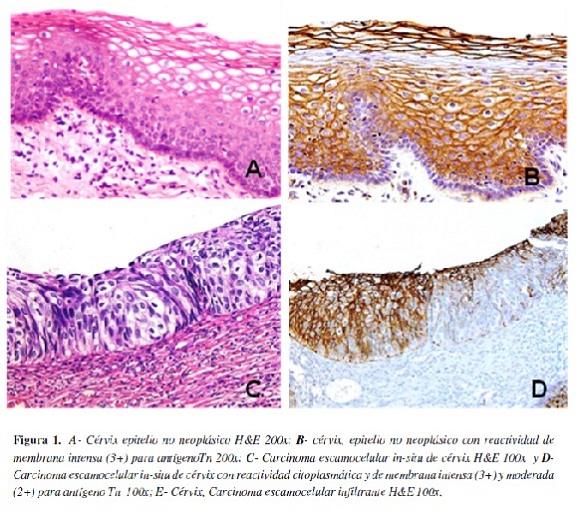
En la tabla 1 se presenta los resultados correspondientes a la localización e intensidad de la expresión del antígeno Tn en los casos de cuello uterino, apreciándose que su expresión en el epitelio no neoplásico del cérvix predominó en la membrana (79,17%), mientras que en los carcinomas escamocelulares presentó acentuado predominio de expresión en el citoplasma, siendo para los tumores in-situ de 93,3% y para los infiltrantes de 91,67%; la mayor intensidad de la marcación (puntajes moderado e intenso) se observó en los carcinomas in-situ e infiltrantes en relación con el tejido normal, pero la extensión (porcentaje) de la expresión (tabla 2) fue mayor en el epitelio no neoplásico (62,5%) (Figura 1).
Glándula mamaria
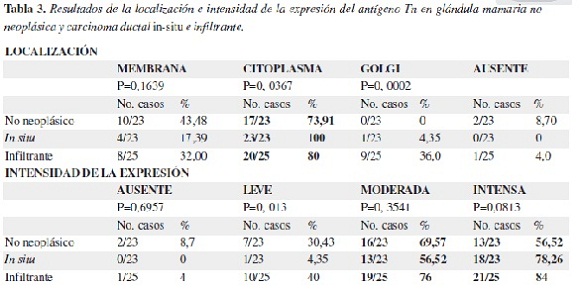
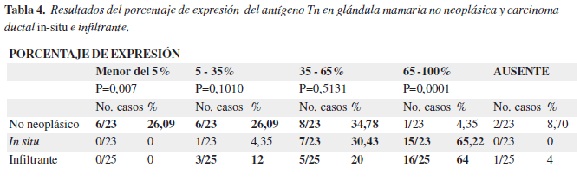
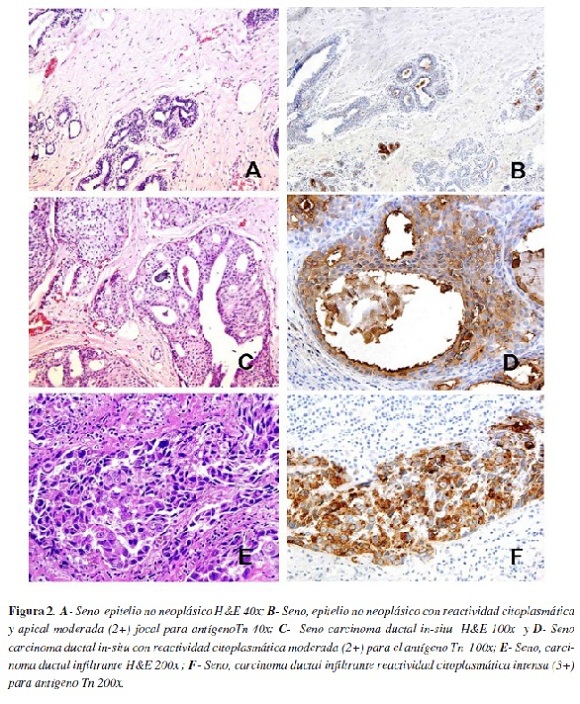
En las tabla 3 y 4 se presentan los resultados correspondientes a la localización, intensidad y porcentaje de expresión del antígeno Tn en los casos de glándula mamaria. Su expresión en el epitelio no neoplásico y tumoral fue predominantemente citoplasmática, con intensidad similar, sin embargo, la extensión (porcentaje) de la expresión fue mayor en los carcinomas ductales in-situ (65,2%) e infiltrantes (64%) (Figura 2).
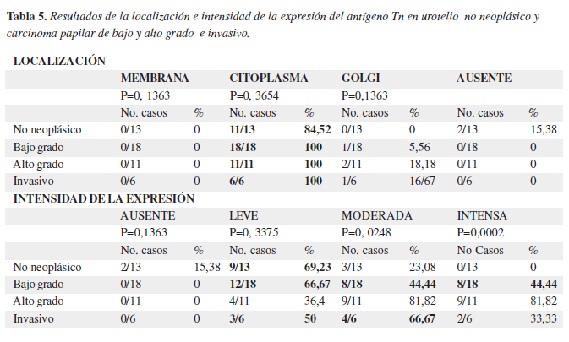
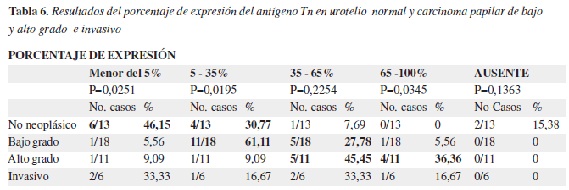
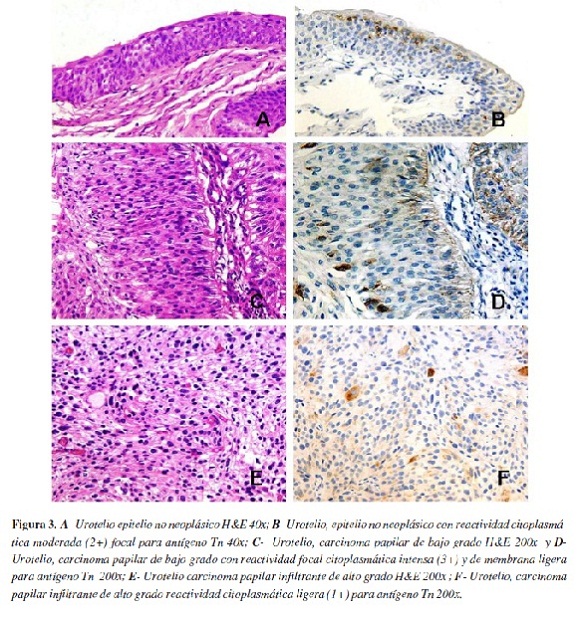
Urotelio
En las tabla 5 y 6 se muestran los resultados correspondientes a la localización, intensidad y porcentaje de expresión del antígeno Tn en los casos de urotelio. La expresión del antígeno Tn en muestras de urotelio no neoplásico y tumoral predominó en el citoplasma siendo de mayor intensidad en las neoplasias no invasivas de bajo y alto grado y menor en el urotelio normal, mientras que en tumores infiltrantes la expresión fué ligera o moderada, sobreponiéndose a los hallazgos encontrados en urotelio normal o en neoplasias no invasivas. El porcentaje de expresión fue mayor en las neoplasias no invasivas de alto grado, mientras que en el urotelio normal es bajo y para los tumores infiltrantes no se encontró una tendencia definida (Figura 3).
Discusión
En los casos de cérvix se observó variabilidad en el tipo de expresión del antígeno Tn, predominó en la membrana plasmática del epitelio no neoplásico, mientras que fue citoplasmática en los carcinomas escamocelulares in-situ e infiltrante, en los cuales la intensidad de la marcación fue mayor, pero paradójicamente, la marcación fue más extensa (porcentaje de marcación) en el epitelio no neoplásico. Estos resultados difieren de los encontrados por Carrilho et al, (41), quienes informaron una tendencia definida con expresión citoplasmática en 10% del epitelio no neoplásico, 30% de la neoplasia intraepitelial cervical III (carcinoma in-situ) y en el 63,8% de carcinomas invasivos con una especificidad de 96% y sensibilidad de 34%.
En seno, la expresión del antígeno Tn en el epitelio no neoplásico y tumoral fue predominantemente citoplasmática, con intensidad similar y la extensión de la marcación (porcentaje de expresión) fue mayor en los carcinomas ductales in-situ e infiltrantes. Konska et al,(36) empleando lectina de VVB4, informaron una mayor proporción e intensidad en la marcación en las células de los tumores in-situ en relación con el epitelio no neoplásico, pero menor que la marcación obtenida en los tumores infiltrantes.
En las muestras de urotelio normal y tumoral analizadas, la expresión del antígeno predominó en el citoplasma siendo de mayor intensidad en las neoplasias de bajo y alto grado no invasivas. En tumores infiltrantes la expresión fué moderada y el porcentaje de expresión fué mayor en las neoplasias no invasivas de alto grado. Nishiyama et al (35) realizaron un trabajo similar empleando lectina de Vicia villosa B4 en el cual no se detectó el antígeno en tumores de grado I ni en urotelio no neoplásico. Posteriormente Pinnock et al (17) estudiaron la expresión del antígeno Tn en carcinomas de células transicionales con anticuerpos monoclonales encontrando que en tumores de grado 1 no se expresaba, mientras en tumores grado 2 se expresaba en el 38% de las muestras y en tumores grado 3 en el 90%, hallazgos que sugerían su utilidad para valorar la agresividad de la enfermedad. Langkilde et al, (42,43) no encontraron relación entre la progresión e invasión tumoral de carcinomas de células transicionales de vejiga y la expresión del antígeno Tn, pero hallaron una relación significativa con el grado nuclear de las células tumorales.
La evaluación de la expresión del antígeno Tn se ha estudiado en líneas celulares tumorales y no neoplásicas con la lectina de VVB4; observándose marcación en la periferia del citoplasma, en retículo endoplasmático, en aparato de Golgi, mientras que en la mayoría de los casos no se detectó en la membrana periplasmática (40, 44-47).
La detección del antígeno Tn con VVB4 en tejidos no neoplásicos, observada en este trabajo, concuerda con lo descrito por Springer et al (19) y Avichezer y Arnon (48) quienes informan la expresión de Tn en baja proporción en tejidos normales de humano y en órganos de roedores. Los resultados obtenidos en este estudio empleando la lectina VVB4 para la detección del antígeno Tn en los tres tipos de tumores estudiados, tanto en etapas in-situ, como invasivas y en los tejidos epiteliales no neoplásicos, solo mostraron una tendencia parcial en la progresión tumoral en los casos de seno, similar a lo observado en estudios previos realizados con lectinas y anticuerpos monoclonales.
En los casos de cérvix aunque hubo diferencias en el tipo de marcación y su intensidad entre epitelio no neoplásico y carcinomas, la extensión de la marcación fue mayor en el epitelio no neoplásico, a diferencia de lo observado en estudios previos y en los casos de urotelio no se apreció una tendencia definida en función de la progresión tumoral.
Los resultados obtenidos muestran gran variabilidad en la localización, intensidad y extensión de la detección del antígeno Tn en las tres neoplasias estudiadas y los epitelios no neoplásicos a partir de los cuales se originaron, no pudiendo definirse a partir de ellos tendencias absolutas de expresión entre las etapas insitu e infiltrante. Estos hallazgos pueden estar relacionados con la heterogeneidad propia de los procesos carcinogénicos presente aún entre tumores de una misma categoría diagnóstica, reflejando también variabilidad de los procesos moleculares subyacentes relacionados con la glicosilación de los antígenos. Además, no es posible excluir definitivamente la posibilidad de que estos hallazgos puedan estar influenciados por la especificidad de la lectina, cuya reactividad pudiera no estar completamente restringida al antígeno Tn, como lo sugieren estudios recientes que utilizan nuevas técnicas de glicoarrays y lectin arrays con las cuales se están explorando aspectos más refinados de la especificidad de estas moléculas (50,51) y cuya información se actualiza periódicamente en la base de datos Lectin Frontier Database http://riodb.ibase.aist.go.jp/rcmg/ glycodb/LectinSearch.
Agradecimientos
Jenny Amaya Bacterióloga de Laboratorio de Patología Interfacultades de la Universidad Nacional de Colombia. Pilar Archila G. MD., Patóloga Hospital San José. Andrea Niño, Bióloga MSc, Grupo de Investigación en Proteínas.
Financiación
División de Investigaciones Sede Bogotá (DIB) Universidad Nacional de Colombia
Referencias
1. Hakomori S. Aberrant glycosilation in tumors and tumor-associated carbohydrate antigens. Adv Cancer Res. 1989; 52: 257-331 [ Links ]
2. Akira K. A retrospective and prospective view of glycopathology. Glycoconjugate J. 1998; 15: 323-331. [ Links ]
3. Paterson AJ, Schlom J, Sears HF, Bennett J, Colcher D. A radioimmunoassay for the detection of a human tumor-associated glycoprotein (TAG-72) using monoclonal antibody B72. Int J Cancer. 1986; 37: 659-666. [ Links ]
4. Berger E. Tn-Syndrome. Biochim Biophys Acta. 1999;1455: 255-268. [ Links ]
5. Dahiya R, Itzkowitz S, Byrd J, Kim Y. Mucin oligosaccharide biosynthesis in human colonic cancerous tissues and cell lines. Cancer. 1992; 70: 1467-1476. [ Links ]
6. Lisowska E. Tn Antigens and their significance in Oncology. Acta Biochim. Pol. 1995; 42: 11-17. [ Links ]
7. Springer GF. T and Tn general carcinoma autoantigens. Science.1984; 244: 1198-1206. [ Links ]
8. Springer GF. Immunoreactive T and Tn epitopes in cancer diagnosis, prognosis, and immunotheraphy. J Mol Med. 1997; 75: 594-602. [ Links ]
9. Kumar S, Sauter, Quinn T, Deutscher S. Thomsen- Friedenreich and Tn Antigens in Nipple Fluid: Carbohydrate Biomarkers for Breast Cancer Detection. Clin Cancer Res. 2005;11: 6868-6871. [ Links ]
10. Osinaga E, Babino A, Grosclaude J, Cairolie E. Development of an immuno-lectin-enzymatic assay for the detection of serum cancer-associated glycoproteins bearing Tn determinant. Int J Oncol. 1996; 8: 401-406. [ Links ]
11. Beuzelin-Yvraut M, Bourguignat A, Phillips E, Roseto A, Osinaga E. Immunocytological analysis of the Tn associated antigen 83D4 in serous effusions from patients with cancer: Comparison with Tn soluble glycoprotein. J Clin Pathol. 1995;48: 433-437. [ Links ]
12. Davidson B, Berner A, Nesland J, Risberg B, Krostensen G, Trope C, et al. Carbohydrate antigen expression in primary tumors, metastatic lesions, and serous effusions from patiens diagnosed with ephitelial ovarian carcinoma; evidence of up-regulated Tn and Sialyl Tn antigen expressions in effusions. Human Pathol. 2000; 31: 1081-1987. [ Links ]
13. Nakata B, Hiraka K, Chung YS, Muruguma K, Yamashita Y, Inoue T, et al. Changes in tumor marker levels as a predictor of chemoterapeutic effect in patients with gastric carcinoma. Cancer. 1998; 83:19-24. [ Links ]
14. Terashima S, Takano Y, Ohori T, Kanno T, Kimura T, Motoki R, et al. Sialyl-Tn antigen as a useful predictor of poor prognosis in patients with advanced stomach cancer. Surg Today.1998; 28: 682-686. [ Links ]
15. Hirao T,Sakamoto Y, Kamada M, Aono T. Tn antigen, a marker of potential for metastasis of urine cervix cancer cells. Cancer. 1993; 72:154-159. [ Links ]
16. Kanitakis J, Al-Rifai I, Euvrard S, Faure M, Claudy A. Differential expression of the cancer-associated antigens T( Thomsen-Friedenreich) and Tn in primary and recurring squamous cell carcinomas of the skin. Anticancer Res. 1999; 19: 619-620. [ Links ]
17. Pinnock CB, Roxby DJ, Ross JM, Pozza CH, Marshall VR. Ploidy and Tn-antigen expression in the detection of transitional cell neoplasia in non-tumourbearing patients. Br J Urol. 1995; 75: 461-469. [ Links ]
18. Akita K, Fushiki S, Fujimoto T, Inoue M, Oguri K, Okayama M, et al. Developmental expression of a unique carbohydrate antigen, in mouse central nervous tissues. J Neurosc Res. 2001; 65: 595-603. [ Links ]
19. Springer GF, Taylor CR, Howard D, Tegtmeyer H, Desai PR, Murthy ST, et al. Tn, a carcinoma-associated antigen, reacts with anti-Tn of normal human sera. Cancer 1985; 55: 561-569. [ Links ]
20. Springer GF, Chandrasekaran EV, Desai PR, Tegtmeyer H. Blood group Tn-active macromolecules from human carcinomas and erythrocytes: Characterization and specific reactivity with mono- and polyclonal anti-Tn antibodies induced by various immunogens. Carbohydr Res.1988; 178: 271-292. [ Links ]
21. Pancino GF, Osinaga E, Vorauer W, Kakouche A, Mistro D, Charpin C, et al. Production of a monoclonal antibody as immunohistochemical marker on paraffin embedded tissues using a new immunization method. Hybridoma. 1990; 9: 389-395. [ Links ]
22. Nakada H, Inoue M, Numata Y,Tanaka N, Funakoshi I, Fukui S, et al. Epitopic structure of Tn glycophorin a for anti-Tn antibody (MLS 128). Proc Natl Acad Sci U S A. 1993; 90: 2495-2499. [ Links ]
23. Kamitani Y, Kajil E, Suda T, Ikemoto S. Expression of Tn antigen on erythroid cells from a patient with Tn syndrome. Japan J. H. Genet. 1992; 37: 271-283. [ Links ]
24. Hirohashi S, Clausen H, Yamada T, Hakamon H. Blood group A cross-reacting epitope defined by monoclonal antibodies NCC Lu-35 and 81 expressed in cancer of blood group O or B individuals. Its identification as Tn antigen. Proc Natl Acad Sci U S A. 1985; 82: 7039-7043. [ Links ]
25. Leatham AJ, Brooks SA. Predictive value of lectin binding on breast cancer recurrence and survival. Lancet. 1987; 1: 1054-1056. [ Links ]
26. Brooks SA, Wilkinson D. Validation of a simple avidin- biotin detection method for Helix pomatia lectin (HPA) binding as a marker in cancer. Acta Histochem. 2003; 105: 205-212. [ Links ]
27. Freire T, Osinaga E. Immunological and biochemical relevance of Tn antigen. Inmunología. 2003: 27-38 [ Links ]
28. Wu AM. Polyvalency of Tn (GalNAcá1 Ser/Thr) glycotope as a critical factor for Vicia villosa B4 and glycoprotein interactions. FEBS Lett. 2004; 562: 51- 58. [ Links ]
29. Osinaga E, Bay S, Tello D, Babino A, Pritsch O, Assemat, Cantacuzene D, Nakada H, Alzari P. Analysis of the fine specificity of Tn-binding proteins using synthetic glycopeptide epitopes and a biosensor based on surface plasmon resonance spectroscopy. FEBS Lett. 2000; 469: 24-28. [ Links ]
30. Pérez G, Vega N. Lamiaceae lectins. Functional Plant Sci. Biotechnol. 2007; 1: 288-299. [ Links ]
31. Tollefsen S, Kornfeld R. Isolation and characterization of lectins from Vicia villosa. Two distinct carbohydrate binding activities are present in seed extracts. J Biol Chem. 1983; 258: 5165-5171. [ Links ]
32. Osinaga E, Tello D, Batthyany C, Bianchet M, Tavares G, Duran R, et al. Amino acid sequence and three-dimensional structure of the Tn-specific isolectin B4 from Vicia villosa. FEBS Lett. 1997; 412:190- 196. [ Links ]
33. Maveyraud L, Niwa H, Guillet V, Svergun D, Konarev P, Palmer R, et al. Structural basis for sugar recognition, including the Tn carcinoma antigen, by the lectin SNA-II from Sambucus nigra. Proteins: Structure, Function and Bioinformatics. 2008; 75: 89-103. [ Links ]
34. Lescar J, Sanchez J, Audfray A, Coll J, Breton C, Mitchell E, Imberty A. Structural basis for recognition of breast and colon cancer epitopes Tn antigen and Forssman disaccharide by Helix pomatia lectin. Glycobiology. 2007; 17: 1077-1083. [ Links ]
35. Nishiyama T, Matsumoto Y, Watanabe H, Fujiwara M, Sato S. Detection of Tn antigen with Vicia villosa agglutinin in urinary bladder cancer: Its relevance to the patients clinical course. J Nat Cancer Inst. 1987; 78: 1113-1118. [ Links ]
36. Konska G, Guerry M, Caldefie-Chezet F, De Latour M, Guillot J. Study of the expression of Tn antigen in different types of human breast cancer cells using VVA-B4 lectin. Oncol Rep. 2006; 15: 305-310. [ Links ]
37. Wu A, Duk M, Lin M, Broadberry R, Lisowska E. Identification of variant glycophorins of human red cells by lectinoblotting : application to the Mi.III variant that is relatively frequent in the Taiwanese population. Transfusion. 1995; 35: 571-576. [ Links ]
38. Smith PK, Krohn Ri, Hermanson GT, Mallia AK, Gartner FH, Provenzano MD, et al. Measurement of protein using Bicinchoninic Acid. Anal Biochem. 1985; 150: 76-85. [ Links ]
39. Hermanson G, Mallia A, Smith P. Immobilized affinity ligand techniques. Academic Press, San Diego. 1992; 53-254. [ Links ]
40. Vega N. Caracterización bioquímica, funcional y biológica de la lectina de Salvia bogotensis y evaluación de su aplicación para la detección del antígeno Tn. 2004; Tesis de Doctorado. Facultad de Ciencias. Universidad Nacional de Colombia. [ Links ]
41. Carrilho C, Cantel M, Gouveia P, David L Simple mucin-type carbohydrate antigens (Tn, sialosyl-Tn, T and sialosyl-T) and gp 230 mucin-like glycoprotein are candidate markers for neoplastic transformation of the human cervix. Virchows Arch. 2000; 437:173-179. [ Links ]
42. Langkilde NC, Wolf H, Clausen H, Kjeldsen T, Orntoft TF. Nuclear volume and expression of T-antigen, sialosyl-Tn-antigen, and Tn-antigen in carcinoma of the human bladder. Relation to tumor recurrence and progression. Cancer. 1992; 69: 219-227. [ Links ]
43. Langkilde NC, Orntoft TF. A comparative study of peanut agglutinin and amaranthin binding to human urinary bladder tumor glycoproteins. Scand J Urol Nephrol suppl. 1995; 172: 57-64. [ Links ]
44. Konska G, Guillot J, De Latoru M, Fonck Y. Expression of Tn antigen and N-acetyllactosamine residues in malignant and benign human breast tumours detected by lectins and monoclonal antibody 83D4. Int J Oncol. 1998; 12: 361-367. [ Links ]
45. Konska G, Vissac C, Zagla K, Chezet F, Vasson MP, Bernard-Gallon D, Guillot J. Ultrastructural localization of binding sites for PNA and VVB4 lectins in human breast cancer cell lines detected by confocal fluorescence microscopy. Int J Oncol. 2002; 21: 1009- 1014. [ Links ]
46. Egea G, Franci C, Gambus G, Lesuffleur T, Zweibaum A, Real FX. cis-Golgi resident proteins and Oglycans are abnormally compartmentalized in the RER of colon cancer cells. J Cell Sci. 1993; 105: 819-830. [ Links ]
47. Gabor F, Klausegger U, Wirth M. The interaction between wheat germ agglutinin and other plant lectins with prostate cancer cells Du-145. Int J Pharmaceut. 2001; 221: 35-47. [ Links ]
48. Avichezer D, Arnon R. Differential reactivities of the Arachis hypogaea (Peanut) and Vicia villosa B4 lectins with human ovarian carcinoma cells, grown either in vitro or in vivo xenograft model. FEBS Lett. 1996; 395: 103-108. [ Links ]
49. Susuki N, Yamamoto K, Toyoshima S, Osawa T, Irimura T. Molecular cloning and expression of cDNA encoding human macrophage C-type lectin:Its unique carbohydrate binding specificity for Tn lectin. J Inmunol. 1996; 156: 128-135. [ Links ]
50. Matsuda A, Kuno A, Ishida H, Kawamoto T, Shoda J, Hirabayashi J. Development of an all-in-one techonology for glycans profiling targeting formalin-embedded tissue sections. Biochem Biophys Res Comm. 2008; 370: 259-263. [ Links ]
51. Kuno A, Kato Y, Matsuda A, Kaneko M, Ito H, Amano K, et al. Focused differential glycan analysis with the platform antibody-assisted lectin profiling for glycan- related biomarker verification. Mol.Cell. Proteomics. 2009; 8: 99-108. [ Links ]