Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.58 no.4 Bogotá Oct./Dec. 2010
COMUNICACIONES BREVES
PROCEDIMIENTO EN CIRUGÍA: TORACOSTOMÍA CERRADA
Surgical procedures: closed thoracostomy
Juan de Dios Díaz-Rosales1 , Lenin Enríquez-Dominguez1
1Residente de tercer año. Especialidad en Cirugía General Sevicio de Cirugía, Hospital General de Ciudad Juárez (México), División de Postgrado, Universidad Autónoma de Ciudad Juárez (México). Correspondencia: juandedios.uaci@gmail.com Recibido: 20100824 Enviado a pares: 20100826 Aceptado publicación: 20100925Resumen
La toracostomía consiste en la introducción de un tubo en la cavidad pleural, para drenar aire, sangre, bilis, pus u otros líquidos. Este artículo detalla paso por paso la técnica para la colocación del tubo pleural. También mencionamos las indicaciones, contraindicaciones y las posibles complicaciones asociadas a este procedimiento.
Palabras clave: cavidad pleural, pleura, toracostomía, traumatismo torácicos.
Díaz-Rosales J, Enríquez-Domínguez L. Procedimientos en cirugía: toracostomía cerrada. rev.fac.med. 2010; 58: 331-340.
Summary
Thoracostomy is the insertion of a tube into the pleural cavity to drain air, blood, bile, pus, or other fluids. This paper provides one approach step-by-step to insertion of chest tube and offers a rationale for practice. It also discusses indications, contraindications and potential complications associated with the procedure.
Key words: pleural cavity, pleura, thoracostomy, thoracic injuries.
Díaz-Rosales J, Enríquez-Domínguez L. Surgical procedures: closed thoracostomy. rev.fac.med. 2010; 58: 331-340.
Introducción
El trauma penetrante y contuso representa un problema grave de salud pública en Ciudad Juárez. Cerca del 40% de los atendidos por este problema durante el 2008 presentaron afección torácica exclusiva, mientras que 44% presentó afección toraco-abdominal (1); la inserción percutánea de un tubo de toráx o toracostomía cerrada, más la reposición hídrica, el único tratamiento instituido y necesario (2-5) hasta en el 75-90% de los pacientes para el trauma torácico (6).
Este acceso a la cavidad pleural, se usa para el drenaje y evacuación de aire, sangre, bilis, pus u otros líquidos (7); es una de las prácticas más frecuentes y de más rápido dominio por el personal médico de urgencias, terapia intensiva y cirugía (8).
La toracostomía se refiere al acceso a la cavidad pleural a través de un espacio intercostal (toracostomía cerrada) o mediante la resección de un segmento de costilla (toracostomía abierta). Es este articulo hablaremos detalladamente de la toracostomía cerrada, procedimiento muy usual en el Hospital General de Ciudad Juárez (México). La toracostomía se realiza de rutina en forma "ciega" en nuestro hospital, en centros donde se tenga, se podrá hacer mediante toracoscopia (9), bajo visión directa. La decisión de colocar una sonda pleural se debe individualizarse en cada paciente, poniendo en una balanza los riesgos y beneficios.
Anatomía, fisiología y patofisiología
Anatómicamente se deben tener en mente varias consideraciones previas a la colocación de una sonda pleural con la finalidad de evitar en lo posible complicaciones técnicas. Los espacios intercostales son más amplios en la parte anterior del tórax; los vasos y nervios intercostales corren por el borde inferior costal, encontrándose estos en la mitad del espacio intercostal a nivel de la línea axilar posterior por lo que una punción a este nivel aumenta el riesgo de lesión al paquete vasculo-nervioso. La posición del diafragma debe tomarse en cuenta, ya que se encuentra a unos 3-5 cm por encima del nivel que aparece en la radiografía de tórax.
Por dentro la caja torácica se encuentra recubierta por la pleura, que es una serosa, y se compone de pleura parietal y visceral; existiendo un espacio virtual entre ambas (cavidad pleural) el cual se encuentra ocupado por líquido pleural que funciona como lubricante y permite el deslizamiento de ambas pleuras (10). La pleura visceral es la que cubre al pulmón y en cada lóbulo se refleja en las cisuras interlobares (10), está completamente inervada por ramos del vago y el simpático mientras que la pleura parietal se dispone en la pared torácica, el diafragma y el mediastino, recibiendo inervación de ramas del nervio frénico y de los intercostales los cuales contienen fibras sensitivas, lo cual explica por qué las afecciones de la pleura parietal son extremadamente dolorosas a diferencia de las que afectan a la pleura visceral únicamente.
Para que exista una adecuada respiración y ventilación se requiere que la pared torácica este intacta, el diafragma descienda y resulte una presión intratoracica negativa, forzando al aire a entrar en el árbol traqueobronquial y los alveolos, donde la respiración toma lugar finalmente en la membrana alveolo-capilar (11). Cualquier situación que interfiera con este sencillo proceso resulta en la disminución de la ventilación.
En el espacio pleural existe una presión negativa que mantiene expandido el elástico parénquima pulmonar, llenado la cavidad torácica. La pérdida de esta presión negativa –en el caso del trauma torácico– nos lleva a un colapso alrededor del hilio pulmonar (11).
Fisiopatologicamente en el trauma de tórax se producen alteraciones en el sistema cardiovascular tanto en la oxigenación como en la eliminación de CO2 y en el aporte de sangre a los tejidos periféricos; lo cual se traduce en acidosis, hipercapnia e hipoxia tisular. La hipoxemia puede resultar de dos mecanismos, por hipovolemia secundaria a sangrado y la alteración en la relación ventilación/perfusión secundaria a diversos mecanismos como contusión pulmonar, hematomas, colapso alveolar y cambios en la presión intratoracica. La hipercapnia se produce por una mala ventilación secundaria a cambios en la presión intratoracica; la acidosis se debe a una mala perfusión de los tejidos que conlleva acumulación de acido láctico intracelular y elevación en la tensión de CO2.
El traumatismo de tórax se divide en cerrado o abierto; el abierto puede ser: no penetrante (sin afección de la pleura parietal); penetrante (entra a la cavidad pleural); o perforante (aquel con orifico de entrada de salida al tórax). También puede ser torácico puro, toracoabdominal o cervicotorácico (12). Así también, puede se clasifican en lesiones letales y lesiones potencialmente letales; las lesiones letales son obstrucción de la vía aérea, neumotórax a tensión, neumotórax abierto, hemotórax masivo, tórax inestable, taponamiento cardíaco; y las lesiones potencialmente letales son contusión pulmonar, contusión miocárdica, ruptura aórtica, ruptura diafragmática traumática, ruptura traqueal-bronquial y ruptura del esófago. Las principales complicaciones del trauma torácico son insuficiencia respiratoria, neumonía y sepsis pleural (13).
El neumotórax es la enfermedad producida por la entrada de aire en el espacio virtual pleural, provocando la pérdida de contacto entre ellas y colapso pulmonar. El neumotórax traumático es producido por lesiones del pulmón, vías aéreas, esófago, barotrauma y lesiones iatrogénicas. El neumotórax abierto existe cuando hay pérdida de la continuidad de la pared torácica, por la que se aspira aire durante la inspiración (traumatopnea). Si la sección transversal de tal defecto excede la de la tráquea todo el volumen corriente pasara por él (14).
El neumotórax se divide en grados: grado I, cuando el límite pulmonar se encuentra por fuera de las líneas hemiclaviculares (se forma una imagen en media luna en el vértice del pulmón) (15); grado II, cuando el límite se encuentra alrededor de esa línea; y grado III, cuando el colapso pulmonar es total (12). El tratamiento del grado I solo requiere vigilancia, con controles radiológicos, si aumenta se debe realizar toracostomía; en los grados II y III hay que realizar toracostomía y en algunos casos toracoscopía y/o toracotomía (12). Algunos autores basan sus criterios para la colocación de un tubo pleural en el porcentaje del neumotórax; requiriendo sonda pleural aquellos neumotórax mayores del 25% del volumen pulmonar en la radiografía de tórax, manteniendo un manejo conservador en aquellos pacientes con lesión menor al 25% (16) y hemodinámicamente estables, los cuales se deben hospitalizar monitorizándolos por 24 horas; si el neumotórax no progresa o disminuye durante ese tiempo entonces el paciente puede ser dado de alta con un control radiológico a las 48 horas.
El hemotórax es una colección pleural de sangre y se divide en grados radiológicos: grado I, cuando el límite de la opacidad llega hasta el 4° arco costal posterior; grado II, cuando el límite llega hasta el 2° arco costal posterior, y grado III cuando la opacidad es total (12). El hemotórax puede ser cuantificado con radiografías de tórax en bipedestación, si la colección es menor de 200 cc por lo general no se visualiza, cuando es de 200-500 cc se borra el ángulo costo-frénico (15) y alcanza la cúpula diafragmática; y por cada espacio costal que va alcanzando progresivamente en sentido cefálico se acumulan entre 200-250 cc por espacio.
El sello de agua
La utilidad del tubo pleural es amplia: monitoriza la pérdida hemática torácica, evacua la sangre en la cavidad pleural, previene el neumotórax a tensión, incrementa la reexpansión pulmonar y mejora la función respiratoria (8). El sistema de succión se basa en tres compartimentos o cámaras conectadas entre ellas y con una conexión única con el paciente: una cámara de recolección o drenaje obtenido de la cavidad pleural; una segunda cámara sellada que sirve como una válvula unidireccional y que permite la salida de aire o líquido del espacio pleural e impide la entrada del mismo a dicho espacio; y una tercer cámara de control graduada con succión controlada a presión negativa, que cuando el volumen de agua llega a 20 cm de altura, se genera una presión de agua de igual intensidad. Dicha presión se genera por la presión hidrostática resultante de la diferencia entre la altura del agua de la tercera cámara menos la altura del agua en la primera. Este sistema es de fácil uso y cuantificación del drenaje, así como control de la presión negativa ejercida sobre la cavidad pleural.
Indicaciones y contraindicaciones
La lista de padecimientos que requieren este procedimiento como parte de su tratamiento es extensa, sin embargo, en nuestro hospital, el principal uso de la toracostomía cerrada es para el tratamiento del traumatismo penetrante de tórax (1). Sus indicaciones absolutas son: neumotórax (abierto o cerrado; simple o a tensión), hemotórax y hemoneumotórax; las indicaciones relativas son: hidrotórax, quilotórax, empiema, derrame pleural, pacientes con trauma torácico penetrante que están intubados o con fracturas costales y ventilación con presión positiva así como hipoxia profunda e hipotensión y datos clínicos de compromiso pulmonar bilateral, también se debe considerar para aquellos pacientes con riesgo de neumotórax que van a ser transportados vía aérea. A menos que se sospeche de neumotórax a tensión, en la mayoría de los casos de pacientes con traumatismo torácico es apropiado esperar a tener radiografías de tórax, anteroposterior y lateral, antes de proceder a la colocación de una sonda pleural.
La única contraindicación absoluta es la necesidad urgente de toracotomía (no se debe perder el tiempo en una toracostomía). Las contraindicaciones relativas son: coagulopatía, bula pulmonar, adhesión pleural, pulmonar o torácica, infección en el sitio de la piel sobre el que se va a introducir el tubo.
Técnica quirúrgica
El paciente debe estar colocado en semifowler en un ángulo a 45 grados o sentado (esto disminuye el riesgo de elevación del diafragma y de daño del mismo durante la inserción de tubo). El brazo del lado afectado se colocará en la parte posterior de la cabeza del paciente (abducción y rotación externa), debiendo advertir al paciente que debe mantener esta posición durante todo el procedimiento.
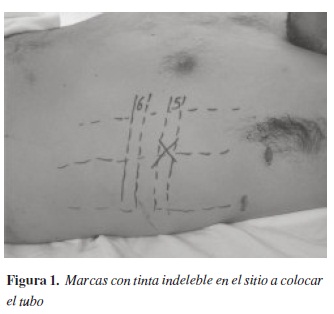
El sitio de inserción se debe valorar previamente de acuerdo con la radiografía de tórax y la percusión, para determinar el nivel líquido en caso de que este presente. Podemos marcar con tinta indeleble el sitio donde se va a insertar el tubo, usualmente el 5° o 6° espacio intercostal en la línea axilar anterior o media (17), por detrás del músculo pectoral mayor para evitar disecar a través del mismo y delante del músculo dorsal ancho, sobre el borde superior de la costilla (figura 1). Algunos autores refieren que se puede insertar en el segundo espacio intercostal en la línea media clavicular (18), particularmente no lo recomendamos, ya que es poco práctico para el paciente tener el tubo colocado de esta forma, además, el tejido mamario dificulta este procedimiento y el riesgo de perforar la arteria mamaria interna es alto.
Se debe realizar asepsia y antisepsia en tres tiempos, colocar campos quirúrgicos y procedemos a infiltrar con anestesia local, el sitio a incidir previamente marcado (se puede usar analgesia sistémica a menos que exista alguna contraindicación). La infiltración de la anestesia local debe ser generosa, sobre la piel, tejido celular subcutáneo (se debe pensar en el posible curso del tubo sobre los tejidos blandos e infiltrar sobre este), si llegamos a periostio debemos infiltrar sobre este, así como entre los músculos intercostales y sobre la pleura, la aspiración de aire, sangre o algún líquido nos confirmará que estamos en el espacio pleural.
Se realiza una incisión en la misma dirección de la costilla de 2-4 cm, se puede realizar ligeramente por debajo del nivel escogido para que el tubo quede en una posición levemente oblicua, esto último con la finalidad de evitar escapes del tubo, aunque también se puede realizar un trayecto directo, sin túnel, prácticamente no existen diferencias, la realización del trayecto dependerá de cada operador. Se escoge el calibre del tubo y se determina la longitud del segmento a introducir.
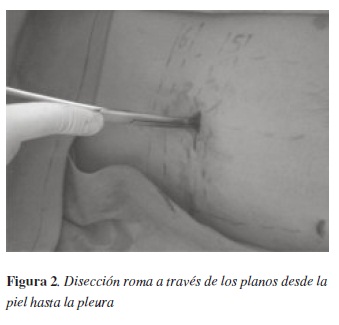
Con una pinza hemostática se abre y diseca de forma roma el tejido celular subcutáneo, avanzando intermitentemente con la pinza cerrada y abriéndola para luego retirarla, siguiendo esta misma maniobra hasta llegar a los músculos intercostales (figura 2). Luego se explora con el dedo para ubicar el borde superior que marca el límite inferior del espacio intercostal. Aquí podemos infiltrar nuevamente anestésico local. Se diseca con una pinza hemostática sobre el borde superior costal, para evitar el paquete vásculo-nervioso que corre bajo el borde inferior de la costilla superior, hasta llegar a la cavidad pleural. Esta última maniobra, tal vez requiera de un poco de fuerza, podemos utilizar una pinza Kelly introduciéndola con la punta cerrada con movimientos giratorios. Este movimiento debe ser contralado, para evitar penetrar demasiado la pinza y lesionar la pleura visceral, el parénquima pulmonar o el diafragma.
Al penetrar dicha cavidad, se puede escuchar la salida de aire o líquido, posteriormente se puede explorar digitalmente la cavidad pleural para corroborar que no existan adherencias del pulmón a la pared torácica, al introducir el dedo se debe rotar en 360 grados. En caso de existir adherencias que no puedan ser liberadas de forma digital, se procederá a colocar el tubo en otro sitio, o bajo fluoroscopia.
Se introduce el tubo, por el área fenestrada por medio de una pinza hemostática o a través de un trocar de laparoscopia (esto último no es muy recomendable), siempre dirigiendo en sentido cefálico con una angulación oblicua de unos 35 grados hacia atrás y hacia arriba, y avanzando hasta la longitud determinada previamente, en caso de colecciones líquidas (hemotórax) se puede dirigir el tubo al área basal y posterior (17). La profundidad ideal para introducir el tubo oscila entre 5 a 15 cm, debiendo estar seguros que todos los orificios de la sonda estén dentro del espacio pleural y que el orifico más proximal este al menos a 2 cm mas allá del margen de la costilla, de lo contrario podríamos ocasionar enfisema subcutáneo. También se puede usar un estilete endotraqueal maleable, para direccionar de forma apical el tubo. Dicho maleable se colocá en el interior del tubo pleural, dándole la curva adecuada para la colocación (debemos recordar siempre retirar el estilete al término de la colocación, en caso de usar esta técnica) (19). Siempre se debe mantener pinzado el extremo distal del tubo hasta que se coloque el sistema de recolección.
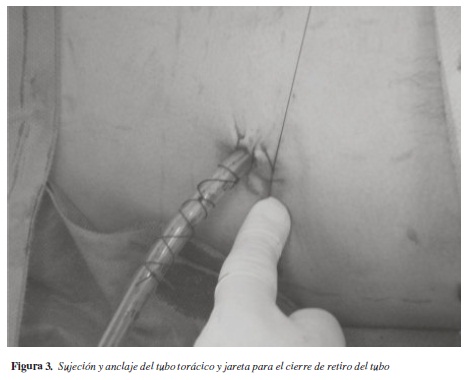
Se conecta el tubo al sistema de succión cerrada y se realiza una jareta para cierre posterior con prolene o nylon del 1 o del 0, aunque algunos autores prefieren la colocación de un punto en U o incluso hay quien considera innecesaria la colocación de material de sutura para un cierre posterior; finalmente se coloca un anclaje para fijación del tubo con seda del 1 o del 0 (figura 3). Se pueden poner gasas con vaselina sobre el sitio de salida del tubo (este material evitaría fuga), aunque se considera que un ligero ajuste a la jareta colocada para el cierre al retiro de la sonda, solucionaría cualquier problema de fuga.
Al término del procedimiento, es indispensable la toma de una radiografía de tórax para evaluar el posicionamiento del tubo, pudiendo realizar controles radiológicos cada 24 a 72 horas dependiendo de las condiciones clínicas y la disponibilidad de recursos. El buen posicionamiento del tubo, se asegura, cuando se obtiene líquido a la colocación (sangre, pus, etc.), o bien en caso de neumotórax, cuando se observa como se condensa el tubo pleural a la respiración del paciente, o bien que oscilan las columnas de agua en el sistema de succión. Este último dato sirve para evaluar la permeabilidad de la sonda mientras dura en el espacio pleural del paciente, en caso de que no exista oscilación, debemos pensar en obstrucción. En este último caso es posible purgar la sonda con solución salina.
Es de suma importancia, no elevar por encima del paciente el contenedor del sello de agua. Se puede conectar el sistema colector a succión continua lo cual puede acelerar el proceso de reexpansión pulmonar, usualmente a unos 15-20 cms de agua. Cuando el pulmón se re-expande y las hojas pleurales se adosan puede producirse dolor y tos lo cual debe advertirse al paciente.
Las medidas estándar apropiadas según el tipo de pacientes son las siguientes: adultos varones 28-32Fr, adultos mujeres 28F, jóvenes 12-28Fr, niños 12-16Fr y neonatos 10-12Fr. Para el drenaje de líquido pleural viscoso se usa una sonda 28Fr, en caso de trauma penetrante, siempre deberá colocarse una sonda 30 a 36 Fr (32). Mientras que las sondas 16 a 22Fr se deben usar para neumotórax espontáneos. La medida 3 French o Fr equivale a 1 mm (18).
Retiro del tubo pleural
Los pacientes describen el retiro del tubo pleural como una maniobra muy dolorosa, en centros de EU se utiliza morfina o derivados opioides para el manejo de este tipo de dolor (20). En nuestro medio se puede utilizar ketorolaco (AINE), el cual se administra a una dosis de 30 mg intravenoso, 30-60 minutos antes de retirar el tubo, con rangos significativos de disminución del dolor (20).
Se debe retirar el tubo pleural, cuando tenga un gasto líquido seroso de menos de 150 ml/día (en promedio entre 100-200 ml/día) (11), cuando el pulmón esté bien re-expandido y sin fugas, esto sucede entre 5-6 días de la colocación (21). Antes del retiro del tubo, se debe pinzar durante unas cuatro horas, para asegurarse de que el paciente está estable antes del retiro.
Existe una amplia discusión en la forma de retirar el tubo pleural. El paciente debe colocarse en decúbito lateral, con el lado afectado hacia arriba. Los médicos que retiran el tubo pleural en inspiración argumentan que no existe presión negativa en la pleura, mientras que los que lo retiran en espiración refieren que es la parte del ciclo en que existe menor presión negativa (22).
El tubo pleural puede retirarse tanto en inspiración como en espiración, con diferencias potenciales entre una y otra forma, como lo demuestra el modelo de Contreras-Ruiz y cols. Si se retira en inspiración máxima y maniobra de Valsalva, el único movimiento respiratorio que el paciente puede hacer es espirar, así que las probabilidades de nuevo neumotórax son bajas; pero si se realiza en espiración, el paciente puede hacer un movimiento inspiratorio, generando presión negativa, pudiendo formar un nuevo neumotórax (22). Esta maniobra es de particular ayuda en niños. Al sacar el tubo pleural en inspiración y Valsalva, se puede retirar el tubo de forma lenta con la seguridad de que no se formará un nuevo neumotórax, lo imperativo es que el paciente no deje de realizar Valsalva hasta que el tubo este completamente fuera y la jareta este cerrada, con lo cual no se forma un neumotórax recurrente a pesar de no retirar el tubo con rapidez (22).
Es necesario instruir al paciente, antes del retiro del tubo, diciéndole que inspire profundo y puje sin sacar el aire, hasta que se le indique. Idealmente la retirada del tubo debe realizarse por dos personas mientras una de ellas retira el tubo la otra ocluye el sitio del drenaje ya sea con la sutura previamente colocada o con una gasa con material vaselinada para evitar en lo posible la formación de un neumotórax residual, que de formarse, usualmente no requiere más que vigilancia. Después de retirar el tubo, siempre debe solicitarse una radiografía de control.
Complicaciones
La complicación más común es la disfuncionalidad del tubo por mala colocación y posicionamiento de la sonda (23), (con dirección hacia diafragma, sonda subcutánea, punta de la sonda en el ápice pulmonar, sonda en la cavidad abdominal, etc.); pero puede ocurrir:
Sangrado sobre la incisión, lesión a arteria intercostal (8) y lesión a arteria pulmonar (8, 24);
Laceración del parénquima pulmonar daño al parénquima pulmonar (secundario a adherencias no liberadas) (25), lesión a hígado o bazo, lesión penetrante a diafragma, esófago (8), estómago o colon (puede ocurrir en caso de hernia diafragmática inadvertida) (26);
Compresión a la aurícula y/o ventrículo (8);
Hemotórax residual o retenido (sangre coagulada que no ha podido ser drenada con un tubo pleural) (27), que puede llevar a empiema (10% de los casos) (28) y sepsis pleural (29), en los cuales la infección es secundaria a la contaminación externa que causó la propia herida al introducir el tubo (10);
Quilotórax traumático y perforación a la vena subclavia después de la colocación de la sonda (18); Derrame pleural postraumático recidivante; la inexpansibilidad es otra complicación muy frecuente (16);
Lesión al nervio torácico largo (30), neuropraxia frénica y parálisis diafragmática (irritación al ápice pulmonar) (25) así como síndrome de Horner (tubo adyacente a la columna cervical y torácica que causa trauma directo o de repetición por la respiración) (31);
Las complicaciones menos frecuentes que pueden llegar a presentarse son infección de la piel en el sitio de inserción de la sonda así como reacciones alergias a los anestésicos locales utilizados durante la infiltración.
Entre los errores técnicos potencialmente evitables se encuentran la pérdida de la relación anatómica al colocar la sonda pleural (grandes quemados, mastectomía, curva de aprendizaje), toracostomía paraesternal, toracostomía transmamaria, toracostomía dorsal, fenestraciones fuera de la cavidad pleural, uso de tubo endotraqueal o sonda de Levin como sonda pleural, caída de la sonda por fijación deficiente a la pared, falla de hermeticidad del sistema, acodamiento y obstrucción, conexiones que disminuyen el calibre y obstruyen la sonda como las conexiones largas.
Antibióticoterapia
Aunque el uso de antibióticos profilácticos en la inserción de un tubo de tórax esta aún en debate (32, 33). En nuestro hospital usamos un esquema antibiótico profiláctico (32) de inicio pronto (menos de 3 hrs a partir de la lesión), que según la literatura, disminuye la incidencia de infección en estos pacientes, persistiendo con un esquema de corta duración. Se deben usar cefalosporinas de primera generación por un lapso no mayor de 24 hrs, aunque con ésto disminuye la incidencia de neumonía postraumática, pero no de empiema (no existe evidencia clínica que el uso de antibióticos prevenga el empiema) (25). Los organismos involucrados son Staphylococcus aureus y especies de Streptococcus en caso de contaminación a la colocación de tubo pleural, y Gram negativos y flora mixta en caso de neumonías.
Consideraciones
La disección roma y la descompresión digital de la pleura, deben ser el primer paso (primordial), durante la recepción del paciente con hemotórax o neumotórax en urgencias. La inserción del tubo pleural es secundaria en los pacientes con inestabilidad hemodinámica (34).
Siempre que sea posible, a los pacientes con trauma torácico cerrado, se les debe realizar una tomografía axial computarizada (TAC) antes de la inserción del tubo pleural, para verificar el lugar apropiado e ideal para el mismo (34).
Se deberá realizar toracotomía en caso de hemotórax masivo, esto es un hemotórax drenado a la colocación de la sonda pleural de 1500cc, o bien de 150-200cc/hora en las primeras 3 horas (11). La vieja tradición de pinzar el tubo durante el drene del hemotórax es completamente innecesaria, ya que tiene efectos adversos sobre la función pulmonar y da un falso estimado acerca de la severidad del daño (11).
Referencias
1. Díaz-Rosales JD, Enríquez-Domínguez L, Arriaga- Carrera JM, Gutiérrez-Ramírez GP. Trauma penetrante en abdomen y tórax: Estudio de casos en el Hospital General de Ciudad Juárez. Cir Gen. 2009; 31: 9-13. [ Links ]
2. Cohn SM. Pulmonary contusion: review of the clinical entity. J Trauma. 1997; 42: 973-979. [ Links ]
3. Meyer DM. Hemothorax related to trauma. Thorac Surg Clin. 2007;17: 47-55. [ Links ]
4. Saaiq M, Shah SA. Thoracic trauma: presentation and management outcome. J Coll Physicians Surg Pak. 2008;18: 230-233. [ Links ]
5. Zargar M, Khaji A, Karbakhsh Davari M. Thoracic injury: a review of 276 cases. Chin J Traumatol. 2007; 10: 259-262. [ Links ]
6. Khandhar SJ, Johnson SB, Calhoon JH. Overview of thoracic trauma in the United States. Thorac Surg Clin. 2007;17: 1-9. [ Links ]
7. Mattox KL, Allen MK. Systematic approach to pneumothorax, haemothorax, pneumomediastinum and subcutaneous emphysema. Injury. 1986;17: 309-312. [ Links ]
8. Ball CG, Lord J, Laupland KB, Gmora S, Mulloy RH, Ng AK, Schieman C, Kirkpatrick AW. Chest tube complications: how well are we training our residents? Can J Surg. 2007; 50: 450-458. [ Links ]
9. Zgoda MA, Lunn W, Ashiku S, Ernst A, Feller- Kopman D. Placement through a single-port thoracoscopy: A novel technique. Chest. 2005; 127: 1805- 1807. [ Links ]
10. Cicero-Sabido R, Páramo-Arroyo RF, Navarro-Reynoso FP, Pimentel-Ugarte L. Procedimientos quirúrgicos en 156 casos de derrame pleural. Resultados inmediatos. Cir Ciruj. 2006; 74: 409-414. [ Links ]
11. Snow N. Tube thoracostomy in the air medical setting. AirMed. 1999; 5: 54-57. [ Links ]
12. Fernandez-Céspedes A, Perrotti PP, Sandrigo SA, Mariel-Giroldi K. Manejo del espacio pleural en el trauma torácico. Rev Post VIa Cat Med. 2005:142;10-15. [ Links ]
13. Stewart RM, Corneille MG. Common complications following thoracic trauma: their prevention and treatment. Semin Thorac Cardiovasc Surg. 2008; 20: 69-71. [ Links ]
14. Melton LJ, Hepper NG, Offord KP. Incidence of spontaneous pneumothorax in Olmstead country, Minnesota: 1950 to 1974. Am Rev Resp Dis. 1979; 120: 1379- 1382. [ Links ]
15. Méndez-Catasús R. Traumatismos del tórax. Conducta a seguir. Rev Cubana Cir. 2006; 45(3-4). [ Links ]
16. Armas-Darias JC, Valdés-Mesa PG, Rodríguez-Rivero A, Valdés-Leyva R. Algunos aspectos clínicoquirúrgicos del neumotórax espontaneo. Rev Cub Cir. 2001; 40: 7-11. [ Links ]
17. Aylwin CJ, Brohi K, Davies GD, Walsh MS. Prehospital and in hospital thoracostomy: indications and complications. Ann R Coll Surg Engl. 2008; 90: 54-57. [ Links ]
18. Oettinger R, Soto S. Pleurotomías en el Hospital Clínico Regional de Valdivia. Generalidades y estudio analítico del periodo Junio 1995- Julio 2000. Cuad Cir. 2001;15: 29-34. [ Links ]
19. Amntimadugu BT, Goldstraw P. A simple (malleable endotracheal tube stylet) to aid positioning of chest drain. Eur J Cardiothrac Surg. 2005; 27: 152. [ Links ]
20. Puntillo K, Ley SJ. Appropriately timed analgesics control pain due to chest tube removal. Am J Crit Care. 2004; 13: 292-304. [ Links ]
21. Rodríguez-Loeches Fernández J, la Rosa U. Heridas penetrantes en tórax. Rev Cub Cir. 1992; 22: 120- 124. [ Links ]
22. Contreras-Ruíz R, Rojas-Díaz O, Vidal-González P, Sáncehz-Jureidini O, González-Avilés JM. Fin a la discusión del retiro del tubo pleural con un sencillo modelo de tórax. Cir Gen. 2007; 29: 136-139. [ Links ]
23. Khanzada TW, Samad A. Indications and complications of tube thoracostomy performed by general surgeons. J Pak Med Assoc. 2008; 58: 39-40. [ Links ]
24. Takanami I. Pulmonary artery perforation by a tube thoracostomy. Interact Cardiovasc Thorac Sur. 2005; 4: 473-474. [ Links ]
25. Poncia H, Ryan JM. An unusual complication of chest tube thoracostomy. CJEM. 2000; 2: 121-123. [ Links ]
26. Andrabi SA, Andrabi SI, Mansha M, Ahmed M. An iatrogenic complication of closed tube thoracostomy for penetrating chest trauma. N Z Med J. 2007: 26; 120 (1264): U2784. [ Links ]
27. García-Nuñez LM, Padilla-Solis R, Lever-Rosas CD. Hemorórax retenido ¿Qué debo saber una vez que lo he encarado? Trauma. 2005; 8: 82-88. [ Links ]
28. Eren S, Esme H, Sehitogullari A, Durkan A. The risk factors and management of posttraumatic empyema in trauma patients. Injury. 2008; 39: 44-49. [ Links ]
29. Karmy-Jones R, Holevar M, Sullivan RJ, Fleisig A, Jurkovich GJ. Residual hemothorax after chest tube placement correlates with increased risk of empyema following traumatic injury. Can Respir J. 2008; 15: 255-258. [ Links ]
30. Hassan WU, Keaney NP. Winging of scapula: an unusual complication of chest tube placement. J Acc Emer Med. 1994; 12: 156-157. [ Links ]
31. Bertino RE, Websbey GE, Johnson RJ. Horner syndrome occurring as a complication of chest tube placement. Radiology. 1987;164: 745. [ Links ]
32. Fontelles MJ, Mantovani M. Incidence of infectious complications following tube thoracostomy with and without use of antibiotic therapy: meta-analysis study. Acta Cir Bras. 2001; 16: 195-199. [ Links ]
33. Meyer DM. Hemothorax related to trauma. Thorac Surg Clin. 2007; 17: 47-55. [ Links ]
34. Fitzgerald M, Mackenzie CF, Marasco S, Hoyle R, Kossmann T. Pleural decompression and drainage during trauma reception and resuscitation. Injury. 2008; 39: 9-20. [ Links ]