Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.61 no.3 Bogotá July/Sept. 2013
Efectos de los nutrientes y compuestos bioactivos de los alimentos en tejidos y células de cáncer humano: aproximación nutrigenómica
Effects of nutrients and bioactive compounds of foods in tissues and cells of human cancer: nutrigenomics approach
Jhonny E. Vargas-Hernández¹ • María P. Camacho-Gómez¹ • Doris Ramírez de Peña¹
¹ Departamento de Nutrición Humana, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá.Correspondencia: Prof. Doris Ramírez de Peña. Departamento de Nutrición Humana, Piso 5, Facultad de Medicina Universidad Nacional de Colombia. Bogotá, Colombia.
Correspondencia: dorisa_ramirez@yahoo.com
Recibido: 04/02/2013 / Aceptado: 19/07/2013
Resumen
El cáncer es una condición de programación genética anormal en la cual cambios en la secuencia genómica alteran la estructura, función y expresión de proteínas que controlan procesos celulares esenciales como el crecimiento, la proliferación, la diferenciación y la apoptosis. Investigaciones en nutrición y cáncer han analizado los efectos de determinados nutrientes y compuestos bioactivos de los alimentos en el desarrollo y evolución de diversos tipos de cáncer.
El objetivo de esta investigación fue revisar, en la información científica reciente, los efectos o interacciones de los nutrientes y compuestos bioactivos de los alimentos en tejidos y/o células de cáncer humano bajo una aproximación nutrigenómica. Se realizó una búsqueda de los artículos, publicados entre enero de 2011 y octubre de 2012, en la base de datos Pubmed, utilizando términos MeSH y "Text Word" relevantes para el objetivo de investigación. De esta búsqueda se obtuvo un total de 250 publicaciones de los cuales se seleccionaron 33.
En general, los efectos e interacciones de los nutrientes y compuestos bioactivos selectivamente inducen la muerte e inhiben el crecimiento y proliferación de las células cancerígenas; sin embargo, bajo ciertas condiciones, dichos efectos e interacciones pueden promover la carcinogénesis.
Palabras clave: Neoplasias, dieta, nutrigenómica, expresión génica (DeCS).
Summary
Cancer is a genetic programming abnormal condition in which the change in genomic sequence may alter the structure, function and expression of proteins that control essential cellular processes such as growth, proliferation, differentiation and apoptosis. Nutrition and cancer research have analyzed the effects of certain nutrients and bioactive food compounds in the development and progression of various cancers.
The aim of this research was to review, in the recent scientific information, the effects or interactions of nutrients and bioactive food compounds in tissue and cells of human cancer under a nutrigenomics approach. We did a search of articles published between January 2011 and
October 2012 in the Pubmed database, using MeSH terms and "Text Word" relevant to the research objective. This search yielded 250 publications which 33 were selected.
In general, the effects and interactions of the nutrients and bioactive compounds selectively induce death and inhibit the growth and proliferation of cancer cells, however, under certain conditions, such effects and interactions may promote carcinogenesis.
Key words: Neoplasms, diet, nutrigenomics, gene expression (MeSH).
Introducción
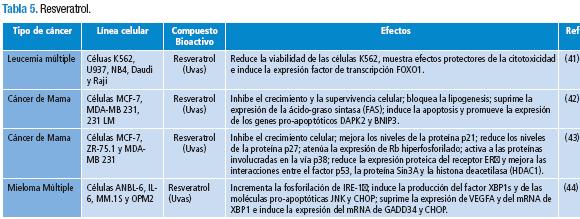
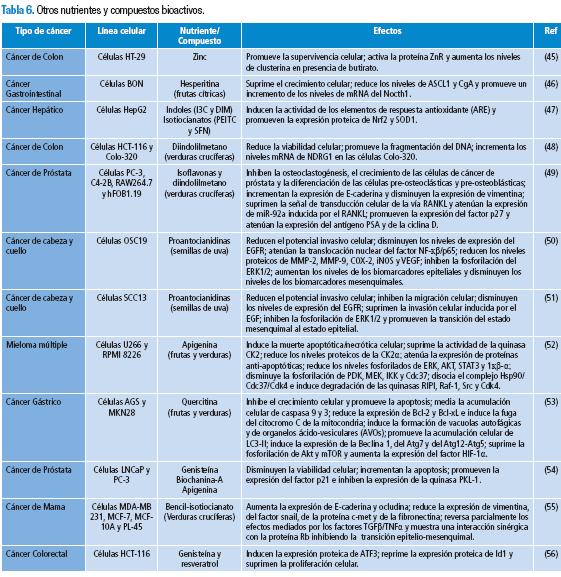
Según datos del Proyecto GLOBOCAN de la Organización Mundial de la Salud (OMS), la incidencia de cáncer a nivel mundial para 2008 fue de 164,4 por 100000 habitantes; de estos casos, el 22,9 % fueron atribuidos al cáncer de mama, 9,4 % al cáncer colono-rectal y el 8,8 % al cáncer de cuello uterino (1). El cáncer es una condición de programación genética anormal en la cual cambios en la secuencia genómica alteran la estructura, función y expresión de proteínas que controlan procesos celulares esenciales como el crecimiento, la proliferación, la diferenciación y la apoptosis (2). Recientemente se ha postulado que solo un grupo reducido de células, denominadas "células madre cancerígenas", tienen el suficiente potencial para iniciar y mantener el crecimiento de un tumor, lo que resulta contrariar lo establecido en el modelo clásico, en el que cualquier célula cancerígena tiene la capacidad de iniciar y mantener el crecimiento tumoral (3).
En investigaciones en nutrición y cáncer se han observado efectos favorables de determinados nutrientes y compuestos bioactivos de los alimentos contra el desarrollo y evolución de diversos tipos de cáncer. Por otro lado, se ha notado que la deficiencia de ciertos micronutrientes, el exceso de calorías, el consumo de alimentos procesados a altas temperaturas (en los que se produce acrilamida), de carnes curadas o conservadas con nitritos y nitratos (que producen compuestos N-nitrosos) y de carnes asadas en exceso (en los que se producen aminas heterocíclicas e hidrocarburos policíclicos), así como el consumo de alimentos contaminados con aflatoxinas y el padecimiento de entidades crónicas como la obesidad y el síndrome metabólico, se vinculan con el desarrollo de diferentes tipos de cáncer (4-8).
El objetivo de esta investigación fue revisar, en la información científica reciente, los efectos o interacciones de los nutrientes y compuestos bioactivos de los alimentos en tejidos y células de cáncer humano bajo una aproximación nutrigenómica. La información condensada en este estudio será de utilidad para que los profesionales en nutrición orienten el desarrollo de nuevas investigaciones y diseñen nuevos esquemas terapéuticos para el tratamiento de los pacientes que padecen esta patología.
Material y métodos
Se realizó una búsqueda de los estudios publicados en la base de datos PubMed, para lo que se construyó la ecuación de búsqueda: Neoplasms AND (Nutrigenomics OR "Gene Expression" OR "Genetic variation" OR "Polymorphism, Genetic" OR "Polymorphism, Single Nucleotide") AND (Diet OR Nutrients OR "Dietary Carbohydrates" OR "Dietary Fats" OR "Dietary Proteins" OR "Micronutrients" OR Vitamins OR "Trace Elements" OR "Dietary Fiber" OR Antioxidants OR Isothiocyanates OR Carotenoids OR Flavonoids) NOT ("Metabolic syndrome" OR "Cardiovascular disease" OR Obesity OR Diabetes OR Hypertension), la cual contiene los términos MeSH y "Text Word" relevantes para el objetivo de investigación. Con el fin de hacer eficiente la búsqueda se emplearon los filtros: "Fecha de publicación", para obtener los estudios publicados entre los años 2011 y 2012, "Especies" y "Disponibilidad del texto", para obtener los estudios realizados en humanos disponibles para descarga.
Para la selección de los artículos se realizó una revisión primaria de los títulos y resúmenes de cada publicación y se preseleccionaron y descargaron aquellos que contuvieran el nombre de algún tipo de cáncer, el término polimorfismo/SNP/expresión genética/variante genética/mutación y el nombre de algún alimento, nutriente o compuesto bioactivo. Se excluyeron los artículos tipo descriptivo, revisión sistemática y meta-análisis que contuvieran el nombre de cualquier tipo de medicamento, que incluyeran el término "tabaquismo" o similares, que indicaran el uso de animales o células de animales y que no tuvieran relación con la pregunta de investigación.
Luego, se hizo una revisión secundaria del contenido de los artículos descargados y se seleccionaron aquellos experimentales que analizaron los efectos o interacciones de los nutrientes y/o compuestos bioactivos con los genes o la expresión génica en tejidos y/o células de cánceres humanos. Se excluyeron los artículos que no usaban cultivos tisulares y/o celulares, que indicaban el uso de tejidos y/o células de animales, que no especificaban el organismo del que se obtuvo el cultivo tisular/celular, que no evidenciaban efectos o interacciones de los nutrientes o compuestos bioactivos con los genes o la expresión génica, que analizaban las interacciones de análogos y/o derivados sintéticos de nutrientes y/o compuestos bioactivos, que estudiaban los efectos o interacciones de compuestos bioactivos y/o análogos extraídos de plantas u otros organismos que no constituían alimentos humanos, que presentaban metodologías confusas y que mostraban inconsistencias entre los objetivos, metodología, resultados y conclusiones.
Resultados
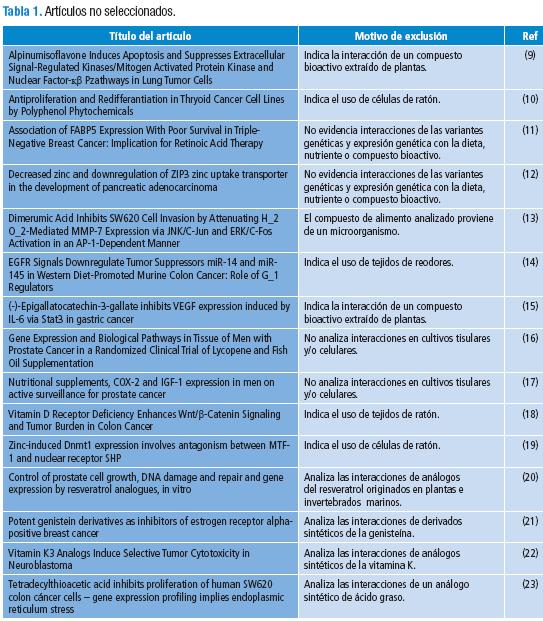
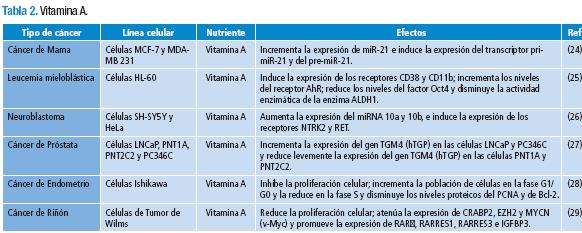
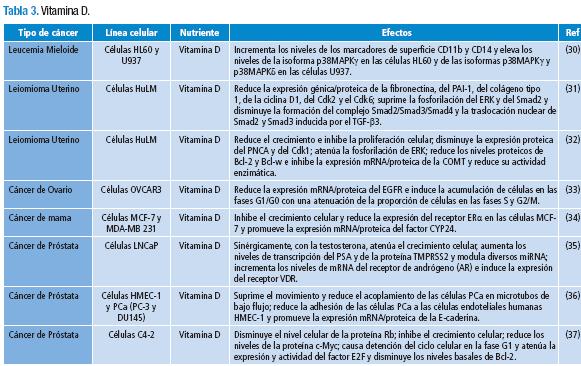
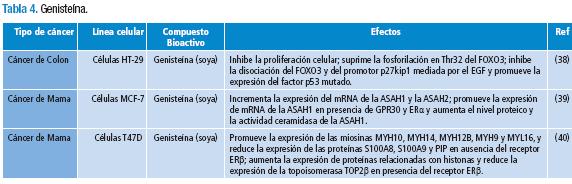
Se obtuvo un total de 250 publicaciones, de las cuales 48 se preseleccionaron y descargaron en la revisión primaria. 15 artículos fueron excluidos (Tabla 1) y 33 cumplieron con los criterios de inclusión (Tablas 2-6) de la revisión secundaria.
Discusión
La investigación en genómica nutricional a nivel internacional está avanzando a pasos agigantados gracias a la publicación de los resultados del proyecto del "Genoma Humano" en el año 2003, al desarrollo de la bioinformática, al mejoramiento de equipos y técnicas de investigación en genómica, transcriptómica, proteómica, metabolómica, entre otras, y al mayor reconocimiento de la importancia de la alimentación y la nutrición en la salud. Un aspecto a destacar, derivado de estos avances, es la puesta en marcha de los proyectos "International HapMap" y "Cancer Genome Atlas", los cuales buscan develar los aspectos genéticos de las enfermedades de mayor impacto sobre la salud humana (57) y cuyos hallazgos se espera sean de enorme relevancia.
En Colombia, la investigación en genómica nutricional es limitada, puesto que son pocos los grupos inmersos en este campo. Si bien el tema compete en gran medida a los profesionales en nutrición, son pocos los que conocen del tema y aun menos quienes están formados y capacitados para desarrollar proyectos de investigación y para aplicar en la práctica los conocimientos derivados de esta disciplina. Por lo tanto, un primer e importante acercamiento implica condesar la información de diversas fuentes científicas de calidad y poner dicha información a disposición de los profesionales en esta área de la salud para que se interesen y se formen en esta nueva área del conocimiento.
Principales hallazgos
La presente investigación muestra que los nutrientes y/o compuestos bioactivos pueden, directa e indirectamente, de forma individual o sinérgica, modificar la estructura de la cromatina, fragmentar el DNA, suprimir o promover la expresión de los genes modulando la transcripción y transducción, bloquear o activar distintas vías de señalización intra y extracelular involucradas en la proliferación, diferenciación y muerte celular, y contrarrestar los efectos de algunas moléculas del entorno intra y extracelular. Aunque, en general, los efectos e interacciones de los nutrientes y/o compuestos bioactivos selectivamente inducen la muerte e inhiben el crecimiento y proliferación de las células cancerígenas, bajo ciertas condiciones, dichos efectos e interacciones pueden promover la carcinogénesis.
Por otro lado, si bien los nutrientes y/o compuestos bioactivos exhiben diversos mecanismos de acción a nivel celular puede que estos no sean igual de relevantes en un nivel de mayor complejidad. Además, es importante considerar que, incluso en el nivel celular, dichos mecanismos no son homogéneos, pues dependen de la característica morfológica y bioquímica de la célula y de las condiciones del entorno celular.
Conflicto de interés
Ninguno declarado por los autores.
Financiación
Ninguna declarada por los autores.
Agradecimientos
Ninguno declarado por los autores.
Referencias
1. International Agency for Research on Cancer-WHO. GLOBOCAN. [Online]. 2008. Available from: http://globocan.iarc.fr/factsheet.asp. Cited 2012 October 15. [ Links ]
2. Man Wong K, Hudson TJ, McPherson JD. Unraveling the genetics of cancer: genome sequencing and beyond. The Annual Reviews of Genomics and Human Genetics. 2011;12:407-30. [ Links ]
3. Ward RJ, Dirks PB. Cancer stem cells: At the headwaters of tumor development. The Annual Review of Pathology: Mechanisms of Disease. 2007;2:175-89. [ Links ]
4. Davis CD, Milner J. Frontiers in nutrigenomics, proteomics, metabolomics and cancer prevention. Mutation Research. 2004;551:51-64. [ Links ]
5. Ardekani AM, Jabbri S. Nutrigenomics and cancer. Avicenna J Med Biotech. 2009;1:9-17. [ Links ]
6. Wicki A, Hagmann J. Diet and cancer. The European Journal of Medical Sciences. 2011;1-8. [ Links ]
7. Gromadzinska J, Reszka E, Bruzelius K, Wasowicz W, Akesson B. Selenium and cancer: biomarkers of selenium status and molecular action of selenium supplements. Eur J Nutr. 2008;47:29-50. [ Links ]
8. Urrego Novoa JR, Díaz GJ. Aflatoxinas: mecanismos de toxicidad en la etiología del cáncer hepático celular. Rev Fac Med. 2006;54:108-16. [ Links ]
9. Namkoong S, Kim TJ, Jang IS, Kang KW, Oh WK, Park J. Alpinumisoflavone Induces Apoptosis and Suppresses Extracellular Signal-Regulated Kinases/Mitogen Activated Protein Kinase and Nuclear Factor-қß Pathways in Lung Tumor Cells. Biol Pharm Bull. 2011;34:203-8. [ Links ]
10. Kang HJ, Youn YK, Hong MK, Kim LS. Antiproliferation and Redifferantiation in Thryoid Cancer Cell Lines by Polyphenol Phytochemicals. J Korean Med Sci. 2011;26:893-9. [ Links ]
11. Liu RZ, Graham K, Glubrecht DD, Germain DR, Mackey JR, Godbout R. Association of FABP5 Expression With Poor Survival in Triple-Negative Breast Cancer: Implication for Retinoic Acid Therapy. The American Journal of Pathology. 2011;178:997-1008. [ Links ]
12. Costello LC, Levy BA, Desouki MM, Zou J, Bagasra O, Johnson LA, et al. Decreased zinc and downregulation of ZIP3 zinc uptake transporter in the development of pancreactic adenocarcinoma. Cancer Biology & Therapy. 2011;12:297-303. [ Links ]
13. Ho BY, Wu YM, Chang KJ, Pan TM. Dimerumic Acid Inhibits SW620 Cell Invation bt Attenuating H2O2-Mediated MMP-7 Expression via JNK/C-JUN and ERK/C-Fos Activation in an AP-1-Dependent Manner. International Journal of Biological Sciences. 2011;7:869-80. [ Links ]
14. Zhu H, Dougherty U, Robinson V. EGFR Signals Downregulate Tumor Suppressors miR-14 and miR-145 in Western Diet-Promoted Murine Colon Cancer: Role of G1 Regulators. Mol Cancer Res. 2011;9:960-75. [ Links ]
15. Zhu BH, Chen HY, Zhan WH, Wang CY, Cai SR, Wang Z, et al. (-)-Epigallatocatechin-3-gallate inhibits VEGF expression induced by IL-6 via Stat3 in gastric cancer. World J Gastroenterol. 2011;17:2315-25. [ Links ]
16. Magbanua MJM, Roy R, Sosa EV, Weinberg V, Federman S, Mattie MD, et al. Gene Expression and Biological Pathways in Tissue of Men with Prostate Cancer in a Randomized Clinical Trial of Lycopene and Fish Oil Supplementation. PLoS ONE. 2011;6:e24004. [ Links ]
17. Chan JM, Weinberg V, Magbanua MJ, Sosa E, Simko J, Shinohara K, et al. Nutritional supplements, COX-2 and IGF-1 expression in men on active surveillance for prostate cancer. Cancer Causes Control. 2011;22:141-50. [ Links ]
18. Larriba MJ, Ordóñez-Morán P, Chicote I, Martín-Fernández G, Puig I, Muñoz A, et al. Vitamin D Receptor Deficiency Enhances Wnt/ß-Catenin Signaling and Tumor Burden in Colon Cancer. PLoS ONE. 2011;6:e23524. [ Links ]
19. Zhang Y, Andrews GK, Wang L. Zinc-induced Dnmt1 expression involves antagonism between MTF-1 and nuclear receptor SHP. Nucleid Acids Research. 2012;40:4850-60. [ Links ]
20. Hsieh Tc, Huang Yc, Wu JM. Control of prostate cell growth, DNA damage and repair and gene expression by resveratrol analogues, in vitro. Carcinogenesis. 2011;32:93-101. [ Links ]
21. Marik R, Allu M, Anchoori R, Stearns V, Umbricht CB, Khan S. Potent genistein derivates as inhibitors of estrogen receptor alpha-positive breast cancer. Cancer Biology & Therapy. 2011;11:883-92. [ Links ]
22. Kitano T, Yoda H, Tabata K, Miura M, Toriyama M, Motohashi S, et al. Vitamin K3 Analogs Induce Selective Tumor Cytotoxicity in Neuroblastoma. Biol Pharm Bull. 2012;35:617-23. [ Links ]
23. Lundemo AG, Pettersen CH, Berge K, Berge RK, Schoberg SA. Tetradecylthioacetic aci inhibits proliferation of human SW620 colon cancer cells - gene expression profiling implies endoplasmic reticulum stress. Lipids in Health and Disease. 2011;10:1-12. [ Links ]
24. Terao M, Fratelli M, Kurosaki M, Zanetti A, Guarnaccia V, Paroni G, et al. Induction of miR-21 by Retinoic Acid in Estrogen Receptor-positive Breast Carcinoma Cells. The Journal of Biological Chemitry. 2011;286:4027-42. [ Links ]
25. Bunaciu RP, Yen A. Activation of the aryl hydrocarbon receptor AhR promotes retinoic acid-inducen differentiation of myeloblastic leukemia cells by restricting expression of the stem cell transcription factor Oct4. Cancer Res. 2011;71:2371-80. [ Links ]
26. Meseguer S, Mudduluru G, Escamilla JM, Allgayer H, Barettino D. MicroRNAs-10a y -10b Contribute to Retinoid Acid-induced Differentiation of Neuroblastoma Cells and Target the Alternative Splicing Regulatory Factor SFRS1 (SF2/ASF). The Journal of Biological Chemistry. 2011;286:4150-64. [ Links ]
27. Rivera-Gonzalez GC, Droop AP, Rippon HJ, Tiemann K, Pellacani D, Georgopoulos LJ, et al. Retinoid acid and androgen receptors combine to achieve tissue specific control of human prostatic transglutaminase expression: a novel regulatory network with broader significance. Nucleid Acids Research. 2012;40:4825-40. [ Links ]
28. Chen YH, Utsunomuya H, Pavone ME, Yin P, Bulun SE. Retinoic acid inhibits endometrial cancer cell growth via multiple genomic mechanisms. Journal of Molecular Endocrinology. 2011;46:139-153. [ Links ]
29. Wegert J, Bausenwein S, Kneitz S, Roth S, Graf N, Geissinger E, et al. Retinoic acid pathway activity in wilms tumors and characterization of biological responses in vitro. Molecular Cancer. 2011;10:1-12. [ Links ]
30. Zhang J, Harrison JS, Studzinski GP. Isoforms of p38MAPK gama and delta contribute to diferentiation of human AML cells induced by 1,25-dihydroxyvitamin D3. Exp Cell Res. 2011;317:117-30. [ Links ]
31. Halder SK, Goodwin S, Al-Hendy A. 1,25-Dihydroxyvitamin D3 Reduces TGF-ß3- Inducen Fibrosis-Related Gene Expression in Human Uterine Leiomyoma Cells. J Clin Endocrinol Metab. 2011;96:E754-E762. [ Links ]
32. Sharan C, Halder SK, Thota C, Jaleel T, Nair S, Al-Hendy A. Vitamin D inhibits Proliferation of Human Uterine Leiomyoma Cells via Catechol-O-Methyltransferase. Fertil Esteril. 2011;95:247-53. [ Links ]
33. Shen Z, Zhang X, Tang J, Kasiappan R, Jinwal U, Li P, et al. The coupling of epidermal growth factor receptor down regulation by 1 alpha, 25-dihydroxyvitamin D3 to the hormone-induced cell cycle arrest at the G1-S checkpoint in ovarian cancer cells. Mol Cell Endocrinol. 2011;338:58-67. [ Links ]
34. Alimirah F, Peng X, Murillo G, Mehta RG. Functional Significance of Vitamin D Receptor Fokl Polymorphism in Human Breast Cancer Cells. PLoS ONE. 2011;6:e16024. [ Links ]
35. Wang WLW, Chatterjee N, Chittur SV, Welsh J, Tenniswood MP. Effects of 1α,25-dihidroxivitamina D3 and testosterone on miRNA and mRNA expression in LNCaP cells. Molecular Cancer. 2011;10:1-15. [ Links ]
36. Hsu JW, Yasmin-Karim S, King MR, Wojciechowski JC, Mickelsen D, Blair ML, et al. Suppression of Prostate Cancer Cell Rolling and Adhesion to Endothelium by 1α,25-Dihydroxyvitamin D3. The American Journal of Pathology. 2011;178:872-80. [ Links ]
37. Washington MN, Kim JS, Weigel NL. 1α,25-Dihydroxyvitamin D3 Inhibits C4-2 Prostate Cancer Cell Growth via a Retinoblastoma Protein (Rb)-Independent G1 Arrest. Prostate. 2011;71:98-110. [ Links ]
38. Qi W, Weber CR, Wasland K, Savkovic SD. Genistein inhibists proliferation of colon cancer cells by attenuating a negative effect of epidermal growth factor on tumor suppresor FOXO3 activity. BCM Cancer. 2011;11:219. [ Links ]
39. Lucki NC, Sewer MB. Genistein Stimulates MCF-7 Breast Cancer Cell Growth by Inducing Acid Ceramidase (ASAH1) Gene Expression. The Journal of Biological Chemistry. 2011;286:19399-409. [ Links ]
40. Sotoca AM, Sollewijn Gelpke MD, Anders Strom SB, Gustafsson JÅ, Murk AJ, Rietjens I, et al. Quantitative Proteomics and Transcriptomics Addressing the Estrogen Receptror Subtype-mediated Effects in T47D Breast Cancer Cells Exposed to the Phytoestrogen Genistein. Molecular & Cellular Proteomics. 2011;10:1-17. [ Links ]
41. Niu XF, Liu BQ, Du ZX, Gao YY, Li C, Li N, et al. Resveratrol protects leukemic cells against cytotoxicity induced by proteasome inhibitors via induction of FOXO1 and p27. BMC Cancer. 2011;11:2-10. [ Links ]
42. Pandey PR, Okuda H, Watabe M, Pai SK, Liu W, Kobayashi A, et al. Resveratrol suppresses growth of cancer stem-like cells by inhibiting fatty acido synthase. Breast Cancer Res Treat. 2011;130:387-98. [ Links ]
43. De Amicis F, Giordano F, Vivacqua A, Pellegrino M, Panno ML, Tramontano D, et al. Resveratrol, through NF-Y/p53/Sin3/HDAC1 complex phosphorylation, ihibits estrogen receptor α gene expression via p38/CK2 signaling in human breast cancer cells. The FASEB Journal. 2011;25:3695-3707. [ Links ]
44. Wang FM, Galson DL, Roodman GD, Ouyang H. Resveratrol triggers the pro-apoptotic endoplasmatic reticulum stress response and represses the pro-survival XBP1 signaling in human multiple myeloma cells. Exp Hematol. 2011;39:999-1006. [ Links ]
45. Cohen L, Azriel-Tamir H, Arotsker N, Sekler I, Hershfinkel M. Zinc Sensing Receptor Signaling, Mediated by GPR39, Reduces Butyrate-Induced Cell Death in HT29 Colonocytes via Upregulation of Clusterin. PLoS ONE. 2012;7:e35482. [ Links ]
46. Zarebczan B, Pinchot SN, Kunnimalaiyaan M, Chen H. Hesperitin, a Potential Therapy for Carcinoid Cancer. Am J Surg. 2011;201:329-33. [ Links ]
47. Saw CLL, Cintron M, Wu TY, Gou Y, Huang Y, Jeong WS, et al. Pharmacodynamics of dietary phytochemical indoles I3C and DIM: Induction of Nrf2-mediated Phase II drug metabolizing and antioxidant genes and synergism with isothiocyanates. Biopharm Drug Dispos. 2011;32:289-300. [ Links ]
48. Lerner A, Grafi-Cohen M, Napso T, Azzam N, Fares F. The Indolic Diet-Derivate, 3,3´-Diindolylmethane, Induced Apoptosis in Human Colon Cancer Cells through Upregulation of NDRG1. Journal of Biomedicine and Biotechnology. 2012:1-5. [ Links ]
49. Li Y, Kong D, Ahmad A, Bao B, Sarkar FH. Targeting Bone Remodeling by Isoflavone and 3,3´-Diindolylmethane in the Context of Prostate Cancer Bone Metastasis. PLoS ONE. 2012;7:e33011. [ Links ]
50. Sun Q, Prasad R, Rosenthal E, Katiyar SK. Grape Seed Proanthocyanidins Inhibit the Invasiveness of Human HNSCC Cells by Targeting EGFR and Revesing the Epithelial-To-Mesenchymal Transition. PLoS ONE. 2012;7:e31093. [ Links ]
51. Sun Q, Prasad R, Rosenthal E, Katiyar SK. Grape seed proanthocyanidins inhibit the invasive potential of head and neck cutaneos squamous cell carcinoma by targeting EGFR expression and epithelial-to-mesenchymal transition. BCM Complementary & Alternative Medicine. 2011;11:134. [ Links ]
52. Zhao M, Ma J, Zhu HY, Zhang XH, Du ZY, Xu YJ, et al. Apigenin inhibits proliferation and induces apoptosis in human multiple myeloma cells through targeting the trinity of CK2, Cdc37 and Hsp90. Molecular Cancer. 2011;10:1-14. [ Links ]
53. Wang K, Liu R, Li J, Mao J, Lei Y, Wu J, et al. Quercitin induces protective autophagy in gastric cancer cells: Involvement of Akt-mTOR and hypoxia-induced factor 1α-mediated signaling. Autophagy. 2011;7:966-78. [ Links ]
54. Seo YJ, Kim BS, Chun SY, Park YK, Kang KS, Kwon TG. Apoptotic Effects of Genistein, Biochanin-A and Apigenin on LNCaP and PC-3 Cells by p21 through Transcriptional Inhibition of Polo-like Kinase-1. J Korean Med Sci. 2011;26:1489-94. [ Links ]
55. Sehrawat A, Singh SV. Benzil Isothiocyanate Inhibits Epithelial-Mesenchymal Transition in Cultured and Xenografted Human Breast Cancer Cells. Cancer Prev Res. 2011;4:1107-17. [ Links ]
56. Bottone FG, Alston-Mills B. The Dietary Compounds Resveratrol and Genistein Induce Activating Transcription Factor 3 While Suppressing Inhibitor of DNA Binding/Differentiation-1. Journal of Medical Food. 2011;14:584-93. [ Links ]
57. National Human Genome Research Insitute. National Human Genome Research Insitute. [Online]. 2011. Available from: http://www.genome.gov/. Cited: 2012 October 15. [ Links ]