Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.61 no.4 Bogotá Oct./Dec. 2013
ACTUALIZACIÓN
Propuesta de un protocolo de electro-estimulación para el tratamiento de úlceras por presión grado II y III
Proposal of electrical stimulation protocol for the treatment of pressure ulcers grade II and III
Paola Andrea Quiroga-Santamaría1; Claribeth Guarín-Corredor 1; Milton Forero-López2; Nancy Stella Landínez-Parra MSc3
1 Fisioterapia. Universidad Nacional de Colombia. Bogotá, Colombia.
2 Universidad Santo Tomás. Bogotá, Colombia.
3 Departamento del Movimiento Corporal Humano, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
Correspondencia: nslandinezp@unal.edu.co.
Recibido: 15/01/2013 / Aceptado: 11/09/2013.
Quiroga-Santamaría PA, Guarín-Corredor C, Forero-López M, Landínez-Parra NS. Propuesta de un protocolo de electro-estimulación para el tratamiento de úlceras por presión grado II y III. rev.fac.med. 2013;61:431-440.
Resumen
Antecedentes. El uso de estimulación eléctrica como terapia ayudante para la curación de heridas se remonta al año 1700. No obstante, a pesar de los avances científicos del siglo XX solo se conocen estudios experimentales hacia la década de los 70, cuando se inicia un proceso investigativo con el fin de conocer a mayor profundidad las propiedades eléctricas de la piel y el efecto que tiene la estimulación eléctrica en las reacciones fisiológicas de las células epidérmicas para aumentar y favorecer la curación de heridas.
Objetivo. Proponer un protocolo de electro-estimulación para el tratamiento de úlceras por presión grados II y III, con base en la mejor evidencia reportada.
Materiales y métodos. Búsqueda de artículos en diferentes bases de datos utilizando los títulos de términos médicos (Medical Subjects Headings) MESH, con la utilización de los vocablos "Wound Healing", "Pressure Ulcer" y el sub encabezado "Electrophysiology" y "Electrical Stimulation".
Resultados. Después de realizar el análisis de la información se presenta la fundamentación de los parámetros que contiene la propuesta del protocolo (tipo de corriente, forma de onda, intensidad, campo eléctrico, frecuencia); se sustenta el cambio de polaridad, ubicación de electrodos y tiempo de tratamiento.
Conclusión. Ante la heterogeneidad de parámetros en la aplicación de electro-estimulación en el proceso de cicatrización de úlceras por presión, se propone desde la evidencia, un protocolo de electro-estimulación fundamentado en los procesos biológicos, eléctricos y mecánicos de la piel.
Palabras clave: Úlcera por Presión, Estimulación Eléctrica, Cicatrización de Heridas, Electrofisiología (DeCS).
Summary
Background. The use of electrical stimulation as adjuvant therapy for wound healing dates back to 1700. However, despite the scientific advances of the twentieth century, experimental studies are known only since the 70s, when research process were initiated in order to study the electrical properties of the skin and the effect of electrical stimulation physiological responses of skin cells to enhance and promote wound healing.
Objective. To propose a protocol of electrical stimulation for the treatment of pressure ulcers grade II and III, based on the best evidence reported.
Materials and methods. Research of articles in different databases using the titles of medical terms (Medical Subject Headings) MESH, with the use of the words "Wound Healing", "Pressure Ulcer" and the sub-heading "Electrophysiology" and "Electrical Stimulation".
Results. The analysis of the information presented substantiation of the parameters contained in the proposed protocol (AC, waveform, intensity, electric field frequency) underlying the change in polarity, electrode location and time treatment.
Conclusion. Given the heterogeneity of parameters in the application of electrical stimulation on the healing process of pressure ulcers, an electro-stimulation protocol is proposed based on biological processes, electrical and mechanical skin.
Key words: Pressure Ulcer, Electric Stimulation, Wound Healing, Electrophysiology (MeSH).
Introducción
La piel es un órgano de tejido conectivo diseñado para proteger al organismo de agresiones físicas, químicas y del ambiente, además, garantiza el equilibrio interno del organismo participando en procesos de termorregulación, inmunológicos y regenerativos, entre otros. Cuando la integridad de este órgano es interrumpida se alteran sus funciones y mecanismos de recuperación, como se evidencia en las úlceras por presión (UPP). Este tipo de lesiones representan un problema de salud pública debido a su alta prevalencia en personas de edad avanzada o que han estado sometidas a procesos que han generado tiempos prolongados de inmovilización. Esto hace necesario el conocimiento de sus mecanismos de producción, sus implicaciones fisiológicas y fisiopatológicas, las cuales generan impacto en el aspecto psicosocial del individuo, su familia y su entorno.
Contrariamente a lo que se piensa la lesión inicial no se origina en la piel: esta se desarrolla en las capas musculares profundas y progresa hacia la piel. La elevación de la presión cutánea produce hipoxia tisular, como resultado de la disminución del flujo capilar. Las fuerzas de presión conducen también al deterioro de la eliminación de los metabolitos tóxicos, como los radicales libres, a causa de la obstrucción de las vénulas.
La lesión tisular inicial es seguida fisiológicamente por vasodilatación con la siguiente hiperemia, la que en ocasiones conduce de manera paradójica a un mayor daño tisular a través de la formación posterior de radicales libres (1).
Para el tratamiento de estas lesiones se ha hecho necesaria la búsqueda de diversas estrategias que favorezcan el proceso de cicatrización y disminuyan el tiempo de recuperación de las mismas. Para lograrlo se ha hecho uso de técnicas como los desbridamientos, apósitos, cierre quirúrgico mediante injertos o colgajos, procedimientos realizados por el equipo médico y de enfermería; sin embargo, es importante tener en cuenta que el tratamiento de este tipo de lesiones requiere un manejo integral que se logra con el trabajo de un equipo interdisciplinario del cual hace parte el fisioterapeuta, profesional que cuenta con variadas estrategias de intervención que favorecen el proceso de cicatrización en heridas crónicas como el laser, UV, ultrasonido y electro-estimulación, siendo esta última una modalidad terapéutica que utiliza las propiedades de la corriente eléctrica con el fin de favorecer procesos de curación (2-4).
La electro-estimulación es la aplicación de corriente eléctrica transmitida a través de un electrodo con el fin de producir reacciones biológicas y fisiológicas para favorecer la regeneración celular en procesos patológicos (5). El uso de estimulación eléctrica como terapia ayudante para la curación de heridas se remonta al año 1700, época en la cual se utilizaban las hojas de oro sobre las heridas abiertas para facilitar la curación (6). No obstante, a pesar de los avances científicos del siglo XX solo se conocen estudios experimentales hacia la década de los 70, cuando se inicia un proceso investigativo con el fin de conocer a mayor profundidad las propiedades eléctricas de la piel y el efecto que tiene la estimulación eléctrica en las reacciones fisiológicas de las células epidérmicas para aumentar y favorecer la curación de las heridas (7).
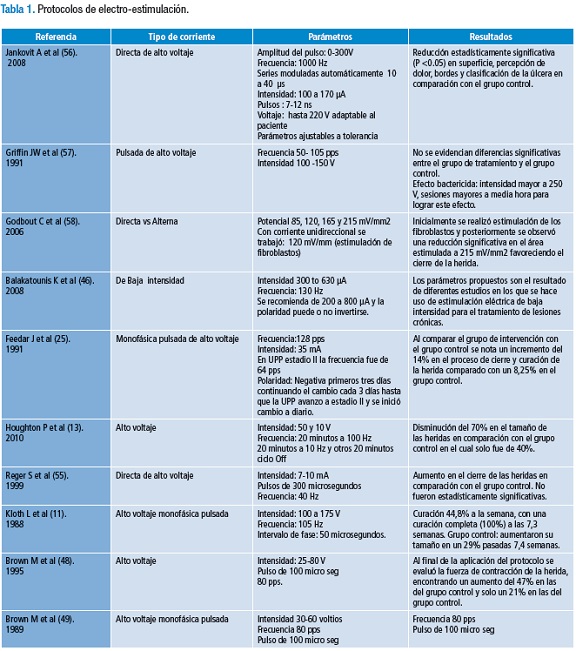
Edelberg y cols., (8) en 1977, determinaron mediante su estudio la capacidad eléctrica presente sobre la capa córnea, la cual genera un potencial transepitelial hasta la hipodermis favoreciendo el flujo de electrones y de células aumentando la permeabilidad de la membrana, concluyendo que la piel humana presenta características de material semiconductor, la cual al ser sometida a un campo eléctrico de tipo exógeno ve favorecidas sus propiedades de regeneración. A pesar de ser una de las modalidades más empleadas en el tratamiento de lesiones crónicas en seres humanos, se evidencia una gran variabilidad en los parámetros de su aplicación y en los objetivos alcanzados con su uso. En la tabla 1 se presentan algunos de los trabajos realizados que hacen uso de esta modalidad; sin embargo, muchos de los parámetros utilizados no especifican criterios claros de aplicación. Por ello, el objetivo de este estudio es proponer un protocolo de electro-estimulación para el tratamiento de úlceras por presión grados II y III basado en la revisión de la evidencia científica, no solo de los procesos de electro-estimulación sino del entendimiento del proceso de cicatrización desde su contexto mecánico, eléctrico y biológico.
Materiales y métodos
Estudio descriptivo propósito desarrollado a partir de tres fases: revisión de la literatura, clasificación y análisis de la información y diseño del protocolo con base en la mejor evidencia encontrada.
Revisión de la literatura
Esta permitió comprender el comportamiento biológico y mecánico de la piel, su conformación anatómica y su importancia funcional. De igual forma permitió analizar desde la teoría su comportamiento en condiciones de normalidad y ante la presencia de úlceras por presión, así como interpretar los diversos procesos de curación de las mismas, incluyendo las propiedades de la corriente eléctrica de alto voltaje y su aplicabilidad en los procesos de cicatrización de heridas.
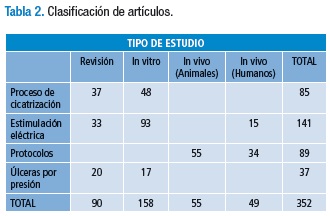
Para desarrollar esta búsqueda de literatura se utilizaron diferentes bases de datos, entre ellas: PubMed, MEDLINE, All EMB Reviews, Blackwell Sinergy, Doaj-Directory Of Open Access Journals, Dynamed, Nature.com, OVID-Journal, Springer Journal, Science Direct y JSTOR. La búsqueda se realizó con base en los títulos de términos médicos (Medical Subjects Headings) MESH, con la utilización de los vocablos "Wound Healing" y los sub-encabezados "Electrophysiology", "Pressure Ulcer" y "Electrical Stimulation"; para ello se empleó el conector boleano AND. Para efectos de la fundamentación del protocolo se emplearon en total 352 trabajos originales, los cuales fueron seleccionados por afinidad con el objetivo de esta investigación. La tabla 2 muestra la clasificación de los documentos utilizados.
Clasificación y análisis de la información
Durante esta fase se evaluaron, desde la evidencia, las características de los protocolos existentes de estimulación eléctrica aplicados en humanos con el propósito de establecer los parámetros de aplicación de un protocolo, teniendo en cuenta las propiedades de la corriente eléctrica de alto voltaje y los procesos de cicatrización de la piel.
Diseño del protocolo
Con base en la revisión previa, se diseñó el protocolo, teniendo en cuenta la mejor evidencia disponible, para seleccionar los parámetros necesarios que favorecen el proceso de cicatrización mediante el adecuado uso de la electroterapia.
Resultados
A continuación se presentan los parámetros de aplicación de un protocolo de electro-estimulación para mejorar el proceso de cicatrización en úlceras por presión.
Tipo de corriente
Se propone el uso de corriente eléctrica pulsada de alto voltaje; este tipo de estimulación se recomienda ampliamente en la literatura (9-12), dado que se caracteriza por brindar una estimulación con un voltaje por encima de los 200 V con una forma de onda monofásica y una duración de fase menor de 100 μs. Este tipo de electro-estimulación es utilizado en curación de heridas en piel con el fin de vencer la alta resistividad de la piel y aumentar la conductividad en este tejido. La impedancia total del circuito incluirá la fuente, la interface del electrodo y la piel.
La impedancia de la piel es la propiedad más difícil de vencer por ser este un tejido irregular, dependiente de factores ambientales y fisiológicos que varían en el tiempo. La capa córnea es la que produce la mayor resistividad por ser un tejido que se compone de células muertas que impiden el traspaso del flujo de corriente. Si el flujo de corriente para vencer la impedancia de la piel es de un voltaje menor a 200V se limita el flujo de corriente a través de este tejido, principalmente en la piel que se encuentra integra. Al ser pulsada y monofásica genera unos cambios electroquímicos a nivel celular, más específicamente en la membrana celular, en la cual se produce una reacción electroquímica entre la adenosin-trifosfatasa (ATPasa) y el adenosin-difosfato (ADP) originando la formación de ATP, con un aumento de la actividad enzimática de la misma. Estas reacciones celulares aumentan el flujo sanguíneo local e intentan restaurar el pH (11), acelerando los procesos de cicatrización.
Forma de onda
Se recomienda el uso de una onda de doble pico, determinado por la acción de despolarización y re-polarización necesaria para generar un potencial de acción a nivel trans-membranal. Este tipo de onda duplica el periodo de estimulación y la frecuencia de excitación aumentando el contenido galvánico que puede lesionar la célula; sin embargo, al llegar al valor instantáneo máximo y descender de forma inmediata contrarresta el efecto galvánico que se produce en mayor medida ante una señal de tipo cuadrada. Además, este tipo de señal asemeja la forma de onda del potencial de acción fisiológico generando una acción de galvanotaxis a nivel intra y extracelular aumentando la migración y direccionalidad de las células. La caída exponencial mitiga la acción de la señal, simulando el estado natural permitiendo la re-polarización de la membrana celular (12-14).
Intensidad
La capacitancia de la piel, especialmente de la epidermis determina el nivel de intensidad que debe entregarse al tejido para generar estimulación a nivel celular (15). En heridas, el líquido intersticial disminuye la resistencia del sistema al flujo de corriente permitiendo que a bajas intensidades se logren cambios celulares. El rango óptimo de intensidad para generar estos cambios está entre los 3 y 6 mA. Cheng y cols., (16) demostraron que en este rango se genera un aumento en la síntesis de proteínas y de ATP en las células epiteliales lo que acelera la actividad celular en las fases proliferativa y de maduración en el proceso de cicatrización.
Este nivel de intensidad facilita el transporte de calcio a través del potencial trans-membrana presente en la piel, el cual tiene un efecto positivo en la regulación, crecimiento y diferenciación de fibroblastos, ya que el calcio es un mensajero que participa en procesos de transducción de señal (17). La estimulación eléctrica a una intensidad de 3 a 6 mA incrementa la expresión del factor de crecimiento transformante β en los receptores de fibroblastos hasta 6 veces e incrementa la biosíntesis de colágeno por la homeostasis del calcio (18), factores determinantes en los procesos de inflamación y proliferación dentro de la cascada de cicatrización.
Frecuencia
La piel como barrera protectora innata posee características capacitantes que definen su comportamiento o respuesta ante estímulos eléctricos exógenos, como la estimulación eléctrica superficial, la cual es uno de los métodos empleados para el tratamiento de lesiones dérmicas (15). Sin embargo, para su adecuado uso terapéutico es necesario tener en cuenta aspectos como la impedancia de la piel, que juega un papel determinante en el efecto de la electro-estimulación como alternativa de tratamiento en lesiones dérmicas, ya que esta determina que factores como el voltaje y la frecuencia tengan las características necesarias para estimular la migración celular (11).
La impedancia de la piel está determinada por dos aspectos relevantes: la resistencia y la reactancia, las cuales en los tejidos biológicos inciden en procesos como la separación de cargas e influyen en los gradientes electroquímicos producidos por la membrana celular y por la interfase de los tejidos (19). Para la piel se han reportado valores de impedancia que varían entre 100 Ω y 1 MΩ de acuerdo a la frecuencia empleada y al tipo de piel (20).
La electro-estimulación disminuye la impedancia, gracias a que facilita el paso de iones cargados a través del estrato córneo, esta disminución es dependiente de la duración de la aplicación del estímulo y de la densidad de la corriente bajo el electrodo (21). En este aspecto, la reactancia, comprendida como el comportamiento de condensador de la membrana celular, es dependiente de la frecuencia de la señal, por ello a bajas frecuencias la reactancia es muy grande para permitir que el estímulo eléctrico atraviese la membrana celular, lo que hace que este sea conducido únicamente por los electrolitos, disminuyendo el efecto deseado (22). A bajas frecuencias (1-10 kHz) el estímulo solo alcanza la membrana celular, la cual actúa como un mecanismo aislante, razón por la cual el flujo de corriente se desplaza por los fluidos extracelulares, en contraste ante el uso de altas frecuencias (50-110 kHz), en donde el flujo logra atravesar la membrana, con lo cual se obtiene el efecto electroquímico requerido para favorecer el proceso de cicatrización (23).
Partiendo de estos principios característicos de la piel y teniendo en cuenta su impedancia, es necesario el uso altas frecuencias que se encuentren en el rango de 50 a 110 kHz, para disminuir la impedancia y entregar a nivel celular el flujo necesario para estimular la migración celular.
Campo eléctrico
Se entiende por campo eléctrico aquel espacio de fuerza creado por la atracción o repulsión de cargas eléctricas. La piel, al tener un comportamiento eléctrico específico maneja un campo eléctrico endógeno de 100 mV/mm (24); adicionalmente estudios in vitro reflejan que la migración celular de los queratinocitos y la estimulación de formación de colágeno mediante la aplicación de electro-estimulación exógena se produce ante campos eléctricos superiores a los 100 mV/mm (25,26). Esta migración de queratinocitos incrementa la fuerza tensil de la lesión, factor que estimula la migración de los fibroblastos lo que garantiza la producción de matriz extracelular de calidad y la activación de la fase de proliferación.
Ubicación y distancia de los electrodos
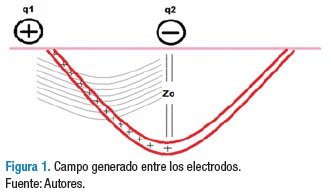
El nivel de fuerza generado entre dos cargas eléctricas (q1 y q2) separadas a una distancia r dependerá de la atracción o repulsión de estas. Si el sistema utiliza dos cuerpos con la misma carga, se repelen, mientras que si utiliza cargas opuestas estas se atraerán permitiendo crear fuerzas de campo eléctrico (27) (Figura 1). La carga eléctrica generada a través de los electrodos dependerá de la ubicación de estos en el espacio. El flujo de corriente de un electrodo a otro permitirá que los tejidos estimulados a una u otra carga se polaricen por la atracción que se crea entre el polo positivo y negativo. Por otra parte, la impedancia del sistema afecta el flujo de corriente (a alta impedancia menor flujo), por tanto es necesario disminuir la resistencia que tiene el tejido al paso de la corriente para que ésta tenga un mayor efecto a nivel celular (28).
La ubicación del electrodo activo (ya sea de polaridad positiva o negativa) sobre la herida permitirá generar un flujo de corriente entre este y el dispersivo; esta actividad eléctrica de naturaleza exógena estimula las células inactivas que se encuentran en el borde de la herida, impulsando en ellas el proceso de galvanotaxis con el fin de invadir el espacio vacío de la herida e iniciar el proceso de cicatrización normal (29). Para que este proceso se genere de forma más efectiva es necesario utilizar un medio de características isotónicas, el cual disminuye la impedancia del tejido que proporciona un medio eléctricamente conductor (30). Por otra parte, la distancia entre los electrodos afecta la profundidad y el trayecto de la corriente, a menor distancia, más superficial el paso de la corriente, cuanto mayor sea la distancia la corriente se desplazará a mayor profundidad, lo cual nos orienta la ubicación de los mismos, dependiendo de la profundidad de la lesión (31,32).
Cambio de polaridad
La superficie de la piel humana (estrato córneo) presenta una carga negativa en comparación a las capas subyacentes; el intercambio iónico entre el ion sodio y el ion cloruro que se genera por la transpiración a través de las células epidérmicas, permite que el ion sodio cargado positivamente sea bombeado hacia el interior del tejido, mientras que el ion cloruro cargado negativamente se sitúe en el exterior del tejido (33). Cuando se produce una herida, se genera un cambio en la polaridad, creando un campo eléctrico dentro de la herida con carga positiva y en la piel circundante con carga negativa; esto produce una corriente bio-eléctrica que facilita el proceso de curación. Estudios in vitro (34,35) sugieren que la aplicación de estimulación eléctrica de forma exógena intensifica la acción de la corriente endógena, aumentando la migración celular mediante el proceso de galvanotaxis.
La ubicación de los electrodos es un factor relevante ya que garantiza que el voltaje administrado de forma exógena, genere el campo eléctrico necesario para promover la migración celular (36). El proceso de galvanotaxis, activado por la estimulación exógena, permite que diversas células implicadas en el proceso de cicatrización se estimulen y migren hacia alguno de los polos de atracción (negativo o positivo) dependiendo de la carga natural de cada célula (37,38). Cuando la herida se encuentra en un proceso inflamatorio o infeccioso se busca estimular la galvanotaxis, la cual facilita que los neutrófilos activados que presentan una carga positiva sean atraídos al electrodo negativo, a fin de que estos inicien el proceso de eliminación de bacterias y material muerto del área de lesión (39).
Finalizado el proceso de inflamación, se busca estimular el proceso de proliferación y activación del tejido de granulación mediado por la acción de los fibroblastos, miofibroblastos y queratinocitos, células que presentan una carga positiva y que serán atraídas por el electrodo de carga negativa (40-42). Por último, se busca promover la activación de células epidérmicas, las cuales generan la contracción y le dan resistencia a la herida; estas presentan carga negativa siendo atraídas por el electrodo con carga positiva (43). No obstante, el cambio de polaridad debe realizarse cada tercer día con el fin de evitar alteraciones de temperatura y pH que puede generar daño celular y quemaduras químicas (44).
Tiempo de sesión y días a la semana
La piel presenta características de material semiconductor, factor que incide en la frecuencia y en el tiempo de sesión, pues a medida que transcurre el tiempo de estímulo los valores de la impedancia tienden a disminuir como resultado del intercambio iónico entre el electrolito y la piel, el sudor y la humedad en el ambiente, entre otros. Estos factores incrementan la conductividad de la piel con la consiguiente disminución en la impedancia como lo reporta Allenby (45), quien reporta que transcurridos 20 minutos de electro-estimulación se evidencia que la impedancia de la piel disminuye obligando a modificar la frecuencia y el tiempo de intervención con el objetivo de no generar lesión tisular. Por tanto, el tiempo de aplicación de cada sesión estará estipulado en 20 minutos de tratamiento.
Considerando la importancia de la continuidad del proceso de cicatrización y el papel que desempeña la electro-estimulación en el mismo, se analizaron estudios como los de Balakatounis (46), Feedar (47), Brown (48,49), los cuales hacen uso de electro-estimulación en procesos de cicatrización de heridas crónicas, se propone una intensidad de tratamiento de entre cinco a siete días. Por efectos de la atención clínica, se propone que el tratamiento se realice cinco días a la semana, hasta completar el tiempo total de tratamiento.
Tiempo total de tratamiento
Cada una de las fases propias del proceso toma un tiempo determinado. Así, el lapso comprendido entre el inicio de la fase de inflamación y la culminación de la fase de proliferación alcanza en total 20 días dentro de los cuales se produce la mayor actividad celular (7). El tratamiento con electro-estimulación busca acelerar el proceso normal de cicatrización, mediante la activación del campo eléctrico endógeno, por tanto el tiempo total de tratamiento se estipulara en 20 días, o menos si antes de este tiempo se produce un cierre total de la UPP, estableciendo como limite la resolución de la fase de proliferación debido a que el desarrollo de la fase de maduración puede tomar hasta 18 meses.
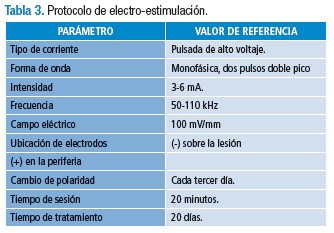
La tabla 3 presenta de manera resumida los parámetros propuestos para el protocolo de electro-estimulación en el manejo de UPP.
Discusión
La utilización de estimulación eléctrica para favorecer el proceso de cicatrización es un campo de investigación de alta trascendencia, especialmente en las últimas décadas; sin embargo, la gran variabilidad en los parámetros de estimulación ha dificultado la utilización de esta técnica en la práctica clínica. Estudios in vitro e in vivo, en animales y humanos, han intentado hacer un acercamiento a los parámetros "ideales" de estimulación, relacionando la efectividad del tratamiento con la aceleración y cierre temprano de la herida (48-51).
En los estudios in vitro se ha observado el efecto de la electro-estimulación en cultivos celulares, principalmente en fibroblastos y células epidérmicas; en estos se han demostrado el efecto de la corriente eléctrica exógena con magnitudes similares a la de tipo endógena. La mayoría de estos muestran un cambio en la actividad metabólica y de quimiotaxis celular. Dunn (50) demostró la actividad de fibroblastos y síntesis de colágeno al aplicar una estimulación con corriente directa en la piel de conejillos de indias; la proliferación de los fibroblastos y la alineación de fibras de colágeno tenía un aumento notable en comparación con el grupo control.
Goldman y Pollack (51) estudiaron el efecto de la estimulación eléctrica sobre fibroblastos de seres humanos; sus resultados demostraron que una fuerza de campo entre 31 y 50 mV/mm a una frecuencia de 10 Hz aumenta la migración y alineación de fibroblastos. En este contexto, las células epidérmicas juegan un papel en la contracción y cierre de la herida; Cooper y Schliwa (38) demostraron la migración de células epidérmicas utilización corriente directa a 50 mV/mm.
Estudios en animales in vivo han demostrado la efectividad de la estimulación eléctrica en el aumento de la fuerza tensil de la herida: Thawer y Houghton (52) demostraron en su estudio un aumento en el depósito de colágeno en heridas hechas en piel de ratones. Bach y cols., (53) realizaron un estudio en heridas cutáneas de profundidad total en ratas, con estimulación de corriente directa y corriente alterna; sus resultados indicaron que ninguno de estos tipos de estimulación tuvo efectos significativos sobre la fuerza tensil de las heridas en comparación con los controles, pero sí se evidenció un incremento en el reclutamiento de colágeno en la herida y alrededor de ella en los grupos de estimulación. Reger y cols., (54) investigaron el uso de estimulación con corriente continua y alterna en un modelo de UPP en piel de cerdos, los dos tipos de estimulación aceleraron el proceso de cicatrización; sin embargo, la estimulación con corriente continua aumentó la contracción de la herida en comparación con el grupo estudio de corriente alterna y el control.
Ensayos clínicos han intentado demostrar la efectividad de la electro-estimulación en heridas que no cicatrizan o que demoran en cicatrizar. Feedar y cols., (25) realizaron un estudio aleatorizado doble ciego en el que tomaron 50 heridas, estas se encontraban en ubicaciones diferentes y en estadíos entre el II y IV; 26 heridas se evaluaron en el grupo de tratamiento, las úlceras se clasificaron según el estado de infección de la herida determinando el tipo de estimulación. Las heridas infectadas se estimularon con corriente pulsada a 128 pps (pulsos por segundo), con una intensidad de 35 mA y con el electrodo negativo dentro de la herida, cuando la infección se eliminó, se alternó la polaridad cada tres días hasta que la herida cicatrizó. Houghton y cols., (55) realizaron un ensayo clínico controlado con 42 úlceras; el protocolo se estipuló a 150 V, 100 pps, con una duración de 45 minutos, 3 veces por semana durante 4 semanas. Se utilizó electrodo negativo dentro de la herida sin inversión de la polaridad. Las heridas del grupo tratamiento disminuyeron en promedio 44% el tamaño en comparación con el grupo control.
Como se demostró anteriormente, numerosos estudios han intentado determinar los parámetros básicos de estimulación eléctrica en la cicatrización de heridas; sin embargo, la falta de homogeneidad en la investigación limita los alcances de los resultados. Al revisar la bibliografía uno de los principales problemas es el tipo de estrategia utilizada, debido a que cada estudio determina una forma de tratamiento independiente, con gran variación en los parámetros y con muestras pequeñas lo que dificulta la extrapolación de los estudios a otras poblaciones.
Conclusiones
La piel, como tejido biológico, presenta características de material dieléctrico. Ante la presencia de una lesión, este mecanismo se altera produciéndose un corto circuito. El proceso de cicatrización, al ser continuo y mediado por diversos factores que favorecen el desarrollo de cada una de sus fases, se ve alterado ante las presencia de lesiones crónicas como las UPP. Para su manejo se han empleado diversas estrategias, como los hidrocoloides, desbridamientos y modalidades físicas como la electro-estimulación, ya que esta tiene la capacidad de restablecer el campo endógeno a partir de un estimulo eléctrico exógeno.
La revisión realizada evidencia que aún no hay un verdadero consenso acerca de los efectos de la electro-estimulación en la aceleración del proceso de cicatrización en UPP. Ante la heterogeneidad de parámetros en la aplicación de electro-estimulación en el proceso de cicatrización de UPP, se propone, desde la evidencia, un protocolo de electro-estimulación fundamentado en los procesos biológicos, eléctricos y mecánicos de la piel.
Conflicto de interés
Los autores declaran no tener ningún tipo de conflicto de interés.
Financiación
El proyecto recibió financiación parcial de la Dirección de Investigación de la Universidad Nacional sede Bogotá (DIB).
Agradecimientos
Los autores desean agradecer a la DIB quienes financiaron parcialmente el proyecto a través de la convocatoria "Semilleros de creación e investigación" en la modalidad de apoyo a trabajos de investigación o creación en el país. Código: 14996.
Referencias
1. Wassermann E, van Griensven M, Gstaltner K et al. A chronic pressure ulcer model in the nude mouse. Wound Repair Regen. 2009;17(4):480-4. [ Links ]
2. Falanga V. Chronic wounds: pathophysiologic and experimental considerations. J Invest Dermatol. 1993;100(5):721-5. [ Links ]
3. Niitsuma J, Yano H, Togawa T. Experimental study of decubitus ulcer formation in the rabbit ear lobe. J Rehabil Res Dev. 2003;40(1):67-73. [ Links ]
4. Peirce S, Skalak T, Rodeheaver G. Ischemia-reperfusion injury in chronic pressure ulcer formation: A skin model in the rat. Wound Repair Regen. 2000;8:68-76. [ Links ]
5. Ojingwa J, Isseroff R. Electrical stimulation of wound healing. J Invest Dermatology. 2003;121:1-12. [ Links ]
6. Shaw T, Martin J. Wound repair at a glance. J Cell Sci. 2009;122:3209-13. [ Links ]
7. Velnar T, Baley T, Smrkolj V. The wound healing process: an overview of the cellular and molecular mechanisms. J Int Med Res. 2009;37:1528-42. [ Links ]
8. Edelberg R. Relation of Electrical Properties of Skin to Structure and Physiologic State. J Invest Dermatology. 1977;69:324-7. [ Links ]
9. Jankovic A, Binic I. Frequency rhythmic electrical modulation system in the treatment of chronic painful leg ulcers. Arch Dermatol Res. 2008;300(7):377-83. [ Links ]
10. Griffin J, Tooms R, Mendius R et al. Efficacy of high voltage pulsed current for healing of pressure ulcers in patients with spinal cord injury. Phys Ther. 1991; 71(6):433-42. [ Links ]
11. Kloth L, Feedar J. Acceleration of wound healing whith high voltage monophasic pulsed current. Phys Ther. 1988;68(4):503-8. [ Links ]
12. Reilly J. Applied biolectricity: from electrical stimulation and electrophatology. 2da ed. New York (Estados Unidos): Springer; 1998. [ Links ]
13. Houghton P, Campbell K, Fraser C et al. Electrical Stimulation Therapy Increases Rate of Healing of Pressure Ulcers in Community-Dwelling People With Spinal Cord Injury. Arch Phys Med Rehabil. 2010;91:669-78. [ Links ]
14. Bronzino J. The Biomedical Engineering Handbook. 2da ed. Florida (Estados Unidos): Springer; 2000. [ Links ]
15. Gault W, Gatens P Jr. Use of low intensity direct current in management of ischemic skin ulcers. Phys Ther. 1976;56(3):265-9. [ Links ]
16. Cheng N, VanHoof H, Bock E. The effects of electric currents on ATP generation, protein synthesis, and membrane transport in rat skin. Clin Orthop Relat Res. 1982;171:264-72. [ Links ]
17. Mitchell P. Vectorial chemistry and molecular mechanism of chemiosmosis coupling: power transmission by proticity. Biochem Soc Trans. 1976;4:400-30. [ Links ]
18. Wood J, Schallreuter K, Jacobson W. A Multicenter Study on the Use of Pulsed Low-Intensity Direct Current for Healing Chronic Stage II and Stage III Decubitus Ulcers. Arch Dermatol. 1993;129(8):999-1009. [ Links ]
19. Lukaski H. Biological indexes considered in the derivation of the bioelectrical impedance analysis. J Clin Nutr. 1996;64:397S-404S. [ Links ]
20. Rosell J, Colominas J, Riu P et al. Skin Impedance From 1 to 1 MHz. Transactions on medical engineering. 1988;35:649-51. [ Links ]
21. Scott B, Flood J. Measurement of soft tissue temperature and impedance following the application of transdermal direct current. Physiotherapy. 2007;93(2):114-20. [ Links ]
22. Chumlea W, Guo S. Bioelectrical Impedance and Body Composition: Present Status and Future Directions. Nutr Rev. 1994;52(4):123-31. [ Links ]
23. Kyle U, Bosaeus I, De Lorenzo A et al. Bioelectrical impedance analysis- part I: review of principles and methods. Clin Nutr. 2004;23:1226-43. [ Links ]
24. Zhao M. Electrical fields in wound healing-An overriding signal that directs cell migration. Semin Cell Dev Biol. 2009;20(6):674-82. [ Links ]
25. Feedar J, Kloth L, Gentzkow G. Chronic dermal ulcer healing enhanced with monophasic pulsed electrical stimulation. J Phys Ther. 1991;71:639-49. [ Links ]
26. Sheridan D, Isseroff R, Nuccitelli R. Imposition of a physiologic DC electric field alters the migratory response of human keratinocytes on extracellular matrix molecules. J Invest Dermatol. 1996;106(4):642-6. [ Links ]
27. Ramtani S. Mechanical modelling of cell/ECM and cell/cell interactions during the contraction of a fibroblast-populated collagen microsphere: theory and model simulation. J Biomech. 2004;37(11):1709-18. [ Links ]
28. Nordenström B. Evidence and Necessity for Biologically Closed Electric Circuits (BCEC) in Healing, Regulation and Oncology. Integr Physiol Behav Sci. 1992;27(4):285-303. [ Links ]
29. El-Sheemy M, Muir I, Wheatley D, et al. Inhibition of the contraction of collagen gels by extracts from human dermis. Cell Biol Int. 2001;25(7):635-42. [ Links ]
30. Horch R, Kopp J, Kneser U et al. Tissue engineering of cultured skin substitutes. J Cell Mol Med. 2005;9(3):592-608. [ Links ]
31. Cameron M. Agentes Físicos en Rehabilitación: de la Investigación a la práctica. 7 Ed. Elsevier; 2009. [ Links ]
32. Watson T. Electroterapia: práctica basada en la evidencia. 12 Ed. Elsevier; 2009. [ Links ]
33. Barker A, Jaffe L, Vanable J. the glabrous epidermis of cavies contains a powerful battery. Am J Physiol. 1982;242:358-66. [ Links ]
34. Mycielska M, Djamgoz M. Cellular mechanisms of direct-current electric field effects: galvanotaxis and metastatic disease. J Cell Sci. 2004;117(9):1631-9. [ Links ]
35. Trollinger D, Isseroff R, Nuccitelli R. Calcium channels blockers inhibit galvanotaxis in human keratinocytes. J Cell Physiol. 2002;193:1-9. [ Links ]
36. Kloth L. Electrical stimulation for wound healing: a review of evidence from in vitro studies, animal experiments, and clinical trials. Int J Low Extrem Wounds. 2005;4(1):23-44. [ Links ]
37. Canaday D, Lee R. Scientific basis for clinical application of electric fields in soft tissue repair. In: Brighton C, Pollack S, Electromagnetics in biology and medicine. San Francisco: San Francisco Press; 1991. [ Links ]
38. Cooper M, Schliwa M. Electrical and ionic controls of tissue cell locomotion in DC electic fields. J Neurosci Res. 1985;13:233-44. [ Links ]
39. Orida N, Feldman J. Directional protrusive pseudopodial activity and motility in macrophages induced by extra-cellular electric fields. Cell Motil. 1982;2:243-55. [ Links ]
40. Eberhardt A, Szczypiorski P, Korytowski G. Effect of transcutaneous electrostimulation on the cell composition of skin exudate. Acta Physiol Pol. 1986;37(1):41-6. [ Links ]
41. Kloth L, Feedar J. Wound Healing: Alternatives in Management Contemporary Perspectives in Rehabilitation. Ed 2ª. Philadelphia; 1995. [ Links ]
42. Bourguignon G, Wenche J, Bourguignon L. Electric stimulation of human fibroblasts causes an increase in Ca2+ influx and the exposure of additional insulin receptors. J Cell Physiol. 1989;140(2):397-85. [ Links ]
43. Stromberg B. Effects of electrical currents on wound contraction. Ann Plast Surg. 1988;21(2):121-3. [ Links ]
44. Nishimura K, Isseroff R, Nuccitelli R. Human keratinocytes migrate to the negative pole in direct current electric fields comparable to those measured in mammalian wounds. J Cell Sci. 1996;109:199-207. [ Links ]
45. Allenby A, Fletcher J. The effect of heat, pH and organic solvents on the electrical impedance and permeability of excised human skin. Br J Dermatol. 2006;81(s4):31-9. [ Links ]
46. Balakatounis K, Angoules A. Low-intensity Electrical Stimulation in Wound Healing: Review of the Efficacy of Externally Applied Currents Resembling the Current of Injury. Journal of Plactic Surgery. 2008;8:283-91. [ Links ]
47. Feedar J, Kloth L, Gentzkow G. Monophasic Pulsed Electrical Stimulation Chronic Dermal Ulcer Healing Enhanced with. Phys Ther. 1991;71:639-49. [ Links ]
48. Brown M, Gogia P, Sinacore D et al. High-Voltage Galvanic Stimulation on Wound Healing in Guinea Pigs: Longer-Term Effects. Arch Phys Med Rehabil. 1995;76(12):1134-7. [ Links ]
49. Brown M, McDonnell M, Menton D. Polarity effects on wound healing using electric stimulation in rabbits. Arch Phys Med Rehabil. 1989;70(8):624-7. [ Links ]
50. Dunn M. Wound healing using collagen matrix: Effect of DC electrical stimulation. J Biomed Mater Res. 1988;22:191-206. [ Links ]
51. Goldman R, Pollack S. Electric fields and proliferation in a chronic wound model. Bioelectromagnetics. 1996;17(6):450-7. [ Links ]
52. Thawer H, Houghton P. Effects of electrical stimulation on the histological properties of wounds in diabetic mice. Wound Repair Regen. 2001;9(2):107-15. [ Links ]
53. Bach S, Bilgrav K, Gottrup F et al. The effect of electrical curren on skin incision. Eur J Surg. 1991;157:171-4. [ Links ]
54. Reger S, Hyodo A, Negami S, Kambic H et al. Experimental Wound healing with electrical stimulation. J Blackwell Science. 1999;23(5):460-2. [ Links ]
55. Houghton P, Kincaid C, Lovell M et al. Effect of electrical stimulation on chronic leg ulcer size and appearance. Phys Ther. 2003;83(1):17-28. [ Links ]
56. Jankovit A, Binit I. Frequency rhythmic electrical modulation system in the treatment of chronic painful leg ulcers. Arch Dermatol Res. 2008;300:377-83. [ Links ]
57. Griffin JW, Tooms RE, Mendius A et al. Efficacy of High Voltage Pulsed Current for High of Pressure Ulcers in Patients with Spinal Cord Injury. Phys Ther. 1991;71:433-44. [ Links ]
58. Godbout C, Frenette J. Periodic Direct Current Does Not Promote Wound Closure in an In Vitro Dynamic Model of Cell Migration. Phys Ther. 2006;86:50-9. [ Links ]