Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.62 no.2 Bogotá Apr./June 2014
https://doi.org/10.15446/revfacmed.v62n2.45417
http://dx.doi.org/10.15446/revfacmed.v62n2.45417
Artículo de revisión
Mecanismos inmunológicos implicados en la patología del asma alérgica
Immunologic mechanisms involved in the pathology of allergic asthma
Freddy Alexander Pazmiño1; Myriam Lucia Navarrete-Jiménez2
1 Facultad de Medicina Universidad Nacional de Colombia. Bogotá, Colombia.
2 Departamento de Microbiología, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
Correspondencia: Myriam Lucia Navarrete-Jiménez. Dirección: Facultad de Medicina, Universidad Nacional de Colombia. Avenida Carrera 30 No. 45. Bogotá, Colombia. Teléfono:+57 3165000, Ext. 15016-15039.
Correo electrónico: mlnavarretej@unal.edu.co
Pazmiño FA, Navarrete-Jiménez ML. Mecanismos inmunológicos implicados en la patología del asma alérgica. rev.fac.med. 2014;62:265-277.
Recibido: 11/11/2013 / Aceptado: 29/05/2014
Resumen
El asma es una enfermedad que afecta a personas de todas las edades. La OMS estima que en la actualidad afecta a 235 millones personas en todo el mundo. Para Colombia se estima que la prevalencia de esta enfermedad es aproximadamente del 12%. El asma se caracteriza por una inflamación de las vías respiratorias y por cambios estructurales en los tejidos de las mismas: como hiperplasia epitelial de las células caliciformes, depósito de colágeno subepitelial e hipertrofia del músculo liso. La inmunopatología del asma alérgica involucra tanto la respuesta humoral como la celular, que colectivamente llevan a un estado de hiperreactividad de la vía respiratoria (AHR). Las células que, en el momento, están implicadas en la cascada inflamatoria del asma atópica son: células epiteliales de la vía aérea, las diferentes subpoblaciones de células T y B, mastocitos, células dendríticas, eosinófilos, basófilos, macrófagos, células iNKT y plaquetas, además de la red de citoquinas, quimioquinas y señales co-estimulatorias y regulatorias correspondientes a cada una de las subpoblaciones celulares que orquestan este proceso. Este artículo revisa algunos de los procesos celulares y moleculares más importantes e implicados en la inmunopatogénesis del asma atópica.
Palabras clave: Asma, Inmunoglobulina E, Mastocitos, Eosinófilos (DeCS).
Summary
Asthma is a disease that affects people of different ages. The WHO estimates that it actually affects around 235 million people around the world, while in Colombia it estimates that is present in about 12% of the population. Asthma is characterized by an airway inflammation and a change in the structural tissue of the respiratory system as: caliciform cells epithelial hyperplasia, subepithelial collagen deposits and airway smooth muscular hypertrophy. Immunopathology of allergic asthma involves humoral and cell mediated immune response, altogether induces a state of airway hyperresponsiveness (AHR).
Inflammatory cells involved in atopic asthma are: airway epithelial cells, different sub-populations of T y B cells, mast cells, dendritic cells, eosinophils, basophils, macrophages, iNKT cells and platelets, as well as cytokines, chemokines and costimulating and regulating signals. The present paper analyses some cellular and molecular processes, considered as the most important related to the immunopathology of atopic asthma.
Key words: Asthma, Immunoglobulin E, Mast Cells, Eosinophils (MeSH).
Introducción
El asma es un síndrome complejo con muchos fenómenos clínicos en los adultos y en los niños. Sus características son: obstrucción al flujo del aire, hiperreactividad e inflamación de las vías respiratorias (airway hyperreactivity, AHR) (1,2). También se define como una reacción de hipersensibilidad tipo 1, provocada por la re-exposición a un tipo específico de antígeno conocido como alergeno (3), o se asume como un trastorno de la conducción de las vías aéreas principales con una obstrucción variable al flujo del aire en asociación con una hiperreactividad bronquial (4).
En términos patológicos, se caracteriza por inflamación de las vías respiratorias y por cambios estructurales en sus tejidos, como hiperplasia epitelial de las células caliciformes, depósito de colágeno subepitelial e hipertrofia del músculo liso, que colectivamente se llama remodelación de la vía respiratoria (5). La heterogeneidad de la enfermedad ha sido reconocida por muchos años y existen varias formas distintas de asma, incluyendo el asma alérgica (que es la forma más común), la inducida por ejercicio, aspirina, polución del aire, infecciones virales, entre otras (6).
Actualmente, el asma afecta a más de 300 millones de personas en el mundo. En Estados Unidos la prevalencia en adultos es de 7,7% y en niños de 9,6%, con valores similares en países desarrollados (7). La prevalencia de síntomas de asma en Colombia para el 2010 era de 12%, resultados que parecen haber aumentado con respecto a los obtenidos hace 11 años, en los cuales era de 10% (8).
Esta enfermedad afecta a personas de todas las razas, grupos étnicos y etáreos del mundo; los niños están más ligeramente afectados que las niñas y, después de la pubertad, afecta más a mujeres que a hombres (9). La enfermedad puede tener un origen en la infancia, por lo cual están implicados factores genéticos y medioambientales que contribuyen a su inicio y evolución. Entre los factores genéticos han sido identificados más de 100 genes mayores y menores de susceptibilidad: alelos HLA específicos, polimorfismo del receptor FceRI-fí, IL-4, CD14 y de otros loci.
Entre los factores medioambientales están: virus, vacunas, sensibilización a alérgenos, higiene excesiva, familia reducida, tratamiento antibiótico en los dos primeros años de vida y la exposición ocupacional. En los individuos susceptibles, los factores medioambientales causan episodios recurrentes de sibilancias, disnea, opresión torácica y ataques de tos, asociados con la obstrucción reversible al flujo aéreo de diferentes grados de severidad (2,6,10).
Los linfocitos T colaboradores (LThCD4+) y sus productos de secreción tienen un papel central en la orquestación de la respuesta inflamatoria única en la vía respiratoria de asmáticos; los LTh2 específicos de antígeno generan esta respuesta mediante la secreción de citoquinas como IL-4, IL-13, IL-5 e IL-9. Se ha demostrado que los LTh17 están implicados en el asma inflamatoria induciendo neutrofilia (6,11). La IL-13 tiene un papel clave en la producción y liberación de histamina, en la AHR, hipersecreción de moco, fibrosis subepitelial e infiltrado eosinofílico (10). Para tratar y prevenir el asma, las drogas más comúnmente utilizadas son los glucocorticoides, usados en combinación con Beta-agonistas y ocasionalmente con otros antinflamatorios (12).
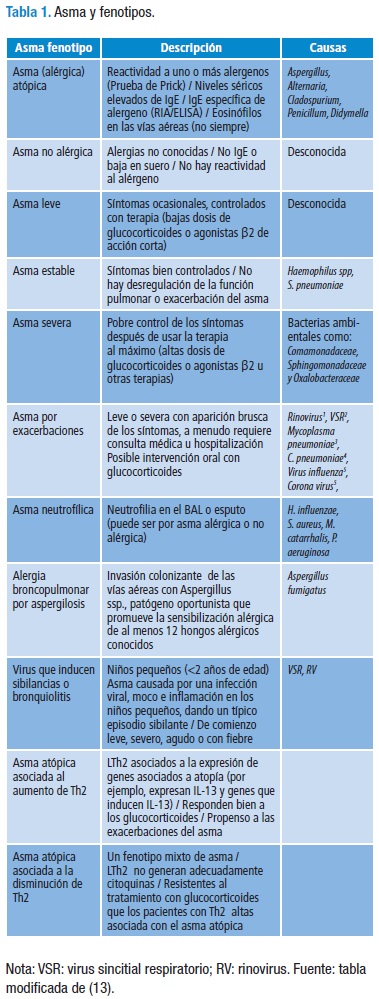
El asma es una enfermedad común y parte del debate médico se centra en establecer si se trata de una sola enfermedad o de un grupo de enfermedades. Recientemente, se ha dividido en fenotipos separados, subdivididos en varios endotipos y las propiedades visibles aplicadas para la clasificación son: clínicas, alérgicas y fisiopatológicas. Estos diferentes fenotipos pueden variar en la respuesta al tratamiento, pronóstico, patrones de inflamación y susceptibilidad a la exposición ambiental (Tabla 1) (13-15). Esta revisión se centra en aspectos inmunopatológicos en el asma alérgica o atópica.
Dado lo anterior, es pertinente señalar los siguientes elementos que entran en la definición de esta enfermedad:
- Rinovirus: causa más frecuente de asma por exacerbación en niños <2años; personas entre 6 y 17 años de edad y adultos.
- Virus sincitial respiratorio humano mayor prevalencia en niños <2años.
- Mycoplasma pneumoniae mayor prevalencia en personas entre 6 y 17 años de edad.
- Chlamydophila pneumoniae tiene prevalencia en personas entre 6 y 17 años de edad y en adultos.
- Virus influenza y Coronavirus mayor prevalencia en adultos.
Epidemiología
La Organización Mundial de la Salud (OMS) estima que, a la fecha, 235 millones de personas del mundo sufren de asma. La prevalencia e incidencia son muy altas en el mundo occidental y sigue aumentando en países desarrollados. Esta enfermedad afecta a personas de todas las edades, siendo su prevalencia mayor entre los niños-jóvenes menores de 18 años (9,3%) que entre los adultos (7,3%); afecta la vida del paciente y la de su familia, incluida su calidad de vida, productividad en el trabajo y en la escuela, uso de los servicios de salud e, incluso, puede ocasionar la muerte. Se ha determinado que el costo del asma en Estados Unidos fue de 56 billones de dólares para el 2007, con pérdidas de la productividad por morbilidad estimadas en 3,8 billones y de la productividad por mortalidad en 2,1 billones (16).
En América Latina, constituye un problema de salud pública que afecta a niños y adolescentes en áreas urbanas. En Colombia, el 70% de su población vive en zonas urbanas, donde cerca de 30% vive en grandes ciudades como Bogotá, Cali, Medellín y Barranquilla; en estas zonas, el asma es la enfermedad crónica más común en niños y la sensibilización a IgE por ácaros es el sello en muchos pacientes (17). La prevalencia de los síntomas varía entre ciudades y por grupo etáreo, pero tienden a ser similares entre géneros.
Aspectos inmunológicos
Receptores tipo Toll-like (TLR)
Son una familia de receptores transmembrana tipo 1 con un dominio extracelular que contiene repeticiones ricas en leucina, uno transmembrana y uno citoplasmático conservado llamado dominio de homología toll/interleuquinal (TIR); son receptores de reconocimiento de patrón (PRRs) que juegan un papel crítico en la activación del sistema inmune innato, mediante la activación de vías de señalización proinflamatorias en respuesta a patógenos bacterianos. Se conocen por lo menos 13 miembros de la familia TLRs identificados y caracterizados en los mamíferos.
TLR1 a TLR9 son conservados tanto en humanos como en ratones. TLR10 se expresa en humanos y TLR11 a TLR13 están presentes en ratones. Los TLR se expresan principalmente en células del sistema inmune: monocitos, macrófagos, células dendríticas (CDs) y LB. Sin embargo, también se expresan en células no inmunes: células epiteliales, endoteliales y fibroblastos. TLR1, TLR2, TLR4, TLR5, TLR6 y TLR11 se expresan en la superficie celular, mientras que TLR3, TLR7, TLR8 y TLR9 en vesículas intracelulares como endosomas, lisosomas y retículo endoplásmico (18-20).
Epitelio de la vía aérea
Es el primer punto de contacto para la invasión de patógenos y de antígenos inhalados, actúa como una barrera física, contribuye en la defensa del hospedero a través de la producción de péptidos antimicrobianos y de citoquinas, quimioquinas y metabolitos del ácido araquidónico que inician el reclutamiento de fagocitos, desencadenando la cascada inflamatoria dentro de la mucosa respiratoria. Esta función se facilita a través de la expresión de TLRs, que se encuentran en las células epiteliales del intestino, tracto urogenital y respiratorio. En el pulmón, tanto en las vías respiratorias primarias como en las células epiteliales alveolares tipo II, se expresa TLR4, cuya activación induce la producción de IL-8 en respuesta al estímulo por lipopolisacáridos; además expresan TLR2, TLR3, TLR5 y TLR9, armadas para iniciar y participar en la respuesta inmune innata a la infección (21-23).
Células implicadas
La cascada inflamatoria incluye las siguientes células: mastocitos, CDs, eosinófilos, basófilos, macrófagos, fibroblastos, neutrófilos, plaquetas y las diferentes subpoblaciones de LT y LB. Cuando la inflamación se intensifica, las vías respiratorias se vuelven muy sensibles a estímulos que provocan y desarrollan hiperreactividad; la acción de estas células, la inflamación de las vías respiratorias, la secreción de moco e inflamación, contribuyen a la broncoconstricción y obstrucción de las vías respiratorias que se observa en los ataques de asma (24).
LTCD4+
Los LTCD4+ o ayudadores, son células efectoras esenciales para el desarrollo de la respuesta inmune protectora y la memoria inmunológica de larga duración contra los microorganismos patógenos (25); pueden diferenciarse en varios tipos dependiendo del antígeno que les sea presentado por las células presentadoras de antígenos (APC), en el contexto del MHC y de las citoquinas presentes en el microambiente creado por la respuesta inmune innata. Estas subpoblaciones son: Th1, Th2, Th17, Th9, Th22 y LTreg (26).
Los LThl producen altos niveles de interferón gamma (IFN-y), son responsables de la activación de fagocitos, producción de opsoninas y generación de respuesta inmune celular. Tienen un papel importante en la protección contra patógenos intracelulares y están implicados en la autoinmunidad órgano-específica y en los desórdenes inflamatorios crónicos. Los LTh2 producen IL-4, IL-5, IL-9 e IL-13, protegen contra parásitos como los helmintos, pero también son responsables de la patogénesis de las enfermedades alérgicas como el asma atópica (27).
Los LTh17 producen IL-17A, IL-17F, IL-21, IL-22 e IL-26, implicadas en la protección frente a bacterias y hongos extracelulares; son responsables de desórdenes autoinmunes y del asma crónica severa. Los LTh9 producen IL-9 e IL-10, su papel fisiopatológico está relacionado con el asma alérgica, en la enfermedad inflamatoria del intestino y en la autoinmunidad. Los LTh22 producen IL-22 y parece que están implicados en la patología y en la homeostasis de la piel, pero aún no es claro (26).
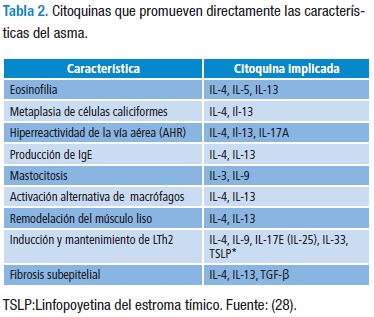
El incremento de LTh2 en las vías aéreas de los pacientes con asma, la ha categorizado como una enfermedad impulsada por esta población linfoide, que inicia y mantiene las características por la secreción de IL-4, IL-5, IL-9 e IL-13. Los experimentos realizados en ratones han proporcionado una visión más clara del papel de las citoquinas secretadas por estas células en la fisiopatología del asma (Tabla 2) (28).
LTCD8+
Al igual que los LTh, los LT citotóxicos se dividen en dos subpoblaciones llamadas Tc1 y Tc2. La diferenciación está dada por la secreción de IL-12 e IL-4. Estas células se han identificado en pacientes que tienen un amplio espectro de enfermedades con una base inmunológica, incluyendo asma, desorden pulmonar obstructivo crónico, enfermedad injerto contra huésped y varias formas severas de cáncer. Los LTc2 y Tc1 pueden producir INF-y, pero los LTc2 lo producen en menor cantidad, de igual forma, los LTc2 producen IL-4 pero en menor cantidad comparados con los LTCD4+ (29,30). La presencia de LTCD8+ en la vía aérea de asmáticos está bien documentada y en las biopsias bronquiales de pacientes con asma atópica y no atópica se observan LTCD8+ productores de IL-4, IL-5 e INF-y independiente de IL-12 (31). La IL-4 producida por LTCD4+ podría ser necesaria para el cebado y la transición de los LTCD8+ a un fenotipo Tc2, que secretarían IL-4, IL-5 e IL-13. Las células TCD8+ de los pacientes con asma atópica secretan IL-5 y contienen más IL-4 que los donantes no atópicos y están incrementadas en los casos de asma fatal.
Además, en el esputo de los pacientes con asma se ha demostrado la producción aumentada de citoquinas (IL-4 e IL-5) por parte de LTCD8+, lo que está relacionado con la severidad de la enfermedad. Estudios recientes han demostrado que el resultado del asma está determinada por la disminución anual en el volumen espiratorio forzado en el primer segundo (FEV1), que puede ser pronosticado por la infiltración bronquial de LTCD8+ pero no por la eosinofilia de la vía aérea o por el engrasamiento de la lámina reticular (32).
En individuos con asma establecida, los niveles de IgE en suero se correlacionan con el FEV1 disminuido, hiperreactividad, eosinofilia en esputo e IgE activa de fase temprana que conlleva a la liberación de mediadores de inflamación que exacerba la respuesta de fase tardía (30). Por tanto, los LTCD8+, particularmente aquellos que expresan el fenotipo Tc1, son capaces de moderar la inflamación y suprimir la AHR; se ha postulado que los LTc2 predominan en el establecimiento del asma y pueden actuar amplificando la respuesta inmune inapropiada que define esta condición (30,31).
LTh2
Todos los seres humanos inhalan aeroalérgenos derivados del polen, de los ácaros del polvo doméstico, de las heces de cucaracha, la caspa de mascotas, entre otros; en general, niños y adultos sin atopia montan una respuesta inmunológica de bajo grado a estos antígenos, produciendo anticuerpos específicos como IgG1 e IgG4, e in vitro los LT responden al alérgeno con un grado moderado en la proliferación y la producción de INF-y. En contraste, las personas atópicas tienen una exagerada respuesta caracterizada por la producción de IgE alérgeno-especifica, presentan niveles séricos elevados de IgE y reacción positiva mediante la prueba de Prick a los extractos de aeroalérgenos comunes in vitro; sus LT periféricos responden a los alérgenos con producción elevada de IL-4, IL-5, IL-9 e IL-13 (10).
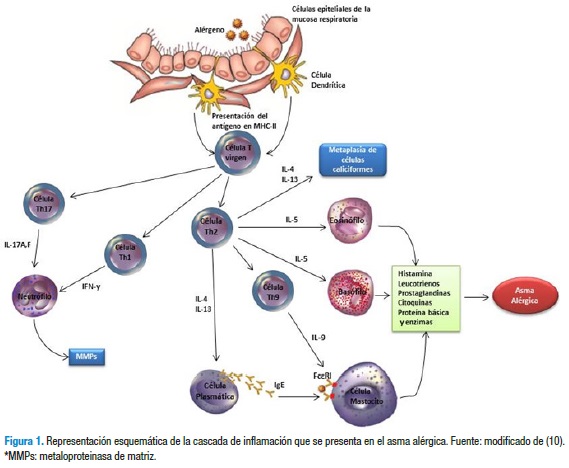
En una persona atópica, la exposición de la piel, la mucosa nasal o de las vías respiratorias a una sola dosis de alérgeno produce una reacción cutánea con un habóny eritema, estornudos y rinorrea o sibilancias en cuestión de minutos. Dependiendo de la cantidad de alérgeno, la reacción de hipersensibilidad inmediata es seguida por una reacción de fase tardía, que alcanza un pico entre 6 y 9 horas después de la exposición, desapareciendo lentamente. Cuando este antígeno entra en contacto con las células epiteliales de la vía respiratoria, es captado por las CDs de esta zona o por los mastocitos. El alérgeno se une a la IgE fijada al receptor FceRI, formando el complejo "alérgeno-IgE-FceRI". La implicación de los mastocitos en el asma se discutirá más adelante. Las CDs son particularmente importantes en el asma, presentan antígenos a los LTh2 en el contexto del MHC-CII (2,10).
La IL-4 y la IL-13 estimulan la producción de IgE por parte de las células plasmáticas, la IL-5 e IL-9 están implicadas en el desarrollo de eosinófilos, la IL-4 e IL-9 promueven el desarrollo de los mastocitos, la IL-9 e IL-13 ayudan a promover la AHR y la IL-4, IL9 e IL-13 promueven la producción en exceso de moco (Figura 1) (10,33).
En síntesis, las IL-4, 5, 9 y 13 inducen cambios en la vía aérea y en el parénquima pulmonar asociados con el asma: eosinofilia de la vía aérea, mastocitosis y linfocitosis pulmonar, activación alternativa de macrófagos, proliferación de células epiteliales con hiperplasia de células caliciformes, incremento en la secreción de moco, hiperplasia, hipertrofia e hipercontractilidad del músculo liso, fibrosis subepitelial, secreción de IgE, incremento en la producción de quimioquinas que atraen LT, eosinófilos, neutrófilos y mastocitos o sus precursores hacia los pulmones y la AHR (definida como un aumento a la sensibilidad por agentes colinérgicos y otros estímulos que causan contracción del músculo liso y que incrementan la resistencia al flujo del aire por estrechez de la vía aérea) (28,31,34).
LTh17
Los LTh17 producen IL-17, son altamente pro-inflamatorios e inducen autoinmunidad. El factor de crecimiento transformante beta (TGF-P) induce la transcripción del factor Foxp3 y genera LT regulatorios, la IL-6 inhibe la expresión del factor Foxp3 y junto con el TGF-P y la IL-ip, promueven la diferenciación de los LTh17. La IL-ip, especialmente en sinergia con la IL-23, juega un papel esencial en la inducción o en la expansión de LTh17 humanos y murinos. Estas células tienen un papel importante en autoinmunidad, inflamación e infección, a menudo co-expresan IL-17A e IL-17F, que forman homo o heterodímeros, estas citoquinas señalizan principalmente a través de receptores IL-17RA. Además, estas células pueden co-expresar IL-22 e IL-23, responsables de la expansión y el mantenimiento de la población Th17 (35,36).
Los mecanismos de inducción de los LTh17 y el papel patogénico de la IL-17 en la inflamación de la vía respiratoria ha sido objeto de estudio basado en modelo murino. Esta interleuquina está moderadamente aumentada en tejido pulmonar, fluido del lavado broncoalveolar, esputo y suero de pacientes asmáticos, además, que los eosinófilos de sus vías respiratorias también la pueden producir (37). En el pulmón de los pacientes con asma grave se encuentra elevado el nivel de IL-17, el porcentaje de LTh17, así como las concentraciones plasmáticas de las IL-17 y 22 tienden a aumentar con la gravedad de la enfermedad (38). La IL-17 puede potenciar la acción de diversas células, como: fibroblastos bronquiales, células epiteliales y músculo liso (39).
LTreg
Se ha demostrado que los LTreg son importantes en el mantenimiento de la homeostasis inmune en las vías respiratorias y su funcionamiento está alterado en la enfermedad asmática. Estudios realizados en ratones demostraron que la exposición repetida a bajas dosis de alérgeno promueve el desarrollo de una población de LTCD4+reg que expresan TGF-P y Foxp3 unidos a su membrana. Posteriormente, se demostró que una dosis mayor de alérgeno inhalado estimula el desarrollo de esta población linfocitaria que secreta altos niveles de IL-10, una potente citoquina antiinflamatoria e inmunomoduladora (40,41).
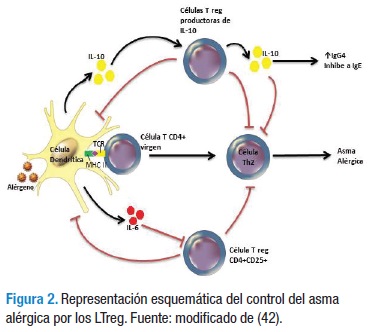
Se han descrito varios subgrupos de LTreg que incluyen LTregCD4+CD25+ y LTreg inducibles. La transferencia de LTregCD4+CD25+ mejora la inflamación de las vías aéreas, la hiperreactividad y previene la activación de CDs de las vías aéreas por alergenos; las CDs pueden secretar IL-6 que inhibe la función de los LTregCD4+CD25+, la función reducida o alterada de los LTreg genera una posible explicación para la respuesta inmune inapropiada a los alérgenos observado en los pacientes con asma. Por tanto, los LTreg ejercen su acción inhibitoria a través de mecanismos directos e indirectos: produciendo IL-10 y TGF-P y expresando moléculas inhibitorias, tal como el antígeno de LT citotóxicos 4 (CTLA-4) (Figura 2) (31,42).
La enfermedad alérgica de la vía respiratoria es causada por una respuesta inmune inapropiada conducida por LTh2 hacia antígenos o alérgenos del medio ambiente. Los LTCD4+CD25+ (LTreg) que producen IL-10 pueden regular la sensibilización alérgica in vivo a través de efectos inhibitorios en las células Th2 o en las células dendríticas en el pulmón. Las células Treg también pueden inducir la producción de la citoquina inmunosupresora IL-10 por los LT del pulmón del hospedero (no se muestra en la figura 2). Además, las CDs pueden producir citoquinas inmunomoduladoras como la IL-6 (la cual tiene un efecto inhibitorio en la función de las células Treg CD4+CD25+) y la IL-10 (que induce la producción de más IL-10 por parte de las células Treg).
La IL-10 es una citoquina inmunomoduladora con una función central durante la fase de resolución de la inflamación, inhibe la respuesta proinflamatoria del sistema inmune innato y adaptativo, y previene las lesiones en tejidos causados por la exacerbada respuesta inmune adaptativa. Sin embargo, evolutivamente los patógenos se han aprovechado de las funciones de la IL-10 para reprimir la respuesta inflamatoria normal del huésped durante las infecciones, estableciéndose así los estados infecciosos crónicos. El aumento de la expresión de IL-10 se ha asociado con muchas infecciones crónicas bacterianas y virales y su producción por CDs y macrófagos representa un poderoso mecanismo de evasión inmune usado por varios patógenos (43).
La IL-10 promueve la producción de IgG4 que, se cree, sirve de protección en el contexto de la respuesta alérgica e inhibe la IgE generando resultados en las proporciones de IgG4/IgE favorables; este equilibrio de Igs se asocia con la salud y la tolerancia inducida después de la inmunoterapia con alérgenos. Un número de estudios en humanos ha revisado la síntesis de IL-10 en pacientes alérgicos y asmáticos en comparación con individuos sanos, reportándose una reducción sustancial del RNAm de la IL-10 y un incremento en las citoquinas proinflamatorias en el lavado bronqueoalveolar (broncheoalveolar lavage, BAL) y en los macrófagos alveolares de pacientes con asma en comparación con sujetos control sanos. Además, se ha reportado polimorfismo en el promotor del gen de la IL-10 que resulta en la reducción de la expresión de esta citoquina, asociado con una enfermedad más grave (40).
El potencial terapéutico de los LTreg es de gran interés, basado en los datos obtenidos de modelos animales que demuestran la capacidad de estos linfocitos para controlar el rechazo de trasplantes y para tratar con éxito enfermedades autoinmunes y alérgicas. Dos estrategias terapéuticas generales han sido consideradas en las iniciativas de investigación en todo el mundo: (i) transferencia adoptiva de LTreg que previamente han sido expandidas in vitro y (ii) inducción o aumento de LTreg endógenas directamente en los pacientes. Este último enfoque puede ser mayormente aplicable en condiciones de alta prevalencia como la alergia y el asma, que causan considerable morbilidad, pero que generalmente no amenazan la vida. La razón de esta estrategia se ve reforzada por la evidencia de que las terapias existentes para enfermedades alérgicas, tal como la inmunoterapia con alérgenos y glucocorticoides, están asociadas con la inducción de una población de LTreg en los pacientes (42,44).
LTh9
Los LTh9 producen IL-9 y se desarrollan a partir de LTCD4+ vírgenes en presencia de IL-4 y TGF-p. Sin embargo, la producción de esta citoquina también está dada por los LTh2, Th17 y Treg. Se ha identificado que en el cromosoma humano 5q31-q33, que contiene varios genes con un papel importante en el desarrollo de atopia y de la AHR, también está ubicado el gen Il9 candidato para la atopia y para la AHR; en el ratón, el gen Il9 está ubicado en el cromosoma 13 y está asociado a la reducción de la AHR. La administración intratraqueal de IL-9 induce una respuesta similar a la de los asmáticos en ratones vírgenes, incluyendo eosinofilia pulmonar, incremento total de los niveles de IgE en suero y AHR. Estos resultados sugieren un papel crítico de la IL-9 en la patogenia del asma (45,46).
La expresión selectiva de IL-9 en el pulmón ha mostrado que causa inflamación de la vía aérea, caracterizada por infiltración eosinofílica y linfocitaria, así como cambios patológicos incluyendo hipertrofia de células epiteliales, producción de moco y un incremento en la producción subepitelial de colágeno. El bloqueo mediante anticuerpos anti-IL-9 durante la fase de sensibilización, atenúa la eosinofilia pulmonar, la IgE sérica, el daño epitelial y la AHR (45,47,48).
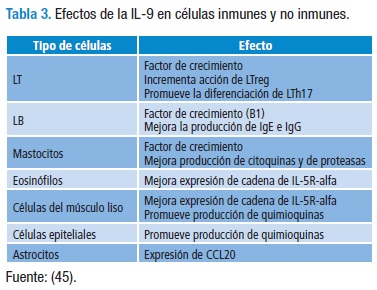
Las muestras de biopsia bronquial de algunos pacientes asmáticos muestran una mayor expresión de IL-9 y de su receptor, en comparación con controles sanos. La evidencia existente de estudios genéticos realizados en ratones indican que la IL-9 es un blanco potencial para el tratamiento del asma, lo que se ha demostrado mediante el uso reciente de un anticuerpo monoclonal humanizado contra la IL-9 en dos estudios de fase II en pacientes asmáticos con alguna evidencia de actividad clínica (45,49). Los efectos de la IL-9 en las células inmunes y no inmunes, se muestran en la tabla 3.
Mastocitos
Paul Ehrlich en 1878 los describió por primera vez basado en sus características únicas de tinción y en el contenido de sus gránulos grandes. Hoy se sabe que los mastocitos juegan un papel fundamental en el mantenimiento fisiológico del organismo, la curación de heridas, la angiogénesis y la defensa contra toda una serie de agentes patógenos, participando tanto en la inmunidad innata como en la adaptativa, contribuyen en el proceso inflamatorio, atrayendo diferentes subpoblaciones de leucocitos al sitio de la lesión en alergia y enfermedades alérgicas (50).
Son reconocidos como células efectoras de la inmunidad innata, localizadas en todo el cuerpo, particularmente en la interface con el mundo externo y en las cercanías a vasos sanguíneos, vasos linfáticos, fibras nerviosas y a una variedad de células inmunes, incluyendo las CDs. Esta posición estratégica les permite actuar como centinelas de los microorganismos invasores siendo reclutadas a los sitios de infección, propiedad que les permite responder rápidamente a cualquier cambio en el medio ambiente por la comunicación con diferentes células implicadas tanto en la respuesta fisiológica como inmunológica (50,51).
Los mastocitos de humanos y murinos expresan receptores TLRs y NODs, a través de los cuales reconocen patrones moleculares asociados a patógenos (PAMPs) como proteoglicanos, induciendo la liberación de proteasas y secreción de citoquinas, quimioquinas y factores de crecimiento para reclutar neutrófilos, eosinófilos, NKc y otras que forman el infiltrado inflamatorio (52). Los mastocitos expresan TLR4, a través del cual median la respuesta inmune contra bacterias; es un transductor de señal de los lipopolisacáridos bacterianos (LPS), componentes de la pared de bacterias Gram negativas (53). También están involucrados en la fase efectora de la inmunidad adaptativa mediante la generación de células y moléculas efectoras (51).
Los mastocitos productores de mediadores como el TNF directamente modulan la activación y la migración de CDs y células de Langerhans desde la piel a los nódulos linfoides de drenaje seguido de la activación dependiente o no de IgE mas un alérgeno; estos mastocitos también pueden activar a células presentadoras de antígeno. Los mediadores que producen son: histamina, PGE2 y PGD2 que modulan a las CDs para que induzcan el desarrollo de una respuesta mediada por Th2 (54), producen muchos otros factores incluyendo a CCL2, CCL3, CCL4, CCL5, XCL1, IL-16 y leucotrienos B4, los cuales tienen potencial para mejorar el reclutamiento de LT al sitio de inflamación (55,56).
Estudios realizados in vitro han mostrado que estas células pueden procesar antígenos y son capaces de presentarlos restringidos a MHC-I o MHC-II. La expresión del MHC-I está confirmada para todos los subtipos de mastocitos y se ha mostrado que están implicados en la activación de los LTCD8+ in vitro. Sin embargo, la expresión del complejo MHC-II sigue siendo controvertido y parece que depende en gran medida de las condiciones del medio (54). Existen dos formas de activación de los mastocitos que son: dependiente de IgE y no dependiente de IgE.
Activación dependiente de IgE
Los FcR son inmunoreceptores que permiten a una variedad de células interaccionar con el antígeno bajo la forma de complejos inmunes; pueden estimular o controlar una variedad de respuestas inmunológicas que primariamente dependen del tipo de célula. El receptor de alta afinidad para IgE en el humano es FceRI, para IgG4 el FcyRI, para IgG3 el FcyRI y el FcyRIIIA y para IgG1 el FcyRI. El FceRI humano tiene una alta expresión y se encuentra en mastocitos y basófilos, y desempeña una función activadora. El FcyRI se expresa en mastocitos mediante la inducción por el INF-y. La activación del FcR puede inducir una variedad de respuestas celulares, incluyendo: endocitosis de inmunocomplejos solubles, fagocitosis de partículas complejas y exocitosis de gránulos mediadores preformados, incluyendo aminas vasoactivas, enzimas proteolíticas, moléculas citotóxicas, producción de lípidos recién formados derivados de mediadores proinflamatorios y secreción de citoquinas, quimioquinas y factor de crecimiento de transcripción reciente (51).
El mejor mecanismo estudiado de activación de mastocitos es el que se da a través del receptor de alta afinidad FceRI para IgE y la sensibilización previa a los antígenos. El enlace cruzado de la IgE o IgG en la superficie de los mastocitos por antígenos específicos conduce a la activación y subsecuente degranulación y a la síntesis de novo de mediadores (50, 57).
Activación no dependiente de IgE
Los mastocitos pueden ser activados a través de una variedad de mecanismos no dependientes de IgE incluyendo proteasas, citoquinas, complemento, adenosina, TLRs, neuropéptidos y la hiperosmolaridad, este evento puede ser positivo o negativo regulado por ligandos o por muchos receptores expresados en su superficie. Por ejemplo, los mastocitos son activados por productos del complemento como C3a y C5a para inducir la expresión de genes de quimioquinas. Los receptores del complemento tienen expresión diferente en los mastocitos que se localizan en varios tejidos, por ejemplo en el pulmón los mastocitos no expresan C5aR (50).
Papel de los mastocitos en el asma
Estas células pueden encontrarse adyacentes a los vasos sanguíneos en la lámina propia de la mucosa de la vía aérea. En pacientes con asma, pueden migrar a otras estructuras como epitelio de la vía aérea, glándulas mucosas y células del músculo liso. La interacción existente entre mastocitos y células del músculo liso, induce que estas últimas expresen TGF-pi mediado por la vía de liberación de p-triptasa, resultando en la diferenciación de un fenotipo mucho más contráctil (54).
En pacientes con asma alérgica, la inhalación de un aeroalergeno conduce la unión cruzada del alérgeno con la IgE ligada a FceRI en la membrana del mastocito, induciendo la liberación rápida de mediadores como: histamina, leucotrienos, proteasas y prostaglandinas que pueden detectarse aumentados en el BAL de estos pacientes retados con alérgenos que inducen vasodilatación, contracción del músculo liso y secreción de moco. Además, conducen a una respuesta de fase tardía caracterizada por infiltración celular inflamatoria como: eosinófilos, LTCD4+, neutrófilos, mastocitos y basófilos, asociada con edema de la pared bronquial y un incremento no específico de la AHR (50,54).
Eosinófilos
Paul Ehrlich identificó los eosinófilos en tejidos y esputo de pacientes asmáticos en 1870; desde entonces, el papel de estas células en la salud y la enfermedad sigue siendo enigmático. Se encuentran en las mucosas y a nivel pulmonar hay evidencias que sugieren que tienen la capacidad de estimular la eliminación de ciertos organismos virales, bacterianos y micobacterianos. No obstante, su papel está bien caracterizado como células efectoras contra las infecciones por parásitos helmintos, durante las cuales los eosinófilos liberan diferentes citoquinas como: TGF-p, factor activador de plaquetas (PAF), leucotrienos C4 (LTC4), proteína básica mayor (MBP) y peroxidasa de eosinófilos (EPO).
Sin embargo, la activación de estas células se asocia con efectos perjudiciales en el hospedero, como: el asma alérgica bronquial y la esofagitis eosinofílica. La primera está caracterizada por una AHR, broncoconstricción y un incremento en la producción de moco, resultando en una inflamación crónica y en un remodelamiento de la vía aérea. Los eosinófilos han sido implicados en todos los aspectos de la patogénesis del asma, la MBP y EPO pueden causar destrucción de tejidos y desarrollar AHR, PAF y LTC4 son potentes broncoconstrictores e incrementan la producción de moco y el TGF-p contribuye a la remodelación de la vía aérea, de donde, estas células se han identificado como el primer blanco terapéutico en la intervención del asma bronquial (51,58).
La IL-5 tiene un papel central en la diferenciación de los eosinófilos, como factor hematopoyético y en su supervivencia; por tanto, la sobrexpresión de IL-5 in vivo incrementa significativamente su número. Desde una perspectiva clínica, una serie de estudios sobre la depleción de eosinófilos en pacientes con anticuerpos monoclonales anti-IL-5 ha fortalecido el argumento de que los eosinófilos tienen un papel activo en la enfermedad pulmonar, como células inmunoreguladoras, con una función clave en la orquestación de la inflamación de la vía aérea mediada por LTh2 y probablemente desarrollando el papel de APCs, fortaleciendo la hipótesis de las implicaciones de estas células en la enfermedad pulmonar (58,59).
Basófilos
Los basófilos al igual que los mastocitos liberan varios mediadores proinflamatorios como histamina,leucotrienos y citoquinas a través de la estimulación por un enlace cruzado de la IgE y del receptor FceRI, o a través de mecanismos no dependientes de IgE como C5a. Tienen un papel crítico en la alergia y en las enfermedades inflamatorias, están circulando en sangre periférica y pueden ser reclutados a los sitios de inflamación alérgica por el tejido afectado y de esta forma contribuir al proceso. El descubrimiento de un marcador único de basófilos como la basogranulina, ha permitido su identificación en las vías respiratorias de pacientes con asma. Sin embargo, no está claro cuál es su papel en la enfermedad aguda o crónica, aunque se sabe que comparten muchos de los mecanismos de reclutamiento con los eosinófilos, es probable que sean los acompañantes del infiltrado eosinofílico(34,60).
Macrófagos
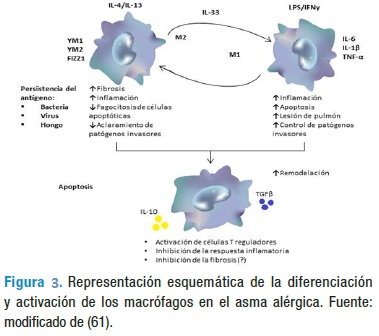
Los macrófagos alveolares e intersticiales representan las dos poblaciones que ocupan diferentes compartimentos en el pulmón. Estas células son funcionalmente distintas, pero ambos tipos sirven como centinelas importantes en el reconocimiento de patógenos invasores y de células apoptóticas. Los macrófagos pulmonares se diferencian de monocitos que están en la circulación sanguínea gracias al factor estimulante de crecimiento de colonias de macrófago (M-CSF). Se han estudiado al menos dos subpoblaciones de macrófagos funcionalmente distintos que son: los de activación clásica (M1) y los de activación alternativa (M2).
Los macrófagos M1 son activados por el INF-γ y por LPS derivados de las bacterias Gram negativas tanto en ratones como en humanos. Estas células liberan citoquinas inflamatorias y quimioquinas como: IL-12, IL-6, TNF-α, CXCL10 y CCL3; también producen altos niveles de óxido nítrico y exhiben un importante papel protectivo contra patógenos intracelulares. Las citoquinas prototípicas IL-13 e IL-4 de los LTh2 están involucradas en la diferenciación de los macrófagos M2. Estas células, tanto de ratones como de humanos, tienen una mayor expresión de receptores de mañosa y "scavenger" que incrementan la fagocitosis, pero son ineficientes en la eliminación de patógenos intracelulares (Figura 3) (61-63).
Los macrófagos pulmonares se diferencian de los monocitos que están circulando en sangre mediante el factor de crecimiento estimulante de colonias de macrófagos (M-CSF). La IL-4 e IL-13, producidas en concentración elevada en los pulmones por los LTh2 de pacientes con alergia, contribuyen a la activación alternativa de los macrófagos M2. La activación clásica de los macrófagos M1 está presente en los pulmones de pacientes con asma grave debido a la exposición a LPS e INF-γ.
Se ha postulado que la activación de los macrófagos en el asma alérgica es insuficiente para contener los patógenos bacterianos y virales comúnmente observados en el tracto respiratorio de pacientes atópicos, lo que sugiere que la liberación de mediadores proinflamatorios, por estas células, puede exacerbar el daño pulmonar y acelerar el remodelamiento de la vía respiratoria. De igual modo, se han detectado altos niveles de óxido nítrico exhalado en pacientes asmáticos. La excesiva generación de óxido nítrico puede amplificar el daño pulmonar durante el asma, debido a que se puede conducir al daño oxidativo del ADN. Los macrófagos M1 producen citoquinas proinflamatorias como la IL-ip e IL-6, que tienen efecto directo en la proliferación de LTh2 y promueven la activación de fibroblastos y otras células (61,64).
Células iNKT
Estas células T asesinas naturales (NKT) pertenecen a un nuevo linaje linfoide, distinto de los LT, LB o NKc. Las NKT se caracterizan por la expresión de un repertorio restringido de TCRs que consiste de Va14 y Ja18 (en el ratón) y Va24 y Ja18 (en humanos). Dado que estos TCRs son altamente restringidos, las NKT son llamadas NKT invariantes (iNKT); su activación tiene un papel crítico en la regulación de varios eventos de la respuesta inmune, tales como: inflamación alérgica, respuesta inmune antitumoral y autoinmunidad (65,66).
La activación de las iNKT puede inducir síntomas del asma alérgica independiente de LTh2, estas células producen una gran cantidad de citoquinas tanto Thl como Th2, es decir, INF-y, IL-4, IL-5 e IL-13, por tanto, las iNKT pueden inhibir o exacerbar la respuesta alérgica. Los experimentos realizados en ratones han demostrado que están implicadas en el desarrollo de la AHR y en la inflamación de la vía aérea. Para determinar su posible papel en humanos con asma, se evaluó el número de células iNKT en pacientes asmáticos.
Un primer informe, publicado en el año 2006, reportó que más del 60% de los LTCD4 obtenidos en BAL de estos pacientes eran iNKT, mientras que estas células no fueron observados en pacientes con sarcoidosis o en controles sanos. Sin embargo, otros cuatro grupos de investigación realizaron estudios similares y llegaron a la conclusión de que las células iNKT no aumentan en los pacientes con asma. Nuevos estudios respecto a estas células en otras etiologías de asma, tales como: crónica, ocupacional, resistente a los esteroides, inducida por el ejercicio y el asma inducida por aspirina, donde los LTh2 no tienen un papel importante, podrían proporcionar conocimiento sobre la función de este nuevo linaje celular de LT (65,67).
Tras la activación de las iNKT y de los LTh2 se producen varias citoquinas en el pulmón que inducen AHR e inflamación de la vía respiratoria. Los experimentos realizados en modelos murinos indican que las células iNKT activadas parecen contribuir como células efectoras y también como amplificadoras de la respuesta de LTh2 alérgeno-específicos en procesos asmáticos. Aunque estos mecanismos están claros en ratones, no se han investigado directamente en pacientes asmáticos. Por tanto, las células iNKT pueden ser un nuevo blanco terapéutico para las enfermedades alérgicas (65).
Plaquetas
Se ha demostrado que las plaquetas participan en la inflamación, así como también en los trastornos del sistema cardiovascular; son capaces de interactuar tanto con leucocitos como con células endoteliales, lo que sugiere su posible papel en la adhesión de los leucocitos y, por tanto, en el tráfico de estos hacia los tejidos. También se ha demostrado que la activación plaquetaria inducida por alérgenos produce broncoconstricción en humanos. Estudios realizados en modelos animales revelan la importancia de las plaquetas en la broncoconstricción aguda, AHR y el remodelamiento de la pared bronquial; intervienen en el tráfico de los leucocitos desde los vasos sanguíneos hacia el tejido pulmonar e intervienen en el reclutamiento de eosinófilos y linfocitos hacia el pulmón en la inflamación alérgica, lo que se ha demostrado en ratones. La remodelación de la pared de la vía respiratoria es dependiente de plaquetas, lo que puede contribuir a una alteración de la función pulmonar, debido a que los procesos mecánicos implicados tanto en la inspiración como en la espiración se ven afectados por cambios en la pared. Esto reduce su calibre y aumenta la resistencia al flujo de aire, mientras que la hiperplasia del músculo liso puede contribuir a un aumento de la reactividad contráctil y de la fuerza de contracción (68-70).
Las plaquetas humanas expresan receptores FceRI para IgE y su estimulación induce la liberación de citoquinas y serotonina, como también la expresión de actividad citotóxica antiparasitaria; lo anterior sugiere que la participación de las plaquetas en la inflamación alérgica está mediada por la activación de los receptores para IgE. Por tanto, las plaquetas se comportan como "células" inflamatorias "per se" en el asma alérgica y no solo como espectadores pasivos; a la fecha no son claros los eventos moleculares que siguen a la interacción entre el alérgeno y la IgE enlazados al receptor FceRI en las plaquetas y esclarecer el papel directo de las plaquetas en la inflamación del tejido puede representar el primer paso en el desarrollo de nuevas estrategias terapéuticas dirigidas a la prevención de este evento que desencadena la inflamación del tejido (68).
Conflicto de interés: Ninguno declarado por los autores.
Financiación: Ninguna declarada por los autores.
Agradecimientos: Los autores agradecen a Diana Shirley Pantoja Ríos, estudiante de Diseño Gráfico (Universidad de Nariño, Colombia) por el diseño de los diagramas.
Referencias
1. Mutius E, Drazen MJ. A Patient with Asthma Seeks Medical Advice in 1828, 1928, and 2012. N Engl J Med. 2012;366:827-34. [ Links ]
2. Busse W, Lemanske RF. Asthma. N Engl J Med. 2001;344:350-62. [ Links ]
3. Crinnion WJ. Do Environmental Toxicants Contribute to Allergy and Asthma? Altern Med Rev. 2012;17:6-18. [ Links ]
4. Holgate ST. Innate and adaptive immune responses in asthma. Nat Med. 2012;18:673-83. [ Links ]
5. Grainge CL, Lau LC, Ward JA, Dulay V, Lahiff G, Wilson S, et al. Effect of Bronchoconstriction on Airway Remodeling in Asthma. N Engl J Med. 2011;364:2006-15. [ Links ]
6. Matangkasombut P, Pichavant M, De Kruyff RH, Umetsu DT. Natural killer T cells and the regulation of asthma. Mucosal Immunology. 2009;2:383-92. [ Links ]
7. Tse SM, Tantisira K, Weiss ST. The pharmacogenetics and pharmacogenomics of asthma therapy. The Pharmacogenomics Journal. 2011;11:383-92. [ Links ]
8. Dennis RJ, Caraballo L, García L, Rojas M, Rondon M, Pérez A, et al. Prevalence of asthma and other allergic conditions in Colombia 2009-2010: a cross-sectional study. BMC Pulmonary Medicine. 2012;12:17. [ Links ]
9. Fanta CH. Asthma. N Engl J Med. 2009;360:1002-14. [ Links ]
10. Kay AB. Allergy and allergic diseases. N Engl J Med. 2001;344:30-7. [ Links ]
11. Ray A, Khare A, Krishnamoorthy N, Qi Z, Ray P. Regulatory T cells in many flavors control asthma. Mucosal Immunology. 2010;3:216-29. [ Links ]
12. Langier S, Sade K, Kivity S. Regulatory T Cells in Allergic Asthma. Isr Med Assoc J. 2012;14:180-3. [ Links ]
13. Edwards MR, Bartlett NW, Hussell T, Openshaw P, Johnston SL. The microbiology of asthma. Nature Reviews Microbiology. 2012;10:459-71. [ Links ]
14. Wenzel SE. Phenotypes in asthma. Am J Respir Crit Care Med. 2004;170:579-82. [ Links ]
15. Hesselmar B, Enelund AC, Eriksson B, Padyukov L, Hanson LA, Aberg N. The heterogeneity of asthma phenotypes in children and young adults. J Allergy. 2012;2012:163089. [ Links ]
16. Barnett SB, Nurmagambetov TA. Costs of asthma in the United States: 2002-2007. J Allergy ClinImmunol. 2011;127:145-52. [ Links ]
17. Acevedo N, Sánchez J, Zakzuk J, Bornacelly A, Quiróz C, Alvarez A et al. Particular characteristics of allergic symptoms in tropical environments: follow up to 24 months in the FRAAT birth cohort study. Pulmonary Medicine. 2012;12:13. [ Links ]
18. Jeong E, Young Lee J. Intrinsic and extrinsic regulation of innate immune receptors. Yonsei Med J. 2011;52:379-92. [ Links ]
19. Kawai T, Akira S. The roles of TLRs, RLRs and NLRs in pathogen recognition. International Immunology. 2009;21:317-37. [ Links ]
20. Shi H, Kokoeva MV, Inouye K, Tzameli I, Yin H, Flier JS. TLR4 links innate immunity and fatty acid-induced insulin resistance. J Clin Invest. 2006;116:3015-25. [ Links ]
21. Phipps S, En Lam C, Foster PS, Matthaei K. The contribution of toll-like receptors to the pathogenesis of asthma. Immunol Cell Biol. 2007;85:463-70. [ Links ]
22. Guillot L, Le Goffic R, Bloch S, Escrio N, Akira S, Chignard M, et al. Involvement of Toll-like Receptor 3 in the Immune Response of Lung Epithelial Cells to Double-stranded RNA and Influenza A Virus. J Biol Chem. 2005;280:5571-80. [ Links ]
23. Gewirtz AT, Navas TA, Lyons S, Godowski PJ, Madara JL. Cutting edge: Bacterial flagellin activates basolaterally expressed TLR5 to induce epithelial proinflammatory gene expression. J Immunol. 2001;167:1882-5. [ Links ]
24. Tauro S, Yung-Chang Su, Thomas S , Schwarze J, Matthaei K, Townsend D, et al. Molecular and cellular mechanisms in the viral exacerbation of asthma. Microbes Infect. 2008;10:1014-23. [ Links ]
25. Montoya CG, Fernández MM, López MR. Reacciones y alteraciones del sistema inmune durante la infección por VIH-1. Infectio. 2006;10:250-65. [ Links ]
26. Annunziato F, Romagnani S. Heterogeneity of human effector CD4+ T cells. Arthritis Research & Therapy. 2009;11:257. [ Links ]
27. Hartenstein B, Teurich S, Hess J, Schenkel J, Kistner SM, Angel P. Th2 cell-specic cytokine expression and allergen-induced airway inflammation depend on JunB. The EMBO Journal. 2002;21: 6321-9. [ Links ]
28. Finkelman FD, Hogan SP, Hershey GK, Rothenberg ME, Wills-Karp M. Importance of Cytokines in Murine Allergic Airway Disease and Human Asthma. J Immunol. 2010;184:1663-74. [ Links ]
29. Croft M, Carter L, Swain S, Dutton R. Generation of Polarized Antigen-specific CD8 Effector Populations: Reciprocal Action of Interleukin (IL)-4 and IL-12 in Promoting Type 2 versus Type 1 Cytokine Profiles. J Exp Med. 1994;180:1715-28. [ Links ]
30. Betts RJ, Kemeny DM. CD8+ T cells in asthma: Friend or foe? Pharmacology & Therapeutics. 2009;121:123-31. [ Links ]
31. Lloyd CM, Hessel EM. Functions of T cells in asthma: more than just TH2 cells. Nat Rev Immunol. 2010;10:838-48. [ Links ]
32. Gelfand EW, Dakhama A. CD81 T lymphocytes and leukotriene B4: Novel interactions in the persistence and progression of asthma. J Allergy Clin Immunol. 2006;117:577-82. [ Links ]
33. Wills-Karp M, Luyimbazi J, Xu X, SchoFeld B, Neben TY, Karp CL, et al. Interleukin-13: Central Mediatorof Allergic Asthma. Science. 1998;282:2258. [ Links ]
34. Holgate ST. Pathogenesis of Asthma. Clinical and Experimental Allergy. 2008;38:872-97. [ Links ]
35. Besnard AG, Togbe D, Couillin I, Tan Z, Zheng SG, Erard F, et al. Inflammasome-IL-1-Th17 response in allergic lung inflammation. J Mol Cell Biol. 2012;4:3-10. [ Links ]
36. Sutton C, Brereton C, Keogh B, Mills K, Lavelle E. A crucial role for interleukin (IL)-1 in the induction of IL-17-producing T cells that mediate autoimmune encephalomyelitis. J Exp Med. 2006;203:1685-91. [ Links ]
37. Molet S, Hamid Q, Davoineb F, Nutku E, Tahaa R, Pagé N, et al. IL-17 is increased in asthmatic airways and induces human bronchial fibroblasts to produce cytokines. J Allergy Clin Immunol. 2001;108:430-8. [ Links ]
38. Souwer Y, Szegedi K, Kapsenberg ML, Jong E. IL-17 and IL-22 in atopic allergic disease. Current Opinion in Immunology. 2010;22:821-6. [ Links ]
39. Oboki K, Ohno T, Saito H, Nakae S. Th17 and Allergy. Allergology International. 2008;57:121-34. [ Links ]
40. Lloyd CM, Hawrylowicz CM. Regulatory T Cells in Asthma. Immunity. 2009;31:438-49. [ Links ]
41. Ito T, Wang YH, Duramad O, Hori T, Delespesse GJ, Watanabe N et al. TSLP-activate dendritic cells induce an inflammatory T helper type 2 cells response through OX40 ligand. J Exp Med. 2005;202:1213-23. [ Links ]
42. Hawrylowicz CM. Regulatory T cells and IL-10 in allergic inflammation. J Exp Med. 2005;202:1459-63. [ Links ]
43. Ouyang W, Rutz S, Crellin N, Valdez P, Hymowitz S. Regulation and functions of the IL-10 family of cytokines in inflammation and disease. Annu Rev Immunol. 2011;29:71-109. [ Links ]
44. Urry Z, Chambers E, Xystrakis E, Dimeloe S, Richards D, Gabrysovâ L, et al. The role of 1a,25-dihydroxyvitamin D3 and cytokines in the promotion of distinct Foxp3+ and IL-10+ CD4+ T cells. Eur J Immunol. 2012;42:2697-2708. [ Links ]
45. Stassen M, Schmitt E, Bopp T. From interleukin-9 to T helper 9 cells. Ann N Y Acad Sci. 2012;247:56-68. [ Links ]
46. Reader JR, Hyde DM, Schelegle ES, Aldrich MC, Stoddard AM, McLane MP, et al. Interleukin-9 induces mucous cell metaplasia independent of inflammation. Am J Respir Cell Mol Biol. 2003;28:664-72. [ Links ]
47. Temann UA, Geba GP, Rankin JA, Flavel RA. Expression of Interleukin 9 in the lungs of transgenic mice causes airway inflammation, mast cell hyperplasia, and bronchial hyperresponsiveness. J Exp Med. 1998;188:1307-20. [ Links ]
48. Cheng G, Arima M, Honda K, Hirata H, Eda F, Yoshida N, et al. Anti-Interleukin-9 antibody treatment inhibits airway inflammation and hyperreactivity in mouse asthma model. Am J Respir Crit Care Med. 2002;166:409-16. [ Links ]
49. Parker JM, Oh CK, Force CL, Miller SD, Pearlman DS, Le C, et al. Safety profile and clinical activity of multiple subcutaneous doses of MEDI-528, a humanized anti-interleukin-9 monoclonal antibody, in two randomized phase 2a studies in subjects with asthma. BMC Pulm Med. 2011;11:14. [ Links ]
50. Weller CL, Collington SJ, Williams T, Lamb JR. Mast cells in health and disease. Clinical Science. 2011;120:473-84. [ Links ]
51. Jonsson F, Daëron M. Mast cells and company. Front Immunol. 2012;3:16. [ Links ]
52. Supajatura V, Ushio H, Nakao A, Okumura K, Ra C, Ogawa H. Protective roles of mast cells against enterobacterial infection are mediated by Toll-Like receptor 4. J Immunol. 2001;167:2250-6. [ Links ]
53. Supajatura V, Ushio H, Nakao A, Akira S, Okumura K, Ra C, et al. Differential responses of mast cell Toll-like receptors 2 and 4 in allergy and innate immunity. J. Clin. Invest. 2002;109:1351-9. [ Links ]
54. Reuter S, Stassen M, Taube C. Mast cells in allergic asthma and beyond. Yonsei Med J. 2010;51:797-807. [ Links ]
55. Nakae S, Suto H, Iikura M, Kakurai M, Sedgwick JD, Tsai M, et al. Mast cells enhance T cell activation: importance of mast cell costimulatory molecules and secreted TNF. J Immunol. 2006;176:2238-48. [ Links ]
56. Nakae S, Suto H, Kakurai M, Sedgwick JD, Tsai M, Galli SJ. Mast cells enhance T cell activation: Importance of mast cell-derived TNF. Proc Natl Acad Sci U S A. 2005;102:6467-72. [ Links ]
57. Galli SJ, Tsai M. Mast cells: Versatile regulators of inflammation, tissue remodeling, host defense and homeostasis. J Dermatol Sci. 2008;49:7-19. [ Links ]
58. Akuthota P, Xenakis JJ, Weller PF. Eosinophils: Offenders or general bystanders in allergic airway disease and pulmonary immunity? J Innate Immun. 2011;3:113-9. [ Links ]
59. Takatsu K. Interleukin-5 and IL-5 receptor in health and diseases. Proc Jpn Acad Ser B Phys Biol Sci. 2011;87:463-85. [ Links ]
60. Mochizuki A, McEuen AR, Buckley MG, Walls AF. The release of basogranulin in response to IgE-dependent and IgE-independent stimuli: Validity of basogranulina measurement as an indicator of basophil activation. J Allergy Clin Immunol. 2003;112:102-8. [ Links ]
61. Moreira AP, Hogaboam CM. Macrophages in allergic asthma: Fine-tuning their pro- and anti-inflammatory actions for disease resolution. J Interferon Cytokine Res. 2011;31:485-91. [ Links ]
62. Varin A, Mukhopadhyay S, Herbein G, Gordon S. Alternative activation of macrophages by IL-4 impairs phagocytosis of pathogensbut potentiates microbial-induced signalling and cytokine secretion. Blood. 2010;14:115:353-62. [ Links ]
63. Zeyda M, Farmer D, Todoric J, Aszmann O, Speiser M, Gyori G, et al. Human adipose tissue macrophages are of an anti-inflammatory phenotype but capable of excessive proinflammatory mediator production. Int J Obes. 2007;31:1420-8. [ Links ]
64. Naura AS, Zerfaoui M, Kim H, Abd Elmageed ZY, Rodriguez PC, Hans CP, et al. Requirement for inducible nitric oxide synthase in chronic allergen exposure-induced pulmonary fibrosis but not inflammation. J Immunol. 2010;185:3076-85. [ Links ]
65. Iwamura C, Nakayama T. Role of NKT cells in allergic asthma. Curr Opin Immunol. 2010;22:807-13. [ Links ]
66. Lisbonne M, Diem S, Keller AC, Lefort J, Araujo LM, Hachem P, et al. Cutting Edge: Invariant Va14 NKT cells are required for allergen-induced airway inflammation and hyperreactivity in an experimental asthma model. J Inmunol. 2003;171:1637-41. [ Links ]
67. Akbari O, Faul JL, Hoyte EG, Berry GJ, Wahlstrom J, Kronenberg M, et al. CD4+ Invariant T-Cell-Receptor+ natural killer T cells in bronchial asthma. N Engl J Med. 2006;354:1117-29. [ Links ]
68. Pitchford SC, Momi S, Baglioni S, Casali L, Giannini S, Rossi R, et al. Allergen induces the migration of platelets to lung tissue in allergic asthma. Am J Respir Crit Care Med. 2008;177:604-12. [ Links ]
69. Pitchford SC, Yano H, Lever R, Riffo-Vasquez Y, Ciferri S, Rose MJ, et al. Platelets are essential for leukocyte recruitment in allergic inflammation. J Allergy Clin Immunol. 2003;112:109-18. [ Links ]
70. Pitchford SC, Riffo-Vasquez Y, Sousa A, Momi S, Gresele P, Spina D, et al. Platelets are necessary for airway wall remodeling in a murine model of chronic allergic inflammation. Blood. 2004;103:639-47. [ Links ]