Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.62 supl.1 Bogotá Dec. 2014
https://doi.org/10.15446/revfacmed.v62n3sup.41182
http://dx.doi.org/10.15446/revfacmed.v62n3sup.41182
Artículo de Actualización
Tamización del riesgo nutricional en el paciente oncológico
Screening nutritional risk in cancer patients
Lilia Lizarda Lancheros-Páez1, Ricardo Alfonso Merchán-Chaverra1, Lizeth Joanna Martínez-Anaya1
1 Departamento de Nutrición Humana. Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
Correspondencia: Ricardo Alfonso Merchán-Chaverra. Calle 45 No. 30-03, Departamento de Nutrición Humana, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia. Teléfono: +57 1 3165000. Correo electrónico: ramerchanc@unal.edu.co.
Recibido: 13/12/2013 Aceptado: 16/06/2014
Resumen
La prevalencia de desnutrición en el paciente oncológico se encuentra entre el 20% y 40% al momento del diagnóstico, aumenta a 80% en estadios tardíos y es mayor en pacientes hospitalizados. La tamización del riesgo nutricional busca identificar a los pacientes desnutridos o con riesgo de desnutrición e iniciar oportunamente la recuperación del estado nutricional; este proceso incluye diferentes indicadores que requieren una interpretación precisa. El objetivo de la presente revisión narrativa es establecer cuáles son las herramientas de tamizaje nutricional más utilizadas y recomendadas para ser usada en oncología, según la literatura publicada y los diferentes órganos internacionales, así como el impacto en los desenlaces clínicos al realizar su aplicación.
Palabras clave: Desnutrición; Neoplasias; Estado Nutricional; Caquexia (DeCS).
Lancheros-Páez LL, Merchán-Chaverra RA, Martínez-Anaya LJ. Tamización del riesgo nutricional en el paciente oncológico. Rev Fac Med. 2014; 62 Supl 1:S57-64. http://dx.doi.org/10.15446/revfacmed.v62n3sup.41182.
Summary
The prevalence of malnutrition in cancer patients is between 20% and 40% at the time of diagnosis, increases to 80% in late stages and is greater in hospitalised patients. Nutritional risk screening seeks to identify malnourished patients or those at risk of malnutrition and to initiate timely nutritional recovery; this includes using indicators which require accurate interpretation. This narrative review was aimed at establishing which nutritional screening tools are most used and recommended for use in oncology, according to a search of the published pertinent literature and international bodies' guidelines, and ascertaining their impact on clinical outcomes.
Keywords: Malnutrition; Neoplasms; Nutritional Status; Chaquexia (MeSH).
Lancheros-Páez LL, Merchán-Chaverra RA, Martínez-Anaya LJ. Screening nutritional risk in cancer patients. Rev Fac Med. 2014; 62 Supl 1:S57-64. http://dx.doi.org/10.15446/revfacmed.v62n3sup.41182.
Introducción
El cáncer se ha constituido en una de las enfermedades de mayor repercusión social, económica y sanitaria, debido a su alta incidencia y prevalencia; cada año se presentan 11 millones de casos nuevos de cáncer, de los cuales el 80% se reportan en países en vía de desarrollo. En Colombia, es la tercera causa de muerte, después de la enfermedad isquémica del corazón y muerte por causas violentas, con una tasa para el año 2009, de 78,03 por cada 100.0000 habitantes y una mortalidad total de 35.099 (1).
Los mecanismos por los cuales el cáncer afecta el estado nutricional son el escaso consumo de energía y nutrientes, alteraciones de la digestión, la absorción, el metabolismo de nutrientes y el aumento de los requerimientos energéticos. La progresión de la enfermedad frecuentemente se acompaña de anorexia, síntomas gastrointestinales, pérdida progresiva de tejido adiposo y de tejido muscular –esquelético y cardíaco–, asociados al aumento de la producción de citoquinas proinflamatorias como la interleuquina-1 (IL-1), interleuquina-2 (IL-2), interleuquina-6 (IL-6), interferón-gama (IFN-γ) y factor de necrosis tumoral alfa (TFN-α) (2,3).
La prevalencia de desnutrición en el paciente oncológico se encuentra entre el 20% y 40% al momento del diagnóstico, aumenta a 80% en estadios tardíos y es mayor en pacientes hospitalizados (2,3). La tamización del riesgo nutricional busca identificar a los pacientes desnutridos o con riesgo de desnutrición e iniciar oportunamente la recuperación del estado nutricional; este proceso incluye diferentes indicadores que requieren una interpretación precisa.
El objetivo de la presente revisión narrativa es establecer cuáles son las herramientas de tamizaje nutricional más utilizadas y recomendadas para ser usada en oncología según la literatura publicada y los diferentes órganos internacionales (4-7), así como el impacto en los desenlaces clínicos al realizar su aplicación.
Materiales y métodos
Se realizó una búsqueda de literatura científica enfocada en herramientas de tamizaje nutricional para paciente oncológico, en bases de datos de literatura biomédica MEDLINE y EMBASE sin restricción de fecha inicial hasta septiembre de 2012, utilizando la combinación de palabras clave "risk assessment", "screening", "neoplasm", "cáncer*", "tumor*", "nutrition screening tool", "malnutrition". Se incluyeron en la presente revisión artículos que se encontraran en idioma español o inglés.
Valoración del riesgo nutricional
El riesgo nutricional se define como un estado de deterioro nutricional que puede favorecer la aparición de la desnutrición cuando es moderado a severo. La tamización del riesgo hace referencia a la "identificación de características que están asociadas con problemas alimentarios o nutricionales, su propósito es detectar a los individuos que se encuentran en riesgo de problemas nutricionales o que presentan un estado nutricional deficiente" (8). El reconocimiento del riesgo nutricional es vital para predecir la probabilidad de desenlaces desfavorables y prevenir la desnutrición intrahospitalaria.
La Academia de Nutrición y Dietética de los Estados Unidos lo define como una prueba, procedimiento o examen estandarizado que se usa para identificar pacientes que requieren intervención especial; esta prueba puede ser aplicada por profesionales de la salud que no necesariamente son nutricionistas (9). Según la Sociedad Americana para la Nutrición Parenteral y Enteral (ASPEN, por sus siglas en inglés) la tamización es "un proceso para identificar un individuo desnutrido o a riesgo de desnutrición para determinar si se encuentra indicada una valoración nutricional detallada" (10).
La Sociedad Europea para la Nutrición Enteral y Parenteral (ESPEN, por sus siglas en inglés) lo define como un proceso rápido y simple realizado por personal de salud en ámbito hospitalario o comunitario (11), el cual tiene como objeto predecir la probabilidad de mejores o peores desenlaces debido a factores nutricionales (12). ESPEN a su vez establece que las herramientas empleadas en el proceso de tamizaje deben identificar la subnutrición calórico-proteica y predecir su impacto en las condiciones presentes y/o futuras del paciente, para lo cual establece cuatro principios esenciales (12):
¿Cuál es la condición nutricional actual del paciente? La talla y el peso permiten estimar el índice de masa corporal (IMC), en el caso de pacientes en los que no sea posible obtener esta información la circunferencia del brazo es una buena opción de valoración. El IMC no ofrece una valoración confiable en niños, adolescentes y adultos mayores.
¿Es estable la condición? La pérdida de peso indica variación de la condición nutricional de paciente, si es mayor al 5% en los últimos tres meses es significativa, revela desnutrición o mayor riesgo de desnutrición.
¿Su condición empeorará? La determinación de cambios en la ingesta usual de alimentos aumenta la probabilidad de deterioro nutricional; es importante cuantificar el cambio y su duración.
¿La patología acelerara el deterioro nutricional? Se refiere al aumento del estrés metabólico asociado a una enfermedad severa, que favorece el deterioro nutricional.
Las herramientas de valoración de riesgo deben ser aplicadas al momento del diagnóstico o admisión hospitalaria, deben ser fáciles de aplicar, rápidas, cortas y no invasivas.
Herramientas de valoración de riesgo validadas en paciente oncológico
Las escalas de riesgo más utilizadas en oncología son las que se presentan a continuación (Tabla 1).
Valoración Global Subjetiva (VGS)
Es el método de valoración más validado en la población y por lo tanto el más empleado en la práctica clínica, fue diseñado por Detsky y Baker en 1982. Engloba parámetros de la historia clínica, de la enfermedad actual y de la exploración física; identifica a los pacientes con alto riesgo de desarrollar complicaciones asociadas a la desnutrición, con un elevado poder predictivo de aspectos como duración de la estancia hospitalaria y mortalidad.
Emplea cinco datos relevantes de la historia clínica: cambios en el peso, cambios en la ingesta, síntomas gastrointestinales, capacidad funcional y efecto de la patología en los requerimientos nutricionales. Para la exploración física tienen en cuenta la pérdida de reserva grasa –tríceps– y de tejido muscular –cuádriceps y deltoides– y la presencia de edema o ascitis (13). Esta herramienta no cuenta con un puntaje numérico, por esto se considera subjetiva, aunque es considerada el Gold estándar del cribado nutricional; clasifica al paciente como bien nutrido, sospecha de desnutrición o desnutrición moderada y desnutrición grave (14).
Componentes de la valoración del riesgo nutricional
La pérdida de peso progresiva y la anorexia son síntomas frecuentes en procesos neoplásicos avanzados, la pérdida de peso es el principal criterio diagnóstico del síndrome anorexia-caquexia, se asocia con la disminución de la capacidad funcional y calidad de vida del individuo, afecta al 40-80% de los pacientes, variando en función del tipo de tumor (15).
Cambios en la ingesta de alimentos
En el paciente oncológico es común encontrar variaciones en la ingesta que van desde el ayuno absoluto hasta la disminución del consumo de la cantidad de alimentos, las razones son variadas, entre ellas la anorexia, los ayunos requeridos para exámenes y tratamientos, los síntomas gastrointestinales producidos por los tratamientos antineoplásicos como por el tumor per se –en tumores del SNC especialmente– y los tumores que imposibilitan la deglución y el tránsito de los alimentos.
En 2008, Gómez Candela y cols., aplicaron una encuesta alimentaria a 131 pacientes oncológicos para determinar las modificaciones en el consumo de alimentos en el último mes; el 51% no refirió cambios, el 26% disminución y el 18% incremento. Respecto a los cambios en la consistencia, 81% de los encuestados seguía una dieta normal, el 8% incluía pocos alimentos sólidos y el 5% consumía solo líquidos. El 47% refirió saciedad precoz, disminución del apetito y náuseas (16).
Síntomas gastrointestinales
Los pacientes oncológicos refieren con frecuencia síntomas gastrointestinales en grados variables de severidad. Los más prevalentes son los siguientes.
Mucositis: Se refiere a lesiones inflamatorias, erosivas o ulcerativas en cualquier región del tracto gastrointestinal, siendo la mucositis oral la más frecuente; suele ser muy dolorosa y afectar significativamente el consumo de alimentos, la salud oral y la calidad de vida. La mucositis oral ocurre en el 10% a 40% de los pacientes que reciben un esquema de quimioterapia tradicional para tumores sólidos, en el 80% de los pacientes con cáncer de cabeza y cuello que reciben radioterapia y en el 89% de pacientes que reciben quimioterapia, como preparación para el trasplante de células hematopoyéticas (16). Puede aparecer como resultado de una lesión directa causada por la quimioterapia citotóxica y la radioterapia, por infecciones secundarias a la inmunosupresión o a la enfermedad injerto contra huésped.
Los agentes quimioterapéuticos que pueden provocar estomatotoxicidad directa son los agentes alquilantes como el metotrexato, los antimetabolitos como el 5-fluoracilo, actinomicina D y daunorrubicina. Las manifestaciones clínicas más precoces aparecen de cinco a siete días después de finalizar el tratamiento y pueden durar desde unos días a dos o tres semanas. La gravedad es dosis dependiente y se relaciona con el tipo de tratamiento; para la graduación se recomienda emplear el sistema desarrollado por el Instituto Nacional de Cáncer que va de 0-4 (17).
Disfagia: Deriva del griego dis –dificultad– y fagia –comer–, indica retraso en el paso de alimentos sólidos y/o líquidos de la cavidad oral al estómago, favoreciendo el paso de este material residual a la vía aérea. Los pacientes con mayor riesgo son los de cáncer de cabeza y cuello, en el 66% de ellos se detecta al momento del diagnóstico, el 30% desarrolla neumonía secundaria a este trastorno. La mortalidad por esta causa varía entre 20% y 65% (18).
El tratamiento quirúrgico puede causar injurias anatómicas o neurológicas con patrones específicos de disfagia y aspiración. En las intervenciones de la cavidad oral y orofaríngea, el área de resección tiene más impacto que el tamaño del tumor; la disfagia es común después de la resección de tumores localizados en la parte posterior de la lengua, especialmente en laringuectomia total.
La radioterapia puede lesionar estructuras anatómicas esenciales para la deglución como la lengua, la laringe y los músculos faríngeos. La radiación afecta de manera diferente a los tejidos, en los mucocutáneos se aumenta la permeabilidad vascular favoreciendo la fibrosis causada por el depósito de fibrina y colágeno. El tipo y severidad de los efectos se relacionan directamente con la dosimetría por sesión, dosis total y duración del tratamiento (19,20).
Náuseas y vómito: La náusea se define como una sensación subjetiva desagradable de querer vomitar, puede presentarse con un aumento de la producción de saliva, mareo, debilidad, dificultad para tragar, cambios en la temperatura de la piel y aceleración del ritmo cardíaco (21,22). El vómito es la expulsión forzosa de contenido gástrico, provocado por el reflejo nauseoso y la contracción de los músculos abdominales o intestinales. Estos síntomas son comunes en enfermedad avanzada. La etiología incluye alteraciones metabólicas –falla hepática, hipercalcemia, hiponatremia y uremia–, metástasis al cerebro, aumento de la presión intracraneal, obstrucción intestinal, quimioterapia, radioterapia, estreñimiento, medicamentos y estrés emocional (21). La prevalencia fluctúa del 42 al 52%.
Los factores que determinan la severidad de éstos síntomas son la clase de agentes quimioterapéuticos administrados, las dosis empleadas –dosis más altas representan mayor riesgo–, horarios y frecuencia en que se administra el medicamento, la vía de administración –los medicamentos intravenosos presentan mayor riesgo de náuseas y vomito que los de vía oral– y la susceptibilidad individual. El principal mecanismo de emesis inducida por quimioterapia se produce a nivel abdominal, por la activación de los receptores 5 HT3 de las aferencias vagales y esplénicas, estimulando el centro del vómito (21). Estos síntomas varían en función del tiempo de presentación.
Los agudos aparecen desde minutos hasta varias horas después de administrar el medicamento, suelen durar hasta 24 horas con picos de severidad de cinco a seis horas después de la quimioterapia. Los de aparición tardía se presentan 24 horas después de la administración del agente, especialmente con cisplatino, carboplatino, ciclofosfamida y doxorrubicina; pueden tardar hasta una semana en resolverse; los picos de severidad dependen del medicamento. Los de anticipación son síntomas en los que por una experiencia desagradable con la quimioterapia anterior el paciente experimenta los mismos síntomas, antes de reiniciar el siguiente ciclo, son estimulados por la asociación con olores y sabores y por la ansiedad. Los resistentes a los medicamentos se presentan a pesar del tratamiento instaurado para prevenirlos. Los que no responden al tratamiento se presentan después de uno, pocos o varios tratamientos de quimioterapia y, a pesar del esfuerzo terapéutico para prevenir las náuseas y el vómito, el paciente no reacciona (22).
La frecuencia de náuseas y vómito en radioterapia es del 50%, pueden presentarse dos horas después de la radioterapia y durar varias horas. Son más frecuentes en quienes reciben radioterapia de cuerpo entero, presentándose en seis a nueve de cada 10 pacientes. La combinación de radioterapia y quimioterapia duplica el riesgo de presentación. El riesgo de malnutrición asociado a los síntomas gastrointestinales es alto no solo porque disminuyen el consumo de alimentos sino por la pérdida de nutrientes. Cuando la condición es crónica –mayor a dos semanas–, de alta frecuencia y con contenido alimenticio el riesgo es aún mayor (22).
Diarrea: Es la deposición, tres o más veces al día de heces sueltas o líquidas. De acuerdo a la duración se clasifica como aguda o crónica, siendo el punto de corte cuatro semanas. Las causas más frecuentes son el síndrome de intestino corto, vagotomía, gastrectomías, neuropatías autonómicas localmente generadas por el propio tumor –cáncer de colon–; la deficiencia de enzimas pancreáticas y de hormonas digestivas; la enteritis actínica causada por el efecto citotóxico de los agentes quimioterapéuticos y la por la radiación pélvica en las vellosidades intestinales; las infecciones causadas por agentes ordinarios menos patógenos debido a la inmunosupresión asociada a la patología y el uso de antibióticos como cefalosporina o clindamicina. La diarrea es un efecto secundario común a agentes como: el 5-fluorouracilo o el irinotecan, el cisplatino y el topotecan, la incidencia en monoterapia es mayor al 50% y en esquemas de combinación alcanza el 30% (23).
Estreñimiento: Se define como el paso infrecuente o dificultoso de heces duras, que usualmente causa dolor e incomodidad; es causado por la disminución de líquidos o por movimiento insuficiente del intestino, falta de actividad, debilidad y el uso de medicamentos tipo opioide; en el último caso, la frecuencia varía entre el 40 y 70%, con el uso de morfina oral (21).
Este síntoma puede provocar vómitos, dolor, distención abdominal, flatulencia, anorexia, inquietud y ansiedad. La prevalencia en pacientes con enfermedad oncológica avanzada es de 40%. Los criterios diagnósticos de ROMA II son esfuerzo, heces duras, evacuación incompleta, bloqueo ano-rectal, necesidad de desimpactación y menos de tres movimientos intestinales a la semana. La etiología en el paciente oncológico incluye anormalidades neurológicas –lesión espinal, neuropatía autonómica–, alteraciones metabólicas –hipokalemia, hipocalcemia, uremia y diabetes– y anatómicas, y medicamentos (21). El estreñimiento no implica alto riesgo de desnutrición a menos que se asocie a síntomas que limitan el consumo de alimentos como anorexia y dolor.
Estrés metabólico: Se define como la respuesta que desarrolla el organismo ante cualquier tipo de agresión; consiste en la reorganización del flujo de substratos energéticos y estructurales con el fin de contribuir a atenuar las alteraciones producidas en los diferentes sistemas corporales. La magnitud de la respuesta metabólica varía con el tipo e intensidad de la agresión y evoluciona con el tiempo (23).
Los requerimientos metabólicos del paciente oncológico suelen estar aumentados en relación con la población saludable debido al aumento del gasto metabólico desencadenado por la respuesta inflamatoria y la producción de citoquinas. En modelos animales se ha demostrado que el tamaño del tumor afecta el metabolismo del huésped; en estudios con ratones se encontró que la caquexia se presenta cuando el peso del tumor alcanza entre 10% y 40% del peso del animal; sin embargo, en humanos se manifiesta cuando la excrecencia alcanza el 1% del peso corporal (24).
El aumento del gasto metabólico suele atribuirse a un incremento de la actividad del ciclo de Cory, resultando en desgaste y recambio acelerado de proteínas (24). Las alteraciones en el metabolismo y en el estado nutricional varían en relación al tipo de neoplasia; así, el cáncer gástrico, el hepatocelular, el de pulmón y el de páncreas son altamente catabólicos, mientras que los de seno y hematológicos suelen ser normo metabólicos (24).
Un estudio descriptivo de tipo transversal realizado en 106 pacientes diagnosticados con cáncer de pulmón irresecable, determinó la relación entre la respuesta inflamatoria y la pérdida de peso previa al diagnóstico, encontró que el 40% de los pacientes habían perdido más del 5% de peso usual en los últimos seis meses y que el 80% cumplía con el criterio de respuesta inflamatoria (PCR >10mg/L), concluyó que existe relación entre la severidad de la respuesta inflamatoria y la severidad de la pérdida de peso (25).
Capacidad funcional: La capacidad funcional refleja la capacidad de un individuo de realizar actividades diarias en las dimensiones física, psicológica, social y espiritual. La valoración de la capacidad funcional reúne todos los métodos para describir el perfil del evaluado, se enfoca en las habilidades del individuo para realizar de forma exitosa actividades funcionales, entendidas como el conjunto de tareas que componen el desempeño normal y autónomo de un individuo, su actuación ocupacional y su interacción social, teniendo en cuenta las demandas que le plantea su medio ambiente. La evaluación de la capacidad funcional comprende cuatro componentes.
El físico evalúa las actividades relacionadas con el movimiento como son el mantenimiento y cambio de posiciones básicas, la postura, los traslados, el tomar, mover y usar objetos y, actividades como caminar, correr o subir escaleras. El mental comprende la percepción y comprensión de los estímulos del ambiente y la respuesta a los mismos, la comunicación, comprensión y habilidades cognitivas como orientación, atención, memoria, concentración, etc. El emocional comprende estados emocionales, los sentimientos, comportamientos, la identidad y el autoconcepto. Finalmente, el social se refiere al rol que desempeña el individuo en un contexto social, a las influencias culturales, los recursos sociales y económicos y a las condiciones y estilos de vida.
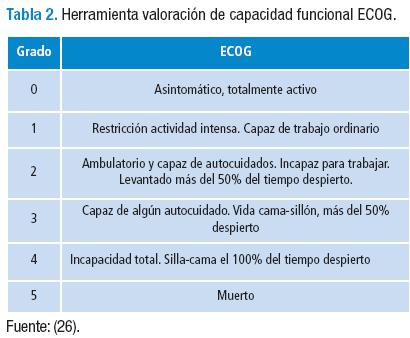
La discapacidad se manifiesta cuando se afecta el desempeño real de un individuo en relación a la expectativa social de normalidad (26). Existen múltiples herramientas validadas para la valoración de la capacidad funcional, como la escala de Karnofsky y la de Barthel. Para el paciente oncológico el Eastern Cooperative Oncology Group (ECOG) desarrolló la siguiente escala (Tabla 2):
Forrest y cols., en 2004 estimaron la mortalidad de pacientes con cáncer de pulmón en función de su capacidad funcional, cuando el ECOG se valoró en 0, 1 y 2 el tiempo de vida media fue de 16, 12 y 7 meses respectivamente (26).
Examen físico
La exploración física detecta la pérdida de masa magra y adiposa especialmente en glúteos, musculatura intercostal tríceps y valorara la presencia de edemas y alteraciones mucocutáneas; la exploración física nutricional está enfocada en revisar los sistemas del organismo y abarca desde la cabeza a los dedos de los pies.
Reserva muscular: La inspección general de brazos y piernas permite valorar la masa muscular y los depósitos de masa adiposa. En estado de depleción nutricional los depósitos de reserva grasa están notablemente disminuidos, al igual que los de masa muscular. El reposo prolongado en cama también favorece la pérdida de masa muscular como se observa en los gemelos de las piernas o los deltoides de los brazos. Se inspeccionan y palpan brazos, manos, codos y hombros para valorar la capacidad motora del paciente y su habilidad para alimentarse y manipular los utensilios.
Para la valoración de la masa muscular se valoran el tono y la funcionalidad. En general, la musculatura de la parte superior del cuerpo suele ser más susceptible de afectación ante una deprivación nutricional, de manera independiente a la actividad del paciente. Las zonas de valoración del estado muscular son fundamentalmente la región temporal, a nivel de la escápula y la clavícula con prominencia de ambas, en los hombros –por pérdida del deltoides–, en muslos y la zona gemelar.
Reserva adiposa: Los depósitos de grasa representan la energía almacenada; la pérdida de grasa subcutánea puede ser diagnosticada a través de la exploración de la zona inferior del ojo, la parte posterior del brazo –pliegue tricipital– y la región intercostal. La observación directa consiste en sujetar un pliegue cutáneo y ver la distancia existente entre los dedos y la zona muscular sin medir con calibrador (14).
Evaluación del estado hídrico: El estrés quirúrgico o la malabsorción crónica pueden llevar a hipoalbuminemia grave y a retención severa de líquidos en forma de edema, ascitis o anasarca; la deshidratación debida a la perdida severa de líquidos se detecta físicamente al evaluar la turgencia de la piel (27).
Causas y consecuencias de la desnutrición en el paciente oncológico
Se pueden establecer cuatro mecanismos principales por los que puede aparecer desnutrición en el paciente oncológico: el escaso aporte de energía y nutrientes, las alteraciones de la digestión o absorción de nutrientes, el aumento de las necesidades energéticas y proteicas y finalmente las alteraciones en el metabolismo de los nutrientes (28).
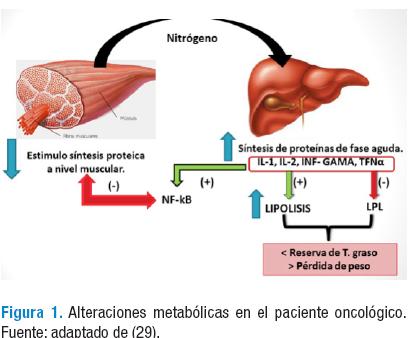
Los pacientes con cáncer cursan con activación del síndrome de respuesta inflamatoria (SIRS); esta respuesta desplaza la síntesis de proteínas de fase media a síntesis de proteínas de fase aguda tales como, proteína C reactiva (PCR), ceruloplasmina C3, haptoglobina, fibrinógeno, antiproteasas y el amiloide A sérico. Las citoquinas proinflamatorias están directamente implicadas en este proceso y su producción está precedida por una cascada inmunológica desencadenada por monocitos y macrófagos. Las citoquinas con mayor impacto son la IL-1, IL-2, IL-6, interferón-gama (IFN-γ) y TFN-α. Este último, participa de manera directa inhibiendo la lipoprotein lipasa (LPL), la cual es la encargada de la lipogénesis; de manera simultánea la IL-2 estimula la acción de la lipasa hormo-sensible (LPL-HS), propiciando la hidrolisis de los triglicéridos en el adipocito, obteniendo ácidos grasos libres. La sinergia de estos dos procesos genera disminución del tejido graso, el cual se refleja primero a nivel del tronco, después en miembros inferiores y por último en miembros superiores (Figura 1) (29).
La atrofia y la pérdida de tejido muscular son resultado de un aumento del catabolismo y de la disminución de la síntesis proteica o de ambos. El aumento del flujo de nitrógeno desde el músculo esquelético al hígado, disminuye el suministro plasmático de los principales precursores para la producción de aminoácidos de cadena larga, necesarios para estimular la síntesis proteica y contribuye como sustrato para la producción de proteínas de fase aguda a nivel hepático. Por otro lado, la IL-1, IL-2, IL-6, IFN-γ y el TFN-α, desencadenan la activación del NF-kβ, el cual favorece la disminución de la síntesis proteica y estimula la proteólisis por la ubiquitina, el mayor sistema responsable del hipercatabolismo relacionado con cáncer (29). La disminución de la fuerza muscular conlleva a la pérdida de fuerza, astenia, inactividad y disminución de la capacidad funcional. La atrofia de los músculos respiratorios induce deterioro funcional; la disminución de la masa miocárdica y de las miofibrillas produce trastornos de la conducción eléctrica y disminución del gasto cardiaco (28,30).
Estos mecanismos humorales y tumorales desencadenan el síndrome de anorexia-caquexia y afectan marcadamente el estado nutricional del paciente oncológico (29). La desnutrición energético-proteica en estos pacientes también afecta la inmunocompetencia, afectando principalmente la inmunidad celular y aumentando el riesgo de complicaciones infecciosas, que es una importante fuente de morbilidad en este grupo de pacientes (28,31). La desnutrición también altera los mecanismos de cicatrización y aumenta el riesgo de complicaciones quirúrgicas tales como la deshiscencia de anastomosis. Tanto las complicaciones infecciosas como las derivadas de la cirugía comportan un aumento de la estancia hospitalaria, circunstancias que contribuyen a elevar los costos de los tratamientos (28,32).
Recomendación
Como se evidencia en la presente revisión narrativa, el paciente oncológico presenta múltiples factores de riesgo que de manera directa o indirecta pueden afectar su estado nutricional y la respuesta al tratamiento antineoplásico instaurado. Es de vital importancia que siempre se realice la tamización nutricional al ingreso hospitalario, con una herramienta validada para la población objeto, con el fin de identificar a los pacientes desnutridos o con riesgo de desnutrición e iniciar oportunamente la recuperación del estado nutricional; esto mejora la respuesta al tratamiento médico y la calidad de vida para los pacientes, cuidadores y familiares. Se requiere de una revisión sistemática de las herramientas de tamización nutricional validadas con el fin de evaluar la calidad metodológica y asi poder recomendar una herramienta específica para el paciente oncológico.
Conflicto de intereses
Ninguno declarado por los autores.
Financiación
Universidad Nacional de Colombia, Sede Bogotá.
Agradecimientos
A quienes hicieron posible la realización del presente trabajo y al Departamento de Nutrición Humana de la Facultad de Medicina. Universidad Nacional de Colombia.
Referencias
1. OPS, OMS, Ministerio de Salud y Protección social. Situación de salud en Colombia. Indicadores básicos. Bogotá: OPS, OMS, Ministerio de Salud y Protección social; 2011 [ Links ]
2. Valenzuela-Landaeta K, Rojas P, Basfi-fer K. Evaluación nutricional del paciente con cáncer. Nutr Hosp. 2012;27:516-23. [ Links ]
3. Chon-Rivas I, Chi-Ramírez D, León-González R, Blanco-Bouza J, Cuevas-Véliz I, Rodríguez-Abascal A, et al. La importancia del estado nutricional para el paciente oncológico. Revista cubana de alimentación y nutrición. 2009;19:133-45. [ Links ]
4. Ulibarri J, Burgos R, Lobo G, Martínez MA, Planas M, Pérez de la Cruz A, et al. Recomendaciones sobre la evaluación del riesgo de desnutrición en los pacientes hospitalizados. Nutr Hosp. 2009;24:467-72. [ Links ]
5. Bauer, Capra S. Comparison of a malnutrition screening tool with subjective global assessment in hospitalized patients with cancer - sensitivity and specificity. Asia Pacific J Clin Nutr. 2003;12:257-60. [ Links ]
6. Isenring E, Cross G, Daniels L, Kellett E, Koczwara B. Validity of the malnutrition screening tool as an effective predictor of nutritional risk in oncology outpatients receiving Chemotherapy. Support Care Cancer. 2006;14:1152-6. http://doi.org/b2vcrp. [ Links ]
7. Kim J, Wie G, Cho Y, Kim SY, Kim SM, Son KH, et al. Development and validation of a nutrition screening tool for hospitalized cancer patients. Clin Nutr. 2011;30:724-9. http://doi.org/b67zp2. [ Links ]
8. FELANPE. Evaluación del estado nutricional del paciente hospitalizado. [Internet]. 2009 [citado 2014 octubre 09]. Disponible en: http://goo.gl/PgdH08. [ Links ]
9. Writing Group of the Nutrition Care Process/Standardized Language Committee. Nutrition care process and model part I: the 2008 update. J Am Diet Assoc. 2008;108:1113-7. http://doi.org/dnkk6b. [ Links ]
10. Teitelbaum D, Guenter P, Howell WH, Kochevar ME, Roth J, Seidner DL. Definition of terms, style, and conventions used in A.S.P.E.N. guidelines and standards. Nutr Clin Pract. 2005;20:281-5. http://doi.org/chkmnf. [ Links ]
11. Lochs H, Allison SP, Meier R, Pirlich M, Kondrup J, Schneider S, et al. Introductory to the ESPEN Guidelines on Enteral Nutrition: Terminology, definitions and general topics. Clin Nutr. 2006;25:180-6. http://doi.org/cjk7c2. [ Links ]
12. Kondrup J, Allison SP, Elia M, Vellas B, Plauth M. Educational and Clinical Practice Committee European Society of Parenteral and Enteral Nutrition (ESPEN). ESPEN guidelines for nutrition screening 2002. Clin Nutr. 2003;22:415-21. http://doi.org/ct796x. [ Links ]
13. Gómez C, Gallego A. Soporte Nutricional en el Paciente oncológico. Madrid: Editorial You & Us S.A.; 2002. p.51-2. [ Links ]
14. Gil A. Tratado de nutrición: nutrición clínica. 2a edición. Madrid: médica panamericana; 2010. p.19. [ Links ]
15. Fearon K, Vos A, Deborah S. Definition of cancer cachexia: effect of weight loss, reduced food intake, and systemic inflammation on functional status and prognosis. Am J Clin Nutr. 2006;83:1345-50. [ Links ]
16. Gómez C, Marín M, Benítez S, Loria V, García M, Lourenço T, et al. Autopercepción de los pacientes con cáncer sobre la relación existente entre su estado nutricional, su alimentación y la enfermedad que padecen. Nutr Hosp. 2008;23:477-86. [ Links ]
17. Olver, IN. The MASCC textbook of cancer supportive care and survivorship. New York: Springer; 2012. p.241. [ Links ]
18. González M. Tratado de medicina paliativa y tratamiento de soporte del paciente con cáncer. 2a edición. Buenos Aires: Médica Panamericana; 2007. p.247-8. [ Links ]
19. Russi EG, Corvò R, Merlotti A, Alterio D, Franco P, Pergolizzi S, et al. Swallowing dysfunction in head and neck cancer patients treated by radiotherapy: Review and recommendations of the supportive task group of the Italian Association of Radiation Oncology. Cancer Treat Rev. 2012;38:1033-49. http://doi.org/xxs. [ Links ]
20. Manikantan K. Dysphagia in head and neck cancer. Cancer Treat Rev. 2009;35:724-32. http://doi.org/chjsp9. [ Links ]
21. Lagman R, Davis M, LeGrand S, Walsh D. Common symptoms in advanced cancer. Surg Clin North Am. 2005;85:237-55. http://doi.org/b5gh5g. [ Links ]
22. American Cancer Society, National Comprehensive Cancer Network. Nausea and vomiting: Treatment guidelines for patients with cancer. 4° versions. [Internet]. 2007 [citado 2014 octubre 09]. Disponible en: http://goo.gl/eC1cSO. [ Links ]
23. Gillespie C, Goode C, Hackett C, Andreyev HJ. The clinical needs of patients with chronic gastrointestinal symptoms after pelvic radiotherapy. Aliment Pharmacol Ther. 2007;26:555-63. http://doi.org/c7cszc. [ Links ]
24. Nitenberg G, Raynard B. Nutritional support of the cancer patient: issues and dilemas. Crit Rev Oncol Hematol. 2000;34:137-68. http://doi.org/bx3g8n. [ Links ]
25. Scott H, McMillan D, Forrest L, Brown DJF, McArdle CS, Milroy R. The systemic inflammatory response, weight loss, performance status and survival in patients with inoperable non-small cell lung cancer. Br J Cancer. 2002;87:264-7. http://doi.org/bsp3vk. [ Links ]
26. Forrest L, McMillan D, McArdle C, Angerson WJ, Dunlop DJ. Comparison of an inflammation-based prognostic score (GPS) with performance status (ECOG) in patients receiving platinum-based chemotherapy for inoperable non-small-cell lung cancer. Br J Cancer. 2004;90:1704-6. [ Links ]
27. Patiño F. Metabolismo, nutrición y shock. 4a edición. Bogotá, D.C: Médica Panamericana; 2006. p.158-9. [ Links ]
28. García LP, Parejo CJ, Pereira CJ. Causas e impacto clínico de la desnutrición y caquexia en el paciente oncológico. Nutr Hosp. 2006;21:10-6. [ Links ]
29. Valenzuela LK, Rojas P, Basfi-fer K. Evaluación nutricional del paciente con cáncer. Nutr Hosp. 2012;27:516-23. [ Links ]
30. Belda C, Castro J, Casado E, González M. Malnutrición y enfermedad neoplásica. En Gómez C, Sastre A (editores). Soporte nutricional en el paciente oncológico. Madrid: You & Us SA; 2002. p.9-15. [ Links ]
31. Valero MA, León M, Celaya S. Nutrición y Cáncer. En Celaya S. Tratado de Nutrición Artificial. Madrid: Grupo Aula Médica; 1998. [ Links ]
32. O'Gorman P, MacMillan DC, AcArdle CS. Impact of weight loss, apetite and the inflamatory response on quality of life in gastrointestinal cancer patients. Nutr Cancer. 1998;32:76-80. http://doi.org/bpth77. [ Links ]