Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.63 no.2 Bogotá Apr./June 2015
https://doi.org/10.15446/revfacmed.v63n2.46195
DOI: http://dx.doi.org/10.15446/revfacmed.v63n2.46195
INVESTIGACIÓN ORIGINAL
Vaciamiento gástrico y diabetes mellitus tipo 2
Gastric emptying and Type 2 diabetes mellitus
Camilo Andrés Quintero-Cadavid1, William Otero-Regino2,3, Roberto Franco-Vega1
1 Unidad de Endocrinología, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá D. C., Colombia.
2 Unidad de Gastroenterología, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá D. C., Colombia.
3 Clínica Fundadores. Bogotá D. C., Colombia.
Correspondencia: Camilo Andrés Quintero-Cadavid. Carrera 30 No. 45-03 Bloque 471. Bogotá, D. C., Colombia. Teléfono: +57 1 3165000. Extensión: 15011. Facultad de Medicina, Universidad Nacional de Colombia. Bogotá D. C., Colombia. Correo electrónico: caaquinteroca@unal.edu.co.
Recibido: 15/10/2014 Aceptado:16/02/2015
Resumen
El adecuado control de la diabetes mellitus tiene una gran importancia desde muchos puntos de vista. En los últimos años, se ha destacado el impacto que tienen los niveles de la glucemia postprandial sobre el manejo y las complicaciones de esta enfermedad. Controlar la hiperglucemia postprandial y, por lo tanto, su participación en el deterioro clínico de los pacientes con diabetes puede conseguirse retardando el vaciamiento gástrico y estimulando el efecto incretina, los cuales se pueden promover utilizando los análogos del péptido similar al glucagón tipo 1 (GLP-1). En este artículo se revisa el concepto del efecto incretina y la utilidad de los análogos GLP-1 en el control de la glicemia en los pacientes con diabetes mellitus tipo 2.
Palabras clave: Diabetes mellitus Tipo 2; Péptido 1 similar al glucagón; Vaciamiento gástrico; Incretinas (DeCS).
Quintero-Cadavid CA, Otero-Regino W, Franco-Vega R. Vaciamiento gástrico y diabetes mellitus tipo 2. Rev. Fac. Med. 2015;63(2):271-8. doi: http://dx.doi.org/10.15446/revfacmed.v63n2.46195.
Summary
Proper control of diabetes mellitus is very important from many points of view. In recent years, the impact of postprandial blood glucose levels on the treatment and complications of this disease has been highlighted. Controlling postprandial hyperglycemia—and, therefore, its participation in the clinical deterioration of patients with diabetes—can be achieved by delaying gastric emptying and stimulating the incretin effect, which can be promoted using the analogues of glucagon-like peptide-1 (GLP-1). In this article, the concept of the incretin effect and usefulness of GLP-1 analogues for glycemic control in patients with type 2 diabetes mellitus is reviewed.
Keywords: Diabetes mellitus, Type 2; Glucagon-like peptide 1; Gastric emptying; Incretins (MeSH).
Quintero-Cadavid CA, Otero-Regino W, Franco-Vega R. [Gastric emptying and Type 2 diabetes mellitus]. Rev. Fac. Med. 2015;63(2):271-8. Spanish. doi: http://dx.doi.org/10.15446/revfacmed.v63n2.46195.
Introducción
La diabetes mellitus (DM) tiene un gran impacto en la población mundial y nacional. El 8,3 % de la población mundial (382 millones) padece esta entidad y para el año 2035 se estima que afectará al 10 % (592 millones) (1). En Colombia, alrededor de 2,13 millones de personas entre 20 y 79 años tienen DM, representando el 7,12 % de la población en ese rango de edades (1) y la prevalencia general de diabetes tipo 2 (DM2) es de 7,4 % en hombres y 8,7 % en mujeres (2). En 2013 la DM estuvo asociada a 5,1 millones de defunciones a nivel mundial, en personas de ese mismo rango etario, siendo las enfermedades cardiovasculares la principal causa de las mismas. En su etiología participan simultáneamente varios factores: genéticos, estilos de vida (dieta, estrés, inactividad física), así como también algunos determinantes metabólicos como resistencia a la insulina y alteración de la tolerancia a la glucosa oral, etc. (3). De diversas maneras y especialmente por el daño macro y microvascular, la DM produce complicaciones serias que deterioran la calidad de vida y aumentan la mortalidad (3). No obstante, a pesar de la disponibilidad de distintos tratamientos, con frecuencia no se logra un adecuado control de la glucemia (4). El tratamiento de esta importante enfermedad se ha dirigido a aumentar la disponibilidad de la insulina, bien sea: administrándola exógenamente o por medio de medicamentos que estimulan su secreción, mejorando la sensibilidad de sus receptores, retardando la liberación y la absorción de carbohidratos en el tracto gastrointestinal o aprovechando el efecto incretina utilizando análogos al péptido similar al glucagón tipo 1 (GLP-1) (4-6). Dado el creciente entusiasmo y la demostración de la eficacia de estas nuevas sustancias, se decidió realizar la presente revisión.
Hemoglobina glicosilada y glucemia postprandial
El control de la hiperglucemia y de la hemoglobina glicosilada (HbA1c) es la piedra angular en el manejo de la diabetes (7). Se considera actualmente que el valor normal de la HbA1c es menor a 5,7 % (4). Los niveles de HbA1c son un reflejo de la integral de la glucosa durante las 24 horas en las últimas 8 a 12 semanas de la medición. Sin embargo, en la última década, diversos estudios han demostrado que la glucemia postprandial participa en la aparición de las diferentes complicaciones y al respecto se ha encontrado lo siguiente:
1. En los pacientes con HbA1c <7,3 %, la glucemia postprandial contribuye hasta en un 70 % a este valor y por lo tanto, para un estricto control, es muy importante el control de la glicemia postprandial (8).
2. Los elevados niveles de glucemia postprandial se asocian a mayores complicaciones cardiovasculares (9,10), debido al estrés oxidativo —especialmente en la célula endotelial— y, aunque existe controversia (11), en general se admite que además de la glucemia en ayunas, la normalización de la glicemia postprandial puede ser un blanco terapéutico (11,12) .
Carbohidratos, incretinas y vaciamiento gástrico
Desde 1932, se ha demostrado que la ingestión de carbohidratos estimula en el tracto intestinal la producción de sustancias que aumentan la secreción de insulina en el páncreas (6). Por esta propiedad, esas sustancias se denominaron incretinas (del inglés intestinal secretion of insulin). Años después se describió "formalmente" el efecto incretina, denominación propuesta por Creutzfeldt en 1979 (13). Dicho efecto se define como el aumento de la secreción de insulina por sustancias de origen intestinal que son producidas en respuesta a ciertos nutrientes (especialmente la glucosa y los lípidos y en menor medida proteínas) (6), por las células enteroendocrinas (5,13).
En virtud de este mecanismo, la administración de una cantidad fija de glucosa produce una secreción de insulina que es 26 % mayor si se suministra por vía oral que si se hace por vía intravenosa (14). El 90 % de este efecto incretina se debe al GLP-1 y al péptido insulino-trópico dependiente de glucosa, conocido inicialmente como polipéptido inhibitorio gástrico (GIP) (5,15,16). El primero es producido principalmente por las células L, que se encuentran distribuidas a lo largo de casi todo el tracto gastrointestinal, especialmente en el íleon y el colon (5); su administración a pacientes con DM2 eleva la secreción de insulina dependiente de glucosa (15,16). La vida media de este GLP-1 es de 2-5 minutos debido, fundamentalmente, a su metabolismo por la enzima dipeptidil peptidasa tipo IV (DPP-IV).
Ahora bien, el GIP es secretado por las células K, que se encuentran en mayor cantidad en el tracto gastrointestinal superior (5). A diferencia de GLP-1, en pacientes diabéticos, la administración exógena de GIP no produce un aumento significativo de la secreción de insulina (15). Los receptores para el GLP-1 (GLP-1R) se encuentran distribuidos en muchos órganos tales como el sistema nervioso central, el tracto gastrointestinal, el sistema cardiovascular y las células β de los islotes pancreáticos, entre otros (5). El GLP-1R estimula la producción de AMP cíclico que, por diversas vías de señalización, produce aumento de calcio intracelular y, además, inhibe los canales de potasio Kν, impidiendo la repolarización de la célula (5). Estos cambios amplifican la secreción de insulina inducida por glucosa y de igual manera la activación de GLP-1R aumenta la transcripción del gen de la insulina, la síntesis de insulina e inhibe la secreción de glucagón (17).
Este último mecanismo ha demostrado ser tan importante como el efecto sobre la secreción de insulina para disminuir la glucemia (18). En personas no diabéticas, el 50-70 % de la secreción de insulina es consecuencia del efecto incretina, mientras en DM2 es sólo responsable del 10 al 40 % (19), por lo cual se considera que en la fisiopatología de la DM2 pueden estar involucrados trastornos en la dinámica de las incretinas y además hay disminución de los niveles de GLP-1 (20,21). Entre los mecanismos considerados claves para el efecto antidiabético de estas sustancias, se encuentran los siguientes:
1. En modelos animales se ha encontrado que GLP-1 disminuye el apetito y aumenta la saciedad y, de la misma manera, se han encontrado receptores GLP-1 en las zonas del sistema nervioso central que se sabe controlan la saciedad/hambre (5,17)
2. Aumento de la masa de las células β, por inducir la proliferación e inhibir la apoptosis de las mismas simultáneamente (5,17,22). Asimismo, se ha demostrado una disminución del estrés del retículo endoplásmico de estas células (5), y en general aumento de células pancreáticas endocrinas y exocrinas en cadáveres de pacientes diabéticos tratados con terapia incretínica frente a diabéticos no tratados con estos medicamentos (23).
3. Disminución del vaciamiento gástrico (VG) (20). Tanto en diabéticos como en no diabéticos, el VG es responsable de aproximadamente el 35 % de la variabilidad de la glucemia (24,25) y probablemente por este mecanismo se explican las principales acciones antidiabéticas de las incretinas, que incluso pueden tener una importancia mayor que el efecto insulino-trópico de las mismas (26).
Los niveles de glucemia postprandial son influidos por diversos factores tales como los niveles de glucosa previos, la composición de los alimentos, la velocidad con que éstos son digeridos e impulsados al intestino, la absorción intestinal y la respuesta insulínica, además del metabolismo periférico que se haga de los carbohidratos. Pero de estos determinantes, los más importantes son el VG y el efecto incretina (26).
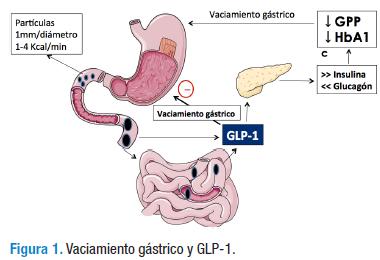
El VG es un proceso complejo en el cual hay una integración coordinada de varios eventos fisiológicos que incluyen la actividad motora del estómago proximal, del antro, del píloro y del duodeno (27). Los pasos más importantes involucrados se inician con una relajación "receptiva" del fundus para acomodar los alimentos ingeridos, seguida de una relajación adaptativa más prolongada. Simultáneamente el estómago distal presenta contracciones circulares las cuales desplazan los alimentos hacía el píloro. Esas ondas se originan en el marcapasos gástrico, localizado en las células intersticiales de Cajal en el estómago proximal, que producen tres ciclos por minuto (28). Los sólidos inicialmente son almacenados en el estómago proximal y progresivamente triturados hasta el punto que las partículas tengan un tamaño de 1 mm. Estas continúan mezclándose con el jugo gástrico formando el quimo, que entonces es vaciado hacia el duodeno a una "velocidad" de 1 a 4 Kcal/min (29). Esta tasa de vaciamiento es controlada por retroalimentación negativa, la cual está mediada por hormonas intestinales tales como la colecistoquinina, el péptido YY y el GLP-1(5)(Figura 1)..
El estómago tritura los alimentos que son liberados cuando su tamaño alcanza 1mm a una velocidad (ver comentario de arriba) de 1-4Kcal/min. Ahora bien, el intestino libera GLP-1, el cual disminuye el apetito, aumenta la secreción de insulina y disminuye la producción de glucagón, que da lugar a una disminución de la glucemia postprandial (GPP) y de la hemoglobina glicosilada (HbA1c). El GLP-1 adicionalmente disminuye el vaciamiento gástrico.
El vaciamiento del contenido gástrico hacia el intestino produce una elevación de la glucemia y simultáneamente estimula la secreción de incretinas. Correlativo a lo anterior, la acción incretínica y la elevación de la glucemia actúan inhibiendo el VG y, de esta manera, se logra un equilibrio homeostático (26). Cuando el GLP-1 es administrado exógenamente por vía venosa produce una marcada reducción de la motilidad gástrica tanto en sujetos sanos como en los que tienen DM2 (30,31), mientras que el GIP produce incluso un pequeño aumento del vaciamiento (32). Cuando hay hiperglucemia, se atrasa el VG y los agentes proquinéticos —como la eritromicina— no producen aumento significativo del éste (33). Por el contrario, la hipoglucemia aumenta el vaciamiento, incluso a pesar de estar utilizando agonistas GLP-1 u otros agentes con acciones similares (34).
La magnitud del retraso del VG que ocurre con GLP-1 depende del estado basal (34); es decir, que si ya existe un vaciamiento lento, los cambios son mínimos, pero hace falta que nuevos estudios cuantifiquen estas diferencias en pacientes con gastroparesia. La capacidad de GLP-1 para disminuir la glucemia postprandial es proporcional a la disminución del vaciamiento (35,36). La regulación del VG y, en consecuencia, de la glucemia postprandial repercute de modo importante en el control metabólico. El alcance del problema es grande, ya que se ha visto que entre un 30 y 50 % de pacientes con DM (DM1 y DM2) de larga evolución presentan retraso del VG (26) y, por tener poca sintomatología (37), la mayor parte de estos pasan desapercibidos. El control y seguimiento de la DM se hace más difícil cuando hay alteraciones del VG.
Cuando el tránsito gástrico se atrasa en diabéticos que no utilizan insulina, se aprecia una disminución de las excursiones glucémicas postprandiales, y lo contrario ocurre cuando aumenta el vaciamiento (38). Es preciso tener presente que en diabéticos con gastroparesia, disminuyen los requerimientos de insulina y, por ello, es preciso ajustar las dosis de los medicamentos para el control de la glucemia (34). Teniendo en cuenta el efecto incretina del GLP-1, los agonistas sintéticos de este han emergido como una importante opción terapéutica en los pacientes con DM. Además de su efecto sobre la secreción de insulina y la disminución del VG, estas sustancias tienen efectos en varios órganos y sistemas que tienen receptores para el mismo (5). Entre éstos, los más importantes son los siguientes:
Cardioprotección. Hay evidencia experimental in vitro y en animales, de que los agonistas del GLP-1R ejercen acciones cardioprotectoras directas sobre los cardiomiocitos y los vasos sanguíneos, disminuyen la presión arterial en DM2, poseen efectos renales natriuréticos y, en estudios preclínicos, han demostrado reducir la disfunción cardiovascular y la inflamación (39).
Neuroprotección. El GLP-1 interviene en la generación de neuronas y células gliales, aumenta la plasticidad neuronal y mejora la actividad del sistema dopaminérgico (40); pero al igual que con los efectos cardiovasculares, hacen falta estudios que demuestren en humanos los efectos observados en los modelos preclínicos.
Natriuresis. Se han encontrado GLP-1R en el riñón localizado en los túbulos proximales y en el endotelio glomerular, y se ha demostrado que la administración de GLP-1 produce aumento de la natriuresis y disminución de la presión arterial. Al parecer hay un mecanismo indirecto adicional consistente en el estímulo de secreción de péptido natriurético auricular (41).
Mineralización ósea. Estudios en roedores han evidenciado que GLP-1 favorece la mineralización del hueso. Se postulan efectos directos sobre los osteoblastos y se conocen mecanismos directos sobre las células C tiroideas (estímulo de secreción de calcitonina y por ende antagonismo de la resorción ósea) (42).
Tejido adiposo. En la grasa blanca, se han encontrado GLP-1R que median acciones lipolíticas y antiinflamatorias lo mismo que en grasa abdominal de sujetos obesos (reducción de macrófagos M1 "proinflamatorios" y de citoquinas) (43).
Farmacológicamente, el efecto de GLP-1 se puede lograr bien sea utilizando agonistas que tengan una vida media más larga y que eviten ser metabolizados por la enzima DPP-IV o bien inhibiendo esta última para que la producción endógena y natural de GLP-1 ejerza su actividad más tiempo al evitar que sea rápidamente metabolizado (44). Ambas estrategias impactan positivamente el control metabólico de los pacientes diabéticos, pero sólo los agonistas directos de GLP-1 tienen efectos significativos sobre el VG y sobre reducción de peso.
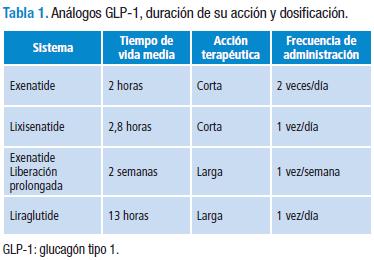
Las diferencias entre los agonistas de GLP-1 y los inhibidores de DPP-IV radican en el comportamiento de GLP-1 que, en el caso de los inhibidores de la enzima, corresponde simplemente al del péptido endógeno. Con el uso de agonistas, hay un aumento de los niveles de GLP-1, mientras que con los inhibidores de DPP-IV sólo se logra disminuir el catabolismo de la incretina endógena (45). Los agonistas directos son más resistentes a la acción enzimática y poseen una afinidad mayor por el receptor. Estas diferencias hacen que los agonistas de GLP-1 reduzcan el VG y logren, en la mayoría de los casos, reducción de peso; mientras los inhibidores de DPP-IV sólo tienen un efecto neutro sobre éste (45) y no modifican el VG (31). Existen varios análogos de GLP1, y los que en la actualidad se encuentran disponibles para uso en la clínica son: el exenatide, lixisenatide, exenatide de liberación prolongada y el liraglutide (46-49). Tabla 1.
No hay estudios que permitan definir, con un soporte claro en la evidencia, las indicaciones precisas sobre el momento en el cual deben incorporarse estos medicamentos en el manejo de la diabetes. Sin embargo, por su mecanismo de acción y por los estudios con los que contamos actualmente, las recomendaciones de las asociaciones internacionales, sugieren su uso como coadyuvante farmacológico en el manejo de los pacientes con DM2, indicando que pueden adicionarse como parte del grupo de medicamentos de segunda o tercera línea, en pacientes en quienes no se haya logrado un control glucémico óptimo y que tienen beneficios adicionales en pacientes con índice de masa corporal elevado (4,50,51). Se señala además la ventaja de ser uno de los medicamentos que no inducen hipoglucemia (52). Basados en los estudios realizados hasta ahora y a las recomendaciones de las asociaciones antes mencionadas, los agonistas del receptor GLP-1 pueden combinarse en la práctica clínica actual con insulinas, metformina, sulfonilureas y tiazolidinedionas.
Lixisenatide es el análogo que tiene mayor afinidad por el receptor de GLP-1 (53). En el grupo de los agonistas de corta acción, exenatide tiene una afinidad al receptor similar al GLP-1 endógeno, mientras lixisenatide es 4 veces más afín (53). El efecto sobre el VG de los análogos de acción larga se aminora con rapidez probablemente por la taquifilaxia secundaria a una estimulación permanente del receptor (54). Esta última e importante diferencia es seguramente la responsable de que los análogos de acción corta tengan un mayor impacto sobre la glucemia postprandial (GPP), y de ahí que se les denomine análogos prandiales; mientras que los de acción larga no impactan esta variable y se conocen como análogos no prandiales (55).
Los dos análogos de acción corta han demostrado mejoría de los niveles de glucemia postprandial, con cifras que varían de acuerdo al diseño de los estudios y del manejo previo con el que venía el paciente. La reducción con exenatide oscila entre el 30,6 mg/dL y el 118,8 mg/dL y lixisenatide entre el 99 mg/dL y el 111,6 mg/dL (55). El estudio GetGoal-X (56), orientado a demostrar no inferioridad de lixisenatide con respecto a exenatide, evidenció que tenían una eficacia similar en reducción de HbA1c como desenlace primario y con un perfil bastante similar en cuanto a disminución de peso, glucemia basal y efectos secundarios.
Varios estudios han comparado análogos de acción corta con los de larga acción con las siguientes diferencias principales:
Exenatide – Liraglutide: Se documentó mayor disminución de la GPP con exenatide (57). Liraglutide fue superior en la intensidad de la reducción de la HbA1c (1,12 % contra 0,79 %) (57).
Exenatide – Exenatide LP: Exenatide de corta acción tuvo un descenso más marcado sobre la GPP. A las 30 semanas de terapia, la glucemia 2 horas postprandial fue de 28,8 mg/dL menor con exenatide de corta acción (58). Sin embargo, se obtuvieron niveles más bajos de HbA1c con exenatide de aplicación semanal (reducción de 1,9 % contra 1,5 %) (58).
Lixisenatide – Liraglutide. A los 28 días de tratamiento, la glucemia 2 horas postprandial en el grupo de lixisenatide fue 154 mg/dL menor (226,8 mg/dL contra 72 mg/dL) (59). Por el contrario, liraglutide mostró superioridad en los parámetros de glucemia basal de ayuno, HbA1c y peso (reducciones con diferencias de 18 mg/dL, 0,2 % y 0,8 Kg respectivamente) (59).
Finalmente, con respecto a las diferencias entre los análogos de larga acción entre sí, el estudio DURATION-6 muestra que liraglutide tiene una reducción mayor sobre los niveles de HbA1c (1,48 % contra 1,28 %), mientras que hubo más pérdida de peso con exenatide LP (3,57 kg frente a 2,68 kg) (60).
Efectos secundarios de los agonistas GLP-1
Los efectos adversos más frecuentes son náuseas, vómito y diarrea, los cuales se han encontrado entre 10-40 % de los pacientes (61). Las náuseas y el vómito usualmente desaparecen una a tres semanas después de iniciar la medicación (57,62). En diversos estudios se han descrito otros efectos más serios, pero existe controversia con relación a los mismos (58,59), ya que no hay evidencia de que haya una asociación de causalidad entre estos medicamentos y las complicaciones reportadas en los estudios preclínicos (63-65). Los principales efectos adversos en disputa asociados a su uso son los siguientes:
Pancreatitis: Clásicamente esta patología se presenta con mayor frecuencia en pacientes diabéticos con respecto a los no diabéticos. En los estudios retrospectivos no se ha encontrado asociación estadística entre esta entidad y el uso de terapia proincretínica (66), aunque hay críticas sobre la metodología utilizada en algunas de esas investigaciones (64). No obstante, en los ensayos clínicos sí se han reportado más casos de pancreatitis en el grupo de tratamiento con agonistas GLP-1 que en el grupo placebo (67,68).
Cáncer de páncreas: Hasta el momento se ha encontrado igualmente una asociación, sin comprobar causalidad, pero sólo se dispone de estudios observacionales (65).
Cáncer de tiroides: En estudios con modelos animales se ha encontrado que la activación del receptor GLP-1 puede desencadenar hiperplasia de las células C de la tiroides y desarrollo de carcinoma medular, pero no hay aún resultados de los estudios en desarrollo que permitan establecer conclusiones de lo que ocurre en humanos a largo plazo (66). Igualmente se ha encontrado expresión de receptores GLP-1 en células de carcinoma papilar de tiroides, aunque se desconoce la significancia clínica de este hallazgo (64).
Como recomendaciones prácticas con respecto a estos posibles riesgos, se desaconseja el uso de estos medicamentos en pacientes con diagnóstico previo de cáncer medular de tiroides o neoplasia endocrina múltiple tipo 2 y cáncer de páncreas. Deben usarse con precaución en pacientes con factores de riesgo para desarrollar pancreatitis (litiasis biliar, ingesta pesada de alcohol e hipertrigliceridemia). Igualmente, es importante explicar al paciente los síntomas de pancreatitis para que busque valoración médica (69).
Conclusiones
DM2 es una enfermedad de alta prevalencia que se encuentra en aumento a nivel mundial y tiene importantes complicaciones con aumento de la morbimortalidad en los pacientes. Su adecuado manejo influye enormemente en la calidad de vida y en la disminución de la mortalidad. El conocimiento sobre la influencia del VG en los niveles de glucemia, mediados fundamentalmente por el efecto incretina de GLP-1, se ha traducido en la síntesis de análogos de éste como una nueva estrategia terapéutica con resultados favorables en el manejo de la DM2. Hasta el momento los resultados son muy alentadores y la inspiración para su utilización es el renovado interés del efecto incretina y la disminución del VG como un mecanismo adicional para disminuir la disponibilidad de glucosa en el tracto gastrointestinal para su absorción. Se esperan estudios a largo plazo para determinar el impacto de estos nuevos medicamentos en el control de esta importante patología, así como también la incidencia real de efectos adversos.
Conflicto de intereses
Ninguno declarado por los autores.
Financiación
Ninguna declarada por los autores.
Agradecimientos
Ninguno declarado por los autores.
Referencias
1. Aguiree F, Brown A, Cho NH, Dahlquist G, Dodd S, Dunning T, et al. IDF Diabetes Atlas [Internet]. 6th edition. Brussels, Belgium: International Diabetes Federation; 2013 [cited 2015 mar 07]. Available from: http://goo.gl/zRrK1E. [ Links ]
2. Asociación Colombiana de Diabetes (ACD). Ciencia y servicio. Centro Educativo IDF. Prevalencia diabetes en Colombia [Internet]. 2012 [cited 2015 mar 07]. Available from: http://goo.gl/jA7qTt3. [ Links ]
3. Zimmet P, Alberti KG, Shaw J. Global and societal implications of the diabetes epidemic. Nature [Internet]. 2001 [cited 2015 mar 07];414(6865):782-7. doi: http://doi.org/csk8xp. [ Links ]
4. American Diabetes Association. Standards of medical care in diabetes-2015. In: Cefalu, W, editor. Diabetes Care [Internet]. 2015 [cited 2015 mar 07];38(Suppl1):S14-80. doi: http://doi.org/twn. [ Links ]
5. Cho YM, Fujita Y, Kieffer TJ. Glucagon-like peptide-1: glucose homeostasis and beyond. Annu Rev Physiol [Internet]. 2014 [cited 2015 mar 07];76:535-59. doi: http://doi.org/2n5. [ Links ]
6. Baggio LL, Drucker DJ. Biology of incretins: GLP-1 and GIP. Gastroenterology [Internet]. 2007 [cited 2015 mar 07];132(6):2131-57. doi: http://doi.org/c8rk2h. [ Links ]
7. Goldstein DE, Little RR, Lorenz RA, Malone JI, Nathan D, Peterson CM, et al.Tests of glycemia in diabetes. Diabetes Care [Internet]. 2004 [cited 2015 mar 07];27(7):1761-73. doi: http://doi.org/b7vg2k. [ Links ]
8. Monnier L, Lapinski H, Colette C. Contributions of fasting and postprandial plasma glucose increments to the overall diurnal hyperglycemia of type 2 diabetic patients: variations with increasing levels of HbA(1c). Diabetes Care [Internet]. 2003 [cited 2015 mar 07];26(3):881-5. doi: http://doi.org/fbgp6f. [ Links ]
9. Cavalot F, Petrelli A, Traversa M, Bonomo K, Fiora E, Conti M, et al. Postprandial blood glucose is a stronger predictor of cardiovascular events than fasting blood glucose in type 2 diabetes mellitus, particularly in women: lessons from the San Luigi Gonzaga Diabetes Study. J Clin Endocrinol Metab [Internet]. 2006 [cited 2015 mar 07];91(3):813-9. doi: http://doi.org/fvdh7c. [ Links ]
10. Hanefeld M, Fischer S, Julius U, Schulze J, Schwanebeck U, Schmechel H, et al. Risk factors for myocardial infarction and death in newly detected NIDDM: the Diabetes Intervention Study, 11-year follow-up. Diabetologia [Internet]. 1996 [cited 2015 mar 07];39(12):1577-83. doi: http://doi.org/bv6cgg. [ Links ]
11. Kilpatrick ES, Rigby AS, Atkin SL. Effect of glucose variability on the long-term risk of microvascular complications in type 1 diabetes. Diabetes Care [Internet]. 2009 [cited 2015 mar 07];32(10):1901-3. doi: http://doi.org/ft22jw. [ Links ]
12. Frontoni S, Di Bartolo P, Avogaro A, Bosi E, Paolisso G, Ceriello A. Glucose variability: An emerging target for the treatment of diabetes mellitus. Diabetes Res Clin Pract [Internet]. 2013 [cited 2015 mar 07];102(2):86-95. doi: http://doi.org/f2n3td. [ Links ]
13. Creutzfeldt W. The incretin concept today. Diabetologia [Internet]. 1979 [cited 2015 mar 07];16(2):75-85. doi: http://doi.org/cqrb27. [ Links ]
14. Shapiro ET, Tillil H, Miller MA, Frank BH, Galloway JA, Rubenstein AH, et al. Insulin secretion and clearance. Comparison after oral and intravenous glucose. Diabetes [Internet]. 1987 [cited 2015 mar 07];36(12):1365-71. doi: http://doi.org/2n7. [ Links ]
15. Nauck MA, Heimesaat MM, Orskov C, Holst JJ, Ebert R, Creutzfeldt W. Preserved incretin activity of glucagon-like peptide 1 [7-36 amide] but not of synthetic human gastric inhibitory polypeptide in patients with type-2 diabetes mellitus. J Clin Invest [Internet]. 1993 [cited 2015 mar 07];91(1):301-7. doi: http://doi.org/c9drkn. [ Links ]
16. Nauck MA, Vardarli I, Deacon CF, Holst JJ, Meier JJ. Secretion of glucagon-like peptide-1 (GLP-1) in type 2 diabetes: what is up, what is down? Diabetologia [Internet]. 2011 [cited 2015 mar 07];54(1):10-8. doi: http://doi.org/c5xhhn. [ Links ]
17. Nogales-Aguado P, Arrieta-Blanco F. Incretinas: nueva opción terapéutica para la diabetes mellitus tipo 2. JANO [Internet]. 2010 [cited 2015 mar 08];1756(1):62-6. Available from: http://goo.gl/BFrR2a. [ Links ]
18. Hare KJ, Vilsbøll T, Asmar M, Deacon CF, Knop FK, Holst JJ. The glucagonostatic and insulinotropic effects of glucagon-like peptide 1 contribute equally to its glucose-lowering action. Diabetes [Internet]. 2010 [cited 2015 mar 08];59(7):1765-70. doi: http://doi.org/fj86n4. [ Links ]
19. Cho YM, Merchant CE, Kieffer TJ. Targeting the glucagon receptor family for diabetes and obesity therapy. Pharmacol Ther [Internet]. 2012 [cited 2015 mar 08];135(3):247-78. doi: http://doi.org/2pf. [ Links ]
20. Imeryüz N, Yeğen BC, Bozkurt A, Coşkun T, Villanueva-Penacarrillo ML, Ulusoy NB. Glucagon-like peptide-1 inhibits gastric emptying via vagal afferent-mediated central mechanisms. Am J Physiol [Internet]. 1997 [cited 2015 mar 08];273(4 Pt1):G920-7. Available from: http://goo.gl/Urq2Vj. [ Links ]
21. Vilsbøll T, Krarup T, Deacon CF, Madsbad S, Holst JJ. Reduced postprandial concentrations of intact biologically active glucagon-like peptide 1 in type 2 diabetic patients. Diabetes [Internet]. 2001 [cited 2015 mar 09];50(3):609-13. doi: http://doi.org/d3pbzx. [ Links ]
22. Farilla L, Bulotta A, Hirshberg B, Li Calzi S, Khoury N, Noushmehr H, et al. Glucagon-like peptide 1 inhibits cell apoptosis and improves glucose responsiveness of freshly isolated human islets. Endocrinology [Internet]. 2003 [cited 2015 mar 09];144(12):5149-58. doi: http://doi.org/b2c2zk. [ Links ]
23. Butler AE, Campbell-Thompson M, Gurlo T, Dawson DW, Atkinson M, Butler PC. Marked expansion of exocrine and endocrine pancreas with incretin therapy in humans with increased exocrine pancreas dysplasia and the potential for glucagon-producing neuroendocrine tumors. Diabetes [Internet]. 2013 [cited 2015 mar 09];62(7):2595-604. doi: http://doi.org/2pt. [ Links ]
24. Horowitz M, Edelbroek MA, Wishart JM, Straathof JW. Relationship between oral glucose tolerance and gastric emptying in normal healthy subjects. Diabetologia [Internet]. 1993 [cited 2015 mar 09];36(9):857-62. doi: http://doi.org/fv5mn8. [ Links ]
25. Jones KL, Horowitz M, Carney BI, Wishart JM, Guha S, Green L. Gastric emptying in early noninsulin-dependent diabetes mellitus. J Nucl Med [Internet]. 1996 [cited 2015 mar 09];37(10):1643-8. PubMed PMID: 8862300. [ Links ]
26. Chang J, Rayner CK, Jones KL, Horowitz M. Diabetic gastroparesis and its impact on glycemia. Endocrinol Metab Clin North Am [Internet]. 2010 [cited 2015 mar 09];39(4):745-62. doi: http://doi.org/bhvn2c. [ Links ]
27. Stevens JE, Jones KL, Rayner CK, Horowitz M. Pathophysiology and pharmacotherapy of gastroparesis: current and future perspectives. Expert Opin Pharmacother [Internet]. 2013 [cited 2015 mar 09];14(9):1171-86. doi: http://doi.org/2pw. [ Links ]
28. Cheng LK, O'Grady G, Du P, Egbuji JU, Windsor JA, Pullan AJ. Gastrointestinal system. Wiley Interdiscip Rev Syst Biol Med [Internet]. 2010 [cited 2015 mar 09];2(1):65-79. doi: http://doi.org/cv5qsf. [ Links ]
29. Horowitz M, Dent J. Disordered gastric emptying: mechanical basis, assessment and treatment. Baillieres Clin Gastroenterol [Internet]. 1991 [cited 2015 mar 09];5(2):371-407. doi: http://doi.org/dm5km7. [ Links ]
30. Nauck MA, Niedereichholz U, Ettler R, Holst JJ, Orskov C, Ritzel R, et al. Glucagon-like peptide 1 inhibition of gastric emptying outweighs its insulinotropic effects in healthy humans. Am J Physiol [Internet]. 1997 [cited 2015 mar 09];273(5 Pt1):E981-8. Available from: http://goo.gl/AOdKmh. [ Links ]
31. Meier JJ, Gallwitz B, Salmen S, Goetze O, Holst JJ, Schmidt WE, et al. Normalization of glucose concentrations and deceleration of gastric emptying after solid meals during intravenous glucagon-like peptide 1 in patients with type 2 diabetes. J Clin Endocrinol Metab [Internet]. 2003 [cited 2015 mar 09];88(6):2719-25. doi: http://doi.org/c6qtrm. [ Links ]
32. Meier JJ, Goetze O, Anstipp J, Hagemann D, Holst JJ, Schmidt WE, et al. Gastric inhibitory polypeptide does not inhibit gastric emptying in humans. Am J Physiol Endocrinol Metab [Internet]. 2004 [cited 2015 mar 09];286(4):E621-5. doi: http://doi.org/bppt5r. [ Links ]
33. Jones KL, Berry M, Kong MF, Kwiatek MA, Samsom M, Horowitz M. Hyperglycemia attenuates the gastrokinetic effect of erythromycin and affects the perception of postprandial hunger in normal subjects. Diabetes Care [Internet]. 1999 [cited 2015 mar 09];22(2):339-44. doi: http://doi.org/bm92wh. [ Links ]
34. Marathe CS, Rayner CK, Jones KL, Horowitz M. Relationships between gastric emptying, postprandial glycemia, and incretin hormones. Diabetes Care [Internet]. 2013 [cited 2015 mar 09];36(5):1396-405. doi: http://doi.org/2p2. [ Links ]
35. Deane AM, Chapman MJ, Fraser RJ, Summers MJ, Zaknic AV, Storey JP, et al. Effects of exogenous glucagon-like peptide-1 on gastric emptying and glucose absorption in the critically ill: relationship to glycemia. Crit Care Med [Internet]. 2010 [cited 2015 mar 09];38(5):1261-9. doi: http://doi.org/bpxtzb. [ Links ]
36. Little TJ, Pilichiewicz AN, Russo A, Phillips L, Jones KL, Nauck MA, et al. Effects of intravenous glucagon-like peptide-1 on gastric emptying and intragastric distribution in healthy subjects: relationships with postprandial glycemic and insulinemic responses. J Clin Endocrinol Metab [Internet]. 2006 [cited 2015 mar 09];91(5):1916-23. doi: http://doi.org/dx7xf4. [ Links ]
37. Bharucha AE, Camilleri M, Forstrom LA, Zinsmeister AR. Relationship between clinical features and gastric emptying disturbances in diabetes mellitus. Clin Endocrinol (Oxf) [Internet]. 2009 [cited 2015 mar 09];70(3):415-20. doi: http://doi.org/dp6gjd. [ Links ]
38. Gonlachanvit S, Hsu CW, Boden GH, Knight LC, Maurer AH, Fisher RS, et al. Effect of altering gastric emptying on postprandial plasma glucose concentrations following a physiologic meal in type-II diabetic patients. Dig Dis Sci [Internet]. 2003 [cited 2015 mar 09];48(3):488-97. doi: http://doi.org/csqsm7. [ Links ]
39. Ussher JR, Drucker DJ. Cardiovascular biology of the incretin system. Endocr Rev [Internet]. 2012 [cited 2015 mar 09];33(2):187-215. doi: http://doi.org/2p3. [ Links ]
40. Holst JJ, Burcelin R, Nathanson E. Neuroprotective properties of GLP-1: theoretical and practical applications. Curr Med Res Opin [Internet]. 2011 [cited 2015 mar 09];27(3):547-58. doi: http://doi.org/dsgn6x. [ Links ]
41. Yerram P, Whaley-Connell A. Novel role for the incretins in blood pressure regulation. Curr Opin Nephrol Hypertens [Internet]. 2012 [cited 2015 mar 09];21(5):463-8. doi: http://doi.org/2p4. [ Links ]
42. Yamada C, Yamada Y, Tsukiyama K, Yamada K, Udagawa N, Takahashi N, et al. The murine glucagon-like peptide-1 receptor is essential for control of bone resorption. Endocrinology [Internet]. 2008 [cited 2015 mar 09];149(2):574-9. doi: http://doi.org/frt6ns. [ Links ]
43. Sancho V, Trigo MV, Martín-Duce A, González N, Acitores A, Arnés L, et al. Effect of GLP-1 on D-glucose transport, lipolysis and lipogenesis in adipocytes of obese subjects. Int J Mol Med [Internet]. 2014 [cited 2015 mar 09];17(6):1133-7. doi: http://doi.org/2p6. [ Links ]
44. Boland BS, Edelman SV, Wolosin JD. Gastrointestinal complications of diabetes. Endocrinol Metab Clin North Am [Internet]. 2013 [cited 2015 mar 09];42(4):809-32. doi: http://doi.org/2p7. [ Links ]
45. Drucker DJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet [Internet]. 2006 [cited 2015 mar 09];368(9548):1696-705. doi: http://doi.org/ffsdxb. [ Links ]
46. Bode B. An overview of the pharmacokinetics, efficacy and safety of liraglutide. Diabetes Res Clin Pract [Internet]. 2012 [cited 2015 mar 09];97(1):27-42. doi: http://doi.org/fxrtd6. [ Links ]
47. Petersen AB, Knop FK, Christensen M. Lixisenatide for the treatment of type 2 diabetes. Drugs Today (Barc) [Internet]. 2013 [cited 2015 mar 09];49(9):537-53. doi: http://doi.org/2p8. [ Links ]
48. Kim D, MacConell L, Zhuang D, Kothare PA, Trautmann M, Fineman M, et al. Effects of once-weekly dosing of a long-acting release formulation of exenatide on glucose control and body weight in subjects with type 2 diabetes. Diabetes Care [Internet]. 2007 [cited 2015 mar 09];30(6):1487-93. doi: http://doi.org/d9wbnh. [ Links ]
49. Schnabel CA, Wintle M, Kolterman O. Metabolic effects of the incretin mimetic exenatide in the treatment of type 2 diabetes. Vasc Health Risk Manag [Internet]. 2006 [cited 2015 mar 09];2(1):69-77. doi: http://doi.org/d3ghrv. [ Links ]
50. Garber AJ, Abrahamson MJ, Barzilay JI, Blonde L, Bloomgarden ZT, Bush MA, et al. American Association of Clinical Endocrinologists' comprehensive diabetes management algorithm 2013 consensus statement executive summary. Endocr Pract [Internet]. 2013 [cited 2015 mar 09];19(3):536-57. doi: http://doi.org/2p9. [ Links ]
51. Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M, et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care [Internet]. 2012 [cited 2015 mar 09];35(6):1364-79. doi: http://doi.org/2qb. [ Links ]
52. Egan JM, Clocquet AR, Elahi D. The insulinotropic effect of acute exendin-4 administered to humans: comparison of nondiabetic state to type 2 diabetes. J Clin Endocrinol Metab [Internet]. 2002 [cited 2015 mar 09];87(3):1282-90. doi: http://doi.org/2qc. [ Links ]
53. Thorkildsen C, Neve S, Larsen BD, Meier E, Petersen JS. Glucagon-like peptide 1 receptor agonist ZP10A increases insulin mRNA expression and prevents diabetic progression in db/db mice. J Pharmacol Exp Ther [Internet]. 2003 [cited 2015 mar 09];307(2):490-6. doi: http://doi.org/drsqjf. [ Links ]
54. Nauck MA, Kemmeries G, Holst JJ, Meier JJ. Rapid tachyphylaxis of the glucagon-like peptide 1-induced deceleration of gastric emptying in humans. Diabetes [Internet]. 2011 [cited 2015 mar 09];60(5):1561-5. doi: http://doi.org/d7pz8z. [ Links ]
55. Owens DR, Monnier L, Bolli GB. Differential effects of GLP-1 receptor agonists on components of dysglycaemia in individuals with type 2 diabetes mellitus. Diabetes Metab [Internet]. 2013 [cited 2015 mar 09];39(6):485-96. doi: http://doi.org/2qd. [ Links ]
56. Rosenstock J, Raccah D, Korányi L, Maffei L, Boka G, Miossec P, et al. Efficacy and safety of lixisenatide once daily versus exenatide twice daily in type 2 diabetes inadequately controlled on metformin: a 24-week, randomized, open-label, active-controlled study (GetGoal-X). Diabetes Care [Internet]. 2013 [cited 2015 mar 09];36(10):2945-51. doi: http://doi.org/2qf. [ Links ]
57. Buse JB, Rosenstock J, Sesti G, Schmidt WE, Montanya E, Brett JH, et al. Liraglutide once a day versus exenatide twice a day for type 2 diabetes: a 26-week randomised, parallel-group, multinational, open-label trial (LEAD-6). Lancet [Internet]. 2009 [cited 2015 mar 09];374(9683):39-47. doi: http://doi.org/bkw3wb. [ Links ]
58. Drucker DJ, Buse JB, Taylor K, Kendall DM, Trautmann M, Zhuang D, et al. Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: a randomised, open-label, non-inferiority study. Lancet [Internet]. 2008 [cited 2015 mar 09];372(9645):1240-50. doi: http://doi.org/dfxjr8. [ Links ]
59. Kapitza C, Forst T, Coester HV, Poitiers F, Ruus P, Hincelin-Méry A. Pharmacodynamic characteristics of lixisenatide once daily versus liraglutide once daily in patients with type 2 diabetes insufficiently controlled on metformin. Diabetes Obes Metab [Internet]. 2013 [cited 2015 mar 09];15(7):642-9. doi: http://doi.org/2qg. [ Links ]
60. Buse JB, Nauck M, Forst T, Sheu WH, Shenouda SK, Heilmann CR, et al. Exenatide once weekly versus liraglutide once daily in patients with type 2 diabetes (DURATION-6): a randomised, open-label study. Lancet [Internet]. 2013 [cited 2015 mar 09];381(9861):117-24. doi: http://doi.org/f2fkpd. [ Links ]
61. Dungan K, DeSantis A. Glucagon-like peptide-1-based therapies for the treatment of type 2 diabetes mellitus [Internet]. 2014 [cited 2015 mar 09]. Available from: http://goo.gl/Lh98fJ. [ Links ]
62. Drucker DJ, Sherman SI, Gorelick FS, Bergenstal RM, Sherwin RS, Buse JB. Incretin-based therapies for the treatment of type 2 diabetes: evaluation of the risks and benefits. Diabetes Care [Internet]. 2010 [cited 2015 mar 09];33(2):428-33. doi: http://doi.org/fb6cbw. [ Links ]
63. Nauck MA. A critical analysis of the clinical use of incretin-based therapies: The benefits by far outweigh the potential risks. Diabetes Care [Internet]. 2013 [cited 2015 mar 09];36(7):2126-32. doi: http://doi.org/2qk. [ Links ]
64. Butler PC, Elashoff M, Elashoff R, Gale EA. A critical analysis of the clinical use of incretin-based therapies: Are the GLP-1 therapies safe? Diabetes Care [Internet]. 2013 [cited 2015 mar 09];36(7):2118-25. doi: http://doi.org/2qm. [ Links ]
65. Halfdanarson TR, Pannala R. Incretins and risk of neoplasia. BMJ [Internet]. 2013 [cited 2015 mar 09];346:f3750. doi: http://doi.org/2qn. [ Links ]
66. Drucker DJ, Sherman SI, Bergenstal RM, Buse JB. The safety of incretin-based therapies--review of the scientific evidence. J Clin Endocrinol Metab [Internet]. 2011 [cited 2015 mar 09];96(7):2027-31. doi: http://doi.org/ccm328. [ Links ]
67. Olansky L. Q: Do incretin drugs for type 2 diabetes increase the risk of acute pancreatitis? Cleve Clin J Med [Internet]. 2010 [cited 2015 mar 09];77(8):503-5. doi: http://doi.org/cs33c6. [ Links ]
68. Neumiller JJ. Incretin-based therapies. Med Clin North Am [Internet]. 2015 [cited 2015 mar 09];99(1):107-29. doi: http://doi.org/2qp. [ Links ]
69. Tibaldi JM. Incorporating incretin-based therapies into clinical practice for patients with type 2 diabetes. Adv Ther [Internet]. 2014 [cited 2015 mar 09];31(3):289-317. doi: http://doi.org/2qq. [ Links ]