Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina
Print version ISSN 0120-0011
rev.fac.med. vol.64 no.1 Bogotá Jan./Mar. 2016
https://doi.org/10.15446/revfacmed.v64n1.51567
DOI: http://dx.doi.org/10.15446/revfacmed.v64n1.51567
ARTÍCULO DE REVISIÓN
Modulación de la respuesta alérgica por los carotenoides de la dieta
Modulation of the allergic response by dietary carotenoids
Andrés Ernesto Merlano-Barón1, Deivis Javier Villanueva-Pájaro1, Javier A. Marrugo-Cano1
1 Universidad de Cartagena - Instituto de Investigaciones Inmunológicas - Grupo Alergología Experimental e Inmunogenética - Línea de Investigación en Alergias a los Alimentos - Cartagena - Colombia.
Correspondencia: Deivis Javier Villanueva-Pájaro. Instituto de Investigaciones Inmunológicas, Universidad de Cartagena. Avenida del Consulado, Zaragocilla, Carrera 50 No.29-11, Campus de la Salud, Primer Piso de la Biblioteca. Teléfono: +57 3105633297. Cartagena. Colombia. Correo electrónico: deivisjavier.29@gmail.com
Recibido: 26/06/2015 Aceptado: 19/10/2015
Resumen
Los carotenoides son pigmentos isoprenoides que están presentes de manera natural y en altas concentraciones en la mayoría de alimentos vegetales —entre ellos, aguacate, papaya, tomate y zanahoria—, pero también encontrados como aditivos y colorantes en diversos productos cárnicos, aceites vegetales, salsas, aderezos, harinas, entre otros.
En los últimos años, algunos estudios han descrito que los carotenoides de la dieta participan en varios procesos fisiopatológicos, incluyendo la respuesta inmune de tipo alérgico. Las tasas de prevalencia para este tipo de enfermedades han incrementado de manera alarmante durante las últimas cinco décadas en todo el mundo, a la vez que varios factores e hipótesis se han planteado tratando de explicar este fenómeno: uno de ellos es la hipótesis de la dieta, la cual plantea que la composición de varios micro y macronutrientes de la alimentación, así como los cambios en los patrones dietarios, influirían en tal problemática.
Evidencia epidemiológica y básica experimental emergente señala que los carotenoides de la dieta participan en la regulación de la inflamación alérgica, y por ello se postulan como coadyuvantes en la terapia de tales padecimientos. En el presente artículo se revisará el estado del arte en relación a los efectos de los carotenoides de la dieta sobre la patología alérgica.
Palabras clave: Alergia e Inmunología; Hipersensibilidad; Dieta; Carotenoides; Beta Caroteno; Luteína (DeCS).
Merlano-Barón AE, Villanueva-Pájaro DJ, Marrugo-Cano JA Modulación de la respuesta alérgica por los carotenoides de la dieta. Rev. Fac. Med. 2016;64(1):123-35. Spanish. doi: http://dx.doi.org/10.15446/revfacmed.v64n1.51567.
Summary
Carotenoids are isoprenoid pigments naturally present in high concentrations in most vegetables — for example, avocados, papayas, tomatoes and carrots—, but they also can be found as additives and dyes found in various meat products, vegetable oils, sauces, dressings, meals, among others.
In recent years, some studies have reported that dietary carotenoids participate in many pathophysiological processes, including the allergic immune response. Prevalence rates for these diseases have had an alarming increase over the past five decades in a world scale, at the same time, a number of factors and assumptions in attempt to explain this phenomenon have been proposed, one of them being the diet hypothesis, which states that the composition of several micro and macronutrients of food, as well as changes in dietary patterns, would had some influence in such problematic.
Arising epidemiological and basic experimental evidence indicates that dietary carotenoids are involved in the regulation of allergic inflammation and thus are postulated as adjuvants in these diseases treatment. In this paper the authors will review the state of art in relation to the effects of dietary carotenoids on the allergic condition.
Keywords: Allergy and Immunology; Hypersensitivity; Diet; Carotenoids; beta Carotene; Lutein (MeSH).
Merlano-Barón AE, Villanueva-Pájaro DJ, Marrugo-Cano JA. [Modulation of the allergic response by dietary carotenoids.] Rev. Fac. Med. 2016;64(1):123-35. Spanish. doi: http://dx.doi.org/10.15446/revfacmed.v64n1.51567.
Introducción
Las enfermedades alérgicas son un grupo de trastornos inflamatorios de etiología inmune que cursan hacia la cronicidad. En las últimas cinco décadas se ha apreciado un alarmante incremento de tales afecciones, tanto en países desarrollados como en vías de desarrollo, afectando principalmente a la población de niños y adolescentes (1-5).
Recientemente, la Organización Mundial de Alergias (WAO) estimó que las tasas de prevalencia de las alergias han alcanzado cifras cercanas al 40% en población general (6), condiciones que, además de afectar la calidad de vida de los que la padecen y la de sus familias, generan importante morbi-mortalidad y enormes gastos económicos en atención en salud, que deterioran el bienestar económico de las sociedades y se traducen en un problema mayor de salud pública a nivel mundial (7).
En concordancia, el estudio ISAAC (International Study of Asthma and Allergies in Childhood) en fase III permitió observar que Latinoamérica es una de las regiones con las tasas más altas de prevalencia para este grupo de trastornos en población infantil y una de las regiones con el mayor número de centros, reportando incremento significativo en dichas prevalencias de manera simultánea (8,9), con cifras incluso similares a las descritas para países desarrollados como Australia, Nueva Zelanda, Reino Unido y EE.UU, a pesar de las acentuadas diferencias en los niveles socio-económicos y en la calidad de vida de estos países (1).
En relación a Colombia, dos estudios de corte transversal independientes, siguiendo metodología ISAAC y publicados en 2012, indicaron que la prevalencia de alergias es superior al 20% en población general (10,11). El primero de estos estudios reportó prevalencia puntual para rinoconjuntivitis alérgica del 17.2% en niños y del 24.9% en adolescentes, asociando la presencia de asma como principal factor de riesgo para su desarrollo en el grupo de 6 a 7 años de edad (10).
El segundo estudio, combinando un enfoque de encuestas poblacionales y de casos y controles anidados en seis ciudades principales de Colombia entre 2009-2010, reportó cifras de prevalencia para alergias en población de 1 a 59 años de edad así: prevalencia general de asma 12%, prevalencia acumulada de síntomas de asma 23%, prevalencia general de asma diagnosticada por médico 7%, prevalencia general y acumulada para rinitis alérgica 32% y 38% respectivamente, rinitis alérgica diagnosticada por médico 14% y prevalencia puntual de rinoconjuntivitis alérgica 20%; así mismo, la prevalencia acumulada de síntomas, puntual y diagnosticada por médico para eccema atópico fue del 24%, 14% y 6% respectivamente (11).
Las anteriores cifras acompañaron una prevalencia de atopia del 63% en individuos con síntomas de asma, rinitis y eccema (11), lo cual evidencia un incremento importante de tales afecciones al comparar con reportes epidemiológicos de años anteriores (12,13); hallazgos que además correlacionan con las descripciones de alergia y atopia para otros países latinoamericanos incluyendo México, Panamá, Chile y Argentina (8,9).
Han sido planteados varios supuestos tratando de explicar el incremento mundial de las alergias y las diferencias geográficas en sus prevalencias (14-17); de estos supuestos se destaca la hipótesis de la dieta (18), la cual expone que la composición de varios nutrientes de la alimentación, expresados como patrones dietarios, influirían en el desarrollo, severidad y prevalencia de las alergias (19,20); planteamientos que se articulan al observar amplias variaciones en la prevalencia de atopia (21) y de alergias entre grupos poblacionales con diferentes patrones de alimentación, p. ej. dieta rural y urbana (22,23), dieta mediterránea (24) y consumo de antioxidantes (25).
Enmarcada en la hipótesis de la dieta encontramos la hipótesis de los anti-oxidantes, señalando que un grupo de antioxidantes no enzimáticos de la alimentación contrarrestan el elevado estrés oxidativo celular y sistémico que acompaña las reacciones alérgicas (26) y donde resaltan los carotenoides por su potente acción moduladora del estrés oxidativo e inflamatorio en los estados alérgicos (27-30). A continuación se describirá la evidencia epidemiológica y básica experimental referente al papel modulador de los carotenoides dietarios sobre las alergias.
Evidencia epidemiológica del papel modulador de los carotenoides dietarios sobre las enfermedades alérgicas
Una primera línea de evidencia epidemiológica es suministrada por un estudio de casos y controles de Schünemann et al. (31) en población de adultos norteamericanos sin patología respiratoria asociada, dicho estudio muestra la existencia de mayores concentraciones de ß-carotenos y ß-criptoxantina en suero y menores recuentos de eosinófilos en sangre periférica en mujeres que en hombres, en quienes los niveles séricos de carotenoides totales se correlacionaron positivamente con los valores del FEV1% (ß-criptoxantina coeficiente ß=1.518 p<0.001, luteína/zeaxantina coeficiente ß=0.9 p<0.01, ß-caroteno coeficiente ß=0.674 p<0.05 y retinol coeficiente ß=0.919 p<0.01, regresión lineal múltiple) y con los valores del FVC%, principalmente para ß-criptoxantina (ß=1.18, p<0.05); mientras que para luteína/zeaxantina únicamente se evidenció asociación individual con los valores del FVC% (ß=0.921, p<0.05). Estos hallazgos indican la existencia de diferencias en el metabolismo de los carotenoides entre géneros, a pesar de lo cual estas moléculas mostraron potentes efectos anti-oxidantes a nivel sistémico que contribuyeron al mantenimiento de la función respiratoria en adultos sanos de ambos géneros.
Del mismo modo, un estudio transversal realizado por Misso et al. (32) reveló que, a pesar de similar ingesta dietaria de carotenoides y otros anti-oxidantes entre sujetos con asma leve a moderada y severa e individuos no asmáticos, existió reducción significativa de carotenoides sistémicos al incrementar la severidad del asma atópica, principalmente en hombres. Este estudio permitió apreciar diferencias en el metabolismo de los carotenoides entre géneros —tanto de individuos saludables como alérgicos— que se acentuaron al incrementar la severidad de la patología alérgica.
Adicionalmente, un estudio de cohorte prospectivo realizado por Ng et al. (33) en población de adultos mayores asiáticos reportó que el consumo de curry —rico en ß-carotenos y retinol—, al menos una vez al mes, se relacionó con mejoramiento de los valores del FEV1% en no fumadores y en fumadores (B=0.049 ± ESM=0.018, p=0.005, Regresión Lineal Múltiple); donde el estatus de fumador mostró una asociación más fuerte entre ingesta de curry y valores de FEV1 (p=0.028, ANCOVA). Incluso, detectaron que en individuos asmáticos —fenotipo no especificado— o con enfermedad pulmonar obstructiva crónica, el consumo de curry se relacionó con incremento en los valores de FEV1 ajustados (b=+0.335 ± ESM=0.104, p=0.002, Regresión Lineal Múltiple), con los valores del FVC (b=+0.324 ± ESM=0.143, p=0.027) y con la relación FEV1/FVC (b=4.50 ± ESM=3.37, p=0.18). Estos resultados indican que los carotenoides —presentes en el curry— actuarían como potentes antioxidantes a nivel pulmonar, reduciendo en gran medida el estrés oxidativo y mejorando la función respiratoria en personas fumadoras o con enfermedades inflamatorias crónicas como el asma y EPOC.
Similarmente, otro estudio de cohorte prospectivo realizado por Patel et al. (34) reportó asociación entre el alto consumo de ß-carotenos totales con reducción del riesgo de sensibilización atópica en niños a los 5 y 8 años de edad (ambas edades OR 0.80 P=0.002 IC95%: 0.68-0.93 Análisis Univariado; 5 años ORadj 0.80 Análisis Multivariado y 8 años ORadj 0.81 P=0.004 IC95%: 0.70-0.94, Regresión Logística). Así mismo, detectaron asociación inversa entre el consumo elevado de ß-carotenos y los niveles séricos de IgE total (Media geométrica-MG primer cuartil 44.5 IC95%: 32.7-60.3, MG cuarto cuartil 23.4, IC95%: 17.6-31.1, P=0.002 ANOVA).
Estos resultados, junto a la evidencia presentada por Schünemann et al. y Ng et al. (31, 33) sugieren que el consumo dietario de carotenoides totales y específicos se traduce en un factor protector contra el desarrollo de alergias en niños y adultos sanos expuestos a factores de riesgo ambientales, incluyendo el hábito de fumar.
De igual modo, Harik-Khan et al. (35) en un estudio de corte transversal —NHANES III-National Health And Nutrition Examination Survey— describieron que niños con asma atópica, en edades entre los 6 y 17 años, exhibían menores niveles séricos de α-carotenos, ß-carotenos y ß-criptoxantina que sujetos control (α-carotenos p=0,0001, ß-carotenos p=0,0062, ß-criptoxantina p=0.0001, t-Student); en quienes además los niveles elevados de α-carotenos se asociaron con protección del desarrollo de asma atópica en la infancia (OR 0.945, p<0.05, IC95%: 0.899-0.993, Regresión Logística). Los hallazgos indican que en sujetos atópicos se configura una mayor utilización metabólica de α y ß-carotenos y de ß-criptoxantina —no así en sujetos no atópicos— y, a su vez, que el incremento de carotenoides totales y específicos a nivel sistémico se asocia con protección del asma atópico en infantes.
En concordancia con lo anterior, Cassano et al. (36), empleando encuestas del NHANES III en un estudio transversal, describieron asociación inversa entre los niveles séricos de ß-carotenos y el riesgo de padecer asma atópica en niños y adolescentes, de los cuales 6.5% eran fumadores pasivos y 2.4% fumadores activos. Además, detectaron que un incremento en una desviación estándar en los niveles séricos de ß-carotenos resultó en una reducción de 10% en la prevalencia del asma atópica en niños no fumadores (OR 0.87, IC95%: 0.7-1.0, Regresión Logística) y de 40% en niños asmáticos fumadores pasivos (OR 0.6, IC95%: 0.4-1.1); resultados que sugieren un efecto protector de los ß-carotenos de la dieta sobre el estado oxidativo e inflamatorio característicos del asma atópica, principalmente en aquellos niños asmáticos y fumadores.
Por su parte, Wood et al. (28), mediante estudio de casos y controles, mostraron que los niveles sistémicos de carotenoides totales y específicos —α y ß-carotenos, ß-criptoxantina, licopeno y luteína/zeaxantina— se encontraron mayormente disminuidos en individuos con asma atópica a pesar de similar ingesta dietaria de carotenoides (carotenoides totales p<0.005, α y ß-carotenos p<0.01, ß-criptoxantina p<0.05, licopeno p<0.005, luteína/zeaxantina p<0.05, t-Student). Las anteriores observaciones soportan la concepción de que en sujetos atópicos ocurre una mayor utilización metabólica de carotenoides totales y específicos versus individuos no atópicos, posiblemente para contrarrestar el incremento del estrés oxidativo a nivel celular, sistémico y pulmonar característico del asma atópica.
Al mismo tiempo, un estudio de casos y controles elaborado por Oh et al. (30) en población de niños coreanos en edad preescolar describió que el alto consumo de ß-carotenos se relaciona con menor riesgo de dermatitis atópica (OR 0.44, IC95%: 0.22-0.88, Regresión Logística, PTrend=0.03, χ2 de Wald). El incremento en una desviación estándar en los niveles séricos de retinol (OR 0.74, IC95%: 0.58-0.96, PTrend=0.0222) y de ß-carotenos (OR 0.76, IC95%: 0.57-1.03, PTrend=0.0749) se asoció inversamente con dermatitis atópica, mientras que el consumo de ß-carotenos fue asociado con disminuido riesgo de dermatitis atópica (OR 0.69, IC95%: 0.50-0.93, PTrend=0.0166). Estos resultados sugieren que el alto consumo dietario de carotenoides, particularmente de retinol y de ß-carotenos, se constituye en un factor protector contra el desarrollo de dermatitis atópica en la edad pediátrica, sustentando el papel benéfico de este grupo de pigmentos en la patología alérgica.
En forma similar, Roselund et al. (37), en un estudio de cohorte prospectivo en población pediátrica sueca, revelaron que la elevada ingesta dietaria de ß-carotenos se asocia con menor riesgo de desarrollar rinitis alérgica entre los 1 y 8 años de edad (ORadj 0.67, IC95%: 0.49-0.93, Regresión Logística, PTrend=0.035 χ2 de Wald), y a su vez redujo el riesgo de desarrollar sensibilización atópica y rinitis alérgica a la edad de 8 años (ORadj 0.63, IC95%: 0.43-0.92, PTrend=0.033). Hallazgos que apuntan a que los ß-carotenos dietarios reducen de manera importante el riesgo de desarrollar sensibilización atópica y rinitis alérgica en la niñez temprana, independientemente del género.
En contraste, un estudio de cohorte prospectivo de Nagel et al. (38) describió que el alto consumo de ß-carotenos se asocia con elevado riesgo de padecer rinitis alérgica estacional en adultos (OR 1.69, IC95%: 1.09-2.63, Regresión Logística), siendo mayormente significativa en riníticos fumadores (OR 2.21, IC95%: 1.22-4.0, PTrend=0.060). Esta última evidencia sugiere la existencia de diferencias inter-individuales y etno-específicas en el control metabólico de los carotenoides —particularmente de los ß-carotenos entre personas alérgicas—, posiblemente conferidas a nivel genético y/o epigenético, que condicionarían disímiles respuestas inmunes frente a estos componentes dietarios y de otros factores de riesgo asociados como el hábito de fumar.
En relación a lo anterior, Pesonen et al. (39), mediante un estudio de cohorte prospectivo, mostraron que a pesar de similar patrón dietario durante el embarazo se observaron diferencias en los niveles de retinol entre niños y niñas en riesgo de atopia al nacimiento y a los 2 meses de edad en sangre de cordón umbilical y plasma sanguíneo respectivamente (0 meses: niñas 240±8.0 µg/L vs. niños 197±6.3 µg/L P=0.0001; 2 meses: niñas 226±5.8 µg/L vs. niños 208±7.1 µg/L P=0.03, ANOVA). Además, aunque sin alcanzar significancia estadística, se apreció que aquellos sujetos atópicos y con síntomas alérgicos a la edad de 5 años presentaron menores niveles de retinol al nacer, comparado a controles. Aún más, describen menores niveles de retinol en aquellos niños con historia familiar de alergias, relacionado con el subsecuente desarrollo de manifestaciones alérgicas en infancia y adolescencia. Sin embargo, en este estudio se detectó asociación directa entre los bajos niveles plasmáticos de retinol a los 2 meses de edad con el desarrollo de sensibilización (P=0.0002) y síntomas alérgicos a la edad de 20 años (P=0.01), principalmente en varones.
En este mismo análisis, los niveles plasmáticos de retinol a los 2 meses de edad correlacionaron inversamente con el desarrollo de sensibilización atópica, síntomas alérgicos (P=0.01 t-Student, Padj=0.01 ANOVA), dermatitis atópica (P=0.01 t-Student, Padj=0.02 ANOVA), rinoconjuntivitis alérgica (P=0.002 t-Student, Padj=0.01 ANOVA) y sibilancias recurrentes (P=0.01 t-Student, Padj=0.05 ANOVA) en la infancia y adolescencia (39). Dichas observaciones indican, por un lado, que los bajos niveles plasmáticos de retinol en infantes con historia familiar de atopia se traducen en factor de riesgo para el posterior desarrollo de sensibilización y síntomas alérgicos y, así mismo, que desde el nacimiento existen diferencias entre géneros en el metabolismo de los carotenoides, que se hacen más pronunciadas entre individuos atópicos y no atópicos, especialmente al analizar el metabolismo de carotenoides específicos como el retinol.
De igual forma, Arora et al. (40), en un estudio transversal en población infantil hindú, describieron que los niveles de retinol en asmáticos atópicos eran menores que en controles (p=0.0001, IC95%: 20.29–29.38, t-Student) en forma independiente de los niveles de proteína de unión a retinol (RBP) y de albúmina sérica (AS) (RBP p=0.47 IC95%: 24.14–30.12, AS p=0.21 IC95%: 3.95-4.4), pero dependientes del estatus nutricional, ya que aquellos niños con mayor severidad del asma atópica tenían menor peso por edad (71.8±7.9% vs. 85±9.3% p=0.035) versus niños con menor severidad del asma. Adicionalmente, detectan una correlación negativa entre los niveles séricos de retinol y la severidad del asma (r=-0.61 p=0.0001 Correlación de Pearson); indicando que el estatus nutricional demarca los niveles sistémicos de retinol, para a su vez modificar el curso y la severidad del asma atópica en la infancia, y que la relación inversa entre niveles sistémicos de retinol y severidad del asma atópica está mayormente relacionado con incremento en la utilización metabólica del carotenoide y no debido a defectos en su biodisponibilidad o transporte.
En argumento al anterior hallazgo, Kompauer et al. (29), en un estudio transversal en población alemana entre los 13 y 81 años de edad, describieron asociación inversa entre los niveles plasmáticos de carotenoides totales y diagnóstico de rinitis alérgica (PTrend=0.0332, χ2 de Wald), cobrando mayor fuerza de asociación en individuos menores de 50 años de edad (segundo cuartil OR 0.98, tercer cuartil OR 0.67, cuarto cuartil OR 0.28, PTrend=0.0218); resultados que correlacionan con la descripción de Misso et al. (32) al indicar la existencia de diferencias en el metabolismo de los carotenoides dietarios entre géneros y sus efectos moduladores sobre la patología alérgica según la edad y género.
Similarmente, Riccioni et al. (41), en un estudio transversal en población de adultos italianos, describieron que los niveles séricos de licopeno en asmáticos atópicos y no atópicos eran significativamente menores a los detectados en controles (Casos 8.12±2.63 µg/dl vs. Controles 18.13±3.67 µg/dl, p<0.001 ANOVA), sugiriendo una posible asociación entre los bajos niveles de licopeno y el riesgo de desarrollar asma bronquial en la edad adulta. Otro estudio de los mismos autores (42) confirma los anteriores resultados y además muestra que los bajos niveles de retinol en adultos con asma atópica se asocian con el riesgo de padecer la enfermedad (Casos 2.38±0.37 µmol/L vs. Controles 3.06±0.56 µmol/L, p<0.01 ANOVA). Ambos estudios describen un papel protector de carotenoides específicos sobre el estado atópico en adultos de ambos géneros.
La anterior evidencia es soportada por un estudio de intervención prospectivo de Wood et al. (43) en adultos australianos que padecen de asma atópica, en el cual se describe que la ingesta de alimentos fuente de licopeno y la suplementación dietaria con cápsulas de extracto de tomate conteniendo licopeno se asoció con reducciones significativas en los valores porcentuales de neutrófilos (Neutrófilos 39.8%, RI; 18.4-77.5 extracto de tomate vs. 42.0%, RI; 21.0-67.8 jugo de tomate vs. 55.1%, RI; 35.0-91.1 placebo, todos los tratamientos p<0.05 ANOVA) y de la actividad elastasa neutrofílica (Elastasa neutrofílica 458 ng/ml, RI; 175-924 jugo de tomate vs. 1551 ng/ml, RI; 379-3069 placebo, p<0.05) en esputo inducido pos tratamiento. Además, en ausencia de consumo dietario de estos antioxidantes, se apreció que el porcentaje de neutrófilos en esputo inducido (41.0, RI; 24.2-56.6 dieta pobre en licopeno vs. 31.0, RI; 13.1-45.9 línea base, p=0.038 ANOVA), los parámetros clínicos de función pulmonar (% FEV1 Predicho; 76.5, IC95%: 68.9-84.1 dieta pobre en licopeno, vs. 79.4, IC95%: 71.6-87.2 línea base, p=0.004. %FVC Predicho; 90.4, IC95%: 84.3-96.5 dieta pobre en licopeno, vs. 93.0, IC95%: 87.1-98.9 línea base, p=0.002) y la puntuación de control clínico en asma (1.4, IC95%: 1.0-1.8 dieta pobre en licopeno, vs. 1.0, IC95%: 0.6-1.4 línea base p=0.035) empeoraron en todos los participantes. Estos hallazgos soportan la hipótesis de los antioxidantes en las enfermedades alérgicas al mostrar que la suplementación con licopeno y alimentos fuentes en licopeno y otros carotenoides, mejora sustancialmente el estado clínico del asma atópica en población adulta.
En forma similar, Neuman et al. (44), en un estudio de intervención prospectivo en población israelí de adolescentes y adultos con asma inducida por el ejercicio (AIE), muestran que la suplementación dietaria con licopeno mejoró los valores del FEV1 post-ejercicio comparado al grupo placebo (Media ± SD, ΔFEV1 pre-ejercicio-post-ejercicio; -26.5%±12.1% grupo placebo vs. ΔFEV1 pre-ejercicio-post-ejercicio; -14.7%±11% grupo tratado, p<0.05, t-Student). Estos resultados confirman que la suplementación dietaria con carotenoides, especialmente con licopeno, mejora los parámetros de función pulmonar en AIE, similarmente a los efectos ejercidos en el asma atópica.
A pesar del emergente cuerpo de evidencia epidemiológica que respalda los efectos benéficos de consumir carotenoides totales y específicos en la dieta sobre el mejoramiento y prevención de los trastornos alérgicos, existe evidencia controversial al respecto. Un ejemplo de esto es presentado en un estudio de cohorte prospectivo por Litonjua et al. (45) en población estadounidense de pares gestantes y sus hijos, al describir asociación nula entre carotenoides específicos de la dieta, p. ej. α y ß-carotenos, luteína/zeaxantina, licopeno y ß-criptoxantina, con la prevención de eccema —fenotipo no especificado— o sibilancias a los 2 años de vida de sus hijos.
De manera análoga, Martindale et al. (46), en un estudio de cohorte prospectivo seguido desde la semana 12 de gestación hasta los 6, 12 y 24 meses de edad de sus hijos, reportaron la no existencia de asociación entre ingesta de ß-caroteno y la presencia de sibilancias o eczema atópico en la progenie. Así mismo, Hijazi et al. (47), en un estudio transversal en población de niños saudíes, mostraron la no existencia de asociación entre el consumo de vitamina A y el desarrollo de asma atópico y sibilancias a la edad de 12 años. Finalmente, Huang et al. (48), también en un estudio transversal en población de adolescentes taiwaneses, describieron la existencia de no asociación entre el consumo de vitamina A y el desarrollo de asma atópica y rinoconjuntivitis alérgica.
Evidencia básica experimental de la influencia de los carotenoides dietarios en la respuesta inmune de tipo alérgico
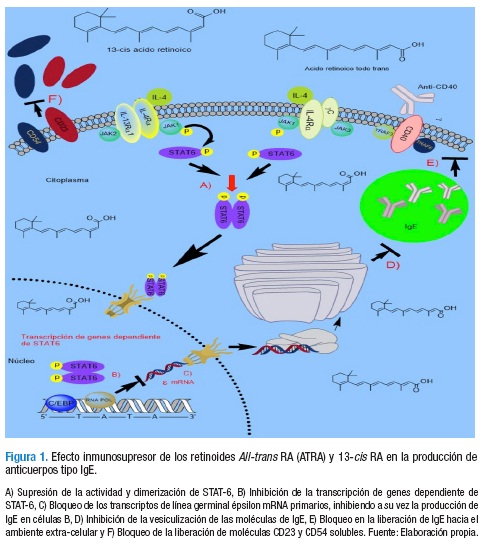
Para iniciar este bloque de evidencias, se puede referir a un estudio in vitro realizado por Worm et al. (49) donde se muestra que algunos carotenoides, p. ej. ácido retinoico All-trans (ATRA) y su isómero 13-cis RA, inhibieron en una manera dosis-dependiente la producción de IgE en células mononucleares de sangre periférica (CMSP) estimuladas con IL-4 y anti-CD40 de donantes con dermatitis atópica, quienes exhibían niveles basales moderadamente altos del anticuerpo a nivel sistémico (IgE total <400 KU/mL; ATRA 10-7 M máxima inhibición 87%; 13-cis RA 10-5 M máxima inhibición 96%); este mismo efecto se reprodujo modestamente en CMSP de sujetos atópicos con niveles basales elevados de IgE total (>2000 KU/mL ; ATRA 10-5 M máxima inhibición 53%; 13-cis 10-5 M máxima inhibición 39%) (Figura 1). Sin embargo, luego de evaluar el potencial in vivo de los retinoides ATRA y CD336 en modelos murinos de sensibilización inducido por OVA (cepas C57BL/6 y BALB/c), encontraron que el tratamiento intraperitoneal (i.p) con estos carotenoides fue insuficiente para reducir los niveles de IgE total, IgE específicos y de IgG1 a nivel sistémico.
Adicionalmente, un estudio in vitro de Worm et al. (50) describe que los carotenoides ATRA y 13-cis RA inhibieron en una manera dosis-dependiente la proliferación de CMSP de individuos no alérgicos (ATRA 10-6 mol/L inhibición 62±5.2%; 13-cis 10-6 mol/L inhibición 58±6.3%) y de células B productoras de IgE estimuladas con IL-4 más anti-CD40 (ATRA 10-6 mol/L, inhibición 55±4.4%; 13-cis 10-6 mol/L, inhibición 58±4.7%); así como la producción de IgE tanto en CMSP como en células B (CMSP; ATRA 81±8% inhibición y 13-cis 82±11.4% inhibición, ambas a 10-6 mol/L. Células B; ATRA 94±1.8% inhibición y 13-cis 96±3.2% inhibición, ambas a 10-8 mol/L). Los anteriores efectos fueron mediados, en parte, por el bloqueo de los transcriptos de línea germinal épsilon (ɛ) mRNA primarios (Figura 1) sin afectar la producción de otros anticuerpos y en una forma independiente de la activación celular mediada por citoquinas de perfil TH1 como el IFN-γ.
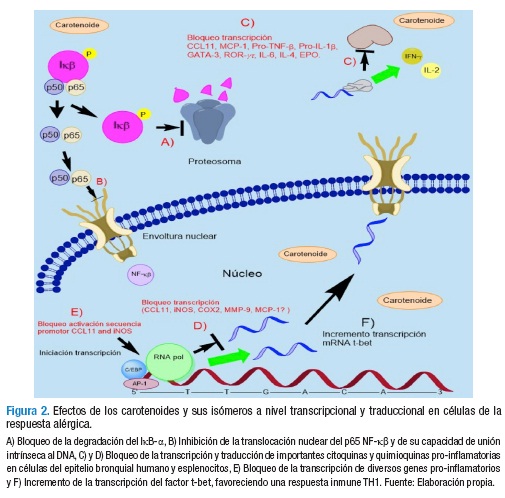
Similarmente, un estudio de Takamura et al. (51) revela que el tratamiento de células del epitelio bronquial humano (CEBH) de la línea BEAS-2B, estimuladas independientemente con IL-4 y TNF-α y tratadas con los isómeros 9-cis RA y ATRA, resultó en inhibición significativa de los niveles de activación de la secuencia promotora del gen de la eotaxina-CCL11 (ATRA solo; 51% inhibición a 10-6 M, p<0.05, ANOVA), en bloqueo de la expresión del mRNA de CCL11 (ATRA solo; 10-8 M a 10-6M, p<0.05) y de la síntesis de esta proteína (10-7 M a 10-6 M, p<0.05) bajo el estímulo de IL-4; mientras que dicho efecto no se apreció bajo estimulo con TNF-α. Además, observaron que ATRA inhibió la producción de la proteína-1 quimioatrayente de monocitos (MCP-1) en células estimuladas con IL-4 (43.5% inhibición, p<0.05) y en menor medida bajo tratamiento con TNF-α (17.7% inhibición, p<0.05). Estos hallazgos indican que los retinoides suprimirían el nivel transcripcional y traduccional de la eotaxina en CEBH in vivo y posiblemente frenarían en ambos niveles la producción de MCP-1, importantes quimioquinas atrayentes de eosinófilos, neutrófilos, monocitos y otros leucocitos al foco inflamatorio, con lo cual se atenuaría de manera importante el grado de infiltración celular e inflamatoria a nivel de vías respiratorias (Figura 2).
De manera similar, Bai et al. (52) apreciaron una reducción dosis-dependiente en la liberación de NO y PGE2 en macrófagos murinos de la línea RAW264.7, tratados con ß-caroteno bajo estímulo in vitro de LPS (IC50≈30 μM, p<0.01, t-Student), al suprimir el nivel transcripcional de las enzimas óxido nítrico sintasa inducible (iNOS) y cicloxigenasa-2 (COX-2). En este estudio incluso se detectó inhibición en la síntesis de Pro-TNF-ß y de Pro-IL-1ß, así como de la liberación de estas citoquinas a nivel intracelular (p<0.01); estos hallazgos fueron confirmados en macrófagos peritoneales murinos y en un modelo inflamatorio sistémico de ratón, obteniendo similares resultados. Así mismo, demostraron que los ß-carotenos inhiben de forma significativa la capacidad de unión intrínseca del factor de transcripción NF-κß al ADN, la actividad promotora del gen iNOS, la translocación al núcleo de la subunidad p65 NF-κß y la degradación del IκB-α (p<0.01) (52).
Los anteriores hallazgos correlacionan con resultados obtenidos por Seon-Jin et al. (53) al emplear un carotenoide sin actividad de vitamina A, conocido como astaxantina; resultados que en su conjunto indican que los ß-carotenos y astaxantina exhibirían potente acción anti-inflamatoria y anti-oxidante a nivel celular y sistémico durante las reacciones alérgicas. Incluso, estos resultados permiten inferir que los efectos inmunomoduladores de los ß-carotenos pueden ser comunes a otros grupos de carotenoides (Figura 2).
En forma similar a las descripciones de Worm et al. (49,50), un estudio de Scheffel et al. (54) muestra que células B activadas con anti-CD40 e IL-4 al ser tratadas con el isómero ATRA incrementaron la expresión de CD23 (FcεRII; ATRA ≥10-8 M, p<0.05, U de Mann-Whitney) y CD54 (ICAM-1; 10-10 M, p<0.05) en la membrana celular, en una forma independiente del nivel de expresión traduccional de estas moléculas. Un efecto contrario fue observado al examinar la expresión de CD23 y CD54 en forma soluble en células B activadas y tratadas con ATRA, ya que los niveles de estas moléculas fueron reducidas de forma dosis dependiente (10-6-10-10 M; inhibición máxima CD23 soluble 24.3±4.5%, CD54 soluble 56.6±7.6%, p<0.05) en presencia del carotenoide, indicando que ATRA inhibe el clivaje de ambas moléculas y su liberación desde la superficie celular (Figura 1). Aún más, ATRA redujo la producción de IL-6 en cultivos de células B funcionales.
En contraste, el efecto inhibitorio de ATRA sobre la producción de IgE fue suprimido parcialmente al añadir al medio de cultivo las formas solubles de CD23 y CD54 (54). Estas descripciones indican que el isómero ATRA del ácido retinoico actúa a dos niveles moleculares distintos para reducir la expresión de IgE y de moléculas inductoras de IgE en forma soluble como son CD23s y CD54s, mecanismos que se conciben como moduladores de la respuesta inmune de tipo alérgico.
Adicionalmente, Wu et al. (55) evaluaron los efectos inmunomoduladores del isómero ATRA sobre el grado de la inflamación local de vías aéreas en un modelo murino de asma atópica (ratones BALB/c), sensibilizados y retados con OVA, y sobre la expresión inflamatoria sistémica. Estos autores reportan que el tratamiento i.p con el carotenoide indujo reducción significativa en los recuentos de células inflamatorias y niveles de citoquinas TH2 en fluido broncoalveolar y biopsias de pulmón (p<0.05, t-Student); a su vez, este tratamiento redujo los niveles de citoquinas TH2 y TH17 en ganglios mediastinales (p<0.001) y el recuento de células T productoras de IL-4 en biopsias esplénicas, relacionado con supresión en la expresión de los factores de transcripción GATA-3 y ROR-γt. Mediante estos mecanismos, el carotenoide reduciría importantemente el infiltrado celular y los niveles de citoquinas pro-inflamatorias a nivel pulmonar y en otros órganos blanco de la respuesta inmune de tipo alérgico.
Al mismo tiempo, Sato et al. (56) estudiaron el efecto de los ß-carotenos en un modelo murino de hipersensibilidad a OVA (ratones BALB/c), detectando reducción significativa en los niveles séricos de IgE específicos de OVA (p<0.01, t-Student), incremento en los niveles séricos de IgG2a (p<0.01) y en la producción de citoquinas TH1 —p. ej. IL-2, p<0.05—, disminución en los niveles de citoquinas TH2 y de IL-6 (p<0.05) en sobrenadantes de cultivos de esplenocitos murinos y aumento en el nivel traduccional del IFN-γ en esplenocitos (Figura 2). Esta evidencia apunta a que los ß-carotenos inhiben la respuesta pro-alergénica TH2 y a su vez estimulan la respuesta TH1 de forma sistémica y local en vías aéreas. Por consiguiente, se postula que la utilización dietaria de ß-carotenos pudiera traducirse en mejoramiento del estado atópico del asma y de otras condiciones inflamatorias de etiología inmune caracterizadas por un perfil celular y de citoquinas TH2.
De igual modo, un estudio realizado por Lee et al. (57) muestra que la administración i.p de licopeno en ratones BALB/c sensibilizados y retados con OVA resultó en reducción dosis-dependiente del infiltrado de células inflamatorias (p<0.01, ANOVA) en las regiones perivasculares y peribronquiales, redujo la hiperrespuesta de vías aéreas inducida por metacolina en ratones retados con OVA (p<0.01), suprimió la expresión del mRNA de MMP-9 (metaloproteinasa de matriz del tipo IV) y la actividad gelatinasa de la misma proteína (p<0.01) y, así mismo, atenúo los niveles de peroxidasa eosinofílica-EPO (-73.8%, p<0.01) en muestras de lavado bronco-alveolar (BAL). Aún más, suprimió el nivel traduccional del factor de transcripción GATA-3 en tejido pulmonar y los niveles de IL-4 en BAL (ambos p<0.01), y simultáneamente incrementó la expresión del mRNA de t-bet y los niveles de INF-γ (57) (Figura 2).
Estos hallazgos muestran que el licopeno reduce de manera significativa el influjo de células inflamatorias a nivel pulmonar y la hiperrespuesta de vías aéreas inducida por aeroalergenos, suprime la producción y actividad de factores solubles que promueven la migración de neutrófilos a través de la membrana basal pulmonar, la producción de mediadores pro-inflamatorios derivados del eosinófilo y la producción de factores de transcripción y citoquinas TH2.
En concordancia a los anteriores hallazgos, un estudio reciente de Whan Kim et al. (58) muestra que la administración i.p de ATRA en un modelo murino de rinitis alérgica (cepa BALB/c) resultó en reducción significativa en el puntaje de síntomas nasales (p<0.05, grupo ATRA vs. Rinitis Alérgica-RA y ATRA vs. Control-CON, Prueba de Kruskal-Wallis); del recuento de eosinófilos infiltrantes de mucosa nasal (grupo CON 36.5 células, grupo RA 173 células y grupo ATRA 70 células, p˂0.030); disminuyó los niveles séricos de IgE específicos de alérgeno (grupo RA: 3.95 ng/mL IC95%: 3.79-4.15 vs. grupo ATRA 1.61 ng/mL IC95%: 1.44-1.71, p<0.001); atenuó la expresión transcripcional de GATA-3 (p˂0.001), ROR-γt (CON p=0.027 vs. ATRA p=0.046) y de IL-4 (p=0.031) y, a su vez, incrementó la expresión del mRNA de INF-γ (p˂0.001), TGF-ß (p=0.005), IL-10 (p˂0.05) y de Foxp3 (p=0.028); sin alterar la expresión de IL-17 y t-bet en mucosa nasal. Paralelamente, el tratamiento i.p de ATRA incrementó significativamente el porcentaje de células TCD4+CD25+foxp3+ en aislados de células mononucleares esplénicas (grupo CON 4.38%, IC95%: 4.01-4.71 vs. grupo RA 2.39%, IC95%: 1.59-4.8 vs. grupo ATRA 10.42%, IC95%: 11.69-16.42, p=0.001).
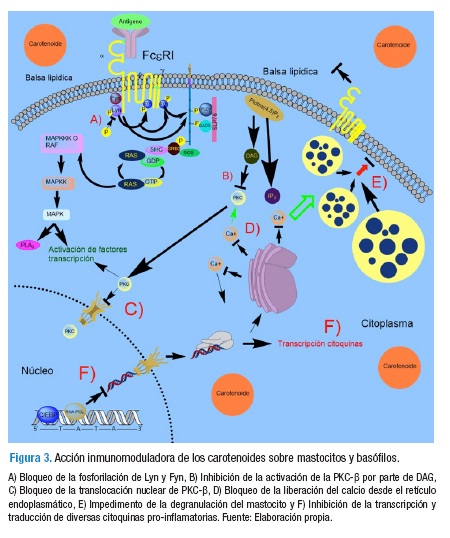
Por su parte, Sakai et al. (59) evaluaron el efecto de varios carotenoides dietarios sobre la degranulación de células de la línea RBL-2H3 y de mastocitos derivados de medula ósea de ratones BALB/c (BMMC), mediado por la agregación del receptor FcεRI inducida por antígeno (DNP-BSA). Los autores reportan que el tratamiento de estas células con ß-caroteno, zeaxantina, astaxantina y fucoxantina inhibió la degranulación mediada por la agregación del FcεRI vía unión IgE-antígeno, verificado al detectar reducción en cerca del 40% en la liberación de la ß-hexosaminidasa (todos p<0.05, ANOVA) en una forma independiente a modificar la actividad catalítica de esta enzima o de inhibir la unión IgE-antígeno. Así mismo, los carotenoides redujeron la agregación de los receptores FcεRI en ambas células (p<0.05) y el nivel de fosforilación de las tirosina quinasas Lyn y Fyn; al tiempo que inhibieron la activación y translocación de PKC-ß, los niveles de calcio intracelular y la translocación del FcεRI hacia las balsas lipídicas inducida por antígeno (Figura 3). Estas descripciones demuestran que carotenoides específicos de la dieta suprimen de forma importante la degranulación del mastocito, esta última mediada por la agregación de los receptores FcεRI para IgE y de eventos de señalización intracelular corriente debajo de dicho receptor, lo cual refuerza el importante papel modulador de los carotenoides sobre las reacciones alérgicas.
Para cerrar este bloque de evidencias se destaca un estudio reciente de Manabe et al. (60), el cual confirma los efectos inhibitorios de los carotenoides evaluados en el estudio de Sakai et al. (59), —ß-caroteno, zeaxantina, astaxantina y fucoxantina— y de otros cinco carotenoides dietarios —ß-criptoxantina, fucoxantinol, 3-hidroxiequinenona, licopeno y sifonaxantina— sobre la degranulación inducida por antígeno en células RBL-2H3, en una forma independiente de la captura celular y generación intracelular de metabolitos derivados de estos pigmentos (Figura 3).
Estas últimas evidencias sugieren que los efectos protectores del grupo de los carotenoides sobre las reacciones alérgicas serían ejercidos, en gran medida, por mecanismos inhibitorios directos sobre la degranulación inducida por la unión IgE-antígeno sobre el mastocito.
Conclusiones
Evidencia epidemiológica en población pediátrica muestra que la ingesta regular y en altas dosis de los carotenoides dietarios reduce en gran medida los niveles séricos de IgE total y específica y el riesgo de sensibilización atópica; también protege contra el desarrollo de enfermedades alérgicas, incluyendo asma, rinitis, rinoconjuntivitis y dermatitis. Así mismo, la introducción de estos pigmentos en la dieta ha mostrado reducir la severidad y prevalencia del asma atópica en infantes y adolescentes, aún en presencia de factores de riesgo ambiental como el hábito de fumar y la exposición a aeroalergenos.
Los niveles de carotenoides totales y específicos a nivel sistémico se han relacionado con el mantenimiento de la función pulmonar en adultos de ambos géneros sin patología respiratoria asociada; inclusive, el consumo de carotenoides en altas dosis se traduce en mejoramiento de la función pulmonar en adolescentes y adultos fumadores, así como en individuos con enfermedades inflamatorias crónicas como el asma y la enfermedad pulmonar obstructiva crónica —eventos relacionados con las propiedades anti-oxidantes y anti-inflamatorias atribuidas a estas moléculas—. En contraste, el deficiente aporte dietario de carotenoides totales y específicos se traduce en factor de riesgo para el inicio vital más temprano y desarrollo de las alergias en la adolescencia y adultez, lo que a su vez correlaciona con la mayor prevalencia y severidad de estos trastornos en diversos grupos etáreos y poblacionales a nivel mundial.
Los estudios epidemiológicos también sugieren la existencia de un metabolismo diferencial de los carotenoides desde el nacimiento hasta la edad adulta, entre géneros y entre niños y adultos con y sin patología alérgica; donde los sujetos atópicos exhiben una mayor utilización metabólica de carotenoides específicos —α y ß-carotenos, ß-criptoxantina, licopeno, luteína/zeaxantina y retinol– en una medida proporcional al incremento de la severidad de las alergias, verificado al detectar menores niveles sistémicos de estos pigmentos a pesar de similar patrón de ingesta dietaria, versus no atópicos en diferentes poblaciones. Estas observancias serían explicadas por la existencia de diferencias inter-individuales y etno-específicas en el control metabólico de los carotenoides conferidas a nivel genético (61) y/o epigenético, con las cuales se modificaría la respuesta inmune y, a su vez, el riesgo de desarrollar enfermedades alérgicas; lo que explicaría en parte, los hallazgos, al parecer contradictorios, de algunos estudios referidos a esta temática.
Se destaca la escasez de estudios de cohorte prospectivo y de ensayos clínicos aleatorizados que evalúen los efectos inmunomoduladores y clínicos de los carotenoides de la dieta —diferentes al grupo de los retinoides— sobre el estado alérgico en población pediátrica y adulta. Tampoco se hallaron estudios que combinen enfoques observacionales y analíticos para evaluar el grado de aporte dietario de carotenoides y su correspondencia bioquímica con los niveles biodisponibles a nivel celular y sistémico, sus isómeros y metabolitos y su asociación con parámetros clínicos de función pulmonar, sensibilización atópica, tipo y frecuencia de síntomas y severidad de las alergias. Aún más, no se observan estudios de intervención que, empleando carotenoides totales y específicos en población de gestantes y lactantes atópicas o con historia familiar de atopia, evalúen los efectos moduladores a mediano y largo plazo en la progenie respecto al desarrollo de alergias.
Por su parte, la evidencia básica experimental proveniente de modelos murinos y de cultivos celulares muestra que los carotenoides y varios de sus isómeros inhiben en forma dosis-dependiente la proliferación de células mononucleares de sangre periférica y de células B funcionales, así como la producción de IgE en estas últimas, en parte al bloquear la expresión de transcriptos mRNA épsilon. Igualmente, en células del epitelio bronquial humano bloquean el nivel transcripcional y traduccional y la liberación de importantes proteínas quimioatrayentes como la eotaxina y MCP-1. Similarmente, los carotenoides a nivel respiratorio en humanos reducen importantemente el recuento porcentual de neutrófilos y los niveles de actividad elastasa neutrofílica en esputo inducido.
De otra forma, los carotenoides actúan en macrófagos frenando la producción y liberación de varios potentes mediadores inflamatorios —NO, PGE2, TNF-ß, IL-1ß—; bloquean la degradación del IκB-α, la translocación nuclear del NF-κß y reducen en este último su capacidad intrínseca de unión al DNA. En esplenocitos murinos suprimen la expresión de GATA-3 y ROR-γt. Así mismo, en células B frenan la producción y liberación de moléculas solubles inductoras de la síntesis de IgE, como son CD23s y CD54s.
En modelos murinos de asma atópica, los carotenoides reducen sustancialmente el infiltrado de células inflamatorias a nivel tisular y los niveles de citoquinas TH2 en vías aéreas superioras; también reducen la hiperreactividad de vías aéreas inducida por aeroalergenos, bloquean el nivel traduccional, la actividad de MMP-9 y la producción de peroxidasa eosinofílica; frenan el nivel traduccional de GATA-3 y disminuyen los niveles de IL-4 en muestras de lavado bronco-alveolar. Similarmente, en modelos murinos de rinitis alérgica, carotenoides específicos reducen los síntomas nasales, el número de eosinófilos infiltrantes en mucosa nasal y los niveles sistémicos de IgE alérgeno-específica; atenúan la expresión transcripcional y traduccional de GATA-3, ROR-γt e IL-4, y, a su vez, incrementan la expresión transcripcional y traduccional del INF-γ, TGF-ß, IL-10 y Foxp3 en tejido nasal y potencian el número de células TCD4+CD25+foxp3+ en aislados esplénicos.
Estos pigmentos, a nivel local y sistémico, disminuyen la producción de citoquinas TH2 y TH17, el recuento de células T productoras de IL-4, los niveles séricos de IgE alérgeno-específicos e incrementan el nivel transcripcional de t-bet y la producción de citoquinas TH1 en modelos murinos. De otro lado, los carotenoides en mastocitos inhiben la degranulación mediada por la agregación del receptor FcεRI inducida por antígeno, en parte al reducir la agregación de estos receptores, al impedir la translocación del FcεRI hacia las balsas lipídicas inducidas por antígeno y al bloquear el nivel de fosforilación de las tirosinas quinasas Lyn y Fyn; además inhiben la activación y translocación de PKC-ß y los niveles del calcio intracelular.
Para finalizar, se resalta el hecho que hasta la fecha no se han identificado y caracterizado molecular y funcionalmente receptores exclusivos de carotenoides o sus isómeros —distintos al grupo de los retinoides— en células y órganos blanco de la respuesta inmune, a través de los cuales ejerzan sus efectos moduladores sobre las reacciones alérgicas; mucho menos se conoce sobre los mecanismos de desaturación y elongación a nivel celular y sistémico de estos pigmentos, ni la interacción y modos de acción de precursores y metabolitos de carotenoides generados por estas y otras vías metabólicas para alterar diversas rutas de señalización intracelular, ni tampoco si estas moléculas inducen o regulan mecanismos epigenéticos que influyan a su vez en el desarrollo de estas patologías.
Conflicto de intereses
Ninguno declarado por los autores.
Financiación
Universidad de Cartagena.
Agradecimientos
Ninguno declarado por los autores.
Referencias
1. Beasley R. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The Lancet. 1998;351(9111):1225-32. http://doi.org/bqg95t. [ Links ]
2. Williams H, Robertson C, Stewart A, Aït-Khaled N, Anabwani G, Anderson R, et al. Worldwide variations in the prevalence of symptoms of atopic eczema in the international study of asthma and allergies in childhood. J. Allergy Clin. Immunol. 1999;103(1 pt 1):125-38. http://doi.org/dc7zmk. [ Links ]
3. Lötvall J, Pawankar R, Wallace DV, Akdis CA, Rosenwasser LJ, Weber RW, et al. We call for iCAALL: International Collaboration in Asthma, Allergy and Immunology. J. Allergy Clin. Immunol. 2012;129(4):904-5. http://doi.org/f2gkd3. [ Links ]
4. Maziak W, Behrens T, Brasky TM, Duhme H, Rzehak P, Weiland SK, et al. Are asthma and allergies in children and adolescents increasing? Results from ISAAC phase I and phase III surveys in Münster, Germany. Allergy. 2003;58(7):572-9. http://doi.org/drc8n3. [ Links ]
5. Isolauri E, Huurre A, Salminen S, Impivaara O. The allergy epidemic extends beyond the past few decades. Clin. Exp. Allergy. 2004;34(7):1007-10. http://doi.org/c8kg78. [ Links ]
6. Pawankar R, Holgate ST, Canonica GW, Lockey RF, Blaiss MS, editors. WAO White Book on Allergy. Milwaukee: World Allergy Organization; 2013. [ Links ]
7. Pawankar R, Holgate ST, Canonica GW, Lockey RF, editors. WAO White Book on Allergy. Milwaukee: World Allergy Organization; 2011. [ Links ]
8. Asher MI, Montefort S, Björkstén B, Lai CK, Strachan DP, Weiland SK, et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC Phases One and Three repeat multicountry cross-sectional surveys. Lancet. 2006;368(9537):733-43. http://doi.org/cw6jbm. [ Links ]
9. Mallol J, Crane J, von Mutius E, Odhiambo J, Keil U, Stewart A, et al. The International Study of Asthma and Allergies in Childhood (ISAAC) Phase Three: a global synthesis. Allergol. Immunopathol (Madr). 2013;41(2):73-85. http://doi.org/f2h5xh. [ Links ]
10. Peñaranda A, Aristizabal G, Garcia E, Vasquez C, Rodriguez-Martinez CE. Rhinoconjunctivitis prevalence and associated factors in school children aged 6-7 and 13-14 years old in Bogota, Colombia. Int. J. Pediatr. Otorhinolaryngol. 2012;76(4):530-5. http://doi.org/fx9zqr. [ Links ]
11. Dennis RJ, Caraballo L, Garcia E, Rojas MX, Rondon MA, Perez A, et al. Prevalence of asthma and other allergic conditions in Colombia 2009-2010: a cross-sectional study. BMC Pulm. Med. 2012;12(1):17. http://doi.org/4m9. [ Links ]
12. Caraballo L, Cadavid A, Mendoza J. Prevalence of asthma in a tropical city of Colombia. Ann. Allergy. 1992;68(6):525-9. [ Links ]
13. Dennis R, Caraballo L, García E, Caballero A, Aristizabal G, Córdoba H, et al. Asthma and other allergic conditions in Colombia: a study in 6 cities. Ann. Allergy Asthma Immunol. 2004;93(6):568-74. http://doi.org/fjp38v. [ Links ]
14. von Mutius E. Influences in allergy: epidemiology and the environment. J. Allergy Clin. Immunol. 2004;113(3):373-9. http://doi.org/fgctv5. [ Links ]
15. Haahtela T, Holgate S, Pawankar R, Akdis CA, Benjaponpitak S, Caraballo L, et al. The biodiversity hypothesis and allergic disease: world allergy organization position statement. World Allergy Organ. J. 2013;6(1):3. http://doi.org/4nb. [ Links ]
16. Ring J, Krämer U, Schäfer T, Behrendt H. Why are allergies increasing? Curr. Opin. Inmmunol. 2001;13(6):701-8. http://doi.org/cnhvwp. [ Links ]
17. Prescott SL. Early-life environmental determinants of allergic diseases and the wider pandemic of inflammatory noncommunicable diseases. J. Allergy Clin. Immunol. 2013;131(1):23-30. http://doi.org/f2gf6s. [ Links ]
18. West CE, D'Vaz N, Prescott SL. Dietary immunomodulatory factors in the development of immune tolerance. Curr. Allergy Asthma Rep. 2011;11(4):325-33. http://doi.org/fmzkts. [ Links ]
19. Devereux G, Seaton A. Diet as a risk factor for atopy and asthma. J. Allergy Clin. Immunol. 2005;115(6):1109-17; quiz 18. http://doi.org/dfpkb7. [ Links ]
20. Sohi DK, Warner JO. Understanding allergy. Paediatr. Child Health. 2008;18(7):301-8. http://doi.org/b9jdkh. [ Links ]
21. Fang L, Urrego J, Muñoz-Mejía C, Hernandez L, Lopez-Kleine L, Marrugo J. Little Changes in a Monotone Dietary Pattern may Influence in Atopy in African-Descendent Colombian Children. Clin. Nutr. Suppl. 2012;7(1):171. http://doi.org/95d. [ Links ]
22. Nagel G, Weinmayr G, Kleiner A, Garcia-Marcos L, Strachan DP, ISAAC Phase Two Study Group. Effect of diet on asthma and allergic sensitisation in the International Study on Allergies and Asthma in Childhood (ISAAC) Phase Two. Thorax. 2010;65(6):516-22. http://doi.org/ccggjt. [ Links ]
23. Vlaski E, Lawson JA. Urban-rural differences in asthma prevalence among young adolescents: The role of behavioural and environmental factors. Allergol. Immunopathol (Madr). 2015;43(2):131-41. http://doi.org/f26n4m. [ Links ]
24. Castro-Rodriguez JA, Garcia-Marcos L, Alfonseda Rojas JD, Valverde-Molina J, Sanchez-Solis M. Mediterranean diet as a protective factor for wheezing in preschool children. J. Pediatr. 2008;152(6):823-8, 8 e1-2. http://doi.org/bm7r24. [ Links ]
25. Ellwood P, Asher MI, BjÖrkstén B, Burr M, Pearce N, Robertson CF. Diet and asthma, allergic rhinoconjunctivitis and atopic eczema symptom prevalence: an ecological analysis of the International Study of Asthma and Allergies in Childhood (ISAAC) data. Eur. Respir. J. 2001;17(3):436-43. http://doi.org/d4z8jc. [ Links ]
26. Bowler RP, Crapo JD. Oxidative stress in allergic respiratory diseases. J. Allergy Clin. Immunol. 2002;110(3):349-56. http://doi.org/ddtfb6. [ Links ]
27. Moreno-Macías H, Romieu I. Effects of antioxidant supplements and nutrients on patients with asthma and allergies. J. Allergy Clin. Immunol. 2014;133(5):1237-44; quiz 1245. http://doi.org/f2rms3. [ Links ]
28. Wood LG, Garg ML, Blake RJ, Garcia-Caraballo S, Gibson PG. Airway and circulating levels of carotenoids in asthma and healthy controls. J. Am. Coll. Nutr. 2005;24(6):448-55. http://doi.org/95h. [ Links ]
29. Kompauer I, Heinrich J, Wolfram G, Linseisen J. Association of carotenoids, tocopherols and vitamin C in plasma with allergic rhinitis and allergic sensitisation in adults. Public. Health. Nutr. 2006;9(4):472-9. http://doi.org/c2bbzr. [ Links ]
30. Oh SY, Chung J, Kim MK, Kwon SO, Cho BH. Antioxidant nutrient intakes and corresponding biomarkers associated with the risk of atopic dermatitis in young children. Eur. J. Clin. Nutr. 2010;64(3):245-52. http://doi.org/crn9n7. [ Links ]
31. SchÜNemann H, Grant BJ, Freudenheim JL, Muti P, Browne RW, Drake JA, et al. The Relation of Serum Levels of Antioxidant Vitamins C and E, Retinol and Carotenoids with Pulmonary Function in the General Population. Am. J. Respir. Crit. Care Med. 2001;163(5):1246-55. http://doi.org/95j. [ Links ]
32. Misso NL, Brooks-Wildhaber J, Ray S, Vally H, Thompson PJ. Plasma concentrations of dietary and nondietary antioxidants are low in severe asthma. Eur. Respir. J. 2005;26(2):257-64. http://doi.org/b7x6b6. [ Links ]
33. Ng TP, Niti M, Yap KB, Tan WC. Curcumins-Rich Curry Diet and Pulmonary Function in Asian Older Adults. PLoS One. 2012;7(12):e51753. http://doi.org/95k. [ Links ]
34. Patel S, Murray CS, Woodcock A, Simpson A, Custovic A. Dietary antioxidant intake, allergic sensitization and allergic diseases in young children. Allergy. 2009;64(12):1766-72. http://doi.org/dwgs8t. [ Links ]
35. Harik-Khan RI, Muller DC, Wise RA. Serum vitamin levels and the risk of asthma in children. Am. J. Epidemiol. 2004;159(4):351-7. http://doi.org/bds3xn. [ Links ]
36. Rubin RN, Navon L, Cassano PA. Relationship of serum antioxidants to asthma prevalence in youth. Am. J. Respir. Crit. Care Med. 2004;169(3):393-8. http://doi.org/cm9435. [ Links ]
37. Rosenlund H, Magnusson J, Kull I, Håkansson N, Wolk A, Pershagen G, et al. Antioxidant intake and allergic disease in children. Clin. Exp. Allergy. 2012;42(10):1491-500. http://doi.org/f25h7b. [ Links ]
38. Nagel G, Nieters A, Becker N, Linseisen J. The influence of the dietary intake of fatty acids and antioxidants on hay fever in adults. Allergy. 2003;58(12):1277-84. [ Links ]
39. Pesonen M, Kallio MJ, Siimes MA, Ranki A. Retinol concentrations after birth are inversely associated with atopic manifestations in children and young adults. Clin. Exp. Allergy. 2007;37(1):54-61. http://doi.org/c22pvb. [ Links ]
40. Arora P, Kumar V, Batra S. Vitamin A status in children with asthma. Pediatr. Allergy Immunol. 2002;13(3):223-6. http://doi.org/bw6tjv. [ Links ]
41. Riccioni G, Bucciarelli T, Mancini B, Di Ilio C, D'Orazio N. Plasma lycopene concentration is low in subjects with stable asthma. Allergy. 2006;61(11):1371-2. http://doi.org/cmd4gb. [ Links ]
42. Riccioni G, Bucciarelli T, Mancini B, Di Ilio C, Della Vecchia R, D'Orazio N. Plasma lycopene and antioxidant vitamins in asthma: the PLAVA study. J Asthma. 2007;44(6):429-32. http://doi.org/djzdwg. [ Links ]
43. Wood LG, Garg ML, Powell H, Gibson PG. Lycopene-rich treatments modify noneosinophilic airway inflammation in asthma: Proof of concept. Free Radic. Res. 2008;42(1):94-102. http://doi.org/cqsczx. [ Links ]
44. Neuman I, Nahum H, Ben-Amotz A. Reduction of exercise-induced asthma oxidative stress by lycopene, a natural antioxidant. Allergy. 2000;55(12):1184-9. http://doi.org/fmfw7n. [ Links ]
45. Litonjua AA, Rifas-Shiman SL, Ly NP, Tantisira KG, Rich-Edwards JW, Camargo CA Jr, et al. Maternal antioxidant intake in pregnancy and wheezing illnesses in children at 2 y of age. Am. J. Clin. Nut. 2006;84(4):903-11. [ Links ]
46. Martindale S, McNeill G, Devereux G, Campbell D, Russell G, Seaton A. Antioxidant Intake in Pregnancy in Relation to Wheeze and Eczema in the First Two Years of Life. Am. J. Respir. Crit. Care Med. 2005;171(2):121-8. http://doi.org/fv5b9k. [ Links ]
47. Hijazi N, Abalkhail B, Seaton A. Diet and childhood asthma in a society in transition: a study in urban and rural Saudi Arabia. Thorax. 2000;55(9):775-9. http://doi.org/b4fsdj. [ Links ]
48. Huang SL, Pan WH. Dietary fats and asthma in teenagers: analyses of the first Nutrition and Health Survey in Taiwan (NAHSIT). Clin. Exp. Allergy. 2001;31(12):1875-80. http://doi.org/bw6qtz. [ Links ]
49. Worm M, Herz U, Krah JM, Renz H, Henz BM. Effects of retinoids on in vitro and in vivo IgE production. Int. Arch. Allergy Immunol. 2001;124(1-3):233-6. http://doi.org/dt7rg8. [ Links ]
50. Worm M, Krah JM, Manz RA, Henz BM. Retinoic Acid Inhibits CD40 + Interleukin-4-Mediated IgE Production In Vitro. Blod. 1998;92(5):1713-20. [ Links ]
51. Takamura K, Nasuhara Y, Kobayashi M, Betsuyaku T, Tanino Y, Kinoshita I, et al. Retinoic acid inhibits interleukin-4-induced eotaxin production in a human bronchial epithelial cell line. Am. J. Physiol. Lung. Cell. Mol. Physiol. 2004;286(4):L777-L85. http://doi.org/bm3wxn. [ Links ]
52. Bai SK, Lee SJ, Na HJ, Ha KS, Han JA, Lee H, et al. ß-carotene inhibits inflammatory gene expression in lipopolysaccharide-stimulated macrophages by suppressing redox-based NF-κB activation. Exp. Mol. Med. 2005;37(4):323-34. http://doi.org/96t. [ Links ]
53. Lee SJ, Bai SK, Lee KS, Namkng S, Na Hj, Ha KS, et al. Astaxanthin Inhibits Nitric Oxide Production and Inflammatory Gene Expression by Suppressing I(kappa)B Kinase-dependent NF-(kappa)B Activation. Mol. Cells. 2003;16(1):97-105. [ Links ]
54. Scheffel F, Heine G, Henz BM, Worm M. Retinoic acid inhibits CD40 plus IL-4 mediated IgE production through alterations of sCD23, sCD54 and IL-6 production. Inflamm. Res. 2005;54(3):113-8. http://doi.org/b2fwtg. [ Links ]
55. Wu J, Zhang Y, Liu Q, Zhong W, Xia Z. All-trans retinoic acid attenuates airway inflammation by inhibiting Th2 and Th17 response in experimental allergic asthma. BMC Immunol. 2013;14(1):28. http://doi.org/96v. [ Links ]
56. Sato Y, Akiyama H, Suganuma H, Watanabe T, Nagaoka MH, Inakuma T, et al. The feeding of ß-carotene down-regulates serum IgE levels and inhibits the type I allergic response in mice. Biol. Pharm. Bull. 2004;27(7):978-84. http://doi.org/b8ht9w. [ Links ]
57. Lee CM, Chang JH, Moon DO, Choi YH, Choi IW, Park YM, et al. Lycopene suppresses ovalbumin-induced airway inflammation in a murine model of asthma. Biochem. Biophys. Res. Commun. 2008;374(2):248-52. http://doi.org/chkpgn. [ Links ]
58. Son HL, Park HR, Park YJ, Kim SW. Effect of Retinoic Acid in a Mouse Model of Allergic Rhinitis. Allergy Asthma Immunol. Res. 2015;7(6):590-8. http://doi.org/96w. [ Links ]
59. Sakai S, Sugawara T, Matsubara K, Hirata T. Inhibitory effect of carotenoids on the degranulation of mast cells via suppression of antigen-induced aggregation of high affinity IgE receptors. J. Biol. Chem. 2009;284(41):28172-9. http://doi.org/d8vj3j. [ Links ]
60. Manabe Y, Hirata T, Sugawara T. Suppressive Effects of Carotenoids on the Antigen-induced Degranulation in RBL-2H3 Rat Basophilic Leukemia Cells. J. Oleo Sci. 2014;63(3):291-4. http://doi.org/96x. [ Links ]
61. Borel P, Desmarchelier C, Nowicki M, Bott R. Lycopene bioavailability is associated with a combination of genetic variants. Free Radic. Biol. Med. 2015;83:238-44. http://doi.org/bb56. [ Links ]