Introducción
La fibrosis quística (FQ) es una enfermedad autosómica recesiva de la que se estima que a nivel mundial 1 de cada 25 individuos es portador sano. En Latinoamérica la incidencia va desde 1 por 3 862 nacidos vivos en Cuba hasta 1 por 8 500 nacidos vivos en México; de manera específica, en Colombia su incidencia se estima en 1 por 5 000 nacidos vivos con una prevalencia incierta y un subregistro de información por falta de diagnóstico oportuno de la enfermedad 1-3.
La FQ es considerada la enfermedad autosómica más común en población blanca no hispánica; esta genera afecciones multisistémicas que afectan a órganos con función secretora glandular como glándulas sudoríparas, pulmón, páncreas, hígado, intestino y aparato reproductor. La expectativa de vida en pacientes con esta enfermedad es de 37 años, con falla respiratoria como principal causa de muerte 4.
Existen pruebas moleculares por PCR (reacción en cadena polimerasa) y secuenciación para realizar la identificación de las mutaciones tanto para los pacientes con la enfermedad como para portadores sanos. En Colombia se reportó una sensibilidad de 92% y una especificidad de 100% para una de las técnicas moleculares aplicadas a la detección de portadores sanos 5. A través del tamizaje de portador prenatal y preconcepcional se busca identificar a las parejas en riesgo genético de presentar un recién nacido con FQ. Las características operativas de estos test genéticos varían según la prevalencia de portador para la raza evaluada y la cantidad de mutaciones detectadas-panel de 23 a 25 mutaciones-, siendo más prevalentes ciertos tipos de mutaciones en blancos no hispánicos y judíos ashkenazi.
Según las recomendaciones del ACOG Committee Opinion en su número 486 4, es recomendable ofrecer el test de portador a todas las mujeres en edad reproductiva y a sus parejas y no solo a las familias y parientes de pacientes diagnosticados con FQ. En esta publicación también se recomienda recordar el estado de portador en gestaciones futuras y un adecuado abordaje en consejería genética.
El objetivo de este estudio es revisar la evidencia disponible sobre la costo-efectividad del test de portador para FQ en personas en edad fértil con o sin antecedente de la enfermedad en comparación con la no intervención.
Metodología
Se realizó una revisión sistemática de evaluación económica de tipo costo-efectividad para el test de portador de FQ. Se revisaron las bases de datos MEDLINE, Embase, NHS Economic Evaluation Database, EBM Reviews - Cochrane Database of Systematic Reviews, LILACS, Health Technology Assessment, Genetests. org, Genetsickkids.org y Web of Science con palabras claves como fibrosis quística, costo efectividad, test de DNA y test genético.
Solo se incluyeron estudios de evaluación económica, sin restricción de lenguaje ni límite de fecha de publicación hasta marzo del 2015, y para el análisis se tuvieron en cuenta las principales características de los estudios económicos: perspectiva, tasa de descuento, unidad de análisis, supuestos, probabilidades y otros ítems dados por las herramientas QHES y CHEERS para análisis y elaboración de evaluaciones económicas.
Resultados
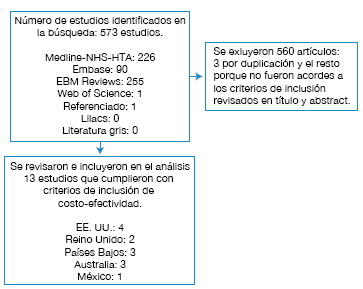
Fueron identificados 573 artículos, de los cuales 3 eran duplicados. Al revisar título y abstract se excluyeron 560 artículos y al final se sometieron 13 estudios de evaluación económica relevantes para su revisión completa y posible inclusión en el análisis, revisando de igual manera las referencias de los artículos seleccionados (Figura 1). Entre los estudios incluidos, 4 fueron realizados en EE. UU., 2 en Reino Unido, 3 en Países Bajos, 3 en Australia y 1 en México.
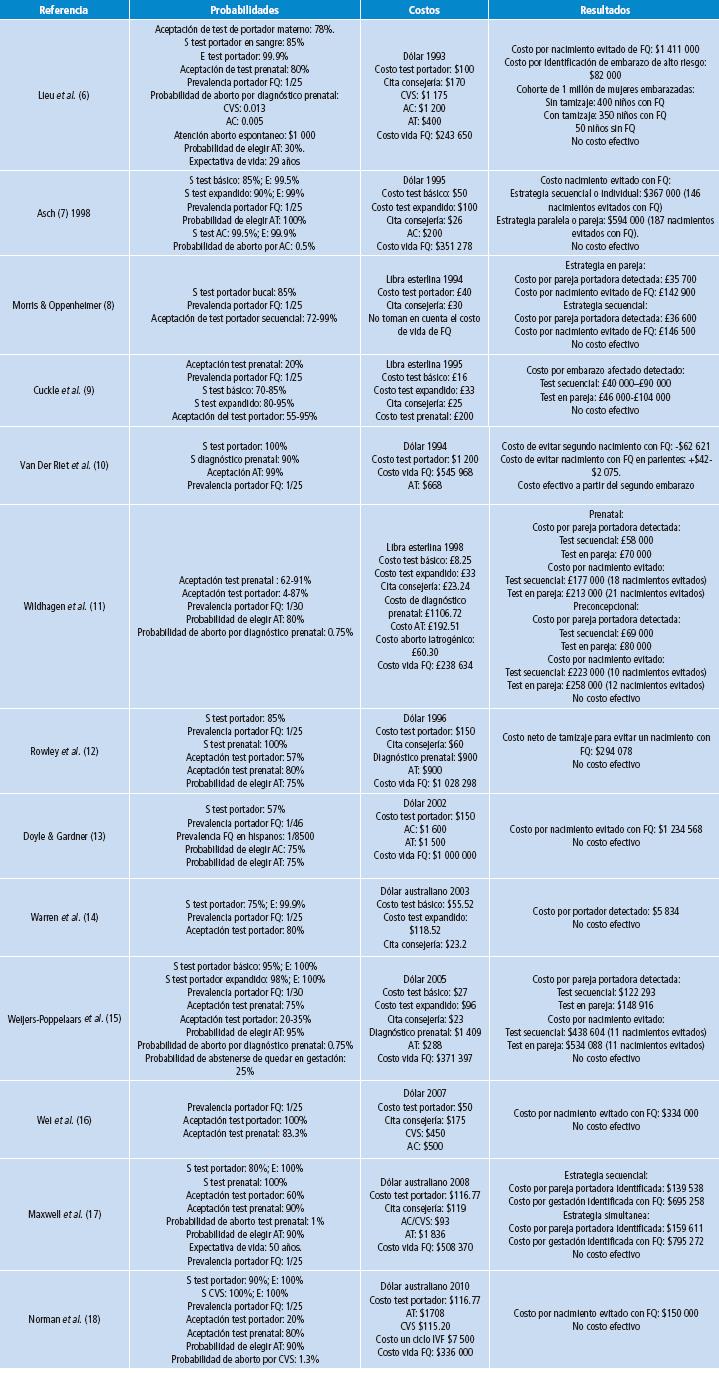
Para cumplir el objetivo, solo se incluyeron estudios de costo-efectividad, aunque dos tenían también análisis de costo-beneficio y uno de costo-utilidad. 6 de los estudios tenían como intervención un tamizaje preconcepcional añadido al tamizaje prenatal, 5 tenían tamizaje exclusivo prenatal y 2 preconcepcional. En los resultados del análisis (Tabla 1 y 2) se encontró que la perspectiva en salud fue la más usada -9 de los 13 estudios incluidos-, seguida de la perspectiva de la sociedad. La tasa de descuento aplicada fue muy heterogénea, desde 3.5% hasta 5%, encontrándose incluso algunos sin tasa de descuento reportada.
Tabla 1 Revisión de los estudios económicos de test de portador para fibrosis quística incluidos en el análisis.

ACE: análisis de costo efectividad; AD: análisis de decisiones; FQ: fibrosis quística; S: sensibilidad; E: especificidad; AT: aborto terapéutico; IVF: fertilización in vitro; CVS: muestra de la vellosidad coriónica. Fuente: Elaboración propia.
Tabla 2 Probabilidades, costos y resultados de estudios incluidos.
FQ: fibrosis quística; S: sensibilidad; E: especificidad; AT: aborto terapéutico; IVF: fertilización in vitro; CVS: muestra de la vellosidad coriónica; AC: amniocentesis.
Fuente: Elaboración propia.
La unidad de análisis principal aplicada fue la del costo por pareja portadora detectada, seguida de costo por nacimiento evitado con FQ. De igual manera, el resultado de cada estudio fue reportado con su unidad de análisis ya que no todos los estudios aplicaron el RCEI (razón de costo-efectividad incremental) como medida final; 10 estudios aplicaron el modelo de análisis de decisiones.
En los supuestos aplicados -número de gestaciones, probabilidad de aceptación del test genético y probabilidad de olvido de su estado de portador- hubo heterogeneidad y la mayoría de los estudios utilizó el método univariado para el análisis de sensibilidad; todos aplicaron como características operativas la sensibilidad y especificidad del test de portador y del test prenatal, según la intervención planteada.
En todos los estudios seleccionados la intervención fue comparada con no realizar test genético, teniendo en cuenta que la mayoría de países no habían establecido aun tamizajes genéticos para portador de fibrosis quística bajo la perspectiva en salud. En ningún estudio se encontró la aplicación de la estrategia de test de portador en cascada para FQ; los estudios encontrados usaron la prevalencia de portador para población caucásica en general, lo que indica que no se tuvo en cuenta de manera exclusiva la probabilidad de ser portador teniendo antecedente familiar de FQ.
Todos los estudios utilizaron el supuesto de una cohorte de pacientes con el fin de aplicar las probabilidades inherentes al modelo de análisis de decisiones. Las prevalencias de portador más usadas fueron de 1 por 25 pacientes y 1 por 30 pacientes, que son las de mayor aplicación para raza caucásica. Los resultados obtenidos en cada estudio fueron heterogéneos debido a la variación en moneda aplicada, año, tasa de descuento y supuestos que difieren en relación al sistema de salud de cada país, además de la percepción de aceptación de un test genético y de la decisión de abortar un feto con alto riesgo de FQ. La probabilidad de elegir aborto terapéutico se presentó entre el 30% y el 100%.
En la estrategia preconcepcional se encontró el supuesto que hasta 25% de los pacientes estaban dispuestos a abstenerse de tener hijos en caso de que la pareja fuera portadora. Ningún estudio reportó la posibilidad de diagnóstico genético preimplantacional en el análisis de decisiones y solo en el estudio más reciente se presentó la posibilidad y el costo de la técnica de fertilización in vitro.
La expectativa de vida más usada para los pacientes con FQ fue de 30 años, aunque uno de los estudios usó una expectativa de 50 años; la estrategia más costo-efectiva fue la del tamizaje preconcepcional asociada al test prenatal, mientras que la preconcepcional aislada no garantizó costo-efectividad dados los supuestos que debía cumplir, como la probabilidad de aceptación o no de optar por otras opciones de consejería genética: abstenerse a la gestación, adoptar un niño o el diagnóstico genético preimplantacional.
La mejor estrategia de tamizaje genético es la secuencial, en la cual primero se realiza el test a un integrante de la pareja y si resulta positivo se realiza el test a su compañero(a); si ambos son positivos se considera pareja en riesgo, pero si resulta negativo alguno de ellos su reporte final es sin riesgo. La ventaja de esta estrategia es que se da un diagnóstico de portador de manera individual, por lo que resulta ser mejor que la estrategia paralela o simultánea en la que se realiza el examen diagnostico al mismo tiempo a los dos integrantes, dando su reporte como pareja con o sin riesgo.
Morris & Oppenheimer 8, Van Der Riet et al.10 y Wei et al.16 no especificaron fuente de financiación ni estado de conflicto de interés en la realización de los estudios económicos.
Discusión
Esta revisión sistemática permitió evaluar la metodología seleccionada en la literatura científica mundial para la realización de evaluaciones económicas de tipo costo-efectividad del test genético de portador para FQ, considerada una enfermedad de alto costo.
Se encontró marcada heterogeneidad en la metodología aplicada que llevó a que los resultados no fueran comparables y se concluyera que existen diferentes enfoques de este test genético según las características operativas de la prueba diagnóstica, la moneda aplicada, los supuestos y las probabilidades que deben ajustarse a las necesidades y características de cada país.
No se encontró ningún estudio económico realizado en Suramérica ni en Colombia, lo que plantea la necesidad de realizarlo según los respectivos costos y supuestos con un modelo de análisis de decisiones acorde a las necesidades. Aunque ningún estudio fue costo-efectivo, se debe aumentar la sensibilidad y especificidad del test de portador con el estudio de mutaciones completo del gen para cada país, esto con el fin de que la prueba diagnóstica sea económica y pueda ser aplicada a población en riesgo por antecedente familiar, teniendo en cuenta que puede prevenir una o más gestaciones a futuro con riesgo de FQ.
Radhakrishnan et al.19, realizaron una revisión de evaluación económica para test de fibrosis quística donde encontraron 14 estudios desde 1990 a 2006 reportando también como análisis primario el costo por nacimiento con FQ evitado y el costo por identificación de pareja portadora afectada, entre otros hallazgos que concuerdan con la presente revisión.
En el 2000, Restrepo et al. 20 analizaron con panel de 16 mutaciones por técnica de PCR a 96 pacientes latinoamericanos: 45 mexicanos, 24 colombianos y 27 venezolanos. La frecuencia de mutaciones prevalentes encontrada para Colombia fue de 35.4% para DF508, 6.3% en G542X y 2.1% en N1303k y similar prevalencia para México y Venezuela. Es importante mencionar que aunque la DF508 es la más frecuente a nivel mundial, estos paneles de mutaciones dependen de la frecuencia encontrada según la región o país, cambiando su sensibilidad y especificidad en donde sea aplicada. En Colombia no se ha estudiado en su totalidad la frecuencia mutacional de todos los pacientes diagnosticados con FQ ni de los portadores de mutaciones.
Para el 2010, Vásquez et al.21 analizaron la frecuencia genética en 66 pacientes colombianos con fibrosis quística encontrando que la mutación más frecuente fue la DF508 y la 621+1G>T con 54.5% y 10.6%, respectivamente; el análisis se realizó con el panel de 32 mutaciones y ratificó que la frecuencia genética depende del número de mutaciones analizadas y de la frecuencia mutacional encontrada en cada país.
La evidencia sugiere que la estrategia de tamizaje preconcepcional puede ser exitosa, pero depende de la aceptación por parte de la pareja y de un excelente abordaje en consejería genética para tener alta probabilidad de aceptar opciones costo-efectivas como la de no tener gestaciones entre parejas en riesgo, adoptar o la donación de gametos (IVF); mientras que las opciones de tamizaje prenatal y de diagnóstico genético preimplantacional tienen riesgo de aborto y un costo más elevado para el sistema de salud. Además, se debe considerar que las valoraciones prenatales suelen iniciarse de forma tardía, no hay una cultura de consulta preconcepcional y tampoco hay un panel especifico ni un estudio de mutaciones prevalentes para ser aplicado en Colombia con el fin de reducir los costos de estas pruebas genéticas y mejorar su sensibilidad y especificidad.