Introducción
El embarazo es un estado fisiológico en el que se presenta resistencia a la insulina, representando un modelo fisiológico de estrés para las células beta (β) a nivel pancreático 1,2. El aumento de la concentración de hormonas en el embarazo, en su mayoría de estrógenos y progestágenos, lleva a disminuir los niveles de glucosa en ayunas y el depósito de grasas, con retraso del vaciamiento gástrico y aumento del apetito. A medida que avanza el tiempo durante la gestación, la sensibilidad tisular a la insulina tiende a disminuir, lo que condiciona un incremento de la glucosa materna de modo sostenido y proporciona energía al feto 3. Debido a la demanda progresiva del feto en desarrollo y la transferencia nutricional transplacentaria, la glicemia en mujeres gestantes suele ser más baja que en mujeres sanas no embarazadas: las mujeres embarazadas sanas tienen niveles pico de glucosa a los 70 minutos posprandiales de alrededor de 120 mg/dL (6.7 mmol/L) 4.
La diabetes mellitus gestacional (DMG) ocurre cuando la secreción de insulina no es suficiente para compensar la disminución en la sensibilidad a esta; en su fisiopatología se ven relacionados mecanismos mediados de modo autoinmune, anormalidades genéticas en la función de las células beta β pancreáticas o deterioro en la resistencia a la insulina. En cuanto a este último, se debe mencionar el rol de la unidad fetoplacentaria y del tejido adiposo, pues con el desarrollo de esta unidad hay aumento de niveles de hormonas asociadas al embarazo (estrógenos, progesterona, cortisol y lactógeno placentario humano en la circulación materna) que llevan a efectos celulares posreceptor de insulina y aumentan su nivel de resistencia; esto suele iniciar entre las semanas 20 y 24 de embarazo y con el parto la producción hormonal se detiene, al igual que la resistencia a la insulina 5,6. En el tejido adiposo se producen las adipocitoquinas, las cuales actúan como hormonas implicadas en la regulación del metabolismo materno y resistencia a la insulina; incluyen la leptina, adiponectina, factor necrosis tumoral alfa (TNFα), interleucina-6 (IL-6), resistina, visfatina, y apelina, y se producen en la placenta, llevando a la modificación de la sensibilidad a la insulina por medio de mecanismos que incluyen la alteración del metabolismo de la glucosa, la atenuación de mecanismos de señalización de la insulina y el favorecimiento de un estado proinflamatorio 4.
La DMG es una condición clínica en donde mujeres gestantes sin diagnóstico previo de diabetes exhiben niveles elevados de glicemia, en su mayoría durante su último trimestre. Esta condición se define como un estado de intolerancia a los carbohidratos que se desarrolla o es reconocida por primera vez durante la gestación y llega a ser una de las complicaciones más comunes del embarazo. Los resultados adversos de esta condición en fetos incluyen macrosomía, distocia de hombros e hipoglucemia neonatal y en madres riesgo aumentado de cesárea, preeclampsia e hipertensión durante el embarazo, así como un mayor riesgo de diabetes mellitus tipo 2 subsecuente 7.
La prevalencia de DMG varía según los criterios diagnósticos y de tamizaje establecidos, las distintas poblaciones, la raza y la composición corporal; a nivel mundial, se presenta como complicación en cerca del 7% de los embarazos, resultando en más de 200 000 casos al año 8. En Colombia se calcula una prevalencia similar, de alrededor del 7% 9, asociados, a su vez, a la epidemia de obesidad en las mujeres jóvenes y en edad fértil 10,11.
Los criterios iniciales para el diagnóstico de DMG fueron establecidos hace más de 50 años por O’Sullivan & Mahan 12,13 y han sufrido posteriores modificaciones que aún siguen en uso. Estos criterios fueron elegidos para identificar mujeres con alto riesgo de desarrollar diabetes después de la gestación o derivados a partir de otros criterios utilizados para pacientes no embarazadas y no solo para identificar embarazos con alto riesgo de resultados perinatales adversos 14-16.
Algunas instituciones, como la Organización Mundial de la Salud (OMS), recomiendan realizar el tamizaje para DMG en todas las mujeres embarazadas, otras sugieren llevar a cabo pruebas diagnósticas solo si lo indica el perfil de riesgo. Es frecuente encontrar desacuerdo en cuanto a los criterios para el diagnóstico de la enfermedad, llegándose a afirmar que los que se usan en la actualidad son restrictivos y que grados menores de hiperglicemia aumentan el riesgo de resultados perinatales adversos 17,18. Por tanto, es necesario mencionar su perspectiva histórica y recordar lo último que se ha establecido en cuanto al diagnóstico, tanto a nivel mundial como nacional; esto con el fin de proveer a profesionales de la salud, a pacientes y al público en general una valoración confiable de la información disponible.
Perspectiva histórica
La historia del conocimiento de la DMG comienza hace más de un siglo, cuando se conocía que la diabetes que antecede al embarazo puede tener resultados adversos en el feto en formación o en el neonato. En 1882, Duncan 19 afirmó que la diabetes se podía presentar durante el embarazo y cesar con la terminación de este. En los años 40, Miller 20 reconoció que las mujeres que habían desarrollado diabetes años después del embarazo presentaron el antecedente de alta mortalidad fetal y neonatal en su última gestación. En 1949, White 21 elaboró una clasificación de pronóstico para sus pacientes diabéticas que se embarazaban, basada en los años de diagnóstico de la enfermedad, complicaciones crónicas de la paciente y su posible resultado en el embarazo y la sobrevida maternofetal 21.
Siguiendo con los aportes a la investigación de DMG, Carrington et al.22 empezaron a utilizar en los años 50 el término “diabetes gestacional” para aquella condición transitoria en la cual se evidenciaban en el feto efectos adversos que se atenuaban posterior al parto. En 1952, Jackson 23 informó acerca de la alta probabilidad de mortinatos previos y macrosomía en mujeres con diabetes; en aquel entonces, el diagnóstico de diabetes se basaba en los criterios del Servicio de Salud Pública de los Estados Unidos que utilizaban la prueba de tolerancia oral a la glucosa (PTG) de 3 horas con 100g de glucosa (Tabla 1) 19.
Table 1 Criterios diagnósticos de diabetes mellitus gestacional según el Servicio de Salud Pública de los Estados Unidos.
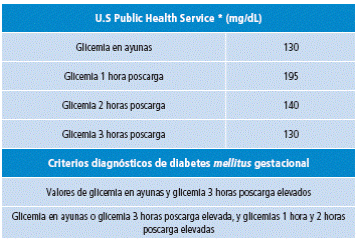
Fuente: Elaboración con base en Vandorsten et al7.
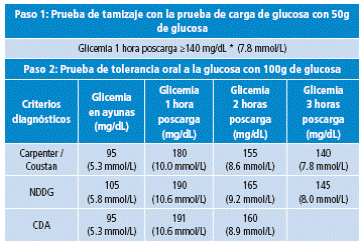
En 1964, O’Sullivan & Mahan 12 descubrieron el grado de intolerancia a la glucosa durante el embarazo, que se relacionaba con el riesgo de desarrollar diabetes mellitus después del parto, y lograron establecer los puntos de corte de la PTOG durante el periodo gestacional como criterios diagnósticos a tener en cuenta para DMG. Más adelante, algunos reportes documentaron el aumento de resultados adversos maternofetales con la elevación de solo un valor de las glicemias medidas en la PTOG 24,25. En 1978 el Colegio Americano de Obstetras y Ginecólogos (ACOG por sus siglas en inglés) recomendó el uso de los criterios de O’Sullivan 26 y en 1979 el Grupo Nacional de Información en Diabetes (NDDG por sus siglas en inglés) 27 realizó la conversión numérica de estos criterios para su medición en plasma. En 1982, Coustan & Carpenter 28 adaptaron esos puntos de corte a los métodos modernos de medición de glucosa y los aplicaron a la definición moderna de diabetes gestacional, aquella intolerancia a la glucosa que se establece o se reconoce por primera vez durante el embarazo (Tabla 2) 28.
Tabla 2 Criterios diagnósticos de la prueba de tolerancia oral a la glucosa de 3 horas con 100g de glucosa para diabetes mellitus gestacional.
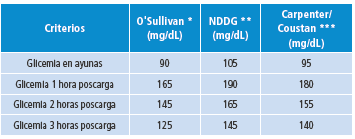
NDDG: National Diabetes Data Group.
* Sangre venosa total.
** Glucemia en plasma venoso.
*** Plasma sanguíneo, glucosa-oxidasa o hexokinasa. Fuente: Elaboración con base en Vandorsten et al. 7.
En 1985, Freinkel & Metzger 29, teniendo en cuenta la estabilidad metabólica como principal factor pronóstico en la gestante diabética, modificaron la clasificación de White y lograron establecer criterios para predecir la posibilidad de diabetes permanente (diabetes mellitus tipo 2) una vez terminada la gestación (Tabla 3). En 1986 la ACOG 30 aprueba la conversión numérica propuesta por la NDDG y en 1989 Sacks et al. demostraron que las conversiones realizadas por Carpenter & Coustan se basaban fielmente en los criterios originales de O’Sullivan más que en los propuestos por la NDDG 31.
Tabla 3 Clasificación de pronóstico para diabetes mellitus gestacional propuesta por Freinkel.

DMG: diabetes mellitus gestacional; DM tipo 2: diabetes mellitus tipo 2; DM tipo 1: diabetes mellitus tipo 1. Fuente: Elaboración con base en Freinkel & Metzger 29.
En 1994, la ACOG recomendaba cualquiera de las dos conversiones 31; en 1998, en la Cuarta Conferencia-Taller de Diabetes Mellitus Gestacional, recomendó el uso de las conversiones realizadas por Carpenter & Coustan 32; después, la Asociación Americana de Diabetes (ADA por su siglas en inglés) también sugirió esta última. En 1999, la OMS empezó a recomendar el uso de la PTOG con 75g de glucosa y de 2 horas, estableciendo el diagnóstico de la enfermedad con un valor de glicemia de 2 horas ≥140 mg/dL (7.8 mmol/L), siendo el mismo criterio para diagnosticar intolerancia a la glucosa en no embarazadas 13.
Factores de riesgo
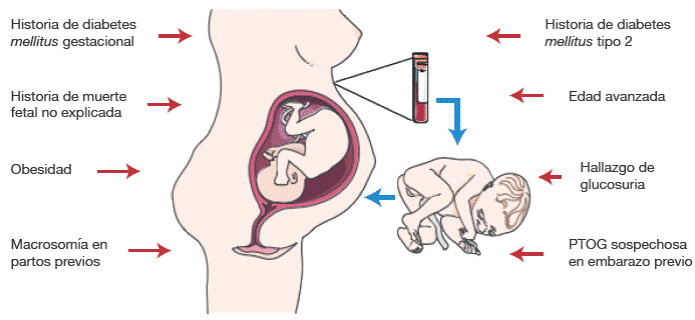
Se han identificado múltiples factores de riesgo de DMG, los principales se muestran en la Figura 1 34-37; se debe mencionar que la obesidad y la edad avanzada siguen siendo los más importantes 36 y que esta última se encuentra asociada con resistencia a la insulina 38. Las mujeres con índice de masa corporal (IMC) de 35 o más tienen probabilidad 5 a 6 veces mayor de desarrollar diabetes gestacional, asociada, a su vez, a otras complicaciones como aborto espontaneo, muerte fetal, aumento de la frecuencia de malformaciones congénitas, macrosomía fetal, hipertensión inducida por el embarazo y cesárea 35.
Al ser comparadas con mujeres normoglicémicas durante la gestación, las gestantes con DMG tienen un riesgo muy alto de desarrollar diabetes mellitus tipo 2 una vez finalizado el embarazo: RR de 7.43 (IC95%: 4.79-11.51) 39. Se puede lograr un beneficio de detección precoz de la enfermedad mediante PTOG con 75g de glucosa previo a la semana 24 en aquellas gestantes que sean afrodescendientes o hispanoamericanas, con índice de masa corporal de 35 o mayor, mayores de 35 años de edad y que presenten enfermedad sistémica crónica o antecedente de macrosomía fetal en gestaciones previas 34-39.
Diagnóstico de diabetes mellitus gestacional
La pruebas para diagnóstico de DMG se deben llevar a cabo entre las semanas 24 y 28 de gestación, período que se tiene en cuenta a partir del estudio HAPO (Hyperglycemia and Adverse Pregnancy Outcome) 40, un estudio epidemiológico multinacional en el que participaron alrededor de 25 000 mujeres gestantes y que demostró que el riesgo de resultados adversos maternos, fetales y neonatales aumentaba continuamente como función de la glicemia materna a las 24-28 semanas de gestación, incluso con rangos previamente considerados como normales para el embarazo, y que para la mayoría de resultados adversos no existía un umbral de riesgo 41,42.
En 2008 se llevaron a cabo discusiones respecto a los valores a establecer como criterios diagnósticos: la Asociación Internacional de Grupos de Estudio de Diabetes y Embarazo (IADPSG por su siglas en inglés) indicó que las mujeres con perfil de riesgo, quienes en su primera cita de control prenatal cumplían criterios diagnósticos de diabetes, recibían diagnóstico sobrepuesto de diabetes nogestacional 13; en 2011, la ADA, basándose en el consenso de la IADPSG, recomendó que aquellas mujeres gestantes sin diagnóstico previo de la enfermedad deberían realizarse PTOG con 75g de glucosa entre las semanas 24 y 28 de embarazo para poder obtener un diagnóstico 8. Luego, en 2013 y al tener en cuenta el reporte del Consenso de los Institutos Nacionales de Salud (NIH por sus siglas en inglés), la ADA también hizo modificaciones a las recomendaciones para diagnosticar DMG 7,8; en la actualidad, la mayoría de prácticas usan el enfoque de un paso o bien el de los dos pasos.
Enfoque de un paso
Es una propuesta de la OMS y la IADPSG y por lo general se utiliza en países distintos a Estados Unidos. En este se hace una PTOG de 2 horas en la que se administra una carga de 75g de glucosa a las mujeres gestantes en ayunas. De acuerdo al enfoque de la OMS, se miden los niveles de glicemia en ayunas y 2 horas poscarga, mientras que según el enfoque de la IADPSG la medición se hace en ayunas, 1 y 2 horas poscarga, para así compararlos con los criterios de diagnóstico recomendados 13. La PTOG debe ser realizada en la mañana, después de un ayuno de por lo menos 8 horas. La OMS y la IADPSG consideran el diagnóstico de DMG como la alteración de un valor de los niveles glicémicos medidos (Tabla 4) 7. Los puntos de corte que se tienen en cuenta según el consenso de la IADPSG son los únicos que están basados en los resultados adversos del embarazo, ya que en el estudio HAPO los valores de punto de corte diagnósticos para la medición de glicemia en ayunas, 1 y 2 horas poscarga fueron definidos al demostrar por lo menos un OR=1.75 (IC95%: 1.42-2.15) para resultados adversos del embarazo, comparado con mujeres que tenían niveles de glicemia dentro de la media del estudio 37.
Tabla 4 Criterios diagnósticos de diabetes mellitus gestacional mediante el enfoque de un paso.

WHO: World Health Organization; IADPSG: International Association of the Diabetes and Pregnancy Study Groups. Fuente: Elaboración con base en 13.
Enfoque de dos pasos
Es una propuesta de Carpenter & Coustan y la NDDG (27,28) y se utiliza de rutina en Estados Unidos 32,34 . El primer paso consiste en realizar la prueba de tamizaje, un test de carga con 50g de glucosa sin necesidad de ayuno. Si el nivel de glicemia medido 1 hora poscarga es menor al punto de corte seleccionado, por lo general el de 140 mg/dL (7.8 mmol/L), se considera que la paciente es negativa para DMG y no requiere realizarse otra prueba. Si el nivel de glicemia es mayor al del punto de corte, cualquiera de los tres que se utilizan en la práctica -140 mg/dL (7.8 mmol/L) que se utiliza de rutina, 130 mg/dL (7.2mmol/L) recomendado por algunos expertos o 135 mg/dL (7.5 mmol/L) recomendado por la ACOG-, se deberá continuar al segundo paso: realizar una PTOG con 100g de glucosa para 3 horas. Esta última prueba requiere que la paciente este en ayuno y mide los niveles de glicemia en ayunas, 1, 2 y 3 horas poscarga para luego ser comparados con los criterios diagnósticos recomendados, que pueden ser los puntos de corte de Carpenter & Coustan o los de la NDDG (Tabla 5) 7,8, logrando obtener o descartar el diagnóstico de DMG. Este enfoque permite identificar las mujeres en riesgo de desarrollar diabetes mellitus posterior, más que diagnosticar diabetes en el embarazo.
El estudio HAPO
El estudio HAPO se hizo con el objetivo de aclarar la asociación entre los niveles de glucosa materna más bajos y aquellos niveles diagnósticos de diabetes con resultados perinatales adversos 37,40,42; esto se logró al realizar una PTOG con 75g de glucosa en una cohorte heterogénea, multinacional, multicultural, multiétnica y de alrededor de 25 000 mujeres en su tercer trimestre de gestación. Los cuidadores médicos fueron cegados para conocer el estado de tolerancia a la glucosa, excepto cuando los criterios predefinidos ya eran conocidos: glicemia en ayunas ≥105 mg/dL (5.8 mmol/L) y glicemia 2 horas poscarga >200 mg/dL(11.1mmol/L) 41. Con lo anterior se predecía la asociación entre la glicemia materna y el riesgo de resultados adversos específicos, esta asociación podría ser utilizada para derivar criterios que fueran aceptables a nivel internacional para diagnóstico y clasificación de la DMG 37.
Los resultados primarios en la cohorte cegada fueron peso al nacimiento mayor al percentil 90, cesárea primaria, hipoglicemia neonatal clínicamente definida y péptido-C en cordón umbilical mayor al percentil 90. Los resultados secundarios fueron preeclampsia, parto pretérmino, distocia de hombros o lesiones durante el nacimiento, hiperbilirrubinemia y necesidad de cuidado intensivo neonatal.
En su mayoría se evidenció una relación gradual y directamente proporcional entre los niveles de glicemia materna y la frecuencia de resultados adversos primarios, independiente de otros factores de riesgo 37. Se observó una asociación similar para los resultados adversos secundarios 37,41 y las asociaciones no difirieron entre los distintos centros que hicieron parte del estudio, permitiendo afirmar sobre su aplicabilidad y posible utilidad para el desarrollo de criterios de clasificación del metabolismo de la glucosa en el embarazo basados en el riesgo de desarrollar resultados perinatales adversos. Debido a que las asociaciones eran continuas sin umbrales asociados a aumento del riesgo de resultados perinatales adversos, se concluyó que se requería de un consenso para llevar estos resultados a la práctica clínica 41.
Consenso de la Asociación Internacional de Grupos de Estudio de Diabetes y Embarazo
Con el fin de traducir los resultados del estudio HAPO a la práctica clínica, en junio de 2008 la IADPSG conformó un panel con representación de 10 organizaciones miembros de la asociación y otras instituciones con interés en diabetes y embarazo; este panel revisó los resultados del estudio para establecer recomendaciones en el diagnóstico y clasificación de la hiperglicemia en el embarazo, su reporte fue emitido en 2010 13.
Basándose en los resultados del estudio, y teniendo en cuenta los niveles medios de glucosa y la presentación de resultados primarios del estudio, se sugirió realizar PTOG con 75g de glucosa y hacer el diagnóstico con la alteración de al menos un valor de las glicemias medidas, sea la glicemia en ayunas, de 1 o de 2 horas, tal como se mencionó previamente en la presente revisión. A pesar de que los puntos de corte diagnósticos que se tuvieron en cuenta en el estudio HAPO difieran en una mínima proporción respecto a los establecidos por Carpenter & Coustan, se estimó que la prevalencia de la enfermedad podría aumentar, lo que se demostró en Estados Unidos con un aumento del 7% al 18%, alrededor de 250 000 a 640 000 mujeres por año respectivamente.
El aumento de la prevalencia se explica por el hecho de poder obtener el diagnóstico a partir de la alteración de un solo valor. Sin embargo, se concluye que este aumento de la frecuencia de desórdenes hiperglucemicos en el embarazo es concordante con el aumento de la prevalencia de la obesidad y desordenes del metabolismo de la glucosa en adultos jóvenes 43,44 y con los reportes recientes de aumento de la prevalencia de la DMG y la diabetes mellitus tipo 2 sobrepuesta en mujeres embarazadas 45. Del mismo modo, se recomienda que todas las mujeres, o al menos las que tienen factores de riesgo para diabetes mellitus tipo 2, sean sometidas a tamizaje para esta afectación sobrepuesta en su primer control prenatal y sean excluidas del diagnóstico de DMG a partir de alguno de los siguientes criterios: hemoglobina glicosilada ≥6.5%, glicemia en ayunas ≥126 mg/dL (7.0 mmol/L) o glicemia casual ≥200 mg/dL (11.1 mmol/L) 13.
Consenso de los Institutos Nacionales de Salud
Se realizó en marzo de 2013 para evaluar la evidencia disponible relacionada con el diagnóstico de DMG. Se conformó un panel de 15 miembros que incluía representantes de los campos de la ginecobstetricia, pediatría, medicina maternofetal, diabetología y epidemiología. Después de amplias discusiones sobre el tema, se concluyó que, aunque la estandarización internacional es benévola, la evidencia es insuficiente para adoptar las recomendaciones de la IADPSG, en su mayoría por la falta de evidencia de mejores resultados posibles en aquellas mujeres que además fueron identificadas, debido a que el estudio HAPO fue observacional, y los costos que implicarían para la sociedad por el aumento del número de mujeres diagnosticadas con DMG 46.
La mayor ventaja del enfoque de dos pasos es la posibilidad de tamizar a las mujeres con una prueba más corta y con un menor número de mujeres sometidas a una prueba de mayor duración. La preparación para la prueba puede hacerse en distintos contextos clínicos que incluyen oficinas, instituciones de salud o centros de control prenatal. La principal desventaja seria la necesidad de que las mujeres tengan que acudir de nuevo para tomarse la muestra para la PTOG de 3 horas y poder confirmar el diagnóstico.
Se afirma que con el enfoque de dos pasos se identifica entre el 5-6% de la población afectada por DMG 13. En cuanto a sus costos, la evaluación del impacto económico aún está incompleta, en principio se afirmaba que la disminución de resultados perinatales adversos compensaba los costos de tamizaje y tratamiento 47,48. Un análisis de costoefectividad en el que se comparó el enfoque de dos pasos (PTOG 50g / 100g) con el enfoque de un paso (PTOG 75g), aplicando los criterios diagnósticos de la IADPSG, sugiere que los costos del primero son menores frente al segundo.
Otro análisis concluyó que el enfoque de un paso es más costoso, pero de mejor costo-beneficio si se incluyen los gastos del tratamiento; estos últimos los conformaban suministros, materiales, procedimientos y pruebas clínicas. Por otro lado, el enfoque de dos pasos es moderadamente sensible a los costos del tratamiento y a la reducción de resultados adversos perinatales, principalmente preeclampsia y cesárea 49. Por último, se afirma que se requieren análisis más exhaustivos que tengan en cuenta períodos de tiempo más allá del parto 13.
Guía de práctica clínica para el diagnóstico, tratamiento y seguimiento de la diabetes gestacional
En Colombia se actualizaron las Guías de práctica clínica para el diagnóstico, tratamiento y seguimiento de la diabetes gestacional en 2015. Esta nueva guía se generó a partir del análisis de una mejor evidencia disponible en el tema y de los aportes de múltiples grupos de expertos y de organizaciones interesadas. Los grupos poblacionales considerados en su realización fueron todas las mujeres embarazadas y aquellas con diagnóstico de diabetes gestacional. Respecto al diagnóstico de DMG, se estableció que el enfoque de un solo paso propuesto por la IADPSG es superior al enfoque de dos pasos para prevenir la presentación de resultados perinatales adversos, por lo cual se recomendó su realización a todas las gestantes a partir de la semana 24. Como tal, se afirmó que no hay evidencia para modificar los límites de los valores de las pruebas para tamizaje y que las cargas metabólicas en cada método diagnóstico son puntos de corte adecuados para seguir teniendo en cuenta 50.
Conclusiones
La DMG es un problema de carácter global asociado a diferentes factores de riesgo que genera complicaciones graves para la madre y el feto en el período perinatal y a futuro y cuya incidencia va en aumento. Dada la complejidad de esta problemática, es necesario que en su manejo participe un grupo multidisciplinario de profesionales que incluya médicos generales, ginecobstetras, endocrinólogos y diabetólogos.
En la actualidad existe una disyuntiva para el diagnóstico de DMG y la controversia en la elección del método diagnóstico a aplicar radica en la falta de evidencia de superioridad de una estrategia sobre la otra. Se requiere de unanimidad para llegar a establecer un concepto absoluto entre las grandes asociaciones científicas mundiales para el diagnóstico de DMG.
El consenso del NIH propugna por el enfoque de dos pasos, mientras que el consenso de la IADPSG, al basarse en los resultados del estudio HAPO, justifica el uso del enfoque de un paso. En Colombia, basados en las ventajas del enfoque de un paso, se estableció la PTOG con 75g de glucosa entre las semanas 24 y 28 de gestación como método de elección para diagnóstico de DMG y se abolió el tamizaje.
Por último, se puede afirmar que existe la tendencia a estandarizar el enfoque de un solo paso como método diagnóstico para DMG dada su superioridad en costo-efectividad, predicción de resultados perinatales adversos y su practicidad en realización. La decisión del clínico sobre qué método aplicar depende de la prevalencia de la enfermedad en el área, del riesgo de desarrollar diabetes a largo plazo, de las variaciones entre los diferentes grupos étnicos, de la evidencia reciente y de buscar un manejo óptimo de la condición de la paciente.