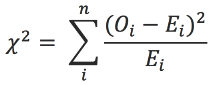Introducción
La anemia perioperatoria es una de las complicaciones más comunes en pacientes de cirugía cardiovascular programada gracias a las condiciones subyacentes y a la hemodilución durante el bypass cardiopulmonar (BC). Además, se asocia a un aumento significativo de eventos cardíacos y no cardíacos con mayor mortalidad 1,2.
Debido a que la hemoglobina contribuye más del 99% del contenido de oxígeno en la sangre, la anemia severa lleva a un suministro de oxígeno inadecuado, lo que resulta en hipoxia de tejidos, falla de órganos y muerte. En adición, la hipoxia promueve la expresión de enzimas glucolíticas y una consecuente producción de ácido láctico, que puede generar hiperlactatemia y conllevar complicaciones en el post-operatorio 3,4.
La hiperlactatemia (HL) se define como niveles aumentados de lactato en la sangre (entre 2 mmol/l y 5 mmol/l) en la ausencia de acidosis metabólica. Esta puede ocurrir en el 10-21% de los pacientes de cirugía cardiovascular, cuya causa principal es una manifestación de isquemia de tejidos que ocurre durante el BC. Los picos en los niveles de lactato se observan durante o justo después de comenzar la circulación extracorpórea (CEC) y se ha demostrado que su presencia incrementa el riesgo de un curso post-operatorio complicado y puede aumentar el riesgo de mortalidad de 8 a 10 veces5.
Sin embargo, el organismo presenta adaptaciones a la hipoxia con el fin de optimizar el suministro de oxígeno a tejidos y órganos y promover la supervivencia 3,4. La mayoría de adaptaciones están mediadas por los factores inducidos por hipoxia (HIF, por su sigla en inglés), los cuales se activan en respuesta a bajas concentraciones de oxígeno y transcriben genes ligados a la regulación de angiogénesis, eritropoyesis, metabolismo energético, función vasomotora y respuestas de proliferación y apoptosis 6,7.
Un polimorfismo en el gen que codifica para HIF-1α, llamado rs11549465 (NM_181054.2:c.1744C>T), presenta una transición de nucleótidos de citosina a timina que cambia el aminoácido correspondiente de prolina a serina en el exón 12, en el dominio oxígeno dependiente, el cual regula su degradación (ODD) 8. Estudios de cultivo in vitro han demostrado que esta presencia de serina en lugar de prolina puede impedir la degradación de HIF-1α y, por lo tanto, incrementar su actividad 9-11. Este polimorfismo ha sido asociado con la progresión de tumores y metástasis en diferentes tipos de canceres, como próstata, seno y tractos digestivo y urinario 12-15. A su vez, se ha demostrado que el alelo T de este polimorfismo se relaciona con aumento en la tasa máxima de toma de oxígeno (VO2 máx) y mejor adaptabilidad al ejercicio 16. Se ha encontrado que este polimorfismo afecta la homeostasis de glóbulos rojos y hierro después de donaciones periódicas de sangre de manera positiva, lo que sugiere que los portadores del alelo T están menos predispuestos a tener una deficiencia de hierro y sufrir de anemia en comparación con individuos no portadores 8.
Se ha establecido que la etnicidad es una variable demográfica importante contribuyente a la variabilidad entre individuos en la respuesta a muchos estímulos endógenos y exógenos 17. Las frecuencias alélicas de diferentes polimorfismos pueden variar entre grupos étnicos debido a las distintas presiones selectivas que cada grupo haya enfrentado, por lo que se favorecen ciertos alelos. Por lo tanto, a fin de generar hipótesis sobre un alelo que explique las diferencias entre individuos de una misma población, es importante conocer su prevalencia 17. Estudios en diferentes poblaciones han demostrado una amplia variabilidad en la frecuencia del alelo T del polimorfismo rs11549465, la cual va desde 0.019 en Taiwán 18 hasta 0.669 en el Tíbet 19. El único estudio realizado en Colombia en 83 personas sanas de Antioquia y Chocó reveló una frecuencia del alelo T de 0.151 17.
La presencia del alelo T del polimorfismo rs11549465 en algunos individuos, relacionado con una mayor actividad de HIF-1α podría explicar las grandes diferencias en las mediciones de hemoglobina y lactato observadas en los pacientes de cirugía cardiovascular de la Fundación Cardioinfantil - Instituto de Cardiología (FCI). Por esa razón, el objetivo de este proyecto fue describir la frecuencia del alelo T del polimorfismo rs11549465 de HIF-1α en una muestra de pacientes de cirugía cardiovascular programada y su relación con los niveles basales de hemoglobina y lactato.
Materiales y métodos
Pacientes
Se reclutaron 84 pacientes programados para cirugía cardiovascular en la FCI. Se tomó una muestra de sangre periférica en K2EDTA de cada paciente, la cual se almacenó a -20°C hasta su procesamiento. Además, se recolectaron datos de características demográficas y clínicas relevantes a partir de la historia clínica y se calculó el nivel de riesgo de la cirugía con el uso del sistema de evaluación de riesgo operatorio cardíaco europeo (Euroscore II) 20. Los valores de hemoglobina y lactato se obtuvieron de los gases arteriales tomados antes, durante y después de la cirugía. En esta investigación, todos los procedimientos realizados que involucraron participantes humanos estuvieron de acuerdo con los estándares éticos del comité de ética en investigación clínica de la FCI y con la declaración de Helsinski y enmiendas posteriores 21. Así, se obtuvo consentimiento informado de los participantes de este estudio.
Extracción de ADN y genotipificación del polimorfismo rs11549465 con base en la secuenciación de Sanger
Se aisló el ADN de todos los pacientes, a partir de las células nucleadas de las muestras de sangre, por medio de precipitación por etanol. Para un volumen de 300μl de muestra, se agregaron 900μl de solución de lisis celular (0.75g de NH4Cl, 0.21g de Tris Base, 100ml de agua pentadestilada y pH 7.4) a un vial de 1.5ml. Se mezcló por inversión y se incubó por 10 minutos a temperatura ambiente. Luego, se centrifugó a 14 000 RPM por 1 minuto, se descartó el sobrenadante y se resuspendió el pellet. Después, se adicionaron 300μl de solución de lisis nucleica (0.060g de Tris Base, 1.17g de NaCl, 200μl de EDTA 0.5 M, pH 8.2, 2.5ml de SDS 20% y 50ml de agua pentadestilada) y se mezcló con la pipeta para lisar las células blancas de la sangre. Se añadieron 100μl de solución de precipitación de proteínas (17.52g de NaCl y 50ml con agua pentadestilada), se mezcló por vórtex vigorosamente y se centrifugó a 14 000 RPM por 3 minutos.
Luego, se transfirió el sobrenadante a un vial nuevo de 1.5ml, se adicionaron 300ul de isopropanol a 4°C y se mezcló con suavidad la solución por inversión hasta visualizar el ADN en forma de mota de algodón. Se centrifugó a 14 000 RPM por 1 minuto, se desechó el sobrenadante y se agregaron 300μl etanol al 70% a temperatura ambiente. Después, se mezcló por inversión con suavidad para lavar el ADN y se centrifugó de nuevo a 14 000 RPM por 1 minuto. Se removió con cuidado el etanol con una pipeta Pasteur fina. Esto, con la precisión necesaria para no aspirar el pellet. Se invirtió el vial con el fin de limpiarlo sobre un papel absorbente y se dejó secar a temperatura ambiente. Finalmente, se añadieron 100μl de solución de rehidratación (0.060g de Tris Base, 100μl de EDTA 0.5 M y pH 8.0) y se incubó a 65°C por una hora.
Para la genotipificación del polimorfismo rs11549465 de HIF-1α (NM_181054.2:c.1744C>T), se estandarizó una reacción en cadena de polimerasa con los oligonucleótidos sentido 5'-GCT GAA GAC ACA GAA GCA AAG AAC-3' y antisentido 5'-GGG TAG GAG ATG GAG ATG CAA TCA-3', lo cuales amplificaron un fragmento del genoma de 443PB. Se combinaron 5μl de mezcla de ADN polimerasa de alta fidelidad (Myfi Mix 2x, Bioline), de mezcla de oligonucleótidos a 2.5 μM, de ADN 0.25x y 3μl de agua grado molecular. Se estableció un programa de ciclado térmico para llevar a cabo la reacción con las siguientes fases: a) predesnaturalización a 95°C durante 4 minutos, b) 35 ciclos de desnaturalización a 95°C por 30 segundos, hibridación de los oligonucleótidos a 57°C por 30 segundos y elongación a 72°C por 1 minuto y c) elongación final a 72°C durante 10 minutos.
Los productos de la reacción en cadena de la polimerasa (PCR, por su sigla en inglés) se purificaron para eliminar oligonucleótidos y nucleótidos libres que pudieran interferir con la secuenciación. Esto se realizó por medio de una incubación con 20U de exonucleasa I (ExoI, Thermo Scientific) y 2U fosfatasa alcalina (FastAP, Thermo Scientific) a 37°C durante 15 minutos, seguida de una inactivación a 85°C durante 15 minutos según las indicaciones del fabricante.
Se mezclaron 5μl de producto de PCR purificado 5μl y de oligonucleótido sentido y antisentido como iniciadores de secuenciación y se sometieron a secuenciación por el método de Sanger en colaboración con un proveedor externo de servicios 22,23. Al final, se analizaron las secuencias obtenidas de cada paciente con el fin de determinar la presencia o ausencia del polimorfismo.
Análisis estadístico
Se describió la población a través del análisis univariado de las características demográficas y clínicas con medidas de tendencia central según su distribución. Se determinó la prevalencia de los genotipos, la frecuencia del alelo T del polimorfismo rs1154946 con un intervalo de confianza de 95% y se llevó a cabo una prueba del equilibrio de Hardy Weinberg 24 por medio de la determinación del estadístico χ2:
Esto, a partir de las frecuencias observadas y las frecuencias esperadas de acuerdo al modelo E 1 =p 2 , E 2 =2pq, E 3 =q 2 donde p y q son las frecuencias alélicas del polimorfismo de estudio. El nivel de significancia elegido para diferencias en el equilibrio de Hardy Weinberg fue <0.05.
Se realizó la evaluación de las diferencias en los niveles de hemoglobina y lactato preoperatorios, intraoperatorios y postoperatorios entre los pacientes con el alelo T de rs11549465 y el alelo ancestral con una prueba de Mann-Whitney. El nivel de significancia elegido para el valor P fue <0.05. A la vez, a fin de evaluar diferencias en hiperlactatemia (≥ 2mmol/l) antes y después de la cirugía, se compararon las proporciones emparejadas.
Al final, se compararon proporciones independientes para establecer las diferencias entre la frecuencia del alelo T de rs11549465 de los pacientes de cirugía cardiovascular de la FCI y la frecuencia de este en otras poblaciones estudiadas.
Todos los análisis se realizaron con Microsoft Excel, el programa estadístico SPSS (IBM Corporation), la enciclopedia online para estudios epidemiológicos genéticos (OEGE, por su sigla en inglés) 24 y el programa para análisis epidemiológico de datos EPIDAT 25
Resultados
El 62% de los pacientes reclutados eran residentes de Bogotá y el 75.6% viven a una altitud mayor a 1500 m s. n. m. En total, se incluyeron 26 mujeres y 58 hombres, con un amplio rango de edades, índices de masa corporal y nivel de riesgo para la cirugía y se transfundieron 12 pacientes (Tabla 1). La cirugía más común fue la revascularización miocárdica (51.19%), seguida de reemplazos (34.52%) y plastias valvulares (9.52%). El 28.6% de los pacientes tuvieron más de un procedimiento quirúrgico (Tabla 1).
Tabla 1 Características de base de pacientes programados para cirugía cardiovascular en la Fundación Cardioinfanti participantes de este estudio.
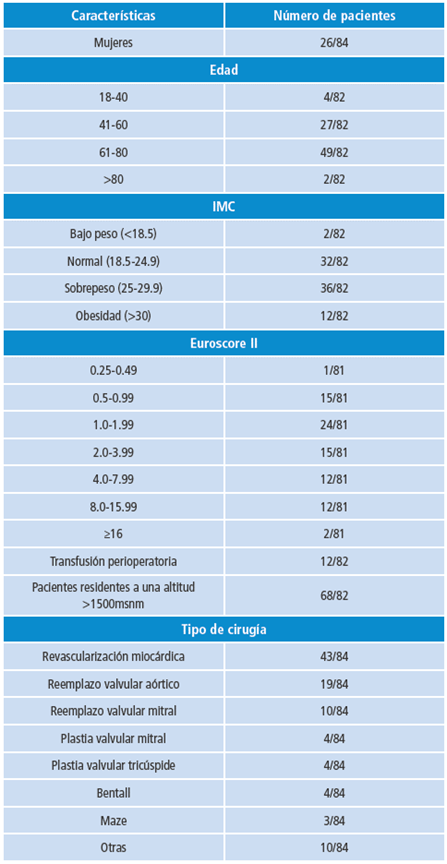
En algunos casos, no fue posible recolectar toda la información, lo que se reflejó en el total de los pacientes para cada parámetro. 28.6% tuvo más de un procedimiento quirúrgico.
IMC: índice de masa corporal.
Fuente: Elaboración propia.
La prevalencia de pacientes con alelo T en esta población fue de 0.119 (IC95%: 0.066-0.205); la frecuencia alélica, 0.066 (IC95%: 0.037-0.114), y la distribución genotípica, 74 pacientes para CC, 99 para CT y 1 para TT. No se encontraron desviaciones del equilibrio de Hardy Weinberg al obtener un valor de χ2<3.84 (p>0.05) para las diferencias entre genotipos observados y esperados en esta población 24 (Tabla 2).
Tabla 2 Frecuencia alélica y genotípica del polimorfismo rs11549465 en los pacientes programados para cirugía cardiovascular incluidos en este estudio.

Fuente: Elaboración propia.
Los niveles de hemoglobina preoperatoria de la mayoría de los pacientes estuvieron dentro del rango normal, descendieron de manera significativa durante la cirugía (causada, en especial, por la hemodilución atribuible a la CEC) y después de la cirugía (tras la suspensión de la CEC) se observó una recuperación que no alcanzaba los niveles basales (Figura 1). Cuando se compararon los niveles de hemoglobina preoperatorios, intraoperatorios y post-operatorios entre los pacientes portadores del alelo T y el ancestral, no se hallaron diferencias significativas (p>0.05).
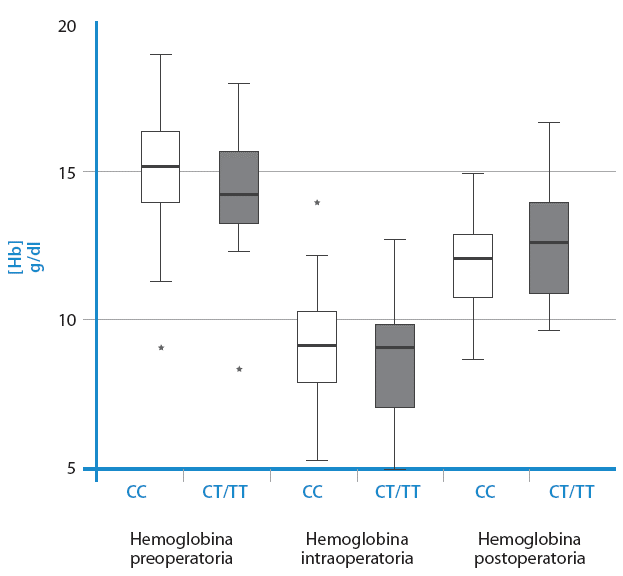
Fuente: Elaboración propia.
Figura 1 No se observaron diferencias en los niveles de hemoglobina preoperatoria, intraoperatoria y post-operatoria en pacientes de cirugía cardiovascular programada portadores del alelo T de rs11549465. Se compararon 74 pacientes con genotipo CC con 10 pacientes con genotipo CT o TT.
De igual forma, los niveles de lactato variaron como consecuencia de la cirugía. Se observó una diferencia significativa en la proporción de pacientes con hiperlactatemia (≥2mmol/l) antes y después de la cirugías (p<0.05) (Figura 2). No se encontraron diferencias significativas en los niveles de lactato preoperatorios, intraoperatorios y post-operatorios entre los pacientes portadores del alelo T y el ancestral (p>0,05).
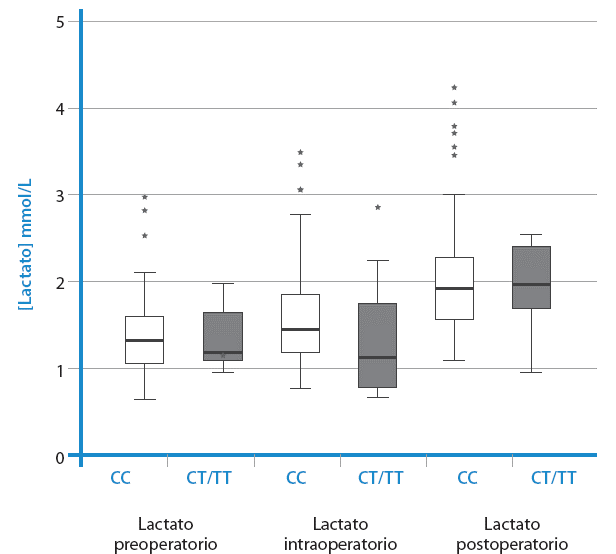
Fuente: Elaboración propia.
Figura 2 No se observaron diferencias en los niveles de lactato preoperatorio, intraoperatorio y post-operatorio en pacientes de cirugía cardiovascular programada portadores del alelo T de rs11549465. Se compararon 74 pacientes con genotipo CC con 10 pacientes con genotipo CT o TT.
Discusión
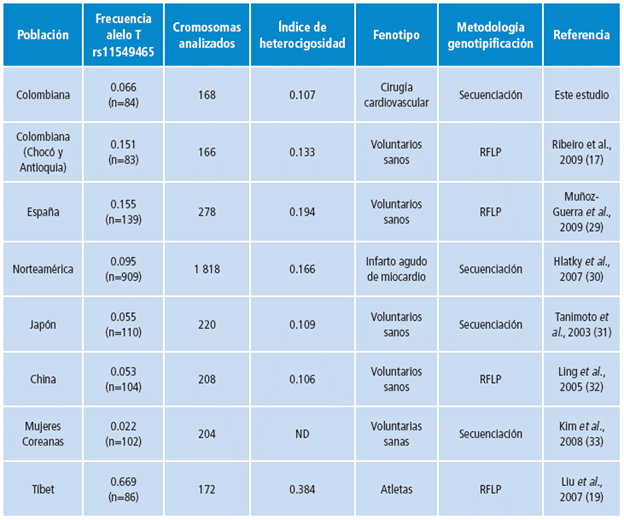
La frecuencia del alelo T del polimorfismo rs1154946 en los pacientes de cirugía cardiovascular de la FCI fue inferior a la frecuencia reportada en otros estudios realizados en poblaciones con etnicidades similares y no fue significativamente diferente de algunas poblaciones étnicamente muy distintas (Tabla 3 y Figura 3). El único estudio en Colombia, en voluntarios sanos de Chocó y Antioquia, reportó una frecuencia alélica de 0.151 (IC95%: 0.1040.213), la cual expone una diferencia estadísticamente significativa (p<0.05) con la de los pacientes de cirugía cardiovascular de la FCI reportada en esta investigación (0.066, IC95%: 0.037-0.114) 17. Esto se puede observar en la Tabla 3. Tanto la población antioqueña como aquella de ancestría africana de Chocó muestran un menor grado de mestizaje, lo cual explica que su composición genética sea distinta 26-28. Del mismo modo, estudios de ancestría genética han mostrado que las poblaciones de Chocó y Antioquia fueron fundadas principalmente por individuos provenientes de un número limitado de comunidades europeas y africanas 26,27. Sin embargo, la frecuencia del alelo T del polimorfismo rs1154946 en los sujetos del proyecto de los 1 000 genomas (Fase 3) fue de 0.0731 y el de colombianos de Medellín (CLM) del mismo proyecto fue de 0.0691, por lo que no se exhiben diferencias significativas a las observadas en este estudio (p>0.05). La frecuencia observada de este alelo puede verse afectada por la confiabilidad de las metodologías utilizadas.
Tabla 3 Frecuencia del alelo T de rs11549465 de algunas poblaciones relevantes para este estudio.
Fuente: Elaboración propia.
Fuente: Elaboración propia.
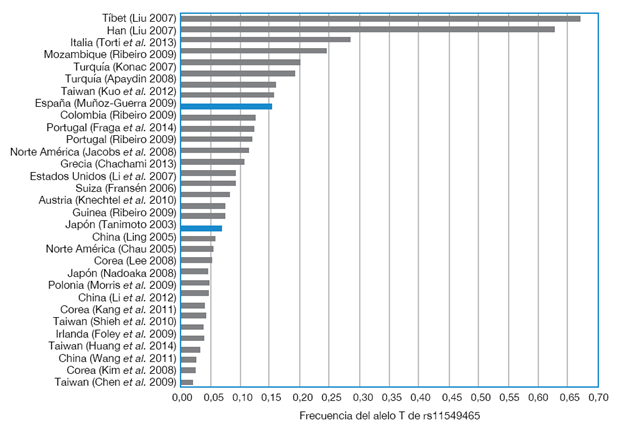
Figura 3 Frecuencia del alelo T de rs11549465 en voluntarios sanos de varias regiones del mundo. Solo se incluyó información de voluntarios sanos, excepto aquellos pacientes de cirugía cardiovascular programada de este estudio 34-54. El estudio antes realizado en personas colombianas y el presente están resaltados en negrilla.
En otra investigación realizada en voluntarios sanos españoles, se halló una frecuencia de este alelo de 0.155 (IC95%: 0.117-0.202), la cual también difiere de modo significativo (p<0.05) con la presente, a pesar de la fuerte contribución española a la composición genética en Colombia 29 (Tabla 3).
Por otro lado, la frecuencia del alelo T de los pacientes de este estudio no tuvo diferencias significativas (p>0.05) frente a la de poblaciones de China, Japón y Corea 31-33. La principal excepción fueron personas del Tíbet, en las que este alelo es favorecido (0.668, IC95%: 0.595-0.735), gracias a la baja concentración de oxígeno que hay en la altura a la que habitan 19 (Tabla 3). En ese sentido, lo más probable es que la variación en la frecuencia del alelo T en las diferentes poblaciones sea producto de la selección natural en ambientes de gran altitud con bajos niveles de oxígeno.
Sin embargo, en una investigación sobre polimorfismos de HIF-1α vinculados con las presentaciones clínicas iniciales de enfermedad coronaria aguda en pacientes norteamericanos 30, se halló una frecuencia del alelo T del polimorfismo rs1154946 de 0.095 (IC95%: 0.083-0.109) en aquellos que presentaron infarto agudo de miocardio (Tabla 3). Los resultados de este estudio demostraron que los pacientes con el alelo T tienen menos riesgo de desarrollar infarto agudo de miocardio en comparación con pacientes con enfermedad cardiovascular (angina estable) que no presentaron infartos (OR: 0.76, IC95%: 0.57-0.99). La frecuencia del alelo T en los pacientes con infarto del estudio mencionado no exhibió una diferencia significativa (p>0.05) frente a la de los pacientes de cirugía cardiovascular de la FCI (0.066, IC95%: 0.037-0.114). La baja frecuencia del alelo T en los pacientes de cirugía cardiovascular de la FCI y la alta proporción de pacientes sometidos a cirugías como consecuencia de infartos de miocardio podrían reflejar la frecuencia del alelo T en este grupo de pacientes y no ser representativas de la población colombiana general. Sería conveniente realizar un estudio de casos y controles con el fin de determinar si el nivel de riesgo de enfermedad cardiovascular es afectado por la presencia del alelo T de este polimorfismo.
No hubo diferencias significativas en los niveles de hemoglobina y lactato entre los portadores del alelo T y el ancestral en la población de pacientes de cirugía cardiovascular de la FCI. Esto puede deberse a varios factores: primero, la gran diversidad de los pacientes manifestada en las características demográficas y clínicas que presentan un amplio rango de edades, índices de masa corporal y nivel de riesgo para la cirugía, lo que ocasiona una amplitud de la distribución de valores de hemoglobina y lactato observados y oculta diferencias menores entre los pacientes portadores del alelo T y el ancestral (Tabla 1). Segundo, el posible efecto en los niveles de hemoglobina y lactato causado por las considerables diferencias analizadas en este grupo de pacientes respecto a la severidad de sus patologías, la presencia de comorbilidades, el tipo de cirugía o cirugías que cada paciente requirió o el estado nutricional del mismo (Tabla 1).
Los resultados de este estudio sugieren que la genotipificación de rs11549465 en pacientes de cirugía cardiovascular no representa un método de estratificación de riesgo de anemia en este grupo. Si bien no se pudieron encontrar diferencias en los niveles de hemoglobina y lactato entre los pacientes con el alelo ancestral y el T, sí se pudo determinar la distribución del alelo T de rs11549465 en esta población, algo que no se había estudiado antes en este tipo de pacientes.