Introducción
La psoriasis es una enfermedad inflamatoria sistémica que no solo compromete la piel 1,2. Hasta el 30% de los pacientes con psoriasis desarrollan artritis psoriásica (APs) 3 y entre el 10% y 60% de los individuos con psoriasis que no cumplen criterios diagnósticos de APs tienen manifestaciones musculoesqueléticas periféricas como entesitis 4,5. La APs y la artritis reumatoide (AR) son las enfermedades inflamatorias articulares más comunes 3,6,7. Se estima que más del 70% de los individuos con APs tienen manifestaciones clínicas de artritis inflamatoria periférica, por lo que establecer un diagnóstico que diferencie ambas entidades es un reto frecuente 8.
Los Criterios para la Clasificación de la Artritis Psoriásica (CASPAR, por su sigla en inglés) tienen una especificidad de 98.7% y una sensibilidad de 91.4% para el diagnóstico de APs en individuos con síntomas musculoesqueléticos periféricos (entesitis o artritis) y al menos un puntaje de 3 en esta escala 9,10. La radiografía simple es de gran utilidad en el diagnóstico y el seguimiento de la respuesta al tratamiento de la APs, ya que permite caracterizar daños estructurales e identificar proliferación ósea yuxtaarticular 11.
Los cambios radiográficos en APs han sido descritos con mayor frecuencia en las falanges distales y en las articulaciones interfalángicas distales. Estos incluyen, a la vez, cambios destructivos como erosiones u osteólisis y cambios proliferativos como formación de nuevo hueso (entesofitos) 12-14. La prevalencia de estos hallazgos es diferente en manos y pies. Por ejemplo, Ichikawa etal.8 sugieren que la resorción del penacho de la falange distal de los dedos de la mano (PFDM) no se asocia a APs, mientras que la misma alteración en los pies indica una asociación estadísticamente significativa en comparación con sujetos que padecen AR.
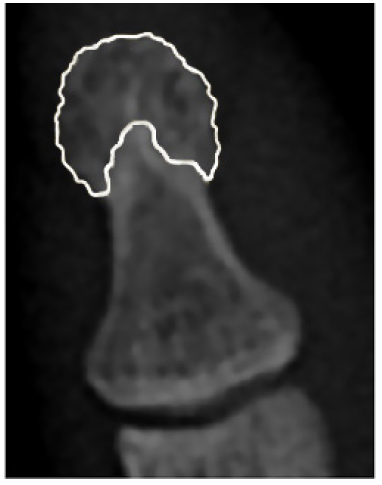
Se considera que el PFDM es el área de la falange distal en la que la cortical deja de ser completamente lisa y adquiere un aspecto lanceolado 15. En la Figura 1, el color blanco demarca el área correspondiente al PFDM. Otras alteraciones del PFDM descritas en radiografía simple de individuos con diagnóstico de psoriasis con o sin criterios de APs son las erosiones y la esclerosis. Estos hallazgos también han sido descritos en individuos con AR 16-18.
Dado que los cambios patológicos del PFDM se presentan en varias enfermedades musculoesqueléticas, en la práctica clínica su descripción se pasa por alto al momento de interpretar una radiografía simple de manos. El objetivo de esta revisión es determinar los hallazgos anormales del PFDM en radiografía simple asociados a psoriasis y APs en adultos.
Materiales y métodos
Esta revisión se realizó siguiendo los parámetros de las guías PRISMA 20,21. Su protocolo fue registrado en la base de datos de revisiones sistemáticas PROSPERO de la Universidad de York con número de registro CRD42015025185.
Método de búsqueda
Se desarrolló una búsqueda sistemática hasta diciembre de 2015 sin restricciones de lenguaje o fecha en las bases de datos MEDLINE, Embase, DeCS BIREME, LILACS, SciELO, Evidence-Based Medicine Reviews, Cochrane Central Register of Controlled Trials, Clinical Trials y Google Scholar.
La búsqueda en MEDLINE se llevó a cabo con los términos MeSH "Arthritis, Psoriatic", "Finger Phalanges" y "Radiography", que se enlazaron mediante el conector booleano AND. Para aumentar la sensibilidad de la búsqueda, se agregaron entry terms para cada término MeSH mediante el conector booleano OR. Una estrategia similar se empleó con el término MeSH "Psoriasis".
Dado que el PFDM no tiene un equivalente MeSH, se realizó una búsqueda adicional remplazando el término "Finger Phalanges" por las palabras: "tuft OR plume", tanto para el término "Psoriasis" como para "Arthritis, Psoriatic".
Este proceso de búsqueda se desarrolló en BIREME empleando los términos DeCS equivalentes y en las demás bases de datos usando palabras claves similares a los MeSH y DeCS ya descritos. Los términos de búsqueda completos se pueden consultar en la plataforma PROSPERO.
Cribado de estudios
Una vez extraídos los duplicados, dos autores no expertos en radiología o reumatologia evaluaron los artículos potenciales. Se incluyeron los documentos cuyo titulo o resumen tenían al menos una de las siguientes palabras en su idioma original: "erosion", "resorption", "sclerosis" o "proliferation". Los desacuerdos se resolvieron en consenso con un tercer autor.
Criterios de inclusión
Tipo de estudios: se incluyeron reportes de casos, estudios de casos y controles, de corte transversal, cohortes y ensayos clínicos aleatorizados o no aleatorizados.
Tipo de población: adultos mayores de 18 años con diagnóstico de psoriasis o APs de acuerdo a los criterios diagnósticos aceptados para la fecha de publicación del estudio.
Intervención: estudios que evaluaran el PFDM en radiografía simple de mano en una o más proyecciones.
Criterios de exclusión
Estudios sobre sujetos con diagnóstico simultáneo de APs o psoriasis y otras enfermedades musculoesqueléticas.
Extracción de datos
Los artículos tamizados se obtuvieron de bases de datos electrónicas, de revistas impresas disponibles en bibliotecas públicas y, en algunos casos, de los autores o editores de las revistas. Tres autores verificaron los criterios de inclusión evaluando los textos completos de forma independiente. Los desacuerdos se resolvieron mediante discusión y consenso.
Evaluación del riesgo de sesgo
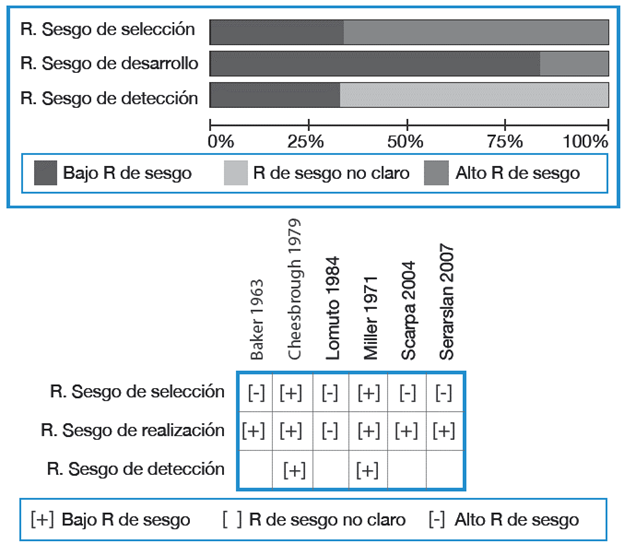
De forma independiente, tres autores realizaron la evaluación del riesgo de sesgo en los estudios incluidos en la síntesis cualitativa. En principio, fueron clasificados según los niveles de evidencia 2011 del Centro de Medicina Basada en la Evidencia de Oxford (OCEBM, por su sigla en inglés) 22. Además, se determinó su riesgo de sesgo de selección, sesgo de detección y sesgo de realización de acuerdo a preguntas elaboradas por los autores, que pueden ser consultadas en PROSPERO.
Los resultados de riesgo para cada artículo fueron registrados en una tabla bajo las categorías "alto riesgo de sesgo", "bajo riesgo de sesgo" y "riesgo de sesgo no claro", siguiendo las recomendaciones del Manual Cochrane para revisiones sistemáticas de intervenciones23. Las diferencias entre las evaluaciones de los autores fueron resueltas de común acuerdo.
Definición de variables
Para el registro de los resultados se tuvieron en cuenta las siguientes definiciones radiográficas:
Acroosteólisis: proceso destructivo caracterizado por la disminución del tamaño del penacho 24,25.
Resorción del penacho: pérdida del patrón lanceolado del PFDM, el cual adquiere una morfología cóncava con o sin ruptura de la cortical.
Esclerosis del penacho: engrosamiento >1mm de la cortical del PFDM con aumento de la radioopacidad ósea 26.
Erosión en el penacho: zona focal de disrupción de la cortical del PFDM 27.
Calcinosis de falange distal: calcificación de los tejidos blandos adyacentes al PFDM 25.
Proliferación ósea del penacho: excrecencias irregulares algodonosas o espiculadas adyacentes a la superficie ósea del PFDM, que suelen estar acompañadas de periostitis o engrosamiento de la cortical 28.
Medidas de resumen
Para sintetizar las variables cuantitativas, se usaron medidas de tendencia central (media) y dispersión (desviación estándar). Los datos de prevalencia se extrajeron como fracción y porcentaje equivalente y las asociaciones estadísticas se expresaron en términos de odds ratio (OR) con sus respectivos intervalos de confianza y valores p.
Recolección de datos
En cuanto a los estudios incluidos en la síntesis cualitativa, dos autores registraron los datos de forma independiente en un formulario diseñado para este propósito. Si surgían discrepancias, un tercer autor resolvía el desacuerdo.
Análisis estadístico
Se realizó un análisis independiente de dos subgrupos. El primer grupo incluyó los estudios sobre individuos con diagnóstico de APs y el segundo grupo abarcó las publicaciones acerca de sujetos con psoriasis.
Mediante el software Review Manager (RevMan) versión 5.3 29, se calcularon los OR, con su IC95% y valor p, para los artículos que no presentaban sus resultados en estos términos estadísticos. La prevalencia de los hallazgos radiográficos se sintetizó usando el modelo de efectos fijos de Mantel-Haenszel con el software Comprehensive Meta-Analysis versión 3.0 30. La heterogeneidad de los estudios se determinó con la prueba de I2, tomando como puntos de corte >75% (alta), 51%-74% (moderada) y <50% (baja).
Resultados
En la búsqueda inicial, se identificaron 17 artículos en MEDLINE, 22 en BIREME, 21 en Embase y 22 en Google Scholar. Tras la extracción de duplicados y tamización, se obtuvieron 26 artículos elegibles para revisión de texto completo y 7 referencias importantes encontradas en sus bibliografías.
En la síntesis cualitativa, se incluyeron tres reportes de caso, tres de corte transversal y cinco estudios de casos y controles. El trabajo de Scarpa et al. (18) se incluyó en ambos grupos de análisis debido a las poblaciones que participaron. El estudio de concordancia radiográfica de Taylor et al.31 se excluyó del análisis final debido a la no discriminación entre sujetos con APs y espondiloartropatías axiales.
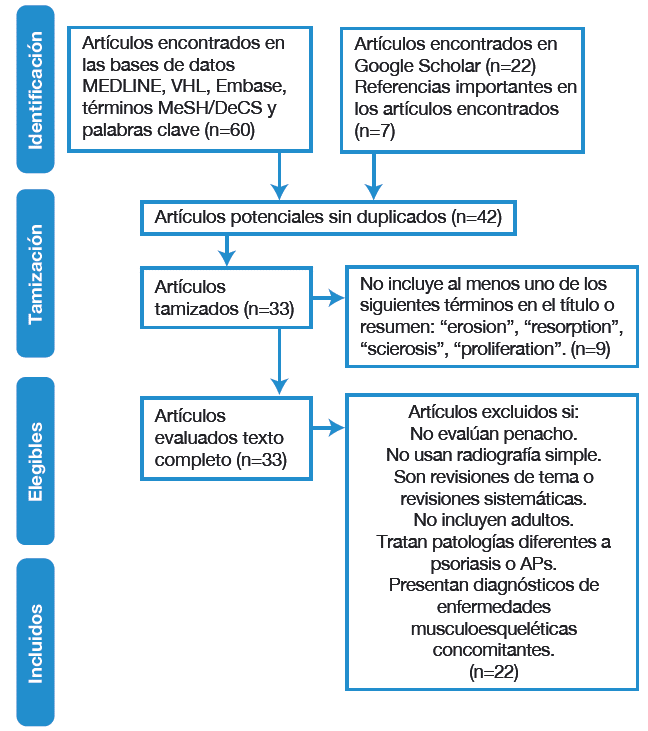
La Figura 2 presenta el diagrama de flujo de la revisión sistemática y los artículos seleccionados.
Fuente: Elaboración propia
Figura 2 Diagrama de flujo de la revisión. >VHL: Virtual Health Library; APs: artritis psoriásica.
Subgrupo psoriasis
Se documentó un riesgo de sesgo de selección alto en el 66% de los estudios debido a que no especificaron los criterios diagnósticos empleados. Más del 60% de las publicaciones presentaron riesgo de sesgo de detección poco claro dado que los autores no mencionaron si la evaluación había sido cegada o no reportaron la variabilidad interobservador o intraobservador. Los resultados de la evaluación de riesgo de sesgo se resumen en la Figura 3.
En el análisis no se incluyó la investigación de Serarslan et al.32 porque no informaron los hallazgos de manera independiente. Sin embargo, dada la relevancia de sus resultados, este artículo se incluyó en la Tabla 1, que describe los artículos incluidos.
Tabla 1 Características de los estudios incluidos.
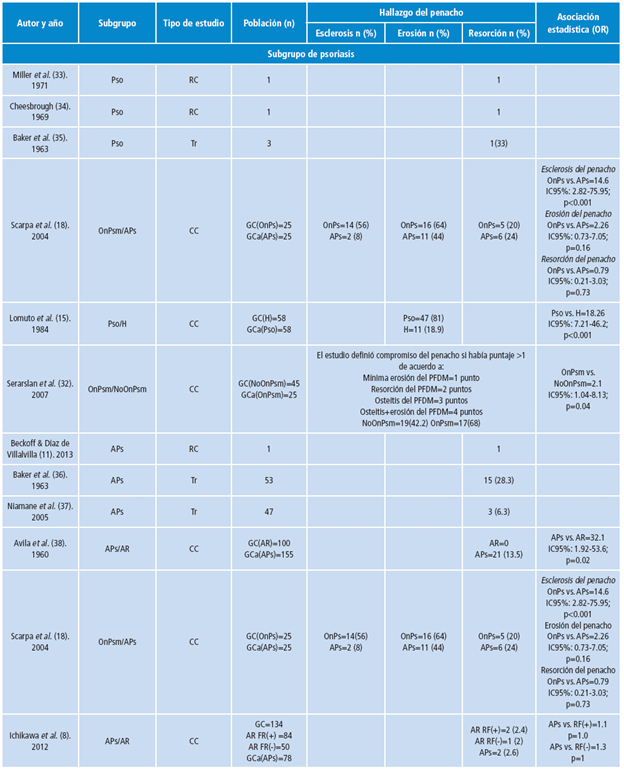
Pso: psoriasis; APs: artritis psoriásica; OnPsm: onicopatía psoriásica manos; H: sanos; NoOnPsm: psoriasis sin onicopatía psoriásica en manos; AR: artritis reumatoide; RC: reporte de caso; Tr: corte transversal; CC: casos control; GC: grupo control; GCa: grupo de casos; Co: concordancia; FR(+): factor reumatoide positivo; FR(-): factor reumatoide negativo; PFDM: penacho de la falange distal de la mano.
Fuente: Elaboración propia.
Ningún estudio reportó proliferación ósea. La prevalencia de resorción del PFDM fue del 21% (IC95%: 0.1-0.406; p=0.005) con baja heterogeneidad (I2=0%). Sin embargo, esta prevalencia no discrimina entre los sujetos con onicopatía psoriásica (OnPs) y sin onicopatía psoriásica (NoOnPs), lo cual reviste gran importancia, ya que los pacientes OnPs tienen un OR para afectación del PFDM de 2.91 (IC95%: 1.04-8.13; p=0.04) en comparación con aquellos NoOnPs 32.
La prevalencia de erosiones del PFDM fue de 75.2% (IC95%: 0.640.83; p<0.001) y un valor I2=62.8%, lo que indica una heterogeneidad moderada. Solo el estudio de Scarpa et al.18 reportó esclerosis del PFDM con OR de 14.6 estadísticamente significativo a favor de OnPs contra APs.
Subgrupo artritis psoriásica
El 66% de los estudios revelaron alto riesgo de sesgo de selección por razones similares a las del grupo de psoriasis. En este subgrupo, el estudio de Scarpa et al.18 fue catalogado con riesgo de sesgo de realización poco claro debido a que solo especificó la duración de enfermedad para el grupo de OnPs más no para el de APs.
En cuanto al riesgo de detección, cinco artículos evidenciaron riesgo alto o poco claro debido a la evaluación no cegada de las radiografías. Los resultados de la evaluación de riesgo de sesgo se resumen en la Figura 4.
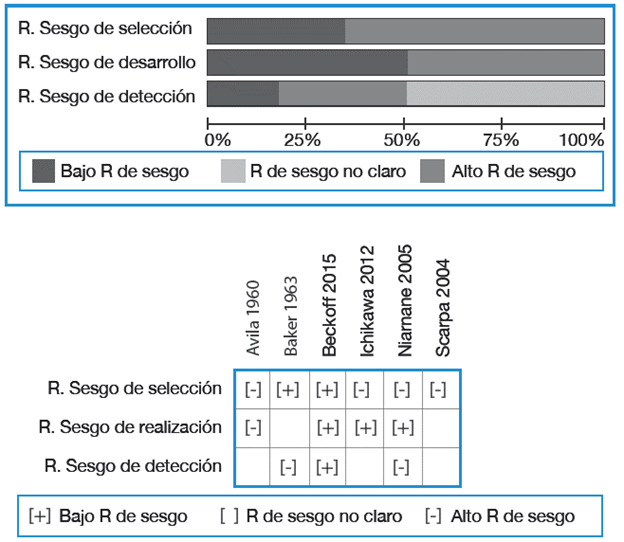
Figura 4 Riesgo de sesgo artículos grupo artritis psoriásica. R: riesgo. La prevalencia de resorción del PFDM fue del 16% (IC95%: 0.12-0.207; p<0.001) con una alta heterogeneidad (I2=77.9%).
La Figura 5 corresponde al diagrama de bosques de este hallazgo con el peso de cada estudio
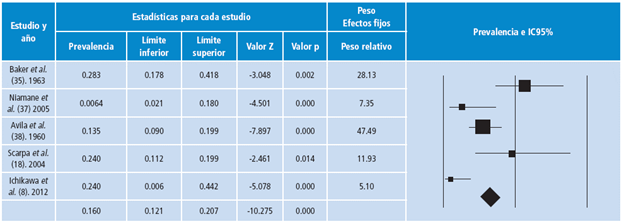
Figura 5 Prevalencia de resorción del penacho de la falange distal de los dedos de las manos en artritis psoriásica.
Solo Scarpa et al.18 identificaron esclerosis y erosiones del PFDM con una prevalencia del 8% y 44%, respectivamente. Ninguna de estas alteraciones tuvo asociación estadísticamente significativa al comparar APs y OnPs.
Discusión
El presente estudio encontró que la resorción del PFDM, con una prevalencia media de 16%, es el hallazgo descrito con mayor frecuencia en estudios sobre individuos con APs. Los estudios de Ichikawa et al.8 y Niamane et al.37 reportaron una frecuencia de esta alteración de 2.3% y 6.3%, respectivamente, con una duración media de la enfermedad de 7 años. Por su parte, las investigaciones de Scarpa et al.18, Avila et al.38 y Baker et al.35 documentaron prevalencias más altas (12.5-28%) pero no informaron la duración de la enfermedad; luego es probable que este hallazgo no esté asociado con APs, al menos en etapas tempranas de la enfermedad.
Avila et al.38 compararon entidades de diferente etiología (APs vs. AR), y encontraron que la resorción del PFDM se asocia con la APs. Por otro lado, no existe una diferencia significativa en la prevalencia de resorción del penacho entre individuos con APs y OnPs 18. Estos resultados sugieren que el compromiso del PFDM en OnPs y APs es resultado de un fenómeno fisiopatológico común 39.
El compromiso ungueal se ha documentado hasta en el 50% de los sujetos con psoriasis y en el 80% de los pacientes con APs 40,41. En 2003, McGonagle & Tan 42 demostraron de forma histológica la existencia de un continuo de tejido conectivo entre el lecho ungueal y el periostio de la falange terminal, lo cual integra la uña al sistema musculoesquelético. En este sentido, el proceso inflamatorio inicial de la entesis ungueal o tendinosa puede diseminarse hacia la porción ósea de la falange distal, incluyendo el penacho 43. Esta teoría explicaría los resultados presentados por Serarslan et al.32, quienes informaron que los pacientes con OnPs tienen 2.91 veces más compromiso del PFDM que los pacientes NoOnPs.
En el grupo de psoriasis, las erosiones del PFDM adquieren una gran importancia dada la prevalencia media del 75%, si bien esta anormalidad solo fue reportada en dos estudios con poblaciones diferentes. Por un lado, Scarpa et al.18 compararon grupos con APs vs. OnPs y hallaron prevalencia de erosión del PFDM del 44% en APs y 64% en OnPs, sin asociación estadística significativa. Por otro lado, al comparar individuos sanos y sujetos con diferentes grados de psoriasis sin manifestaciones musculoesqueléticas, Lomuto et al.15 encontraron una prevalencia de erosiones del PFDM del 81%, un hallazgo estadísticamente significativo por el OR 18.2 (IC95%: 7.2146.2; p<0,001). Es de resaltar que este último trabajo no discriminó los pacientes con OnPs; por tanto, las erosiones podrían tener una mayor asociación con compromiso ungueal que con la presencia de psoriasis.
Los individuos con OnPs tienen 14.6 veces más riesgo de presentar esclerosis del PFDM que los individuos con APs sin onicopatía 18. Esto puede ser una consecuencia de la respuesta del periostio a la reacción inflamatoria diseminada por contigüidad desde el lecho ungueal 44. Las erosiones y la esclerosis del PFDM parecen ser resultado de la entesitis del compartimiento ungueal, fenómeno que se ha asociado con un alto grado de limitación funcional y un mayor riesgo de entesopatía sistémica y desarrollo de .APs45)-(18.
Varios factores limitan los resultados de esta revisión. En primer lugar, solo se identificaron 11 artículos, la mayoría con una baja calidad metodológica reflejada en los riesgos de sesgo establecidos. Dada la gran variabilidad estadística y clínica de los artículos seleccionados, no fue posible realizar un metaanálisis.
Conclusiones
La evidencia actual acerca del compromiso del PFDM en APs y psoriasis es limitada. Al parecer, existe una relación directa entre las alteraciones del PFDM y la presencia de patología ungueal, siendo las erosiones y la esclerosis las anormalidades radiográficas más significativas. Nuevas investigaciones son necesarias para determinar la relación entre la magnitud de la respuesta inflamatoria del lecho y la matriz ungueal, el tiempo de evolución de la enfermedad ungueal y la presencia de erosiones y esclerosis del PFDM en estas poblaciones.
La literatura disponible hasta el momento no permite establecer el nivel de asociación entre la resorción del PFDM y la presencia de APs o psoriasis; por tanto, nuevos estudios que evalúen este hallazgo y su relación con la onicopatía psoriásica son necesarios.