Introducción
Las parasitosis intestinales se asocian con carga elevada de morbimortalidad en poblaciones pobres de países tropicales, lo que se refleja en déficit nutricional, disminución del aprendizaje y, en general, deterioro de su desarrollo físico y mental sobre todo en población infantil 1.
En particular, las geohelmintiasis se caracterizan por prevalencias altas en habitantes de regiones tropicales y subtropicales del mundo debido a la contaminación de agua y alimentos con heces. Esto como consecuencia de la carencia de saneamiento básico y de agua potable, además de hábitos deficientes en los comportamientos higiénico-sanitarios asociados a niveles bajos de educación 1. En el 2010, la carga global estimada de helmintiasis intestinales fue de 5.2 millones de años de vida saludable perdidos (AVISA) 2.
Se estima que la uncinariasis es el mayor componente de la carga de enfermedad por geohelmintiasis a nivel mundial (3.2 millones AVISA) debido a que contribuye a la anemia hipocrómica microcítica por deficiencia de hierro, lo cual causa un impacto negativo en la salud de la población en general, sobre todo en niños, mujeres en edad fértil, fetos y neonatos 3,4.
De acuerdo con la última encuesta nacional de parasitismo intestinal 1, realizada entre 2012 y 2014 en niños y niñas colombianos escolarizados de siete a diez años de edad, la prevalencia de infección por Uncinaria sp. (Ancylostoma duodenale/N. americanus) para dicha población fue 6.4% (IC95%: 3.7-10.8; error=1.7). De la misma manera, la encuesta permitió observar variaciones de las prevalencias para este parásito entre las regiones biogeográficas definidas en dicho estudio: Territorios insulares 0% (IC95%: 0-0; error=0), Cinturón Árido Pericaribeño 13.2% (IC95%: 4.9-30.8; error=6.1), Sierra Nevada de Santa Marta 3.4% (IC95%: 2.2-5.1; error=0.7), Norandina 1% (IC95%: 0.2-4.9; error=0.8), Chocó-Magdalena 8.9% (IC95%: 3.5-20.7; error=4), La Orinoquía 9.8% (IC95%: 3-27.5; error=5.5), La Guayana 10.8% (IC95%: 10.1-11.5; error=0.4), y la biorregión específica de la Amazonía que presentó una prevalencia de 35.7% respecto a Uncinaria sp. (IC95%: 32.4-39; error=1.6).
Las manifestaciones clínicas asociadas a la infección por uncinarias se pueden agrupar en cutáneas, pulmonares, intestinales y sistémicas; estas últimas relacionadas con el síndrome anémico. El cuadro clínico de la infección por uncinarias está en estrecha relación con la intensidad parasitaria de la infección 4,5.
Las lesiones en piel hacen parte del síndrome de larva migrante cutánea, originada por las larvas de diferentes helmintos, dentro de los que se encuentran las uncinarias y se caracteriza por lesiones serpenteantes, pruriginosas y migratorias vinculadas con el sitio de ingreso de la larva al hospedero humano. La sintomatología pulmonar se enmarca en el síndrome de Löeffler como parte del cuadro vinculado a la presencia del parásito en tejido alveolo-capilar pulmonar durante el proceso de migración larvaria por diferentes helmintos. Este síndrome respiratorio asociado a una reacción inflamatoria se determina por tos, disnea, espasmo broncoalveolar (pulmón sibilante), eosinofilia periférica e infiltrados pulmonares evidentes en rayos X, los cuales son característicamente migratorios y transitorios 4,5.
La sintomatología gastrointestinal asociada a la infección por uncinarias es leve, poco frecuente y puede relacionarse con epigastralgia, náusea y, en ocasiones, diarrea. La anemia ferropénica es quizás la manifestación sistémica más importante vinculada a la infección por uncinarias, producto de la pérdida crónica de sangre y secundaria a la lesión de la mucosa intestinal y al consumo de sangre del parásito adulto enclavado en el intestino delgado del hospedero humano 4,5.
La técnica elegida para el diagnóstico de las geohelmintiasis -entre ellas la uncinariasis- es el coprológico directo y para determinar la intensidad de la infección, se emplea la técnica de Kato Katz 6,7.
Las sustancias preservantes que se adicionan a la muestra de materia fecal se utilizan con el fin de mantener la estructura morfológica apta de las formas parasitarias y asegurar así un adecuado diagnóstico en los casos en que se requiere su transporte para la evaluación horas después de la recolección de la misma. Como sustancias preservantes utilizadas para el transporte y almacenamiento de las muestras de materia fecal están: formalina (formol al 10%), formol al 5%, solución de MIF (mertiolate-iodo-formol), PVA (alcohol polivinílico) y fijador de Schaudinn 8. Algunos autores afirman que el preservante más usado es la formalina, la cual no conserva la morfología de los protozoos de manera adecuada y que el PVA contiene mercurio con disposición y tratamiento final como residuos difíciles y costosos. Además, este preservante no favorece la realización de técnicas de concentración como la de sedimentación con éter y Kato Katz, ni técnicas inmunoquímicas como las pruebas coproantigénicas o las pruebas moleculares 9.
Otra solución que, aunque ha sido menos usada, ofrece buen desempeño en la preservación de las heces es el SAF, el cual no contiene mercurio y es adecuada para realizar técnicas de sedimentación con éter o de concentración como Kato Katz 9-11. La solución de SAF también se ha empleado como preservante en la técnica de concentración formalina-éter para describir la diversidad morfológica de Blastocystis hominis12. Al evaluar muestras seriadas o únicas preservadas con SAF frente a una sola muestra en fresco sin preservante, se demostró que el uso de SAF mejora la detección de parásitos intestinales de modo considerable 9. Por lo tanto, su aplicabilidad en la conservación de muestras para encuestas epidemiológicas es de gran utilidad, en especial cuando se requiere el uso de métodos de concentración como Kato Katz, en los que es necesario hacer la lectura en las primeras 24 horas. En ese sentido, esta solución facilita la lectura después del primer día de recolección de la muestra.
El presente artículo tiene como objeto describir un caso en el que se utilizó esta solución como preservante de muestra de materia fecal con huevos de N. americanus y se demostró la presencia de los huevos durante 10 meses mediante la técnica de Kato Katz.
Materiales y métodos
Descripción del caso clínico
La muestra de materia fecal fue recolectada en el 2014 de un paciente masculino de 33 años, quien vivió durante dos años en la frontera colomboecuatoriana en Putumayo, a orillas del río San Miguel. El individuo refirió que, debido a su trabajo, sus piernas y pies estaban en contacto permanente con agua pantanosa. La enfermedad inició 6 meses atrás con un cuadro súbito de dolor precordial, fiebre y cefalea. En ese momento, le realizaron electrocardiograma y otras pruebas de laboratorio que resultaron normales. Posterior a este evento, persistió una sensación de palpitación precordial y astenia.
Dos meses después presentó un cuadro de dolor abdominal tipo cólico acompañado de deposiciones con sangre, pero no manifestó fiebre. 20 días antes de la consulta exhibió de nuevo dolor abdominal tipo cólico, diarrea acuosa abundante, con moco al final de la deposición asociado a palidez cutánea importante. En esa oportunidad, recibió ibuprofeno, loperamida y rehidratación oral. Como antecedentes de importancia, en 2008 le realizaron apendicectomía por apendicitis aguda y en 2009 se le diagnosticó giardiasis intestinal. No refirió dengue, malaria o leishmaniasis. No se encontraron alteraciones al examen físico.
Diagnóstico microscópico y recuento de parásitos intestinales
Se tomaron cerca de 100g de materia fecal, recolectada en recipientes rotulados, limpios, transparentes, de boca ancha y herméticos de 50ml. En el lapso de las dos horas siguientes a su recolección, la muestra de materia fecal fue procesada en el Laboratorio de Parasitología de la Facultad de Medicina de la Universidad Nacional de Colombia, sede Bogotá, distribuida en las siguientes partes:
Parte 1: realización del examen directo por microscopía de luz con aumento de 400X, utilizando la metodología de diagnóstico convencional con solución salina y lugol 12. Parte 2: ejecución de la técnica de Kato Katz para el recuento de los huevos y determinación de la intensidad de la infección por microscopía de luz con aumento de 100X 5,13. Parte 3: fijación en SAF, en proporción peso a volumen 1:2 (materia fecal:SAF). Esta muestra fue almacenada a 4°C para la observación periódica por el método de Kato Katz durante 10 meses.
Parte 4: fijación de la muestra de materia fecal en etanol al 70% en proporción 1:4 (materia fecal:etanol al 70%) y extracción de ADN a partir de 250mg de esta con QIAmp DNA Stool Mini Kit (Qiagen, Hilden, Germany) para la prueba de reacción en cadena polimerasa (PCR, por su sigla en inglés) en tiempo real (qPCR).
Las lecturas de las pruebas microscópicas se hicieron por dos observadores expertos certificados en diagnóstico, con amplia experiencia en este tipo de lectura y en trabajos anteriores mostraron una concordancia superior al 95% 7.
Diferenciación de las especies de Uncinaria sp. por qPCR
Para determinar la especie de Uncinaria sp., se empleó qPCR dirigida a la secuencia de ADN ITS-2 de la subunidad ribosomal pequeña con los cebadores descritos en la Tabla 1 15.
Tabla 1 Cebadores utilizados en la qPCR para la identificación de la especie de Uncinaria.
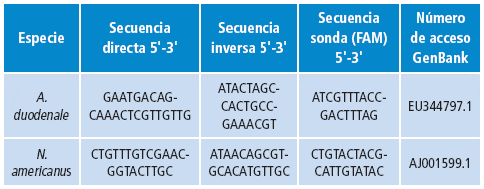
Fuente: Elaboración con base en Mejía et al.15.
Condiciones de la qPCR
Se emplearon dos juegos de cebadores específicos para la identificación con su respectiva sonda tanto para A. duodenale como para N. Americanus. Se realizó una qPCR para estos parásitos conservando las mismas condiciones de mezcla para cada qPCR y el mismo perfil térmico. Una medición con un CT menor a 38 se consideró como positiva 15.
Esta investigación fue considerada de riesgo mínimo para el individuo. Las consideraciones éticas que guiaron el desarrollo de este trabajo fueron coherentes con la Declaración de Helsinki 16 y la Resolución 8430 de 1993 del Ministerio de Salud de Colombia 17. Se obtuvo consentimiento informado por escrito y se suministró el tratamiento indicado de acuerdo con los esquemas vigentes y la información sobre la infección por geohelmintos.
Resultados
En el examen microscópico directo, utilizando la metodología de diagnóstico convencional con solución salina y lugol, la muestra era de consistencia blanda, color café y con presencia de sangre. Además, se observaron huevos de Uncinaria sp. La intensidad de la infección en la muestra inicial determinada con la prueba de Kato Katz fue de 2 040 huevos por gramo de materia fecal (hpg).
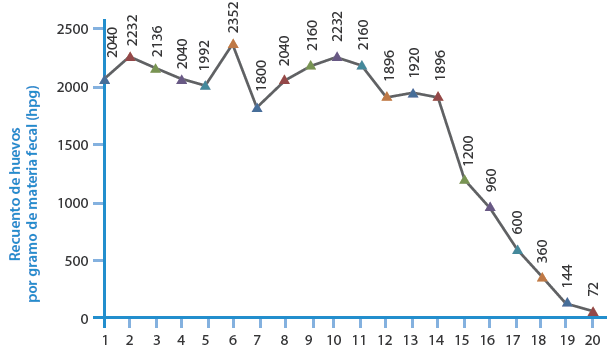
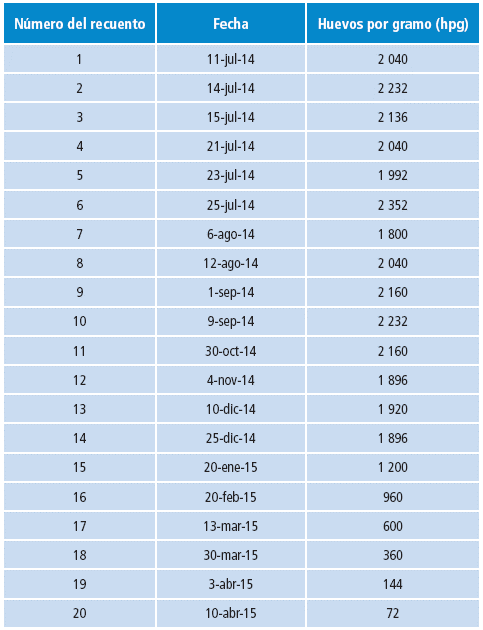
Durante 10 meses en las fechas descritas en la Figura 1 y la Tabla 2, se realizaron los siguientes recuentos por la técnica de Kato Katz con el fijador SAF, siendo la última lectura el 10 de abril de 2015, momento en el cual fue muy difícil observar los huevos de Uncinaria sp. En el primer mes, se realizaron seis observaciones y durante el resto del estudio se practicaron en promedio 1.5 recuentos cada mes, para un total de 20 recuentos en 10 meses.
Fuente: Elaboración propia.
Figura 1 Tendencia del recuento de huevos por gramo de materia fecal (hpg) durante el tiempo de evaluación.
Tabla 2 Recuento de huevos por gramo de material fecal (hpg) durante el tiempo de evaluación.
Fuente: Elaboración propia.
Se observó un descenso progresivo a partir de la lectura número 14 (al quinto mes) en la detección de los huevos de Uncinaria sp., por lo que se establecieron los primeros cinco meses como el tiempo más seguro para observar el número de recuento más semejante al inicial. El promedio hpg durante todo el período fue de 1 611.60 (SD=737.91), con un rango entre 72 y 2 352.
El promedio hpg en el primer mes fue de 2 132 (SD=125.79), con un rango entre 1 992 y 2 352. El promedio en los primeros cinco meses del estudio fue de 2 064 (SD=150.43), con un rango entre 1 800 y 2 352. En las observaciones de los últimos dos meses, la morfología de los huevos se alteró, lo que causó dificultad en su identificación y recuento. Posterior a la realización de la qPCR, se confirmó que la especie de Uncinaria sp. correspondió a N. americanus.
Discusión
El caso clínico corresponde a una descripción de signos y síntomas inespecíficos que con frecuencia acompañan a las infecciones por geohelmintos intestinales e impiden distinguir y confirmar el diagnóstico solo con la descripción clínica. De esta forma, es necesario realizar su confirmación con pruebas de laboratorio como examen microscópico directo utilizando la metodología de diagnóstico convencional con solución salina y lugol.
La procedencia del paciente lo enmarca en una zona de riesgo para estas infecciones en Colombia, como lo informa la última encuesta nacional de parasitismo intestinal realizada entre 2012 y 2014 en niños y niñas colombianos escolarizados de 7 a 10 años de edad 1, en la cual Putumayo, perteneciente la biorregión de la Amazonía, presentó una prevalencia de 35.7% respecto a Uncinaria sp. (IC95%: 32.4-39; error=1.6), cifra que ubica a este departamento dentro de las prevalencias más altas del país.
En la valoración clínica del paciente no se encontraron hallazgos sugestivos de lesiones en piel, relacionados con la dermatitis pruriginosa propia de la larva migrante cutánea 4,5. A pesar de que al paciente no se le realizaron estudios con el fin de evaluar la presencia o no de anemia, es bastante posible que la sensación de palpitación precordial, la astenia, la palidez cutánea y la cefalea hacen parte de un síndrome anémico no diagnosticado. Tampoco se observó el síndrome de Löeffier como manifestación de la migración larvaria por helmintos en los pulmones 4,5. Si bien en el caso de la infección por uncinarias, los síntomas gastrointestinales son infrecuentes, inespecíficos y de poca intensidad 4,5, en el paciente, estos fueron los más evidentes. Sin embargo, vale la pena recordar que durante la evolución clínica se le hizo diagnóstico de giardiasis, infección que con mayor probabilidad se vincula con síntomas gastrointestinales.
En este estudio, se utilizó la técnica de Kato Katz, recomendada por la Organización Mundial de la Salud a fin de determinar la intensidad de la infección por helmintos intestinales que, para este caso, se considera moderada, según con los parámetros establecidos por la OMS: 1-1 999hpg para leve, 2 000-3 999hpg para moderada y ≥4 000hpg para severa 18.
Existe una dificultad en la determinación de la intensidad parasitaria por Kato Katz cuando las muestras son trasladadas desde un sitio remoto a un laboratorio de referencia y no es posible realizar la lectura en las primeras 24 horas 10. Los resultados obtenidos en este estudio coinciden con lo reportado por Fernández-Niño et al.10, quienes informan que el uso del preservante de SAF para ejecutar la técnica Kato Katz permite obtener recuento de huevos similares en los primeros seis meses después de su preservación. Además, los autores demostraron que, si se emplea el preservante de SAF para fijación de la muestra, es posible obtener buena conservación de huevos de Ascaris lumbricoides y Trichuris trichiura por más de 6 meses, a diferencia de lo que ocurre con las uncinarias, cuyas características morfológicas se ven alteradas después de este tiempo, por lo que se dificulta la realización de un adecuado recuento de huevos.
Como en el estudio realizado por Mejía et al.15 que diferenciaron N. americanus y A. duodenale por medio de qPCR, en el caso actual se logró hacer esta distinción a través de esta prueba molecular.
Es necesario anotar que, hasta el momento, en el país se reportan resultados de estudios epidemiológicos con datos obtenidos a partir de examen microscópico directo utilizando la metodología de diagnóstico convencional con solución salina y lugol o por otros métodos. Es importante conocer la frecuencia y distribución de N. americanus y A. duodenale en Colombia mediante técnicas de biología molecular, ya que no es posible diferenciar estas especies a través de los exámenes de rutina, con el fin de aclarar el panorama epidemiológico de esta y otras helmintiasis intestinales 14.














