Introducción
La enfermedad por el virus del Ébola (EVE), o fiebre hemorrágica del Ébola (FHE), constituye una amenaza para la sobrevivencia de la humanidad, pues existe un elevado riesgo de su propagación a partir de los países endémicos y es evidente la letalidad potencial de nuevos brotes 1. El origen etimológico del nombre de EVE proviene del río Ébola, ubicado en la República Democrática del Congo donde en 1976 se identificó el virus por primera vez en una epidemia con alta mortalidad 1-3. Esta es una enfermedad infecciosa altamente contagiosa y grave, de elevada letalidad, que cursa con una fiebre hemorrágica viral 2-5.
La sistematización teórica sobre este tema permitirá triangular la información y definir los referentes teóricos esenciales para actualizar a los profesionales de la salud en el conocimiento de la enfermedad, garantizando así una adecuada prevención, un diagnóstico precoz y un tratamiento oportuno. Esta sistematización también permitirá limitar la expansión del virus y favorecer el desarrollo de estrategias de intervención comunitarias en los países endémicos y de prevención en los países no afectados, lo cual redundará en un beneficio social y económico con repercusión universal y será de particular importancia para los proveedores de atención sanitaria y responsables de políticas de salud.
En el presente artículo de revisión se abordan de manera actualizada y sintética los elementos más importantes en que se ha avanzado en el diagnóstico y tratamiento de esta enfermedad letal 6.
La EVE exhibe una gran virulencia que causa la muerte del 50-90% de los infectados por el virus. 2-4,7,8; por esto y por su contagiosidad, se ha considerado como un agente de bioseguridad nivel 4. Hasta la fecha no existe una vacuna aprobada ni un tratamiento estándar específico disponible, aunque promisorias opciones terapéuticas se encuentran en fase de investigación 7.
Hasta el año 2014, los brotes de ébola solo habían afectado a regiones específicas de África, ocasionando 2 127 muertes (54% de letalidad) 4; a partir de entonces se han producido contagios de dispersión de la enfermedad a otros continentes 9. Martínez et al.3 consideran el brote de 2014-2015 como el más devastador; este afectó a Guinea, Sierra Leona, Liberia y Nigeria 3,4. La Organización Mundial de la Salud (OMS) y el Centers for Disease Control and Prevention (CDC) han brindado continuamente atención a los ministerios de salud de los países afectados en el Sur de África, donde se contabilizaron 17 908 casos (Sierra Leona: 7 897, Liberia: 7 719 y Guinea: 2292), con una incidencia acumulada mayor de 300 casos por 100 000 habitantes, que incluye a trabajadores de la salud en estos países 10.
La epidemia de ébola de 2014-2016 ha sido el mayor brote epidémico de la enfermedad; tuvo sus inicios en diciembre de 2013 en Guinea y se extendió a Liberia, Sierra Leona, Nigeria, Senegal, EE. UU., España, Malí y Reino Unido 11,12. La OMS declaró el fin de la emergencia de salud pública de importancia internacional el 29 de marzo de 2016, pero se mantiene la vigilancia en los países más afectados por la aparición de casos aislados debido a restos aislados del brote 13.
Esta investigación tuvo como objetivo realizar una revisión sistemática de la literatura médica existente sobre la infección por virus del Ébola y se centró en la definición, la epidemiología, los factores etiológicos, el diagnóstico y el tratamiento durante el periodo 2009-2017.
Material y métodos
Se llevó a cabo una revisión sistemática de la literatura médica existente sobre la infección por el virus del Ébola mediante la búsqueda de artículos en las bases de datos PubMed, ProQuest, Embase, Redalyc, Ovid, Medline, DynaMed y ClinicalKey durante el periodo 2009-2017. Además, se realizó revisión de los informes de la OMS y la Organización Panamericana de la Salud durante los años 2014, 2015 y 2016. Se tuvieron en cuenta como criterios de inclusión referencias en texto completo y textos en inglés, español, francés y portugués. Se hizo la búsqueda con descriptores en ciencias de la salud (DeCS) de Bireme y los Medical Subject Headings (MesH) de la National Library of Medicine en inglés (Figura 1).
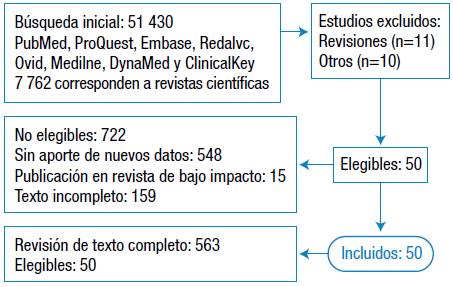
Fuente: Elaboración propia.
Figura 1 Flujograma de la metodología utilizada para la selección de publicaciones.
Dos de los autores de esta investigación revisaron de forma independiente la literatura, mientras que un revisor extractó los datos. Se emplearon dos modelos para combinar estadísticamente los resultados, el modelo de efectos fijos y el modelo de efectos aleatorios, lo cual permitió resumir de manera sintética los elementos fundamentales del manejo epidemiológico, el diagnóstico clínico y el tratamiento. Lo anterior permite a los profesionales apropiarse de las competencias necesarias para diagnosticar y tratar esta enfermedad, evitar el subdiagnóstico, prevenir las complicaciones y motivar el desarrollo de estrategias de prevención y diagnóstico oportuno.
Resultados
El número total de registros o citas identificados en las búsquedas fue de 51 430; de ellos, 7 762 correspondían a revistas científicas, de los cuales 7 423 habían sido evaluados por expertos. El número total de artículos a texto completo analizados para decidir su elegibilidad fue 772, el número total de artículos excluidos no relacionados con los criterios para inclusión o no relevantes fue 722 (debido a limitaciones en aporte de nuevos datos, publicación en revista de impacto, informes parciales y no disponer de texto completo del artículo) y el número total de estudios incluidos en la revisión sistemática fue de 50.
En la Tabla 1 están plasmadas algunas de las investigaciones revisadas y sus resultados más significativos según formato PRISMA:
Tabla 1 Resumen de algunos referentes teóricos y prácticos sobre la enfermedad por el virus del Ébola.
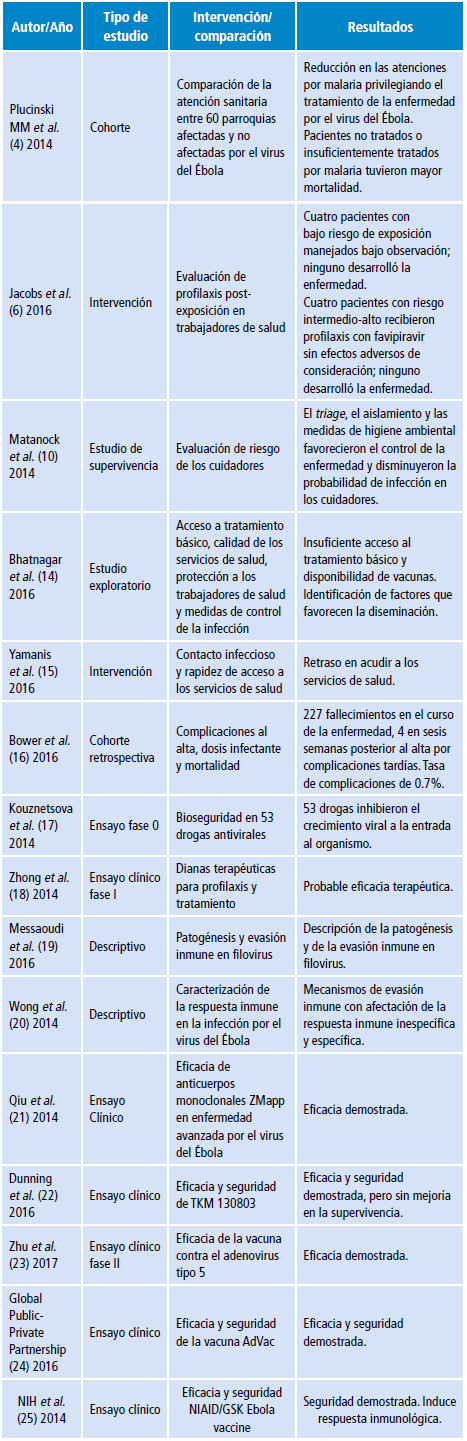
Fuente: Elaboración propia.
A continuación se exponen los aspectos en los cuales existe consenso en la literatura revisada:
El Ébola es un virus de morfología variable o pleomórfico monomolecular (se compone de una única molécula de ARN monocatenario lineal de polaridad negativa), perteneciente a la familia Filoviridae, altamente contagioso y que se transmite por el contacto con fluidos o líquidos corporales de la persona infectada con el virus, tales como sangre, saliva, orina, sudor e, inclusive, vómito, tanto para especies vivas como muertas 3,26. Asimismo, afecta también a otros mamíferos y tiene un lapso de incubación normal de entre 5 y 12 días 27. Esta enfermedad ocasiona choque hemorrágico que conduce a la muerte y presenta un alto nivel de mortalidad, de cerca del 90% 2-4,7,8,10,11.
El nombre de ébola es de origen congoleño, del río que lleva ese mismo nombre. Allí se identificó por primera vez esta enfermedad en el año de 1976 2-4,10,27.
Se han descrito cinco cepas del virus: Bundibugyo ebolavirus (BDBV), Reston ebolavirus (RESTV), Sudan ebolavirus (SUDV), Taï Forest ebolavirus (TAFV) y Zaire ebolavirus (ZEBOV) 2,4,7,10,26-29.
El virus puede contraerse por contacto con la sangre o con los fluidos corporales de animales infectados, por lo general monos o murciélagos de la fruta; sin embargo, no se ha documentado la transmisión aérea en el entorno natural. Una vez que un ser humano resulta infectado, la enfermedad también puede contagiarse entre personas 30 y la transmisión puede ocurrir por contacto directo a través de lesiones cutáneas o de las membranas mucosas, con la sangre u otros fluidos o secreciones corporales u órganos de personas o animales infectados vivos o fallecidos o por contacto indirecto con el ambiente o fómites contaminados con dichos fluidos (agujas, funerales, personal de salud) 2,27,29,31,32.
Algunos autores han considerado la posibilidad de que el virus del Ébola pueda permanecer en el semen hasta siete semanas después de la recuperación del paciente 33.
El ZEBOV es la cepa de mayor mortalidad (90%); su brote en África Occidental en el 2014 afectó a Guinea Conakry, Sierra Leona, Liberia y Nigeria y se reportaron más de 1 000 fallecidos por esta epidemia 7,34.
La FHE se presenta con un periodo de incubación de 2 a 21 días 2,14,27,35; no obstante, la duración del periodo depende de la respuesta inmune del paciente y de la tipología de cepa infectante. El periodo de transmisibilidad comienza desde la fase febril y aumenta mientras la sangre y las secreciones contengan el virus 15. Los síntomas fundamentales son fiebre alta de inicio súbito, postración, mialgias, artralgias, dolor abdominal y cefalea 36. Una semana más tarde se presentan erupciones generalizadas en todo el cuerpo, frecuentemente hemorrágicas 16. Las hemorragias se presentan, por lo general, en el tubo gastrointestinal, por lo que el infectado sangra por la boca y por el recto o el ano 2,31,37. Además, los pacientes presentan náuseas, vómitos, diarrea, alteraciones de la función hepática y renal e incluso meningoencefalitis 38; también pueden sufrir choque hipovolémico por la pérdida de sangre, lo cual, a su vez, puede conducir a un fallo múltiple de órganos y a la muerte 10,11,27,30,39. La tasa de mortalidad es elevada y tiene una frecuencia de fallecimientos de entre el 50% y el 90% de los infectados por el virus 40.
A continuación se enlistan los elementos a considerar para el diagnóstico epidemiológico que se encuentran definidos en la literatura consultada 41:
Definición de caso sospechoso
Se considera como un caso sospechoso a todo paciente con fiebre >38°C y alguno de los siguientes antecedentes epidemiológicos:
Contacto con caso confirmado de EVE en los 21 días anteriores a la aparición de los síntomas.
Viaje a regiones con circulación confirmada del virus del Ébola durante los 21 días anteriores a la aparición de los síntomas. Contacto directo con muestras de laboratorio recolectadas de casos sospechosos de EVE los 21 días anteriores a la aparición de los síntomas.
Definición de caso confirmado
Se considera como un caso confirmado a un paciente sospechoso más resultados de laboratorio positivos para virus del Ébola, ya sea por detección de virus ARN por RT-PCR o por detección de anticuerpos IgM contra virus del Ébola 42. A partir de ahí se puede confirmar por la clínica y el nexo epidemiológico, considerando además el contacto de humanos con animales enfermos fallecidos.
En cuanto al proceso de confirmación por el laboratorio, es importante tener presente que el virus tiene una baja especificidad y no está indicado el uso de pruebas rápidas 12,27,30,41,43.
Se recomienda tomar muestras de sangre total, suero, saliva y orina. Si el paciente está fallecido, se debe proceder a realizar frotis oral, pues la autopsia está contraindicada. Las muestras solo serán tomadas en los hospitales designados por personal capacitado para cumplir todas las medidas de bioseguridad 5,39,41,43,44.
El diagnóstico de laboratorio de la FHE se logra de dos formas 9,27,45-48: la primera, a través de la determinación de la respuesta inmune específica del hospedero a la infección y, la segunda, mediante la detección de las partículas virales en individuos infectados. Para la detección de la respuesta inmune se utiliza la prueba ELISA que detecta los anticuerpos IgG e IgM: los primeros aparecen a los 618 días de iniciados los síntomas y los segundos, a los días 2-9. La detección de los antígenos virales se obtiene a través de la prueba ELISA y por PCR (reacción en cadena de la polimerasa transcriptasa inversa). El antígeno viral podrá ser detectado entre los días 3-6 de haber iniciado los síntomas, pero su positividad desaparece entre los días 7-163.
Se consideran como métodos confirmatorios por el laboratorio el aislamiento del virus mediante cultivo celular, la prueba ELISA, la inmunofluorescencia, la microscopia electrónica, la inmunohistoquimica y la técnica RT-PCR.
El diagnóstico diferencial se debe realizar con paludismo, fiebre tifoidea, shigelosis, cólera, leptospirosis, peste, rickettsiosis, fiebre recurrente, meningitis, hepatitis y otras fiebres hemorrágicas virales. Para confirmar el diagnóstico se hacen pruebas de sangre que detecten anticuerpos, ARN viral o el propio virus.
Se debe destacar que el virus del Ébola no tiene manejo específico aprobado 49, por lo que solo se prescribe tratamiento de sostén: administración de sales de rehidratación oral o fluidos intravenosos 50. En su evolución, el paciente podrá requerir soporte cardiopulmonar e incluso traslado a cuidados intensivos. Es imprescindible el aislamiento precoz del paciente y la protección de riesgo biológico para los prestadores de salud 17, manteniendo cuidado extremo con las secreciones del paciente que son altamente contagiosas. La transmisión por aerosoles es dudosa. Se estima que 53 drogas pueden bloquear el virus, en específico las que actúan en la glicoproteína y en la matriz VP40 51.
Las acciones de prevención incluyen la reducción del contagio de la infección de monos, murciélagos o cerdos al hombre. Después de verificar la infección en dichos animales, es importante su matanza y la posterior eliminación de los cuerpos. También se recomienda una adecuada cocción de la carne, llevar ropa protectora durante su manipulación y lavarse las manos siempre que se esté cerca de alguien infectado 1,2,36,39,52. Las muestras de tejidos o fluidos corporales de pacientes infectados deben manipularse con especial precaución. Se trabaja en la identificación de nuevas dianas terapéuticas para la profilaxis y el tratamiento de la infección 18,53.
La sangre o suero de humanos enfermos convalecientes se ha empleado como inmunización pasiva 28,32,42,48,54, de lo que se han obtenido resultados alentadores que disminuyen la mortalidad de 80% a 12%, lo cual es estadísticamente significativo.
In vitro se ha comprobado la presencia de anticuerpos monoclonales neutralizantes específicos para la glicoproteína del virus del Ébola, los cuales muestran propiedades protectoras y terapéuticas en animales (roedores). Por otro lado, se ha desarrollado un suero hiperinmune a partir de muestras de animales: ovejas, cabras y caballos 45,54. Este mismo se ha utilizado en humanos, con resultados aparentemente esperanzadores 45.
Dentro de las precauciones estándares recomendadas se encuentra el lavado de manos, la manipulación segura de instrumentos cortopunzantes, el uso de elementos de protección personal (EPP) y la limpieza y desinfección de derrames de secreciones, medio ambiente y equipos de seguridad reutilizables 19.
Asimismo, las precauciones para quienes están en contacto directo con el paciente incluyen restricción del personal dedicado al cuidado del paciente; restricción de visitas; uso de EPP; lavado de manos; uso de mascarillas, protectores oculares, delantal impermeable, guantes y zapatos cerrados; retiro de EPP al salir de la habitación; uso de EPP desechables, e incineración de la vestimenta del paciente y de cama.
La estrategia de desinfección más recomendada es limpiar las superficies contaminadas con agua y detergente antes de desinfectar y hacer la desinfección con solución de hipoclorito al 0.05%.
Discusión
En la revisión sistemática de la literatura efectuada se ha detectado una serie de aspectos con relación a esta enfermedad que resultan controversiales o sobre los cuales no existe consenso, quizás porque requieren de una mayor precisión científica.
Debido a la progresión rápida y grave de la FHE, ninguna terapia podría ser lo suficientemente potente, por lo que se sugiere la combinación de terapias 4,28,45,55.
Otro aspecto en el que no existe consenso absoluto, aunque se han desarrollado numerosas investigaciones científicas con resultados alentadores, es la persistencia viral y transmisión sexual del virus. Se considera que existe un riesgo probable de transmisión sexual a partir de personas que se recuperan de la infección por ébola y se ha demostrado que el RNA del virus puede permanecer en fluidos corporales de un sobreviviente hasta 284 días 45. No existen estudios científicos específicos sobre la protección del condón para el virus del Ébola 45.
Otro aspecto que genera controversia es el tratamiento farmacológico específico 50; aunque aún no se ha aprobado ningún fármaco de este tipo, existen resultados de investigaciones sobre opciones terapéuticas experimentales en modelos animales (primates y roedores) 20, las cuales involucran uso de factores inhibidores tisulares (rhNAPc2, rhAPC) que incluyen tratamiento de la coagulopatia y empleo de antivirales tales como la combinación de anticuerpos monoclonales (ZMapp, MB-003), oligomeros morfolino fosforodiamidato (PMOs), liposomas que contienen siRNA (LNP-siRNA:TKMEbola) y pequeñas moléculas inhibidoras (BCX4430, favipiravir) 20.
Otro aspecto que genera polémica son las razones de persistencia de la epidemia 39, donde se plantea deteriorada infraestructura de salud, dificultades en la prevención y diagnóstico precoz, alta movilidad humana, inadecuados medios de protección del personal de salud, influencia de determinados aspectos culturales y creencias ancestrales, uso de medicina alternativa durante la epidemia y publicidad negativa.
Se ha avanzado a pasos acelerados en el estudio de la respuesta inmune del hospedero durante la infección por el virus 56 y, con vistas al desarrollo de una vacuna efectiva cuya protección dure toda la vida, los consorcios farmacéuticos se han dado a la tarea de generar rápidamente ensayos clínicos con vacunas potenciales 57: cAd3-EBOZ, rVSV-EBOV, Ad26- y MVA-EBOV, las cuales se encuentran en estos momentos en evaluación en ensayos clínicos fase I, con resultados prometedores. No menos importante resulta el anuncio efectuado en el Congreso Internacional de Botánica por el Dr. Maurice Iwu acerca de que el extracto de la fruta Garcinia Kola detiene el crecimiento del virus en el laboratorio 58,59.
Por otro lado, la empresa farmacéutica USAMRIID produjo vacuna de virus del Ébola desactivado montado en virus del resfriado común; esta vacuna demostró seguridad y eficacia en ratones y monos 60. Asimismo, existe un grupo de nuevos tratamientos potenciales en evaluación en ensayos clínicos:
Mapp Biopharmaceutical Inc. desarrolló el suero experimental inmunológico ZMapp a partir de un anticuerpo monoclonal murino 21,22. El 12 de agosto de 2014 la OMS lo aprobó como tratamiento experimental para curar el ébola en África. Canadá Tekmira Pharmaceuticals exhibió el fármaco TKM -Ébola con seguridad y eficacia demostrada en monos 23. New Link Genetics Corp de Iowa anunció una vacuna con 100% de efectividad en ensayos con animales y que se empezará a experimentar en humanos 24.
El Dr. Matthew Snape, miembro del Oxford Vaccine Group, anunció los resultados de un estudio fase I en humanos que demostró seguridad e inmunogenicidad de la vacuna AdVac(R) 25
NIAID and GlaxoSmithKline (GSK) empezó la producción de una vacuna denominada NIAID/GSK Ebola que ya se encuentra en ejecución un ensayo clínico fase I para demostrar su seguridad e inmunogenicidad 12.
Los resultados hasta ahora son muy prometedores, ya que ambas vacunas, cAd3-EBOV y VSV-EBOV, han demostrado un 100% de eficacia en primates no-humanoides. La cAd3-EBOV es una vacuna derivada del adenovirus tipo III en chimpancés modificado mediante ingeniería genética para expresar la única glicoproteína de membrana del virus del Ébola; en Oxford (Inglaterra) y Maryland (EE. UU.), se están ejecutando los ensayos clínicos. Además, la FDA autorizó iniciar un ensayo con la vacuna VSV-EBOV 25.
El comportamiento clínico de la epidemia ha sido descrito acuciosamente por numerosos autores 61-82, lo cual ha constituido un impulso a la industria farmacéutica y biotecnológica para el desarrollo de nuevas ofertas de tratamiento, donde se destacan sueroterapia, ZMapp, vacunas y antivirales como Favipiravir (T705) 83,84.
La compañía farmacéutica canadiense Tekmira anunció hace poco que las autoridades sanitarias estadounidenses le habían confirmado que cambiaba su tratamiento TKM-Ébola de "ensayo clínico total" a "ensayo clínico parcial", lo que permitió su posible uso en individuos afectados por el virus del Ébola. TKM no es la única farmacéutica que está trabajando en la cura de esta enfermedad: Mapp Biopharmaceutical, en California, es la responsable del medicamento suministrado a los dos trabajadores estadounidenses que contrajeron el virus en Liberia y que han mostrado signos de mejora 84.
Conclusiones
El virus del Ébola constituye una amenaza para toda la humanidad por su elevada letalidad; sin embargo, existe la esperanza y convicción de que los nuevos tratamientos que se encuentran en evaluación o uso compasional, aunque aún no aprobados para su uso de manera rutinaria, puedan ayudar en el control de las epidemias o brotes. En cualquier caso, una epidemia pondrá a prueba la infraestructura de salud de cualquier país donde se presente tan solo un caso. Por tal motivo, la vigilancia epidemiológica es trascendental para detectar a tiempo su entrada al país, tomar las medidas oportunas para su control inmediato y evitar la propagación de tan letal enfermedad, todo lo cual hace imprescindible que el personal de salud tenga pleno conocimiento de la enfermedad y de cómo enfrentarla.














