Introducción
La glomerulonefritis membranoproliferativa (GnMP) es un patrón de lesión glomerular caracterizado histológicamente por hipercelularidad mesangial, adelgazamiento de la membrana basal glomerular y proliferación endocapilar. En la GnMP existe inicialmente una fase de injuria renal mediada por inmunoglobulinas o elementos del sistema del complemento en el mesangio y en el endotelio capilar; luego, una fase proliferativa y reparativa mediada por células inflamatorias que inducen regeneración de la matriz mesangial y de la membrana basal glomerular. Tales cambios se evidencian en imágenes típicas de expansión mesangial y doble contorno de la membrana en la microscopía electrónica (ME) 1-3.
Por tradición, la GnMP se ha clasificado de acuerdo a los hallazgos de la ME en tres tipos: I, es la forma más frecuente y se caracteriza por depósitos inmunes subendoteliales; II, los depósitos predominan en la membrana basal glomerular (enfermedad de depósitos densos), y III, los inmunodepósitos son de localización subepitelial, mesangial y subendotelial. Una nueva clasificación basada en la inmunofluorescencia (IF) distingue los hallazgos según el mecanismo subyacente: mediada por inmunocomplejos y mediada por complemento 2-4.
Entre las glomerulopatías primarias, la GnMP se ubica entre la tercera o cuarta causa de enfermedad renal estadio 5 (ERC-5) y representa el 7-10% de los casos confirmados por biopsia 2. La enfermedad renal crónica (ERC) es un grave problema de salud pública que afecta a 1 de cada 10 adultos en el mundo y su incidencia se duplica en los mayores de 65 años, con una prevalencia del 24.5%. En Colombia, la cuenta de alto costo estima que existen 1 039 119 pacientes con ERC; el 60.84% (632 211) de los casos son mujeres y el restante 39.16% (406 908) hombres 5.
La evolución y presentación clínica de la GnMP es extensa y varía de un lento a un rápido deterioro de la función renal, lo cual dificulta la realización de ensayos clínicos controlados basados en la farmacoterapia 1,2. La mayoría de los estudios se centran en la GnMP tipo I y tienen un periodo relativamente corto de seguimiento. Además, las antiguas pautas de tratamiento son más complejas de analizar debido a que en la actualidad es conocido que muchos de los casos antes diagnosticados como GnMP idiopática están relacionados con infección por virus de la hepatitis C (VHC), neoplasias, enfermedades autoinmunes y microangiopatía trombótica crónica 6-8.
Existen escasos ensayos clínicos controlados que hayan sido publicados con evidencia suficiente para determinar los beneficios de la farmacoterapia para la GnMP. El abordaje terapéutico se basa en la causa subyacente, ya sea por disregulación de la vía alterna del complemento o por circulación de complejos autoinmunes 3,4,6,9. En consecuencia, la farmacoterapia incluye terapia antiviral para hepatitis B y C, inmunosupresión con micofenolato mofetil (MMF) o ciclofosfamida (CFM) en monoterapia o conjugado con corticosteroides, indicado en pacientes que cursan con síndrome nefrótico, descenso progresivo de la función renal o signos de inflamación activa demostrada por biopsia 10-12. Los diuréticos son utilizados para el control de la hipertensión y el manejo del edema, mientras que la combinación de inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas del receptor de angiotensina II (ARA-II) pueden favorecer la reducción de la proteinuria. Por su parte, las terapias no esteroideas y anticoagulantes tienen efectos beneficiosos mínimos y están asociadas a efectos adversos graves 13.
En concordancia con lo propuesto por Rabasco-Ruiz et al.4, se hace necesario incrementar los esfuerzos por llevar a cabo ensayos clínicos controlados que permitan hacer seguimiento de los pacientes diagnosticados con GnMP, esto con el fin de detectar el deterioro prematuro de la función renal, evitar la progresión a ERC y contribuir a establecer bases para el diseño de estrategias terapéuticas más precisas. De este modo, el objetivo del presente estudio fue evaluar la respuesta al tratamiento farmacológico en los pacientes diagnosticados con GnMP analizando el comportamiento de variables sociodemográficas, clínicas, inmunológicas e histopatológicas.
Materiales y métodos
Diseño del estudio
La investigación realizada fue de carácter cuantitativo y logró medir distintas variables para luego analizar los resultados obtenidos mediante métodos estadísticos. El tipo de estudio fue analítico de cohorte retrospectivo y se realizó a partir de la evolución de la respuesta al tratamiento farmacológico.
Población de estudio
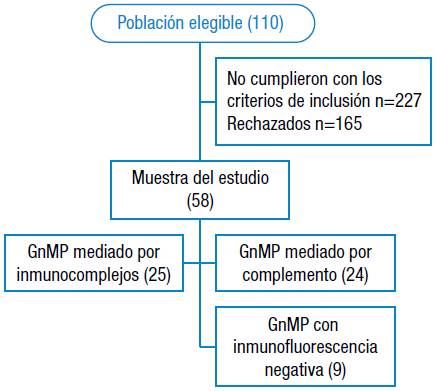
Se incluyó a los pacientes mayores de 18 años con diagnóstico compatible con GnMP confirmado por biopsia renal atendidos en una clínica de Barranquilla. Se excluyeron del estudio a pacientes en terapia dialítica en el momento de la selección, a aquellos que no hubieran recibido terapia inmunosupresora, a los que tuvieran información incompleta en expedientes clínicos o en la base de datos del Centro de Referencia de la Red de Nefrólogos del Caribe: Registro de Nefropatía de Colombia (NEFRORED) y a quienes hayan sido atendidos en un periodo distinto al del estudio (Figura 1).
La población estuvo compuesta por 58 pacientes con diagnóstico anotado de GnMP confirmado por biopsia renal en la Clínica de la Costa de Barranquilla con apoyo en la base de datos NEFRORED 14. Luego, se llevó a cabo un estudio de microscopia e IF. Todo el material fue revisado por un mismo nefropatólogo cegado a datos clínicos y bioquímicos.
Recolección de datos y clasificación
De los expedientes clínicos registrados entre los años 2007 y 2014, se tomaron datos sociodemográficos (edad, sexo) e inmunológicos (inmunoglobulinas IgM-IgG, complemento C3-C4, anticuerpos antinucleares y anticuerpos anti-dsADN) y parámetros bioquímicos (hemograma, creatinina sérica, nitrógeno ureico, urea, proteinuria de 24 horas, parcial de orina, sedimento urinario). Los pacientes se clasificaron, de acuerdo a los hallazgos de la IF, en GnMP mediado por inmunocomplejos, GnMP mediado por complemento y GnMP con IF negativa.
De igual forma, los pacientes fueron clasificados de acuerdo a la respuesta al tratamiento en respondedores y no respondedores. Se consideraron pacientes respondedores aquellos que evidenciaron remisión parcial (reducción de al menos el 50% de la proteinuria de 24 horas o sedimento urinario activo dado por recuento de hematíes o leucocitos >5 por campo de alto poder) y remisión completa (proteinuria <0.5 g/24h y sedimento urinario inactivo). Por su lado, los pacientes no respondedores fueron aquellos en los que no hubo modificación en la proteinuria de 24h o que evidenciaron aumento del 25% de la misma, progresión hacia ERC-5 y sedimento urinario activo.
Tratamiento
Se registró el tipo de inmunosupresor que recibieron los pacientes durante el tiempo del estudio: MMF y CFM en monoterapia o conjugado con corticoides. El MMF fue iniciado a dosis de 500 mg/día vía oral e incrementado de forma gradual dependiendo de la tolerancia del paciente hasta un máximo de 2 g/día. Si los pacientes alcanzaban remisión de la proteinuria, la dosis del MMF era reducida de manera paulatina hasta 500 mg/día. Por otro lado, la dosis recibida de CFM fue de 500-1000 mg/m2 de superficie corporal intravenoso cada 15 días por 3 meses. La decisión de utilizar MMF o CFM en la inducción de la remisión de la función renal o proteinuria estuvo a cargo del médico tratante. Todos los pacientes recibieron prednisolona en dosis de 1 mg/kg/día vía oral durante 4 semanas y luego se redujo hasta 10 mg/día. Se establecieron controles a los 6 y 12 meses de tratamiento.
Análisis estadístico
La caracterización de las variables sociodemográficas, clínicas e inmunológicas se realizó mediante medidas de tendencia central y de localización; para la correlación de las variables con los hallazgos histopatológicos en el pronóstico renal se aplicó la prueba de correlación de Spearman, el análisis de correspondencias múltiples y el análisis discriminante. La comparación del cambio en el tiempo de las variables fue analizada a través de diferencias entre dos proporciones independientes. Los análisis estadísticos fueron realizados con el paquete estadístico R y se consideró un valor p<0.05 para ser estadísticamente significativo 15.
El proyecto fue aprobado por el Comité de Ética en Investigación de la Clínica de la Costa de Barranquilla en carta emitida el 29 de julio de 2016.
Resultados
La población de estudio fue de 58 pacientes, la edad promedio fue de 35±13 años y 52% de la muestra correspondió a mujeres. La presentación clínica más frecuente (70%) fue síndrome nefrótico, la cual se presentó en 41 pacientes. La ERC se manifestó como concomitante en 28 (48%) de los pacientes con síndrome nefrótico.
En relación a los parámetros, el valor de la hemoglobina (Hb) aumentó de forma significativa hasta el año de tratamiento en la población masculina (de 12.28±1.61 a 13.47±1.86; p=0.009), mientras que en las mujeres el aumento no fue estadísticamente significativo (p=0.067). En el análisis del sedimento urinario se observó que del total de pacientes, 52 (89%) debutaron con sedimento urinario activo dado por recuento de hematíes >5 por campo de alto poder y leucocituria en 9 (15%) pacientes (Tabla 1).
Tabla 1 Resumen de los principales parámetros clínicos a lo largo del seguimiento de acuerdo al grupo de glomerulonefritis membranoproliferativa.
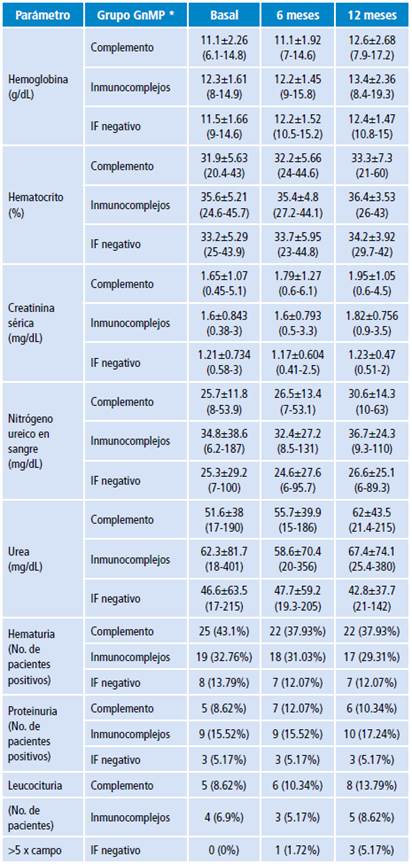
GnMP: glomerulonefritis membranoproliferativa; IF: Inmunofluorescencia.
* Valor p<0.05.
Fuente: Elaboración propia.
En el análisis de la función renal, la tasa basal de filtración glomerular calculada por CKD-EPI fue de 58.5±29 mL/min/m2. Al comparar los hallazgos por IF y el valor de la proteinuria 24 horas, se evidenció un promedio más elevado en los pacientes con GnMP mediado por complemento, mientras que los pacientes con GnMP mediado por inmunocomplejos presentaron una tendencia al descenso en los controles a los 6 y 12 meses (p>0.05) (Figura 2).
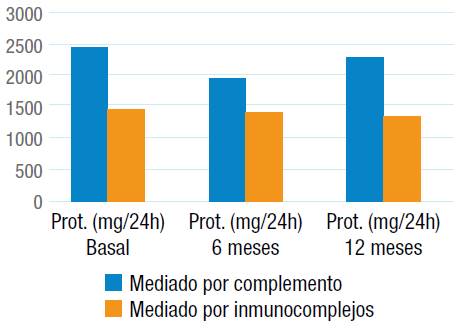
Fuente: Elaboración propia.
Figura 2 Representación gráfica de la proteinuria en 24 horas a los 6 y 12 meses.
Respuesta al tratamiento
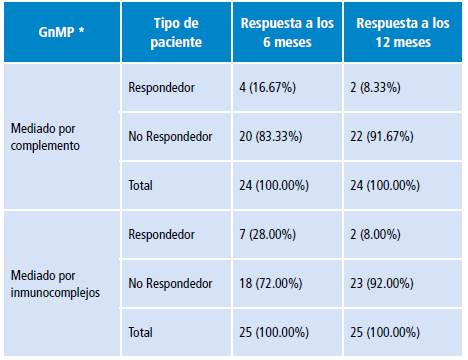
En relación a la respuesta al tratamiento, i 5 (25.8%) pacientes lograron remisión (22.4% parcial y 3.4% completa) y 43 (74.1%) no lograron entrar en remisión. A los 12 meses, solo 5 (8.6%) sujetos alcanzaron respuesta (parcial o completa), mientras que el semestre anterior lo lograron 13 (22.4%). Al comparar la respuesta al tratamiento con los hallazgos de la IF, se encontró que no hubo diferencia estadísticamente significativa a los 6 y 12 meses de tratamiento en los grupos de GnMP mediado por inmunocomplejos versus GnMP mediado por complemento (Tabla 2).
Hallazgos histológicos e inmunológicos
El promedio del número de glomérulos por biopsia renal y microscopía de bajo poder (lpf) fue de 14±2; 23 (40%) pacientes evidenciaron engrosamiento de la membrana basal glomerular por microscopía de alto poder (hpf) y 20 (35%) presentaron hipercelularidad mesangial y dobles contornos. La proliferación extracapilar estuvo presente en 14 (25%) pacientes.
El estudio de la inmunología evidenció que 9 (16%) pacientes carecen de depósitos de complemento C3 - C4 e inmunoglobulinas IgM e IgG, 24 (41%) presentaron depósitos únicamente de complemento C3 y 25 (43%) depositaron tanto inmunoglobulinas como complemento C3. Se analizaron anticuerpos antinucleares y anti DNA resultando positivos en el 20% y 22% de la población, respectivamente, y con un nivel de dilución mayor de 1:160, por lo que se consideró positivo.
Discusión
En este estudio de cohorte retrospectivo se analizaron diversas variables sociodemográficas, clínicas, inmunológicas e histopatológicas que pueden influir en la respuesta terapéutica de los pacientes con GnMP a los 6 y 12 meses de farmacoterapia.
La ERC se manifestó concomitante en 28 (48%) de los pacientes con síndrome nefrótico, cifras que concuerdan con lo reportado en otras series 11. La sobrevida de la función renal de los pacientes con GnMP es pobre. Aroca et al.16 reportan que el 40-50% de los pacientes que no reciben tratamiento inmunosupresor progresarán a ERC en 4 años y el 90% en 10 años. Por su parte, Sethi et al.17 afirman que el 40% de los pacientes con diagnóstico de GnMP progresan a ERC-5 a los 10 años, mientras que Jones et al.11 evidencian que hasta 60% de los pacientes cursaron con ERC-5 en el mismo tiempo de evolución, cifra muy similar a la del presente estudio, donde se encontró que el 63% de los pacientes desarrollaron ERC; sin embargo, llama la atención que fue en un periodo de evolución mucho menor.
Jones et al. {W) evidenciaron que la farmacoterapia inmunosupresora permitió una reducción significativa de la proteinuria en 24 horas desde una media basai de 5.009-1.977 mg/dl a los 6 meses (p=0.003) y de 1.966 mg/dl a los 12 meses (p=0.003), tendencia que se mantuvo favorable hasta un tiempo posterior a los 18 meses. En la presente investigación también se evidenció tendencia a la reducción de la proteinuria tanto en hombres como mujeres a los 6 y 12 meses, aunque a los 6 meses en las mujeres no fue estadísticamente significativo (p=0.97). Otras series no evidenciaron beneficio con inmunosupresores en la reducción de la proteinuria en aquellos pacientes con valores >2.000 mg/dl en 24 horas 18.
El análisis inmunológico evidenció que, del total de la muestra, solo en 24 (41%) pacientes con GnMP se detectó C3 como único complemento y en 25 (43%) se encontraron depósitos tanto de C3 como de Ig; estas cifras difirieron de los datos presentados por Imtíaz et al.12, quienes encontraron que de 54 pacientes, 17(31%) manifestaron glomerulopatía C3 y 37 (68%) presentaron depósito C3-Igs 12. En el presente estudio, 9 (16%) pacientes carecían de depósitos de complemento C3-C4 e inmunoglobulinas, lo que sugiere que la fisiopatología que se relaciona a la presencia de GnMP en estos casos es la microangiopatía trombótica 2.
Los autoanticuerpos encontrados en varias enfermedades autoinmunes causantes del patrón membranoproliferativo, como el lupus eritematoso sistémico, han permitido correlacionar la cantidad de células plasmáticas en bazo y médula ósea con los títulos de ANA y Anti-dsADN de doble cadena en el estudio de pacientes con glomerulonefritis, las cuales están implicadas en la severidad del deterioro de la función renal 19.
En el presente estudio, a los pacientes con diagnóstico de GnMP no se les realizaron cultivos en sangre, reacción en cadena de polimerasa ni serología para infecciones bacterianas, fúngicas y virales.
Diversos autores plantean que cuando el estudio inmunohistoquímico de una biopsia renal revela depósitos de inmuglobulinas se indica la evaluación de infecciones, enfermedades autoinmunes y gammapatías monoclonales para determinar la posible causa subyacente de la GnMP 2,9.
En la actualidad, el eculizumab, un anticuerpo monoclonal que inhibe la activación de C5, representa una terapia innovadora que beneficia en gran medida a los pacientes con diagnóstico de GnMP, en especial aquellos cuya fisiopatología está relacionada con disregulación del sistema de complemento (glomerulopatía C3), pues reduce significativamente los niveles de creatinina sérica y de proteinuria en 24 horas 20,21. Su uso se encuentra limitado por el alto costo y la escasez de estudios que permitan evaluar sus efectos adversos a largo plazo 22.
Conclusiones
En la población estudiada, la GnMP es una causa importante de ERC. La respuesta al tratamiento inmunosupresor no demostró beneficios estadísticamente significativos, independiente del tipo de GnMP estudiado, ni en remisión parcial ni completa de la función renal a los 6 y 12 meses de tratamiento.
Debido a que esta patología afectó en su mayoría a población joven, se recomienda continuar el estudio a 5 años de seguimiento y utilizar otras alternativas de tratamiento tales como anticuerpos monoclonales en los pacientes cuya fisiopatología está relacionada a la disregulación del sistema de complemento (glomerulopatía C3).