Introducción
La fibrosis pulmonar idiopática (FPI) es una enfermedad intersticial, crónica y progresiva, de causa desconocida, que se caracteriza por tener un patrón histológico de neumonía intersticial usual y que se presenta con mayor frecuencia en personas de 50 años o más 1-7. Los pacientes con FPI presentan alteraciones en el estudio de la función pulmonar en mayor grado que otras enfermedades pulmonares intersticiales (EPI), además, suelen manifestar disnea, tos generalmente no productiva y deterioro progresivo de la tolerancia al ejercicio y a las actividades de la vida diaria; a su vez, esta limitación física se asocia con compromiso a nivel psicológico y de interacción social 1,8-14. Esta enfermedad, además, se caracteriza por ser la de peor pronóstico dentro de todas las EPI, que presentan una vida media que varía entre 2 y 3 años 15-18.
Tanto para las enfermedades intersticiales en general como para la fibrosis pulmonar en específico, las opciones de tratamiento son limitadas y no han demostrado grandes mejoras a nivel de supervivencia y calidad de vida relacionada con la salud (CVRS) 15,19,20, a excepción del trasplante de pulmón, que tiene favorable supervivencia a largo plazo si se compara con otras enfermedades; hasta el momento, esta es la única alternativa, aunque la calidad de la evidencia demostrada es baja 21. Al respecto, Mason et al.22 revelan que la supervivencia no es mayor que la de los pacientes trasplantados por otra causa que no sea FPI.
No existe una fuerte recomendación de rehabilitación pulmonar en pacientes con FPI 23, a pesar de que algunos estudios han demostrado cambios positivos en síntomas y capacidad funcional medidos con el Test de marcha de 6 minutos (6MWT), no existiendo documentación a largo plazo 24,25.
El éxito de la rehabilitación no ha sido identificado con claridad en este tipo de pacientes; algunos estudios han evidenciado, en forma estadística y clínica, mejoras significativas en la capacidad funcional, la disnea y la CVRS de pacientes con EPI de diversas causas 26 y con beneficios más duraderos para aquellos que presentan una enfermedad leve 24,27.
Los síntomas característicos de la FPI permiten que su seguimiento sea a través de mediciones de la capacidad funcional por medio del 6MWT, el volumen espiratorio forzado en el primer segundo (VEF 1), la capacidad vital forzada (CVF) y la difusión de monóxido de carbono (DLCO); la CVRS a se mide través de cuestionarios y evaluación de la disnea 28.
El 6MWT es una prueba práctica, económica y fiable que puede ser realizada en aquellos pacientes que presentan mayor deterioro y que permite, además, informar acerca del pronóstico de la enfermedad; es considerada un predictor de mortalidad 29-32.
La estimación de la función pulmonar, y en específico de la CVF, por medio de espirometría es el mejor predictor de mortalidad en términos de función pulmonar; cuando este valor disminuye suele correlacionarse con la etapa de la enfermedad, la condición funcional y la morbilidad 33-35.
La medición de la CVRS se realiza por medio de cuestionarios como el SF-36 36 y el Saint George (SGRQ) 37, que ahora cuenta con una versión específica para FPI denominada SGRQ-I; esta versión es fiable, pero se requieren más estudios para determinar si es más sensible que el SGRQ 38. La evaluación de la disnea es un síntoma que se asocia a la CVRS y a la mortalidad por FPI, por lo que debe ser evaluado constantemente 39.
Se han realizado estudios en relación a los efectos de la rehabilitación pulmonar en pacientes con FPI, pero son escasos, muchos no tienen grupo control y han sido realizados en poblaciones pequeñas o realizan seguimiento solo a corto plazo 36,40-42. De igual forma, son imprecisos y no dejan claro cuáles son los beneficios reales de la rehabilitación en este tipo de pacientes y cuál es la modalidad y dosificación de entrenamiento más adecuada o los efectos a largo plazo de esta.
Considerando estos factores, resulta pertinente realizar una revisión de ensayos aleatorios que permita proporcionar información acerca de los efectos de un programa de rehabilitación y su aplicabilidad clínica.
El objetivo de esta revisión es determinar la efectividad de la rehabilitación pulmonar en la capacidad funcional, la función pulmonar y la calidad de vida en pacientes con FPI luego de ser sometidos a un programa de rehabilitación pulmonar.
Materiales y métodos
Los criterios de elegibilidad seleccionados para las publicaciones fueron: estudios aleatorios randomizados controlados, estudios con participantes diagnosticados con FPI de sexo masculino o femenino con edad superior a los 50 años, estudios publicados entre enero de 2000 y enero de 2016 en idioma inglés o español y estudios con los siguientes tipos de medidas de resultado: capacidad funcional (distancia recorrida en 6MWT), disnea, calidad de vida, DLCO y CVF. Los criterios de exclusión para la selección de los artículos fueron: estudios solo con participantes que padezcan de otra EPI que no sea FPI y estudios que solo realicen evaluación clínica de pacientes y no programas de intervención.
Para la presente revisión se utilizaron las bases de datos PubMed y ScienceDirect y la búsqueda de la literatura se realizó para cada palabra clave y sus posibles combinaciones: "Idiopathic Pulmonary Fibrosis", "Lung Diseases, Interstitial", "Rehabilitation", "Activities of Daily Living", "Exercise Therapy", "Exercise Tolerance", "Dyspnea/rehabilitation, "Dyspnea/therapy", "Quality of Life", "Walk Test", "Vital Capacity", "diffusing capacity for carbon monoxide". Dos revisores seleccionaron de forma independiente los títulos y resúmenes de los estudios potencialmente elegibles identificados por la estrategia de búsqueda.
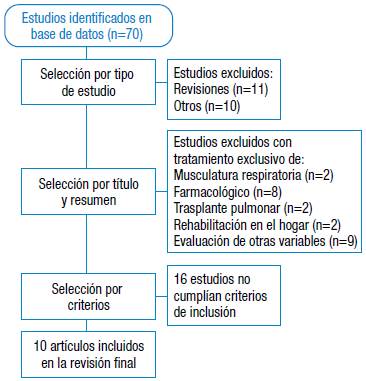
De los 70 estudios encontrados en la búsqueda, 10 cumplieron los requisitos para ser incluidos en la revisión (Figura 1).
Resultados
De acuerdo a la búsqueda realizada, los resultados se agruparon en capacidad funcional, función pulmonar, CVRS y disnea. Las características de los artículo seleccionados se describen en la Tabla 1.
Tabla 1 Características de los estudios incluidos en la revisión.
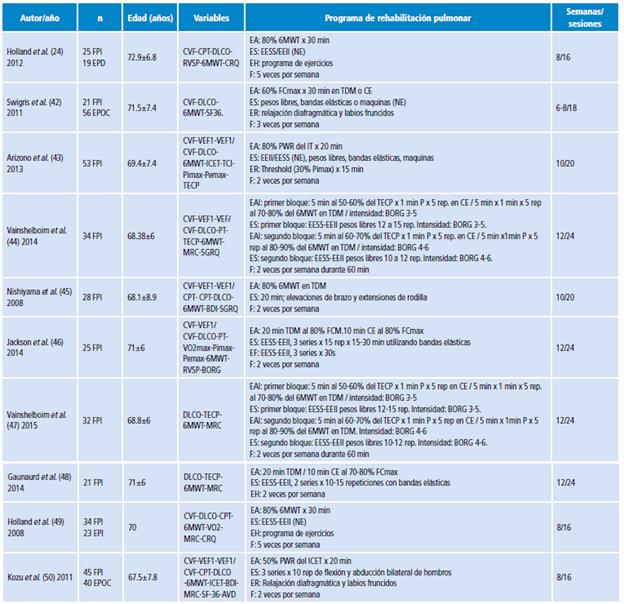
n: Numero de sujetos; FPI: fibrosis pulmonar idiopática; EPI: enfermedades pulmonares intersticiales; EPOC; enfermedad pulmonar obstructiva crónica; CVF: capacidad vital forzada; VEF1:volumen espiratorio forzado en el primer segundo; DLCO: difusión de monóxido de carbono; CPT: capacidad pulmonar total; VEF1/CPT: relación VEF1/CPT; 6MWT: Test de la marcha 6 minutos; BDI: índice de disnea basal; SGRQ: cuestionario respiratorio St. George; VO2: consumo de oxigeno; MRC: medical research council; CRQ: Cuestionario de enfermedad respiratoria cronica; ICET: Test de carga constante; SF-36: Cuestionario de salud SF-36; AVD: actividades de la vida diaria; RVSP: presión sistólica del ventrículo derecho; ITT: Test de carga incremental; Pimax: presión inspiratoria; Pemax: presión espiratoria; TECP: Test ejercicio cardiopulmonar; PT: pletismógrafia; BORG: Escala de disnea de Borg; EA: ejercicio aeróbico; ES: ejercicio sobrecarga; ER: ejercicio respiratorios; EH: ejercicios en el hogar; EF: ejercicios de flexibilidad; EAI: ejercicios aeróbico intervalado; F: frecuencia; TDM: Treadmill; Min: minutos; EESS: extremidades superiores; EEII: extremidades inferiores; NE: no especificado (Grupos musculares, Intensidad, Volumen); PWR: Peak trabajo; CE: cicloergometro; FCmax: frecuencia cardiaca máxima; Rep: repeticiones. Fuente: Elaboración propia.
Capacidad funcional
De los 70 estudios recuperados en la búsqueda, 10 cumplieron los requisitos de selección y todos incluyeron evaluación de la capacidad funcional a través del 6MWT. Las investigaciones en pacientes con FPI incluyeron entre 20 y 50 sujetos con edades >50 años; algunos de ellos incluían pacientes con enfermedad pulmonar obstructiva crónica (EPOC) y otras EPI. La intervención se realizó durante 8 a 12 semanas, 2 veces por semana con ejercicio aeróbico en cicloergometro o caminata durante 20 a 30 minutos, intensidad entre el 50-60% de la frecuencia cardiaca alcanzada en un test de carga constante o entre el 60-80% de la velocidad obtenida en el 6MWT. Además de ejercicio de sobrecarga para extremidades con banda elástica o pesas libres, se realizaron 2 a 3 series de 10 a 15 repeticiones en progresión, ejercicios de flexibilidad y de respiración. Solo un estudio incluyó evaluación y entrenamiento de la musculatura respiratoria con válvulas Threshold al 30% de la potencia inspiratoria máxima 43.
En el estudio de Vainshelboim et al.44 se realizó entrenamiento aeróbico tipo interválico (5 minutos de ejercicio y 1 minuto de pausa activa con 5 repeticiones) al 50-60% de la frecuencia cardiaca alcanzada en el test de carga constante. Por otra parte, Arizono et al.43 mostraron que el test de carga constante es el mejor instrumento para valorar la capacidad funcional, ya que logra determinar en forma más sensible la capacidad de ejercicio en estos pacientes; asimismo, encontraron aumentos cercanos a 10 minutos en el tiempo de resistencia en comparación a su valor inicial (p<0.01). Los 10 estudios restantes utilizaron el 6MWT para evaluar la capacidad funcional.
Siete estudios solo evaluaron sujetos con FPI; de estos, dos revelaron como resultado un aumento en la distancia recorrida en el 6MWT en el grupo sometido a rehabilitación, en comparación con el grupo control (p<0.01 y p<0.05, respectivamente) 44,45. Sin embargo, en otros estudios no se observaron cambios (p>0.05) en la distancia recorrida en el 6MWT tras la intervención para ninguno de los dos grupos 46,47. En la investigación de Gaunaurd et al.48 no se realizó evaluación final del 6MWT.
La variación en el 6MWT se calculó entre la evaluación inicial y la evaluación al terminar el programa de entrenamiento que fluctuó entre 6 a 12 semanas y, excepto en el estudio realizado por Vainshelboim et al.47 que duró 11 meses, se observó un aumento en la distancia recorrida en 6MWT en los grupos que fueron sometidos a rehabilitación 43-46,49.
En dos estudios seleccionados se incluyeron pacientes con otras EPI. En el primero no se observaron diferencias en la distancia recorrida al evaluar los resultados del 6MWT en el total de pacientes, pero tras el entrenamiento se observó un aumento de esta distancia en el grupo que fue rehabilitado (p<0.01). En el segundo, un análisis más específico, se detalló que los pacientes con FPI lograban menos beneficios en comparación a los pacientes con otras EPI, aunque no de manera significativa 49.
Holland et al.24 compararon sujetos con FPI y con otras EPI; luego de la intervención, ambos grupos aumentaron la distancia recorrida (p<0.05), pero entre ellos no hubo diferencia (p>0.05). Los resultados no se mantuvieron a los 6 meses.
Otra población comparada con pacientes con FPI fueron los que padecían EPOC. En el estudio de Kozu et al.8 se observó un aumento (p<0.01) en la distancia recorrida en el 6MWT, tanto en el grupo de FPI como en el grupo EPOC, con una diferencia entre ambos grupos (p<0.001). Sin embargo, datos discordantes fueron demostrados en otro estudio que comparaba las mismas patologías, y en donde el aumento de la distancia recorrida solo se mantuvo para el grupo FPI (p<0.01) al comparar la distancia recorrida antes y después del programa de entrenamiento 42.
La tendencia en los resultados fue de un aumento significativo en la distancia recorrida en el 6MWT para todos los pacientes que fueron sometidos a un programa de rehabilitación, tanto para los sujetos con FPI, como para otras EPI y EPOC, aunque la mayoría de las veces en menor grado para los pacientes con FPI. En algunos estudios estas diferencias no fueron significativas (p>0.05), salvo en dos estudios que no se evidenció aumento en la distancia recorrida en el 6MWT 46,47.
Función pulmonar
De los 10 estudios seleccionados, todos realizaban evaluación de la función pulmonar. Los exámenes correspondían a espirometría, DLCO y pletismografía. Por medio de la espirometría se evaluó la CVF, el VEF1 y la relación entre ambos VEF1/CVF; con la DLCO se evaluó la capacidad de difusión del monóxido de carbono y con la pletismografía se evaluó la CPT.
Siete estudios evaluaron solo población con FPI; en estos no se observaron diferencias (p>0.05) entre los grupos rehabilitación y control. Además, los valores de CVF, VEF1 y CPT se mantuvieron sin cambios después de la intervención (45), excepto en la investigación de Gaunaurd et al.48, donde la DLCO tendió a disminuir levemente en el grupo control al compararlo con sus valores basales (p<0.05).
Los estudios de Holland et al.24 y Holland et al.49 incluyeron pacientes con otras EPI; en ninguno de estos se observaron diferencias al inicio en la función pulmonar, pero tras la intervención, se evidenció una disminución de la CVF (p<0.05) sin diferencia significativa entre los grupos. La DLCO se mantuvo constante 24.
Solo dos estudios mostraron beneficios en la función pulmonar. El primero, que además se diferencia de los demás en que incluye en su intervención el entrenamiento aeróbico interválico, provocó aumento solo en CVF (p<0.05) y leve aumento en VEF1 (p>0.05) 44. En el segundo, 11 meses después de la aplicación del programa de rehabilitación los valores disminuyeron o se mantuvieron en sus niveles basales (CVF, CPT y DLCO) (p>0.05) 47.
En otro estudio que compara FPI con pacientes de EPOC se observaron diferencias al inicio entre los grupos (p<0.001) y postentrenamiento, asimismo se produjo una reducción en todos los índices (disnea, fuerza muscular periférica, 6MWT, actividades de la vida diaria y estado de salud) (p <0.001) en ambos grupos, excepto VEF1 que se mantuvo y CVF que aumentó en pacientes con EPOC (p<0.001) 50.
Por su parte, Swigris et al.42 reportaron que, a pesar del entrenamiento, en los pacientes con FPI era más notorio el deterioro a los 6 meses. Por otro lado, al comparar con sujetos con EPOC no se observaron cambios en los valores de función pulmonar CVF y DLCO (p>0.05) en ninguno de los grupos después del entrenamiento.
CVRS y disnea
De los estudios seleccionados en los que solo se analizan pacientes con FPI, 3 evaluaron CVRS con SRGQ. Nishiyama et al.45 observaron que, tras la rehabilitación, las puntuaciones aumentaron en comparación al grupo control y los resultados se correlacionaban con el 6MWT; los pacientes percibieron menor grado de disnea (p<0.05). Estos autores también observaron aumentos en los puntajes obtenidos con el cuestionario en los pacientes del grupo de rehabilitación, en el dominio "síntomas" (p<0.05), en el dominio "impacto" (p <0.05) y en el "puntaje total" (p <0.05) 44,48.
En el estudio de Vainshelboim et al.44 no se encontraron mejoras en los niveles de disnea en ningún grupo medidos a través de la escala de Borg (p>0.05). Finalmente, los investigadores determinaron el grado de disnea utilizando la Medical Research Council (MRC). En este estudio todos los sujetos padecían FPI, y tras una intervención de 12 semanas se produjeron mejoras en este índice (p<0.05). Por otro lado, Jackson et al.46 hicieron la evaluación a través del índice de disnea basal y no observaron disminución de la disnea después del 6MWT una vez completado el periodo de entrenamiento.
La CVRS se evaluó con el Chronic Respiratory Questionaire (CRQ) en sujetos con FPI y otras EPI. La población fue dividida en dos grupos, uno de control y otro de entrenamiento; tras el programa de intervención se encontraron diferencias en el dominio de disnea y fatiga (p<0.05). También se evaluó la disnea con MRC obteniendo mejoras (p<0.05), sin embargo ningún valor se mantuvo a los 6 meses de evaluación 49. Holland et al.24 apreciaron incrementos en el dominio "disnea" (p<0.05).
Al comparar pacientes de FPI con EPOC, se realizaron evaluaciones con SF-36 sin diferencias al inicio, pero con grandes mejoras en los pacientes EPOC en todas las subescalas, excepto función social (p<0.05) 50. En FPI los cambios fueron menores, pero significativos para las variables de dolor corporal, salud general y función social (p<0.05).
En el estudio de Swigris et al.42, que también comparaba pacientes con FPI y EPOC, no se observaron diferencias (p>0.05) tras la intervención en ningún grupo en términos de CVRS evaluada con SF-36.
En general, todos los pacientes de los estudios que se les evaluó CVRS a través de cuestionarios como SF-36, SRGQ, SRGQ-I y CRQ obtuvieron mejores puntajes que los pacientes del grupo control una vez que fueron intervenidos. Solo en un estudio que evaluó la disnea en los pacientes con escala de Borg no se obtuvieron cambios o estos fueron leves, no logrando significancia estadística 47.
Discusión
El objetivo de esta revisión ha sido determinar la efectividad de la rehabilitación pulmonar en la capacidad funcional, la función pulmonar y la calidad de vida en pacientes con FPI luego de ser sometidos a un programa de rehabilitación pulmonar. El análisis incluyó 10 estudios que reportaron distintos resultados según las variables de estudio planteadas; de estos, todos evaluaron la capacidad funcional a través del 6MWT y la función pulmonar a través de espirometría, DLCO y pletismografia. La CVRS se evaluó utilizando cuestionarios como SF-36, SRGQ, SRQI-1, CRQ, mientras que para los grados de disnea se utilizó MRC y escala de Borg.
Los resultados evidenciados en el indicador "capacidad funcional a través del test de marcha de 6 minutos" fueron favorables en todos los pacientes, independiente del énfasis que se le hubiera dado al programa 24,42-50.
Por otro lado, los progresos alcanzados comenzaban un declive progresivo con el paso del tiempo, alrededor de 3 o 6 meses después de concluida la investigación 49. Resultados similares encontró el estudio de Dowman et al.51, donde 61 sujetos con FPI fueron sometidos a un programa de entrenamiento y la distancia recorrida en el 6MWT a los 6 meses post rehabilitación mantuvo sus valores iniciales. Los pacientes con FPI transcurren largos periodos en conducta sedentaria, lo cual influye en una disminución de la calidad de vida y de la capacidad funcional 52.
Estudios recientes sugieren que los factores que afectan de manera significativa la disnea post 6MWT corresponden a la capacidad vital y la fatiga de extremidad inferior 53. En relación a la distancia recorrida durante el 6MWT, los niveles de actividad física diaria influirían en el rendimiento de esta capacidad 54 y en la mortalidad 55. Por otro lado, se plantea que incluso el mantener bajos niveles de actividad física entre 100-105 min/semana se asocia a reducir el riesgo de mortalidad y una mayor supervivencia en pacientes con FPI 56.
En materia de función pulmonar, uno de los programas que basó su plan de rehabilitación en ejercicios aeróbicos interválicos arrojó resultados positivos en este indicador, lo que permitiría considerar esta metodología en futuros estudios 44. En sujetos con EPOC esta técnica de ejercicio de alta intensidad estaría asociada con cambios positivos en parámetros ventilarios y en la disnea 57.
Por último, en el indicador "calidad de vida relacionada con la salud", todos los pacientes evaluados que participaron de la rehabilitación evidenciaron mejoras 24,42-50. Sin embargo, resultó novedoso que al momento de evaluar la disnea los resultados no presentaron variación respecto a las evaluaciones iniciales; este aspecto no debiera resultar indiferente, dado que puede ser de gran relevancia incorporar otras estrategias terapéuticas a la intervención de pacientes con FPI 44,46. Por otra parte, la disnea, la fatiga y la calidad de vida se asocian con el nivel de actividad física en pacientes con FPI, independiente de la función pulmonar 58. En este mismo indicador, las experiencias confirman que el impacto del programa de rehabilitación en pacientes con FPI es menor que en los grupos de control que padecen otras enfermedades intersticiales 49, lo que no debe hacer que se pierda de vista que el efecto en los pacientes con FPI es sumamente significativo dada su condición general y las características de la enfermedad; por lo anterior, toda variación positiva debe ser considerada de relevancia clínica.
Como limitación en este estudio se presentó que los idiomas de la bibliografía revisada representan un universo específico de posibilidades, lo que deja por fuera estudios y experiencias cuyos resultados están escritos en idiomas diferentes del inglés.
Conclusiones
Los programas de rehabilitación pulmonar presentan beneficios en términos de capacidad funcional y calidad de vida relacionada con la salud; sin embargo, los estudios siguen siendo escasos y con poblaciones pequeñas. Asimismo, se evidencia que los efectos de dichos programas no se mantienen a los 6 meses de evaluación postentrenamiento.