Introducción
Los trasplantes representan la mejor opción terapéutica para muchos pacientes, no solo para patologías orgánicas sino como opciones reconstructivas. Es posible que el mayor problema asociado a estos procedimientos sea la necesidad de inmunosupresión (IS) de por vida para evitar el rechazo del injerto 1. La inducción de tolerancia inmunológica representa una solución a los problemas asociados con la IS.
Este artículo pretendió, por un lado, realizar una búsqueda sistemática en la literatura con el fin de revisar los distintos mecanismos inmunológicos de inducción de tolerancia de los modelos clínicos utilizados y los resultados obtenidos y, por el otro, comparar los resultados entre las experiencias de trasplante de órgano sólido y de alotrasplantes compuestos vascularizados (ACV), todo con el fin de conocer qué tan cerca se está del desarrollo de tolerancia inmunológica clínica en trasplantes en la práctica clínica cotidiana 2.
Materiales y métodos
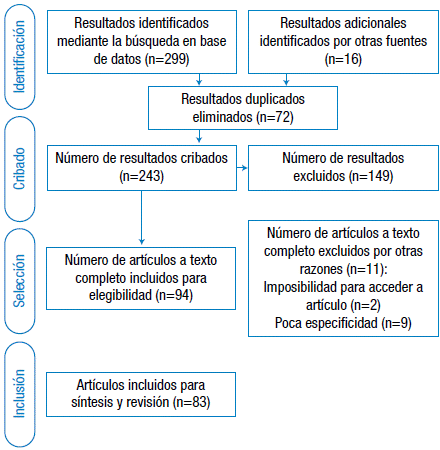
Se realizó una búsqueda en la base de datos PubMed utilizando combinaciones de los términos MeSH "Organ Transplantation", "Immune Tolerance", "Composite Tissue Allograft" y "Bone Marrow Transplantation" de la cual se obtuvieron 299 resultados. Se leyeron los resúmenes y se restringió la búsqueda a estudios en humanos, modelos animales y publicaciones enfocadas en fisiopatología de tolerancia inmunológica; también se revisaron las bibliografías de los artículos y se consultaron las referencias pertinentes para finalmente seleccionar 83 artículos (Figura 1).
Resultados
Inmunología de la inducción de tolerancia en trasplantes
Para entender las estrategias que permitirían desarrollar tolerancia a los alotrasplantes, hay que entender cómo el sistema inmune desarrolla tolerancia hacia tejidos propios. El desarrollo de rechazo a trasplantes alógrafos esta mediado, en su mayoría, por la rama adaptativa del sistema inmune, formada por linfocitos T (LT) y B (LB) 3,4; por tanto, la tolerancia apunta a estos tipos celulares. Existen dos mecanismos de tolerancia, central y periférica.
Tolerancia central
Los linfocitos son producidos por progenitores linfoides en la medula ósea (MO) durante la maduración del sistema inmune; luego, los LT migran al timo, donde pasan por un proceso de selección, llamado deleción clonal, tras el cual una pequeña porción de las células pasa a formar parte de la respuesta inmune (2-5%), mientras la mayoría es eliminada. Esta selección intratímica es responsable de la tolerancia central y consta de dos procesos: selección positiva, donde los timocitos son expuestos a antígenos propios por células presentadores de antígenos como células dendríticas, macrófagos y células tímicas epiteliales y son seleccionados solo los timocitos cuyo receptor (de células T o RCT) reconoce moléculas del complejo mayor de histocompatibilidad (CMH) tipo I y II asociado a dichos antígenos, y selección negativa, donde los timocitos que reaccionan de manera exagerada a los antígenos propios asociados a CMH expresados por las células epiteliales del timo entran en apoptosis para prevenir fenómenos autoinmunes 5-8. Cabe anotar que durante este proceso los LT adquieren receptores CD4 o CD8, dependiendo del tipo de CMH con el que reaccionen.
Aunque en el timo las células T son expuestas a numerosos antígenos propios gracias a la proteína reguladora autoinmune, la cual permite a las células epiteliales del timo expresar gran cantidad de antígenos de otros tejidos, es imposible expresar todos los antígenos propios, por lo que es inevitable que algunos clones autorreactivos escapen a la selección negativa. Por esto, se requieren mecanismos periféricos para generar tolerancia.
Tolerancia periférica
El primer mecanismo para evitar la autorreactividad es mantener físicamente apartados los antígenos específicos de tejidos de los LT vírgenes; esto se logra mediante la regulación estricta de moléculas de adhesión, en especial receptores CCR7 y CD62L 9 que dirigen al linfocito desde la sangre hasta los ganglios linfáticos y de vuelta a la sangre, sin permitir su ingreso a tejidos periféricos donde encontrarán antígenos propios.
La anergia, otro mecanismo implicado en la tolerancia periférica, es un estado de inactividad funcional de los linfocitos que se produce al encontrar y ligar un antígeno sin las señales coestimulatorias adecuadas para reaccionar, como la interacción entre receptores CD40 y CD40L o CD28 y B27 y la secreción autocrina de citoquinas. Al no recibir los estímulos necesarios para la activación, los linfocitos quedan en un estado de inactividad permanente y terminan sufriendo apoptosis 9,10.
La deleción periférica impide la sobreexpansión de linfocitos reactivos a antígenos propios mediante la inducción de apoptosis por el reconocimiento de las moléculas de superficie Fas- FasL 9,11.
Los LT también cumplen un papel importante en la tolerancia periférica, en específico los reguladores (LT reg), una población heterogénea que comprende varias subpoblaciones; estas últimas incluyen LT CD4+ que expresan CD25 y FoxP3 (nTreg) y linfocitos Th3 y Tr1, encargados de suprimir la respuesta inmune tras procesos inflamatorios para evitar respuestas exageradas. Estas son células antígeno-específicas que actúan mediante citoquinas antiinflamatorias -IL-2, IL-10, TGF-b- y contacto célula-célula y que están relacionadas con la prevención de autoinmunidad y reacciones alérgicas 9-15.
En el campo de los trasplantes los mecanismos de tolerancia periférica han sido menos utilizados que los de tolerancia central; sin embargo, es importante exponerlos porque en el futuro pueden ofrecer caminos importantes para el desarrollo de tolerancia. Los linfocitos reguladores son especialmente prometedores.
Estrategias de inducción de tolerancia inmunológica
La mayoría de las estrategias se basan en la tolerancia central, en específico en la selección negativa, y consisten en repoblar el timo del receptor con células inmunitarias del donante, las cuales son capaces de seleccionar y eliminar a los linfocitos reactivos contra antígenos del injerto para impedir el desarrollo de una inmunidad específica contra el donante mientras se mantiene intacta la respuesta contra otros antígenos potencialmente nocivos. Estas células deben ser, por un lado, presentadoras de antígeno (CPA) que expongan a los timocitos a antígenos unidos a CMH del donante y, por el otro, capaces de eliminar clones reactivos indeseados en el proceso de maduración.
Cabe recordar que los antígenos más asociados al proceso de rechazo son los CMH; por tanto, al desarrollar tolerancia hacia estas moléculas se espera desarrollar tolerancia al injerto 5,6,16,17. El trasplante de MO se ha utilizado como fuente de estas CPA necesarias para repoblar los órganos linfoides del receptor 18-22.
En modelos animales se ha visto una mayor tasa de rechazo en trasplantes de injertos cutáneos comparados con trasplantes que contienen piel y hueso 23-25; se cree que los trasplantes de tejido compuesto que contienen hueso funcionan como un trasplante de MO vascularizado, lo que explicaría la baja incidencia de rechazo en comparación con la de trasplantes que contienen solo piel, dada su alta antigenicidad 23,25-27.
Es importante anotar que para que las células inmunes encaminadas a repoblar los órganos linfoides tengan la oportunidad de injertarse, se deben utilizar regímenes inmunosupresores. De esta forma, es necesario eliminar las células linfoides tanto del receptor como del donante para evitar el desarrollo de reacciones contra antígenos específicos del otro sujeto, de modo que se haga tolerancia a CMH del donante y se evite el desarrollo de enfermedad injerto contra huésped (EICH).
En principio se utilizaron regímenes mieloablativos con dosis letales de radiación para destruir los progenitores linfoides 6,28 con buenos resultados en cuanto al desarrollo de tolerancia; sin embargo, los efectos secundarios de la radiación hacían inviable su utilización en la práctica clínica. Luego, se utilizaron anticuerpos antilinfocitos como alternativa, con resultados igualmente buenos, evitando la toxicidad de la radiación 29-33.
Se han utilizado anticuerpos contra LT combinados con otros inmunosupresores con el fin de crear las condiciones de baja reactividad necesarias para que las células inmunes se injerten de manera adecuada al receptor. El estudio de Siemionow et al.34 demuestra que el régimen de anticuerpos monoclonales anti RCT, mas ciclosporina, logra una depleción de LT >95%.
Otro aspecto clave en el desarrollo de tolerancia es el quimerismo inmunológico, que se refiere a la presencia de varios tipos celulares genéticamente diferentes en un mismo individuo, en este caso células inmunológicas del donante y del receptor 6,17-19,27,35. El desarrollo de quimerismo se ha relacionado de forma directa con el desarrollo de tolerancia, por lo que se llegó a creer que este era necesario para lograr alcanzar la tolerancia; Khan et al.36 realizaron un estudio en quimeras que desarrollaron tolerancia a aloinjertos y encontraron que tal tolerancia se perdía cuando las células del donante desaparecían, lo cual apoya la idea de que el quimerismo es necesario para la tolerancia 37. Sin embargo, estudios posteriores han demostrado que el quimerismo se pierde con el tiempo sin que desaparezca la tolerancia; esto se demostró en modelos animales en los que, a pesar de que no se detectaban células hematopoyéticas del donante uno a dos meses después del procedimiento, la tolerancia a aloinjertos no se vio afectada a largo plazo 31-33,38-41.
Diferencias inmunológicas entre trasplante de órgano solido (TOS) y alotrasplante compuesto vascularizado
Los TOS son una opción terapéutica real hace más de medio siglo; en la actualidad se cuenta con bastante experiencia clínica y con una gran cantidad de pacientes, por lo que la información disponible es considerable. Por otro lado, los ACV cuentan con poca experiencia clínica. El primer trasplante de mano exitoso se realiza en 1998, en ese momento se abre el campo de los ACV como una opción terapéutica real 42-44, pero aún hay pocos pacientes. En 2014, 72 pacientes reciben trasplante de mano unilateral o bilateral, siendo el ACV el método utilizado en mayor número de pacientes 45. Hasta el momento los resultados funcionales han sido aceptables.
La posibilidad de desarrollar tolerancia inmunológica en los ACV reviste especial importancia dado que son trasplantes reconstructivos encaminados a mejorar la calidad de vida del paciente y no a aumentar su sobrevida como en los TOS, por lo que la decisión de llevar a cabo el procedimiento es más complicada, más si se tiene en cuenta los riesgos de la IS sopesados y los beneficios 46-52.
Los TOS están compuestos por tejidos relativamente homogéneos, por lo que su antigenicidad es limitada y su respuesta inmune, aunque problemática, es predecible. Los ACV son injertos compuestos por diferentes tejidos como piel, musculo, hueso, tendones, cartílago, nervios, etc., con distintas variantes antigénicas, por lo que la respuesta inmune es más complicada que la de los TOS 24,25,48.
Uno de los puntos más problemáticos en lo que respecta a la inmunología de los ACV es la inmunogenicidad de la piel, que es por mucho el tejido más inmunogénico existente. Se cree que esto se debe a la alta concentración de células inmunes producto de la continua exposición a antígenos potencialmente nocivos: hasta el 10% de las células en la piel son células inmunitarias, del cual el 5% son CPA expresando CMH II 52-56.
Sin embargo, contrario a lo que se esperaba, en diversos modelos animales se observó que los ACV producían una respuesta inmune menor que los injertos de piel. Existen varias teorías con respecto a este fenómeno. Por un lado, se cree que, al haber un gran número de variantes antigénicas, los tejidos distintos a la piel ejercen un efecto de señuelo que dispersa la respuesta inmune e impide que se enfoque en atacar la piel. También se ha postulado que los ACV pueden inducir algún grado de tolerancia per se, ya que las trazas de MO que contienen los fragmentos óseos trasplantados pueden actuar como trasplantes vascularizados de MO; sin embargo, la escasa cantidad de células inmunes es insuficiente para producir tolerancia completa 23-27,57.
Si bien hasta hace poco había sido imposible inducir tolerancia a piel -fenómeno denominado tolerancia disociada y en el que se desarrolla tolerancia a todos los tejidos de un ACV excepto a piel 4,58-, Horner et al.59 publicaron en 2009 un estudio realizado en cerdos con trasplante de MO y miembro trasero; allí, uno de los animales desarrolló quimerismo persistente e hizo tolerancia a aloinjertos de piel, sin signos de rechazo al año de seguimiento, por lo que se concluyó que una condición para el desarrollo de tolerancia a piel es el quimerismo permanente.
Cabe anotar que los episodios de rechazo agudo en piel son mediados por toxicidad celular. Aunque se han encontrado depósitos de C4d en biopsias de pacientes con trasplante de mano, este es un fenómeno mucho menos frecuente que en pacientes con TOS y su significado clínico es incierto, ya que no se asocia a signos clínicos de rechazo humoral 4,60,61. También es menos frecuente la aparición de rechazo crónico 4.
Otro órgano con características inmunológicas remarcables es el hígado, que parece poseer un gran potencial tolerogénico, pues se ha visto una menor incidencia de rechazo agudo y crónico en pacientes con trasplante hepático respecto a otro tipo de tejidos. En modelos animales se ha observado desarrollo espontáneo de tolerancia, e incluso se ha desarrollado tolerancia específica hacia donante 62. En estudios en humanos la tolerancia espontánea es menos frecuente, pero se ha visto que 5-40% de los pacientes que suspenden IS, ya sea por una decisión terapéutica o por mala adherencia, no presentan evidencia histológica de rechazo con seguimiento de hasta cinco años 63-65. En estos pacientes el factor más importante implicado en el éxito de la suspensión de la IS es el tiempo transcurrido desde el trasplante, teniendo peores desenlaces entre más prematuramente se inicia la supresión de medicamentos.
Se ha postulado una serie de hipótesis que explican el potencial tolerogénico del hígado:
El hígado debe limpiar antígenos hematógenos sin levantar respuestas agresivas contra antígenos derivados de alimentos provenientes de la circulación portal. Es por eso que la presentación de antígenos en el hígado lleva a una respuesta tolerogénica más que a una activación de la respuesta inmune. La activación de LT CD8 resulta en un proceso único llamado emperipolesis, en el cual los linfocitos son fagocitados por hepatocitos, lo que contribuye al desarrollo de tolerancia 66,67. En modelos experimentales se demostró que los injertos hepáticos en los que se realizó depleción de linfocitos fueron incapaces de inducir tolerancia 68,69, mientras que al infundir leucocitos del donante se restableció la capacidad de desarrollar tolerancia, lo cual sugiere que los leucocitos hepáticos del donante juegan un papel fundamental.
El tamaño del injerto también parece tener importancia, ya que entre mayor sea la masa de tejido trasplantado, mayor será el agotamiento del sistema inmune. En un modelo animal, al poner dos injertos cardiacos en el mismo sujeto, la sobrevida de los injertos aumentó de manera significativa con respecto al monoinjerto, lo cual apoya esta hipótesis. El tamaño del hígado es aproximadamente 10 veces mayor al del corazón o el riñón 70, lo cual podría contribuir a su capacidad tolerogénica comparado con tales órganos. También se ha visto una mayor expresión de HLA-G, molécula que se expresa en las células epiteliales biliares, lo que se correlaciona con menor incidencia de rechazo 71. En los trasplantes conjuntos de riñón e hígado se ha visto mayor expresión de HLA-G circulante, lo que se asocia con menor frecuencia de rechazo agudo en el injerto renal, en comparación con el riñón solo 72.
Ensayos clínicos
En la actualidad, varios grupos trabajan en el desarrollo de tolerancia, la mayoría en pacientes con trasplante renal, aunque hay estudios en pacientes con trasplante hepático e incluso con trasplante de miembro superior. Aunque cada vez los mecanismos de tolerancia periférica parecen tomar mayor relevancia, los ensayos clínicos se han enfocado en el trabajo con trasplante de células hematopoyéticas.
La primera experiencia clínica en humanos se llevó a cabo en un paciente con falla renal secundaria a mieloma múltiple, a quien se le realizo trasplante conjunto de MO y riñón, logrando establecer quimerismo hematológico y tolerancia al injerto 73. Luego, el mismo grupo realizó un ensayo clínico con seis pacientes con características similares (falla renal secundaria a mieloma múltiple) que recibieron trasplante combinado de riñón y MO de hermanos con HLA idéntico 74; los resultados del seguimiento a largo plazo de los pacientes mencionados fueron publicados en el año 2006 75. Para la inducción se utilizó ciclofosfamida, irradiación tímida y globulina antitimocito y se continuó con ciclosporina A, que se disminuyó hasta suspenderse. Dos pacientes hicieron quimerismo completo, uno espontáneamente y otro tras recibir una segunda infusión de linfocitos del donante; estos pacientes hicieron EICH, por lo que continuaron con IS, sin embargo nunca hicieron rechazo al injerto renal. Otros cuatro pacientes tuvieron quimerismo mixto transitorio detectable entre 71 y 123 días y solo uno hizo rechazo tras la suspensión de la IS al día 104 post trasplante, por lo que volvió a recibir IS, aunque finalmente pudo ser suspendida de forma indefinida. A la fecha del estudio los seis pacientes continuaban con injerto renal sin IS (excepto de los dos con EICH) entre 2 y 7 años y con creatinina y función renal normales.
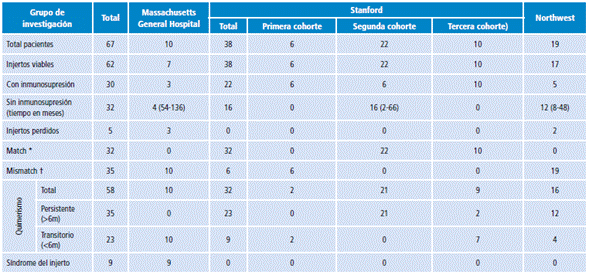
A raíz del éxito del ensayo de Fudaba et al.74 para inducir tolerancia inmunológica, se realizaron otros estudios con pacientes sin enfermedades hematológicas 76-80. En la actualidad hay tres grupos en EE. UU. trabajando en el problema clínico, los resultados han sido publicados recientemente 76 y se muestran en la Tabla 1. Por las diferencias en los pacientes incluidos, la cantidad de pacientes y los tiempos de seguimiento, estos resultados pueden no ser comparables.
Tabla 1 Resultados en ensayos clínicos con trasplante renal y de médula ósea.
* Antígenos CMH contra los que no reacciona.
† Antígenos CMH contra los que reacciona.
Fuente: Elaboración con base en Elias et al.76, Kawai et al.77, Kawai et al.78, Scandling et al. (79) y Leventhal et al.80.
El grupo del Massachusetts General Hospital (MGH) publicó en 2014 los resultados obtenidos en 10 pacientes con trasplante de riñón y de MO 77,78. Par la inducción se utilizó ciclofosfamida, anti CD2, ciclosporina A (CsA) e irradiación tímica prequirúrgicas; después del tercer paciente se adicionaron dos dosis de rituximab y prednisona porque este sujeto perdió el injerto por rechazo humoral agudo, además, después del sexto paciente se aumentó la dosis de rituximab ya que aún se detectaron anticuerpos específicos contra donante (AED). Tras la cirugía se continuó con tacrolimus, que se disminuyó hasta suspenderse entre 9 y 14 meses después.
Todos los pacientes incluidos en el estudio desarrollaron quimerismo mixto transitorio no detectable entre 2 y 3 semanas post trasplante. Tres pacientes perdieron sus injertos, uno por rechazo humoral agudo y dos por rechazo celular agudo, y tres tuvieron que reiniciar IS entre 5 y 8 años, uno por reactivación de enfermedad de base y dos por evidencia de rechazo humoral crónico; los dos pacientes que hicieron rechazo humoral crónico fueron del grupo que recibió solo 2 dosis de rituximab, mientras en el grupo que recibió cuatro dosis no se evidenció rechazo humoral.
Otro fenómeno común fue la presencia de síndrome del injerto, también llamado síndrome de fuga capilar, una condición descrita en trasplantes de MO causada por el aumento en la permeabilidad capilar y fenómenos mediados por citoquinas que se manifiesta con fiebre, eritema cutáneo, edemas y lesión renal aguda y que se presentó en nueve pacientes. Tres pacientes recuperaron función renal de forma espontánea, cuatro requirieron IS adicional y dos terminaron perdiendo el injerto, uno asociado a rechazo humoral agudo y otro a rechazo celular. Este fenómeno no se presentó en ninguno de los otros grupos 76.
En un reporte preliminar 77, en el que solo se incluyeron cinco pacientes, se midió actividad de FoxP3 y granzima B, como marcadores de LT Reg y LT CD8 respectivamente, y se encontró un nivel seis veces superior de FoxP3 en los pacientes libres de IS respecto a los que aún la tenían, con niveles similares de granzima B, lo que implica un papel importante de los LT Reg como mecanismo periférico para mantener la tolerancia.
Además, se tomó una población control de 21 sujetos con trasplante renal con IS convencional a la cual se le hizo seguimiento para comparar desenlaces 78. En el grupo control, 19% de los pacientes perdieron injertos por rechazo, 85% necesitó medicación antihipertensiva, 65% requirió manejo para hiperlipidemia, 35% presentó diabetes de novo, 10% hizo neoplasias en piel y 25% requirió hospitalizaciones por enfermedades infecciosas; mientras tanto, en los pacientes sin IS, solo 45% requirió tratamiento antihipertensivo y ninguno para hiperlipidemia, además no se encontraron casos de diabetes, neoplasias ni hospitalizaciones por enfermedades infecciosas, lo que sugiere una amplia disminución de la morbilidad.
El grupo de Stanford es el que hasta el momento tiene mayor cantidad de pacientes incluidos en ensayos clínicos 79. Se incluyeron 38 pacientes tanto "match" como "mismatch" -antígenos CMH similares y antígenos CMH contra los que reacciona-, divididos en tres cohortes en las que se realizó trasplante de MO enriquecido con células hematopoyéticas progenitoras CD34+ tras realizar trasplante renal; en todas las cohortes se utilizaron regímenes inmunosupresores con irradiación linfoide total post quirúrgica variando las dosis y timoglobulina, con ligeras variaciones. En la primera cohorte solo dos pacientes desarrollaron quimerismo mixto transitorio, en ellos se intentó suspender la IS; sin embargo, hicieron rechazo tras 3.5 y 5.5 meses, por lo que reiniciaron IS. En la segunda cohorte se utilizaron dosis mayores de irradiación más ciclosporina A, micofenolato mofetil (MMF) y prednisona posoperatorias, que se disminuyeron hasta descontinuar; los criterios para suspender IS fueron ausencia de rechazo, EICH y quimerismo detectable por al menos 6 meses. 18 pacientes cumplieron criterios para suspender IS, 16 lograron suspenderla de forma exitosa entre 2 y 66 meses al momento del seguimiento, uno tuvo que reiniciar medicamentos por reactivación de enfermedad de base y otro estaba en proceso para suspenderla. Los pacientes restantes tuvieron hallazgos histológicos de rechazo, por lo que continuaron con IS. En la tercera cohorte se aumentó la dosis de células CD34+ trasplantadas, pues el tiempo de seguimiento era muy corto al momento del estudio. 2 pacientes desarrollaron quimerismo persistente por más de 12 meses, 3 llevaban 3 meses, otros 4 perdieron quimerismo a los 2 meses, y 1 paciente no desarrolló quimerismo. Hasta el momento de esta revisión no se habían reportado pacientes sin IS en esta cohorte.
En el grupo de Northwester se realizaron trasplantes de riñón y tejido hematopoyético enriquecido con células facilitadoras (linfocitos CD8+/TCR-), cuya utilización es una de las principales diferencias con los anteriores grupos 80. El régimen preparatorio utilizado consistió en fludarabina, ciclofosfamida e irradiación corporal total preoperatorias, con tacrolimus y MMF de mantenimiento. La IS fue suspendida solo en pacientes con quimerismo mixto persistente, sin AED, con biopsias normales y función renal normal. Dos pacientes perdieron sus injertos por complicaciones infecciosas. Los 12 pacientes con quimerismo persistente han sido descargados de IS con adecuada tolerancia entre 8 y 48 meses. Ninguna de las quimeras mostró AED ni otros signos de rechazo. Además, hubo una adecuada reconstitución inmune, con buena respuesta a antígenos de terceros, disminución de complicaciones infecciosas y respuesta normal ante vacunas. También se vio que en las quimeras no hubo reactivación de enfermedades autoinmunes, por lo que se cree que este protocolo podría inducir tolerancia a antígenos propios. Este es el grupo con mejores resultados en pacientes "mismatch". Además, solo un paciente falló en desarrollar quimerismo.
Hay que aclarar que en este grupo no se intentó suspender la IS en los pacientes con quimerismo transitorio, contrario al grupo del MGH, en el que se lograron resultados aceptables en pacientes que perdieron el quimerismo en el primer mes post trasplante. También es llamativo que en los grupos de Northwest y Stanford hubo pacientes que no lograron desarrollar ningún tipo de quimerismo 79,80.
Conociendo los resultados obtenidos en TOS, en los que se logró un éxito relativo al suspender la IS de mantenimiento, se ha intentado llevar estos hallazgos a los ACV, en específico al trasplante de mano. En 2013 se realizó en Pittsburg, un ensayo clínico con cinco pacientes a quienes se les practicó trasplante unilateral o bilateral de miembro superior, para lo que se utilizó alemtuzumab o metilprednisolona como inducción, con mantenimiento de monoterapia con tacrolimus 81. Al día 14 se realizó trasplante de MO del mismo donante.
Los pacientes que desarrollaron episodios de rechazo celular agudo fueron tratados de forma satisfactoria con tacrolimus/clobetasol o esteroides tópicos. En estos sujetos no se detectó quimerismo persistente, tampoco hubo casos de EICH. Además, la funcionalidad del injerto es similar a la de pacientes con tratamiento convencional, incluso mejor, correlacionándose con el tiempo desde el trasplante y el nivel de la amputación. Lo más interesante es que los pacientes han podido ser manejados con monoterapia con tacrolimus a dosis bajas, mientras la mayoría de pacientes con trasplante de miembro superior son manejados con triple terapia de tacrolimus, micofenolato mofetil y corticoides 49,50. Durante el seguimiento se detectaron AED en cuatro pacientes, depósitos de C4d en las biopsias de control y cambios vasculares mínimos en un paciente, todos hallazgos de rechazo humoral. Sin embargo, ninguno de estos pacientes mostró evidencia de compromiso funcional.
Como se esperaba por la experiencia previa con ACV y modelos animales, los episodios de rechazo agudo fueron dirigidos en su mayoría a piel, lo que reafirma el desafío inmunológico que representa este tejido.
Discusión
Los resultados obtenidos hasta el momento han demostrado que la inducción de tolerancia inmunológica es posible. Los ensayos clínicos que utilizan trasplante de MO conjunto evidencian resultados prometedores en órgano sólido; en cuanto a los ACV, el único ensayo disponible 81 mostró resultados aceptables al permitir manejar pacientes con dosis menores de IS, aunque es prematuro arrojar conclusiones teniendo en cuenta que los pacientes han mostrado signos de rechazo humoral sin compromiso funcional.
Además de ser eficaces al disminuir la necesidad de IS, estos protocolos han demostrado ser relativamente seguros. La principal preocupación en pacientes con trasplante de MO es la EICH, aunque el mayor riesgo de presentar este fenómeno, especialmente de episodios severos, lo tienen pacientes con quimerismo completo 76,82. Aunque hasta el momento no se ha presentado este fenómeno, hay otros asuntos que deberían ser observados con detalle, como el llamado síndrome del injerto, que solo se ha visto en pacientes del grupo del MGH 78. Se ha evidenciado correlación entre la pérdida del quimerismo, la reaparición de elementos hematológicos del receptor y la aparición de este síndrome, por lo que se cree que es un fenómeno inmunológico en el que reaparecen células T de memoria sensibilizadas a antígenos del donante 76. También se ha postulado que este fenómeno se debe a la rápida reconstitución del sistema inmune, por lo que los pacientes podrían beneficiarse de esquemas con una mayor depleción de la línea linfoide, de modo que la reconstitución inmune fuese menos abrupta. Hay muchas variables que podrían explicar la aparición de síndrome del injerto en el grupo del MGH, como la ausencia de quimerismo persistente y el régimen preparatorio, pero queda claro que esta entidad pone en riesgo la sobrevida del injerto, pues los tres injertos perdidos en este grupo iniciaron con lesión renal aguda secundaria a síndrome del injerto, haciendo al protocolo potencialmente nocivo en comparación con el tratamiento inmunosupresor estándar.
En cuanto al ensayo en pacientes con trasplante de miembro superior, preocupa que se hayan identificado hallazgos compatibles con rechazo humoral y rechazo crónico, ambas complicaciones poco frecuentes en ACV, tanto que muchos autores consideran que los pacientes con este tipo de trasplantes no desarrollan estas condiciones 60,61. Se podría pensar que las células hematopoyéticas trasplantadas son las responsables de estos fenómenos, por lo que valdría la pena intentar una depleción más vigorosa de células B para evitar el rechazo humoral. Aunque hasta el momento no hay evidencia de que esto tenga repercusión funcional, hay que tener en cuenta que al momento del estudio el seguimiento había sido aún muy corto para esperar alteraciones funcionales. Por tanto, es necesario esperar nuevos reportes de estos pacientes para observar desenlaces como sobrevida del injerto, funcionalidad y hallazgos histológicos para poder vigilar la aparición de rechazo humoral crónico y para determinar la seguridad de este protocolo con respecto al tratamiento estándar.
Tanto los pacientes con síndrome del injerto como los del grupo de Pittsburg tienen en común que no desarrollaron quimerismo persistente y que ambos tuvieron signos de rechazo humoral en alguna medida; esto hace pensar que el desarrollo de quimerismo persistente podría evitar este fenómeno. Otra aproximación potencialmente útil para evitar el rechazo humoral es utilizar regímenes similares al utilizado por el grupo del MGH con dosis altas de rituximab, el cual evitó la aparición de rechazo humoral agudo; esto se debe hacer teniendo en cuenta el reto que constituye desarrollar quimerismo mixto persistente.
Está claro que el quimerismo es una condición para desarrollar tolerancia; sin embargo, no es claro si es necesario desarrollarlo de forma persistente o si basta con un estado transitorio. Quizá solo se requiere una exposición inicial a las CPA del donante en el momento de la reconstitución del sistema inmune para activar mecanismos como la deleción clonal que impidan el desarrollo de células reactivas. Si bien el grupo del MGH incluyó pacientes con quimerismo transitorio en protocolos para suspender la IS y logró hacerlo sin signos de rechazo por un tiempo de hasta 11 años, es cierto que este grupo tuvo dos pacientes que debieron reiniciar IS por presentar rechazo crónico, lo cual implica un fallo en la tolerancia. Mientras tanto, los grupos que solo incluyeron pacientes con quimerismo persistente han podido suspender la IS en todos estos pacientes, sin signos de rechazo, y ninguno ha requerido reiniciar la medicación. Hay que aclarar que los pacientes que requirieron reiniciar IS lo hicieron entre 5 y 8 años, mientras en los otros dos grupos el máximo tiempo de seguimiento fue de 66 y 48 meses, es decir, aún están en el rango de tiempo en el que se reinició la IS en el primer grupo. Esto implica que, aunque el quimerismo permanente no sea indispensable para hacer tolerancia a un aloinjerto, hay mejores desenlaces con respecto a los pacientes con quimerismo transitorio.
Lo último es un gran problema teniendo en cuenta que en los grupos de Northwest y Stanford hubo pacientes que fallaron en desarrollar quimerismo en cualquiera de sus formas, excluyéndolos de cualquier posibilidad de tolerar sus injertos, por lo que se hace necesario desarrollar, por un lado, protocolos con los que todos los pacientes hagan quimerismo y, por el otro, esquemas con los que se alcance un estado de quimerismo persistente.
El grupo que más se acerca a los resultados esperados es el de Stanford en la segunda cohorte, donde solo un paciente no logró hacer quimerismo y se logró suspender de forma exitosa la IS en 16 pacientes, con un paciente en proceso de suspensión; es llamativa la diferencia en los resultados entre la primera y la segunda cohorte de este grupo: en la primera solo dos pacientes lograron desarrollar quimerismo transitorio, mientras en la segunda solo uno fallo al desarrollar quimerismo. Teniendo en cuenta que el régimen preparatorio utilizado fue similar, la mayor diferencia fue que en el primer grupo se utilizaron pacientes "mismatch" y en el segundo "match". Aunque hubo gran éxito al inducir quimerismo persistente en pacientes "match", los resultados en pacientes "mismatch", en los que el desarrollo de tolerancia es teóricamente más complejo, son desalentadores.
Alcanzar un estado de quimerismo mixto persistente ha sido un desafío, ya que por lo general los sujetos expuestos a trasplante de MO desarrollan quimerismo transitorio o quimerismo completo si se trasplantan dosis altas de células hematopoyéticas, lo que es un problema dada la alta incidencia de EICH en esta población.
Hay que considerar la posibilidad de realizar nuevas infusiones de MO en los pacientes que no hayan alcanzado estados quiméricos. En uno de los estudios mencionados se indujo quimerismo completo en un paciente, quien antes había hecho quimerismo transitorio al realizar una nueva infusión de células del donante 73-75; estrategias similares podrían utilizarse para inducir estados de quimerismo persistente, o al menos para aumentar el tiempo de quimerismo transitorio. Esto sería muy útil en pacientes en los que se pierde el quimerismo con rapidez, ya que se prolongaría el estado quimérico y se podría evitar el síndrome del injerto. Sin embargo, al aplicar nuevas infusiones de células hematopoyéticas existe el riesgo de desarrollar quimerismo completo, lo que aumentaría la incidencia de EICH.
Otra aproximación para lograr quimerismo persistente es la infusión intraósea de células hematopoyéticas. En un estudio que compara la infusión intravenosa contra la intraósea para inducción de quimerismo en ratas, el método intraóseo fue 75% más efectivo que el intravenoso; esto podría deberse a que el compartimento óseo supone un microambiente más apropiado para la reproducción de las células hematopoyéticas 83.
Por último, hasta el momento el único grupo que ha intentado instaurar un grupo de control es el del MGH, con lo que ha mostrado una importante disminución de la morbilidad asociada a la eliminación de la IS 78. De esta forma, hace falta incluir grupos control en los próximos estudios realizados para evaluar el comportamiento de la morbilidad al suspender la medicación.
Conclusiones
Los intentos por desarrollar tolerancia operativa, más allá de modelos animales, han dado resultados prometedores. Aunque se ha logrado suspender la IS sin signos de rechazo, aún hay que realizar ajustes, perfeccionar los regímenes preparatorios, establecer protocolos claros de preparación de las células hematopoyéticas trasplantadas y establecer unos criterios de selección claros antes que estos protocolos puedan ser aplicados en la práctica clínica.
Los resultados aún son inconsistentes y, a pesar de que han mostrado ser relativamente seguros, sería imposible extrapolarlos a la práctica clínica. Sin embargo, los hallazgos hacen considerar la necesidad de llevar a cabo ensayos clínicos más amplios y con diseños más ambiciosos.
Es necesario solucionar problemas como la incapacidad para inducir quimerismo en todos los pacientes, la aparición de síndrome del injerto y el desarrollo de rechazo crónico y humoral en pacientes con ACV, esto con miras a hacer trasplantes sin la carga que representa el uso de medicamentos inmunosupresores.