Introducción
Dada su frecuencia en las poblaciones, el cáncer de próstata (CAP) es una patología de importancia en la salud pública a nivel nacional e internacional 1. Debido a las dificultades del sistema de salud, la poca disponibilidad de especialistas y la alta prevalencia, el conocimiento de esta condición debe ser del dominio de todo médico general y no se debe quedar en esferas de la medicina especializada como la urología y la oncología. No obstante, el tratamiento, de manera integral, debe ser dado por centros de excelencia en cáncer 2.
El objetivo de esta investigación fue obtener una visión actualizada a través de una revisión detallada y al día de la epidemiología, los factores de riesgo, la clasificación, el diagnóstico y el tratamiento del CAP.
Materiales y métodos
Se realizó una búsqueda en las bases de datos Embase y MEDLINE (a través de OVID) desde enero de 2000 hasta marzo de 2017. Las palabras clave utilizadas fueron: "prostate" OR "prostate, neoplasm" AND "diagnosis" OR "treatment". Además, se realizó una exhaustiva evaluación manual de la bibliografía proporcionada en los artículos encontrados.
Resultados y discusión
Epidemiología
El CAP es la neoplasia con mayor frecuencia en hombres alrededor del mundo y representa la segunda causa de muerte por cáncer en esta población en EE. UU. 3. Esta patología presenta una incidencia de 131.5 por cada 100 000 habitantes 3 con una distribución según raza de 123 por cada 100 000 habitantes en la raza blanca y 208 por cada 100 000 habitantes en la raza negra 4. Se estima que 1 de cada 7 hombres serán diagnosticados a lo largo de su vida con CAP y que 1 de cada 38 hombres morirán como consecuencia de este 5.
El estudio GLOBCAN notificó que en países del norte de Europa (Dinamarca, Noruega y Suecia) se ha incrementado el diagnóstico de CAP 8.2% por año; sin embargo, se presenta una mortalidad en descenso desde el 2000 de 3.1% por año 6. En EE. UU. y Canadá se han encontrado datos similares, con una incidencia estable de 4.3% y una disminución en la mortalidad de 3.1%; no obstante, en países en vía de desarrollo la mortalidad ha ido en aumento 6,7. En cuanto a la epidemiología nacional, Colombia tiene una de las incidencias más bajas de CAP en Latinoamérica y una proporción de 28% entre incidencia y mortalidad, un valor muy cercano al promedio mundial de 28.6% e inferior al de países como Ecuador (40.41%), Cuba (46.65%) y Perú (37.74%) 6; del igual forma, la mortalidad ha disminuido en los últimos 4 años 7 y las regiones con el mayor número de pacientes con CAP reportados son Bogotá D.C., Valle y Antioquia (las regiones más pobladas y con mayor cantidad de urólogos) 5,7.
Factores de riesgo
Raza
Los pacientes de raza negra presentan mayor prevalencia de CAP 8; además, en esta población se presenta a edades más tempranas y con mayor volumen tumoral, mayor antígeno prostático y peor pronóstico 9,10. Algunos autores relacionan estos resultados con las inequidades sociales y dificultades de acceso a servicios de salud a las que se expone esta población 11; sin embargo, existe mucha más evidencia que sustenta la raza como factor riesgo para CAP. Por otro lado, se han encontrado tasas mucho menores en asiáticos, lo cual se ha relacionado con la dieta, los estilos de vida y los factores ambientales 12.
Historia familiar
Cerca del 10-15% de los hombres con CAP tienen, por lo menos, un familiar con antecedente de esta patología 8,13. Se estima que contar con un familiar de primer grado de consanguinidad con CAP incrementa el RR 2 a 4 veces y es 5 veces mayor si son dos los familiares con dicho diagnóstico.
Inflamación
La inflamación crónica se considera un factor de riesgo dado que conlleva a hiperproliferación celular; esto, a su vez, genera una alteración en los niveles de antioxidantes, en la reparación del DNA y en la apoptosis. Además, se ha encontrado que el antecedente de una infección de transmisión sexual tiene un OR= 1.5 14 y haber tenido o tener prostatitis tiene un OR=1.57 15. A pesar de ser una de las hipótesis más fuertes, aún no es claro el mecanismo que llevaría a la inflamación a producir el CAP o si es una causa suficiente para su desarrollo.
Estrés oxidativo
Algunos estudios han sugerido que las especies reactivas de oxígeno (ROS), como el superóxido o el peróxido, crean un ambiente de mutagénesis propicio para el inicio del CAP 16,17. Este elemento podría estar asociado con la hipótesis de la inflamación crónica.
Andrógenos
Existe evidencia de que un aumento en la concentración de los niveles de testosterona incrementa la incidencia de CAP, aunque no se ha establecido una relación dosis-respuesta ni una concentración a partir de la cual se incremente el riesgo; además, no se ha encontrado mayor riesgo de CAP en pacientes con hipogonadismo tratados con terapia de reemplazo de testosterona 18.
Estrógenos
Se ha evidenciado que los estrógenos pueden predisponer e incluso causar CAP. En este aspecto es necesario recalcar que el 17P-estradiol ya se ha clasificado como carcinógeno, sobre todo en cáncer de mama y endometrial. Se cree que el efecto de los estrógenos en el CAP es causado por mutaciones directas a través de la regulación por efectos epigenéticos o por alteración endocrina propiamente dicha 19.
Dieta
Diversos estudios han sugerido que una dieta baja en grasas y calcio y con aumento en el consumo de vitamina E y licopenos, así como el ejercicio regular, podrían comportarse como factores protectores para el desarrollo de CAP. Por otro lado, la ingesta elevada de grasas saturadas de origen animal y las carnes rojas han sido descritas como factores de riesgo; sin embargo, los hallazgos no son consistentes entre los diferentes estudios, por ejemplo, en el estudio SELECT no se demostró el factor protector del uso de la vitamina E ni el selenio 20.
Aumento de niveles del factor de crecimiento similar a la insulina (IGF-1)
El factor de crecimiento similar a la insulina es un factor mitogénico y antiapoptótico. Altos niveles implican más riesgo de CAP 21; sin embargo, otros estudios no lo encuentran como factor de riesgo.
Genética
Se han encontrado alteraciones en genes supresores como el p53 y el PTEN, los cuales se relacionan con aumento de la incidencia y progresión y agresividad del CAP. Entre otros genes alterados se ha encontrado: oncogén RAS, EIF3S3, BCL2 (anti-apoptosis), EGFR, FGFR2c, ERBB2, BRCA 2, MET, además de algunas mutaciones en el cromosoma 1 (riesgo CAP familiar) y 8 (cáncer esporádico). Asimismo, se han evidenciado polimorfismos genéticos en algunas enzimas como: 5 alfa reductasa, mayor en raza negra; receptor de vitamina D (VDR), el cual ha sido reconocido como un factor protector, aunque en pacientes de raza negra se disminuye e incrementa el riesgo de CAP; receptor androgénico (AR), el cual aumenta el riesgo de CAP familiar, y telomerasa, un factor para cáncer esporádico.
Muchas de las investigaciones han centrado su atención en el gen BRCA2 (Breast Cancer susceptibility protein type 2), el cual presenta un patrón de herencia autosómica dominante con una dominancia incompleta. Este gen codifica para una proteína del mismo nombre, cuya función es actuar como centro reclutando proteínas reguladoras para reparar las rupturas de doble cadena por recombinación homóloga; además, facilita la reparación de cadenas simples al promover la formación del complejo RAD51-ssDNA (cadena simple de DNA) 22.
A lo largo de la historia, el gen BRCA2 se ha relacionado con el cáncer de mama; sin embargo, hallazgos recientes indican que este puede jugar un papel importante en el CAP. No se ha logrado identificar con certeza el mecanismo por el cual sus mutaciones predisponen al desarrollo del CAP, aunque por su función se deduce que alteraciones y mutaciones de este predisponen a una menor reparación de los daños del genoma, lo cual podría resultar en alteraciones del ciclo celular y, por consiguiente, en una mayor proliferación celular.
Por lo general, los pacientes con mutaciones del gen BRCA2 presentan mayor incidencia de CAP 23, estadios más avanzados (T3-T4), fenotipos más agresivos y menor sobrevida a pesar de recibir un tratamiento local con intento curativo similar 24.
Obesidad
Algunos autores sugieren que la obesidad juega un papel en el desarrollo del CAP, pues se cree que la resistencia a la insulina producida por la obesidad lleva a una elevación de esta hormona, la cual, por su capacidad anabólica, podría generar desarrollo de cáncer o su progresión 25. Se cree que los obesos tienen menos probabilidad de tener el antígeno específico prostático (PSA) elevado y por consiguiente menos probabilidad de realización de biopsia y de diagnosticar CAP; esto, junto a las asociaciones con los niveles circulantes de hormonas metabólicas y sexuales, lleva a que se sugiera a la obesidad como un factor de riesgo para CAP agresivo 26.
Alcohol
La relación de la ingesta de alcohol con el CAP es controvertida. Rota et al.27, en un metaanálisis con 52 899 casos de cáncer (50 estudios de casos y controles y 22 cohortes), no encontraron evidencia material entre la ingesta de alcohol y CAP, incluso no se hallaron diferencias estadísticas en el grupo de alta ingesta (>4 bebidas alcohólicas al día) 27.
Cigarrillo
Es conocida la capacidad cancerígena del tabaco, así como el mecanismo por el cual se genera el daño genético. En el CAP no se ha descrito un aumento en la incidencia, sin embargo sí se ha encontrado que puede generar mayores tasas de muerte que, aunque son modestas, podrían tener impacto a nivel de salud pública por tratarse de un factor de riesgo modificable 28.
Historia natural
En autopsias se ha encontrado una prevalencia a nivel histológico de 30-40% de CAP en hombres >50 años, de 5% o menos en <30 años y de 60-70% en >79 años 29. Se calcula que el 1.5% de estos se hacen detectables por clínica cada año. El CAP es de carácter progresivo y su agresividad biológica está directamente relacionada con el grado de diferenciación celular (escala de Gleason), el TNM, el valor de PSA, entre otros factores.
Clasificación histopatológica
Para la clasificación de histopatología es utilizado el sistema Gleason, el cual expone el grado de diferenciación celular encontrado en el estroma prostático. Esta clasificación está compuesta por dos valores: el grado encontrado más frecuentemente y el siguiente, así se obtiene un valor final (por ejemplo: 4+5=9), el puntaje va de 2 a 10. En el caso en que los dos valores se encuentren en las mismas proporciones, se coloca el más indiferenciado primero.
La nueva clasificación de Gleason realizada por el Colegio Americano de Patología relaciona la puntuación con el pronóstico que tiene cada grupo (Tabla 1) 30.
Tabla 1 Clasificación de Gleason del Colegio Americano de Patología.
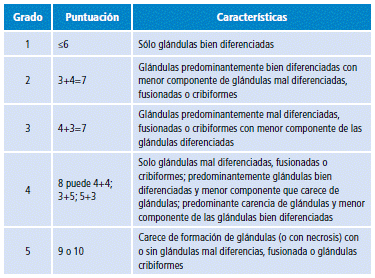
Fuente: Elaboración con base en Epstein et al.30.
Clasificación clínica y patológica
La clasificación clínica y patológica se realiza con base en la clasificación TNM 2016 (Tabla 2) 31. Esta consta de tres elementos: la T, relacionada con el compromiso tumoral en la glándula y fuera de ella; la N, asociada con el compromiso nodular local, y la M, relacionada con la extensión o difusión a distancia por metástasis del tumor.
Tabla 2 Clasificación TNM para cáncer de próstata.
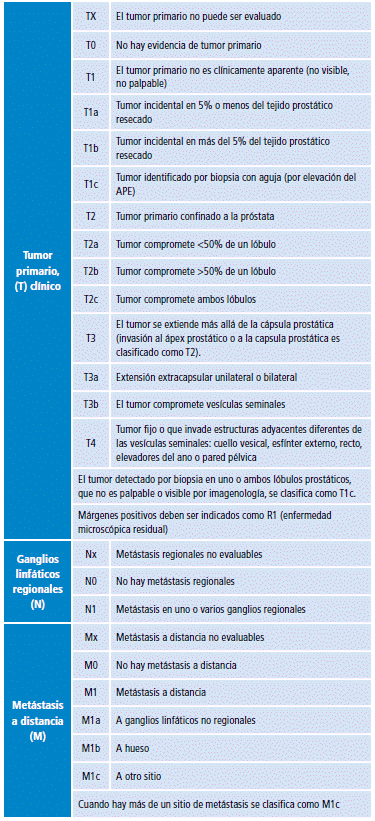
Fuente: Elaboración con base en 31. Estadíficación
La estadificación del CAP se muestra en la Tabla 3. Para determinar este estadio hay que tener en cuenta que si el PSA o el valor de Gleason no están disponibles, la clasificación debe tener en cuenta el T o el valor de PSA o el Gleason que esté disponible.
Tabla 3 Estadificación del cáncer de próstata.
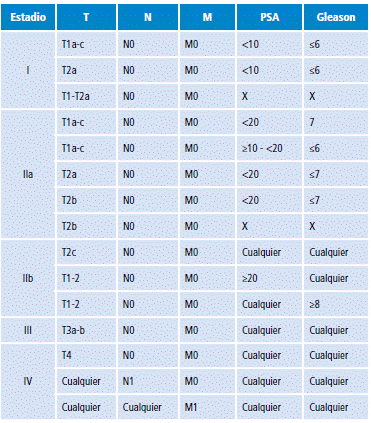
T: tumor; N: nódulo; M: metástasis; PSA: antígeno específico prostático.
Fuente: Elaboración con base en 31.
Clasificación de riesgo para carcinoma localizado
La clasificación de riesgo para carcinoma localizado utilizada por tradición para el CAP es la de D'amico (Tabla 4) 32. Sin embargo, durante los últimos años se han generado diferentes cambios de acuerdo al pronóstico tan heterogéneo que puede presentarse con diferentes factores, por lo cual se han realizado modificaciones y una nueva clasificación sugerida por la National Comprehensive Cancer Network (NCCN) (Tabla 5) 33.
Tabla 4 Clasificación de D'Amico para carcinoma localizado.
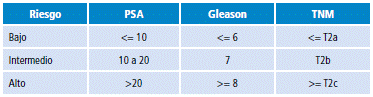
PSA: antígeno específico prostático; TNM: tumor, nódulo, metástasis. Fuente: Elaboración con base en D'Amico et al.32.
Tabla 5 Nueva clasificación para carcinoma localizado sugerida por la National Comprehensive Cancer Network.
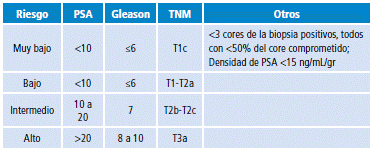
PSA: antígeno específico prostático; TNM: tumor, nódulo, metástasis. Fuente: Elaboración con base en 33.
Diagnóstico
En la actualidad, el PSA y el tacto rectal constituyen los métodos diagnósticos más usados en la clínica para detectar el CAP; sin embargo, estos tienen bajo rendimiento diagnóstico, tanto a nivel individual como en conjunto 5.
Antígeno específico prostático
El PSA, también llamado calicreína III, es una glicoproteína de 34kDA, la cual es casi exclusiva de las células epiteliales prostáticas y circula unida a la alfa-1-antiquimiotripsina y la alfa-2-macroglobulina; su función es dividir la semenogelina I y II en polipéptidos de menor tamaño, evitando así formación del coágulo seminal 34-38.
El PSA es encontrado en el fluido prostático en concentraciones de 1 000 000 ng/mL; en condiciones normales una pequeña cantidad -<4 ng/mL- es liberada al torrente sanguíneo, pero en un proceso neoplásico estos niveles se elevan 34. Por tal motivo se considera realizar biopsia de próstata a aquellos hombres con un nivel de PSA sérico >4ng/mL 34. Sin embargo, este valor también se ha encontrado elevado en otras patologías como cáncer de mama, carcinoma de células renales, cáncer de ovario, neoplasia suprarrenal 39 y patologías urológicas como hiperplasia prostática benigna (HPB), prostatitis, cistitis, instrumentación y cirugía del tracto urinario reciente 34,40. Cabe aclarar que el tacto rectal no incrementa los valores de PSA.
Según la American Cancer Society, la sensibilidad del PSA para valores de referencia de 4 ng/mL y 3 ng/mL para el diagnóstico de cáncer es de 21% y 32%, respectivamente. La especificidad es de 91% para valores de corte de 4 ng/mL y de 85% para valores de 3 ng/mL 41.
En el estudio PLCO, en lo concerniente a CAP, se evaluaron hombres entre los 55 y los 74 años, a quienes se les realizó tamizaje anual con PSA durante 13 años. Como resultado se obtuvo que realizar tamizaje con PSA no lleva a disminución de la incidencia de CAP (RR: 1.09, IC95%: 0.87-1.36) 42.
Otro gran estudio fue el ERSPC, donde se realizó tamizaje con PSA durante 11 años a hombres de ciertos países europeos, evaluando la mortalidad por CAP. Los resultados indicaron una reducción relativa del 21% en las tasas de mortalidad (RR: 0.79, IC95%: 0.68-0.91) 43.
Un metaanálisis de Cochrane realizado en el 2011 resumió los resultados de cinco experimentos poblacionales con un total de 341 351 participantes y mostró que realizar tamizaje con PSA es efectivo para la detección de CAP (RR: 1.35, IC95%: 1.06-1.72); sin embargo, esta prueba no disminuyó la mortalidad (RR: 0.95, IC95%: 0.85-1.07) 44, de manera tal que en la actualidad no se recomienda realizar tamizaje poblacional de CAP.
No existe evidencia suficiente para determinar la mejor medida de tamización en salud pública, por ahora se sugiere tamizaje de oportunidad en hombres entre 50-70 años (de acuerdo a la expectativa de vida de la población) que ingresen a la consulta del urólogo y pacientes con factores de riesgo (raza negra y familiares con CAP).
Es de vital importancia hacer claridad en que al decidir el inicio de la búsqueda del diagnóstico del CAP debe realizarse el tacto rectal en conjunto con PSA.
Otros biomarcadores en el diagnóstico del cáncer de próstata
La falencia del PSA ha llevado a la necesidad de identificar nuevos biomarcadores con mayor sensibilidad y especificidad que permitan alcanzar un diagnóstico temprano del CAP 5. El PSA, al encontrarse elevado tanto en condiciones benignas (hiperplasia prostática benigna) como malignas 45, ha generado que se soliciten biopsias costosas e innecesarias a pacientes que no lo requerían desde un comienzo 45. Como consecuencia, se han explorado otras técnicas y moléculas para hacer un diagnóstico más específico, tales como el PCA3, la microglobulina, las mucinas, entre otras 5. Algunos de estas técnicas fueron incluidas en una revisión detallada publicada con anterioridad por Esquivel-Parra et al.5, pero se sugiere revisar para profundizar en el tema.
Otras herramientas que intentan disminuir el número de biopsias innecesarias, pero que aún no han tenido éxito y se utilizan para pacientes con valores de PSA entre 4 y 10 ng/mL, son:
Relación PSA libre/PSA total: con relación a éste ítem, la relación eleva la especificidad para el diagnóstico del CAP en aquellos casos con los niveles mencionados ante presencia de duda en cuanto a la indicación para la toma de biopsia.
El PSA puede transitar en el suero libremente (fPSA) o acompañado de inhibidores de proteasa (cPSA) con el fin de evitar proteólisis. Al sumar el fPSA y cPSA se obtiene el PSA sérico total (tPSA), gran parte de este (70-90%) puede estar ligado a alfa-1-antiquimiotripsina y en menor proporción a la alfa-2-macroglobulina, alfa-1 antitripsina o a un inhibidor de la proteína C (38). En consecuencia, cerca del 10-30% del tPSA circula libremente (fPSA) 5.
Con índices <0.07, la probabilidad de CAP es casi del 90%. Aún no se encuentra definido un valor límite, sin embargo se recomienda el uso de 0.20 para decidir entre biopsia o seguimiento; los valores por encima de este sugieren un diagnóstico y tratamiento adecuado para hiperplasia prostática benigna. Por otro lado, se sugiere la realización de biopsia en valores menores a este por la probabilidad elevada de CAP.
Densidad de PSA: este ítem se calcula con base en el valor de PSA total dividido por el volumen de la próstata en cm3 (determinado por ecografía). Se sugiere realizar biopsia ante valores >0.15 ng/mL/cm3, ya que estos sugieren adenocarcinoma.
Velocidad de PSA: con relación a este ítem, se encuentra que un valor >0.75 ng/mL/año, sugiere la presencia de cáncer. Además, para aquellos pacientes que han sido sometidos a prostatectomía por patología benigna, sugieren un incremento >0.4 ng/mL/año.
Aunque se cuenta con todas estas herramientas para intentar elevar la especificidad del PSA, hasta el momento no han demostrado disminuir el número de biopsias innecesarias y en la actualidad se considera la toma de biopsia prostática en todo paciente con PSA >4 ng/mL; sin embargo, algunos autores sugieren tomar un valor único de PSA como <2.5 ng/mL (puede ser aplicado para pacientes <50 años dado que faltan estudios para confirmar su valor) para definir la necesidad de biopsia prostática.
Biopsia transrectal de próstata guiada por ecografía
Es el estándar de oro para el diagnóstico del CAP en la actualidad. Las muestras son tomadas en la periferia prostática, que es el sitio en el que más se presenta carcinoma. Por lo general, en la primera biopsia se deben tomar mínimo seis cilindros por cada lóbulo; en caso de contar con biopsia negativa con persistencia de PSA elevado, es necesario proceder a la realización de una biopsia por saturación (>10-12 muestras/lóbulo). Existen estudios que demuestran que la biopsia de próstata requiere adecuada analgesia/anestesia y el uso de profilaxis antibiótica.
La ecografía transrectal de próstata solo se encuentra indicada si va acompañada de biopsia, no debe realizarse en otra condición. Las indicaciones para biopsia de próstata son PSA >4ng/mL y presencia de alteraciones en la superficie prostática (nódulo o próstata pétrea) predominantemente, aunque hay variantes que no son el objeto de esta revisión.
Medicina nuclear
La gammagrafía ósea se debe realizar obligatoriamente de manera inicial en pacientes con PSA >10 ng/mL o en aquellos clasificados como de riesgo intermedio y alto. La probabilidad de que los pacientes con niveles de PSA <10 ng/mL tengan una gammagrafía positiva se encuentra por debajo del 1%; sin embargo, un PSA >49 tiene un LR+ (likelihood ratio positivo) >6, es decir, hay 6 veces más probabilidades de encontrar una gammagrafía positiva en pacientes con CAP que en pacientes sin CAP 46.
Tomografía computarizada (TC)
La TC abdominal, al igual que la resonancia magnética (RM), evalúa de forma indirecta la invasión nodal al medir el diámetro de los ganglios linfáticos. Sin embargo, su sensibilidad es baja y la invasión microscópica no puede ser detectada. La sensibilidad es <40%. Si se utiliza un umbral de 10mm, la mediana de la sensibilidad, la especificidad, el valor predictivo negativo y el valor predictivo positivo estimado son de 7%, 100%, 85% y 100%, respectivamente.
Aunque la biopsia por aspiración con aguja fina puede ser un buen complemento en casos con imágenes positivas, la dificultad de alcanzar los ganglios por su posición hace que esta no sea muy sensible para la estadificación y tenga una tasa de falsos negativos de 40%. Para la TC, al igual que la RM, la detección de invasión ganglionar microscópica es <1 % en pacientes con puntaje Gleason <8, PSA <20 ng/mL o enfermedad localizada. Su uso debe ser reservado para pacientes de alto riesgo.
Aunque la TC de hueso tiene baja especificidad, se prefiere su uso sobre otras técnicas que evalúan metástasis óseas. Se recomienda su realización en pacientes sintomáticos, sin importar los niveles de PSA, la clasificación de Gleason o el estadio clínico 47.
Resonancia magnética de próstata/pelvis
La imagen ponderada en T2 es la más útil para la estadificación local en la RM. A 1.5T (Tesla), la RM tiene baja sensibilidad para detectar extensión extraprostática de carcinoma (22-82%) o invasión de vesículas seminales (0-71%), pero mayor especificidad (61-100% y 62-100%, respectivamente). La exactitud global de la RM para distinguir las etapas T1/T2 de la T3 es 50-85%; estos resultados se deben a que la RM no puede detectar la extensión extraprostática microscópica, de tal manera que su sensibilidad aumenta con el radio de extensión dentro de la grasa periprostática 47.
El uso de la sonda endorrectal mejora la precisión del estadio a 1.5T, además se ha demostrado una mejor precisión en el uso combinado de sondas endorrectales y externas frente al uso solo de las externas. La alta intensidad de campo permite una alta resolución T2-WI y los resultados a 3T parecen mejores que a 1.5T. Aunque la experiencia del lector sigue siendo de suma importancia, la precisión de la RM a 3T varía entre 67% y 93%, dependiendo de la experiencia del personal. La predicción de la etapa patológica por parte de la RM puede mejorar cuando se combina con datos clínicos. Dada la baja sensibilidad para la extensión extraprostática focal (microscópica), la RM de próstata multiparamétrica no se recomienda para estadificación local en pacientes de bajo riesgo. Sin embargo, puede ser útil en la planificación del tratamiento en seleccionados pacientes de bajo riesgo 48.
Tomografía por emisión de positrones/tomografía computarizada
La tomografía por emisión de positrones de 11C- o 18F-colina (PET/TC) tiene una buena especificidad para las metástasis ganglionares, pero la sensibilidad es de 10-73%. En un metaanálisis de 609 pacientes, la sensibilidad y la especificidad de la PET/TC para las metástasis a ganglios pélvicos fue de 62% (IC95%: 51-66) y 92% (IC95%: 89-94), respectivamente 49; dada su baja sensibilidad, esta no se recomienda para la estadificación inicial en metástasis ganglionar, por lo que en la actualidad se están desarrollando estudios con psmaPET-TC (antígeno de membrana específico de próstata-PET/TC).
La PET/TC de 18F-colina muestra una sensibilidad superior a la TC ósea convencional a la hora de evaluar metástasis en hueso. No está claro si la PET/TC de 11C-colina es más sensible que la exploración ósea convencional, pero tiene mayor especificidad con menos lesiones indeterminadas; sin embargo, la relación costo-efectividad de estas intervenciones todavía no se ha evaluado. Por lo tanto, se prefiere la TC ósea sobre la base de la disponibilidad y el costo.
Tratamiento
El tratamiento de elección depende del estadio del tumor en el momento del diagnóstico. Se pueden emplear seis modalidades:
Quirúrgica
Radioterapia externa conformacional
Braquiterapia
Hormonoterapia
Vigilancia activa
Observación.
Carcinoma de próstata localizado <cT2c, Nx, M0
El abordaje del carcinoma de próstata localizado depende del nivel del riesgo, determinado con anterioridad por D'amico y las guías del NCCN, realizándose de la siguiente forma:
Riesgo muy bajo: puede realizarse cualquier modalidad del tratamiento. Se han encontrado buenos resultados con la observación y la vigilancia activa para evitar el sobretratamiento; sin embargo, en pacientes con expectativa de vida >10 años se podría considerar el tratamiento quirúrgico. Riesgo bajo: al igual que en el grupo anterior, puede realizarse cualquier modalidad de tratamiento. La expectativa de vida también cobra un papel importante, ya que en aquellos pacientes con pronóstico <10 años es probable que no se justifique el tratamiento quirúrgico. En aquellos que presenten una expectativa de vida >10 años, y se consideren candidatos a tratamiento quirúrgico, la prostatectomía radical es el tratamiento de elección, sin necesidad de realizar linfadenectomía, la cual ha demostrado mayor efectividad en comparación con la radioterapia 50.
Riesgo intermedio: la prostatectomía radical retropúbica con linfadenectomía pélvica bilateral es el manejo de elección en estos pacientes con expectativa de vida >10 años; este, como todo procedimiento quirúrgico, puede tener complicaciones como sangrado, infección, incontinencia urinaria y disfunción eréctil, sin embargo las de mayor importancia para el paciente son las dos últimas. Cabe aclarar que la frecuencia de estas dos ha disminuido dada la mejoría de la técnica quirúrgica y la preservación de las bandeletas neurovasculares junto con el esfínter externo. Otra modalidad de tratamiento pata estos pacientes es la radioterapia externa, que puede ser 3D conformacional, con intensidad modulada (74- 80 Gy) o braquiterapia de baj a tasa (preferible para pacientes de bajo riesgo). Todas tienen complicaciones relacionadas, similares a la cirugía, como incontinencia, disfunción eréctil, proctitis o cistitis. Riesgo alto: en este grupo de pacientes el tratamiento se realiza de la misma forma que en el paciente de riesgo intermedio.
Carcinoma de próstata localmente avanzado cT3-4, Nx, M0
Una de las opciones terapéuticas para carcinoma de próstata localmente avanzado es la prostatectomía radical retropúbica con linfadenectomía pélvica bilateral en pacientes jóvenes muy seleccionados, con estadio clínico T3, gleason <8 y PSA <20 ng/mL, esto dado que hasta 25% pueden estar sobreestadificados. Otra opción es la radioterapia externa combinada con terapia hormonal (análogos LHRH neoadyuvante, concurrente y adyuvante (por 1-3 años)).
Carcinoma de próstata avanzado cualquier T, N1, M1
El tratamiento de elección en los pacientes con CAP avanzado es la hormonoterapia (quirúrgica o médica). Los medicamentos que se utilizan en la actualidad para la orquiectomía médica son los análogos LHRH (acetato de leuprolide, acetato de goserelina y acetato de triptorelina) y los antagonistas del receptor de la hormona liberadora de gonadotropina (GnRH)(Degarelix), cuyo uso lo debe llevar a cabo personal especializado. A estos medicamentos se les puede adicionar otros emergentes como la abiraterona (inhibidor de la síntesis de testosterona), la enzalutamida (inhibidor del receptor de andrógenos) y el radio-223 cuando el paciente es denominado resistente a la castración (51). Los criterios para ser definido como resistente a la castración son (51) nivel de testosterona <50 ng/dl o 1.7 nmol/l más
Progresión bioquímica: tres elevaciones consecutivas del PSA al menos con una semana de diferencia y con resultado en dos incrementos del 50% por encima del nadir y un PSA >2, o Progresión radiológica: aparición de dos o más lesiones nuevas en una gammagrafía ósea o una lesión de tejidos blandos usando los criterios RECIST (Response Evaluation Criteria in Solid Tumors).
Los antiandrógenos se utilizan como coadyuvantes en el tratamiento y existen de dos tipos: esteroideos y no esteroideos. Dentro de estos últimos se encuentran la flutamida, la bicalutamida, entre otros, sin embargo sus indicaciones, dosis y seguimiento deben ser realizados por el especialista 51.
En aquellos pacientes con CAP metastásico y resistente a la castración se pueden hacer clasificaciones de acuerdo con el estado funcional y con la presencia de síntomas o metástasis viscerales. Para aquellos con deterioro del estado funcional, el tratamiento aún está en investigación dado el pobre pronóstico de los pacientes. Por el contrario, para aquellos con buen estado funcional, se cuenta con diferentes tratamientos como los antiandrógenos de nueva generación y la quimioterapia. Los pacientes asintomáticos o levemente sintomáticos podrían recibir abiraterona, enzalutamida y radio 223, mientras que los sintomáticos y que tienen metástasis viscerales son candidatos a quimioterapia (docetaxel o cabazitaxel, como segunda línea), cuyo manejo es dado por el especialista en oncología o en juntas interdisciplinarias 51.
Conclusiones
La presente investigación presenta una visión actualizada en diferentes aspectos del CAP. Se trata de una patología muy frecuente, con una incidencia que varía entre mantenerse estable o aumentar y una prevalencia que, con claridad, está en aumento, quizá debido a la mejoría para diagnóstico y tratamiento. Con respecto a los factores de riesgo, se tienen los clásicamente reconocidos, como raza, edad y factores genéticos; los que todavía no se ha podido encontrar el rol que juegan, como la alimentación, y algunos que antes se creía eran factores protectores y ahora apuntan a jugar un papel carcinógeno, como los estrógenos.
Es importante realizar una adecuada clasificación y estadificación clínica, anatómica y patológica del CAP, ya que de dicho proceso depende la aproximación y utilización de técnicas de imágenes y radiología, además del tratamiento oportuno, individualizado e indicado según la medicina basada en la evidencia.
La caracterización genética y microbiológica del CAP es hacía donde apuntan y apuntarán la mayoría de esfuerzos e investigaciones, ya que se requieren pruebas con mayor sensibilidad y especificidad que lleven a un diagnóstico más temprano y certero y, de ser posible, faciliten terapias más específicas y menos mórbidas.
Se realizó un recorrido a través de las condiciones de riesgo, tamizaje, diagnóstico, nuevos biomarcadores y tratamiento del CAP. Varios elementos han cambiado en los últimos años, principalmente acerca de la comprensión de la fisiología del cáncer, los factores asociados, la búsqueda de nuevos biomarcadores en cada una de las etapas del cáncer y varios elementos relacionados con el tratamiento; sin embargo, hay mucha investigación en curso acerca de la prevención, el diagnóstico y el tratamiento de esta condición tan importante, relevante y pertinente para los hombres alrededor del mundo.














