Introducción
La generación de respuesta inmune de tipo inflamatorio beneficia al hospedero cuando se presenta de forma oportuna (contra un patógeno, por ejemplo) y con una intensidad suficiente para eliminar la amenaza sin ocasionar daños colaterales mayores a los que se derivan del agente nocivo. Sin embargo, en ciertas ocasiones esta respuesta inmunitaria ante un antígeno puede desarrollarse de manera inadecuada y excesiva, lo que genera manifestaciones clínicas de hipersensibilidad.
A medida que se conoce más sobre los mecanismos patogénicos de las reacciones clínicas exageradas a estímulos que son tolerados por la mayoría de las personas, se ha vuelto más complejo clasificar y definir estas condiciones. Teniendo en cuenta que una parte de estas reacciones no se produce por mecanismos inmunológicos, los consensos de expertos han decidido denominar como alergia solo a las reacciones de hipersensibilidad mediada por mecanismos inmunológicos; dentro de estas se incluyen la clásicamente conocida como hipersensibilidad tipo I, mediada por IgE, pero también las mediadas por otros mecanismos inmunológicos descritos en la clasificación clásica de Phillip Gell y Robin Coombs, la cual, a pesar de sus limitaciones teórico-prácticas, continúa siendo utilizada como marco de referencia en clínica 1.
Las diversas descripciones de cómo el sistema inmune puede generar reacciones de hipersensibilidad también han tenido un impacto en las herramientas diagnósticas que se utilizan. En este sentido, el reconocer que hay reacciones alérgicas mediadas por otros isotipos diferentes a la IgE se acopla a la necesidad de detectar otros mecanismos de activación del sistema inmune que puedan aplicarse en clínica.
La prueba de activación de basófilos (PAB) aparece como una herramienta útil para un estudio más incluyente de distintos mecanismos inmunológicos relacionados con hipersensibilidad. Esta técnica se utiliza desde hace algunas décadas, pero la aplicación más reciente de citometría de flujo ha mejorado su sensibilidad y especificidad. En los últimos años sus usos clínicos se han extendido y, en esencia, tiene mayor campo en el estudio de alergias a medicamentos, como escalón previo a la prueba de exposición. También es de utilidad en alergia alimentaria para monitorizar la eficacia de la inmunoterapia, en los procedimientos de desensibilización y en el estudio de procesos alérgicos en los que no se puede detectar por los métodos convencionales la existencia de IgE específica 2.
El objetivo de esta investigación fue revisar de manera detallada la forma de realización de la PAB, su utilidad clínica en el manejo de las enfermedades alérgicas, los avances metodológicos en su desarrollo y su posicionamiento como una prueba recomendada en el diagnóstico de algunos problemas alérgicos.
Materiales y métodos
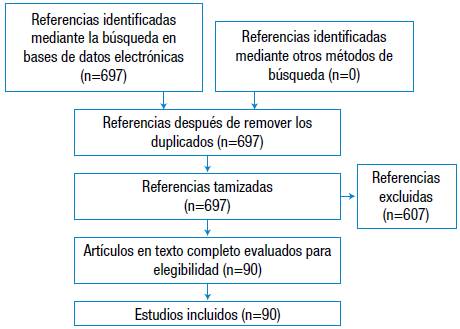
Se realizó una revisión narrativa de la literatura mediante la búsqueda electrónica en las bases de datos y metabuscadores Ovid Medline, Google Scholar y PubMed, sin limitar la búsqueda por fecha, idioma o tipo de artículo. La fecha final de busqueda fue el 1 de octubre de 2016. Se buscaron artículos sobre los detalles técnicos de la prueba, los fundamentos teóricos y su utilidad clínica en el manejo de enfermedades alérgicas. Para la selección final de los artículos se tuvo en cuenta aquellos cuyo texto completo estuviera disponible para lectura o descarga. El flujograma de busqueda se presenta en la Figura 1.
Resultados
De la revisión de la literatura se identificaron 90 referencias, de las cuales 10 correspondieron a revisiones de tema y 80 a artículos originales de texto completo. Todos los artículos identificados fueron escritos en idioma inglés.
Discusión
A continuación se abordan diferentes temas relacionados con la revisión de publicaciones sobre la PAB. En primer lugar, se realiza una breve reseña de los conceptos básicos sobre la biología, las formas de activación (anticuerpos, citoquinas y otros) y los mecanismos de secreción del basófilo. Luego, se discuten aspectos más específicos de la prueba, como las estrategias de identificación de esta población celular y sus marcadores de activación, y aspectos metodológicos de importancia y su uso en el diagnóstico de alergias.
Conceptos básicos sobre la biología y la activación del basófilo
Los basófilos son granulocitos circulantes muy poco frecuentes (<1% de los leucocitos en sangre) que responden a varios estímulos, entre estos a la IgE a través de receptores FceRI que tras su activación liberan diferentes mediadores preformados y otros sintetizados de novo característicos de la reacción alérgica, tales como histamina, LTC4 y citoquinas Th2, como interleucina (IL) 4 e IL-13.
El papel del basófilo como célula efectora en varios trastornos alérgicos no se conoce lo suficiente, aunque se sabe que aumenta en número y hace parte del infiltrado inflamatorio del tejido afectado 3. No obstante, la detección de su activación puede utilizarse como indicador de sensibilización ante un antígeno/alergeno y funciona como ayuda diagnóstica en diferentes enfermedades alérgicas 2,4.
Formas de activación del basófilo
Los basófilos expresan en su superficie citoplasmática una variedad de receptores que le confieren la capacidad de responder a distintas señales que regulan sus funciones de desarrollo y efectoras. Por tanto, además de la degranulación, el basófilo puede activarse y efectuar otras formas diferentes de respuesta de acuerdo al estímulo inductor. Algunos de los más importantes mecanismos de activación en los basófilos comprenden:
Anticuerpos
Inmunoglobulina E: los basófilos expresan el receptor de IgE de alta afinidad y median reacciones de hipersensibilidad tipo I tras el entrecruzamiento de los complejos IgE-FceRI por antígenos multivalentes, incluyendo alergenos, lo que provoca activación/ degranulación de la célula 5. Falta mucho por conocer sobre el papel directo del basófilo en la generación de reacciones de hipersensibilidad, aunque se sabe que participa en varios procesos que culminan en que otras células efectoras liberen su contenido proinflamatorio en cantidades suficientes para inducir fenómenos clínicamente visibles 6.
Inmunoglobulina G: en ratones se ha observado que los basófilos promueven una vía alternativa de anafilaxia. Tsujimura et al.7 encontraron que tras la estimulación con complejos IgG1-alergeno, los basófilos liberan factor de activación plaquetaria, llevando así a anafilaxia sistémica a través del aumento de la permeabilidad vascular. La vía de señal de la IgG a través de su receptor FcyRIIA contribuye en reacciones alérgicas y anafilácticas en humanos, sin embargo se ha observado en células diferentes a los basófilos 8. De esta manera, aunque se ha encontrado cierta relación entre anafilaxia y vías mediadas por receptores IgG, no se conocen estudios que demuestren tal mecanismo en basófilos humanos.
Citoquinas
La IL-3 tiene un papel crucial en la biología del basófilo, pues participa no solo como factor de diferenciación 9, sino también como agente regulador de la función de estas células en las que aumenta la síntesis de histamina y su liberación ante una posterior estimulación por vía IgE 10, induce mayor expresión del marcador de activación CD63 ante estímulos como el alergeno especifico 11,12 y aumenta de forma inespecífica la expresión de CD203c, otro marcador de activación, en basófilos en reposo 13.
La linfopoyetina estromal timica (TSLP, por su sigla en inglés) puede promover selectivamente la hematopoyesis de basófilos a partir de precursores de la medula ósea e inducir respuestas en basófilos maduros periféricos en ambientes suficientes y deficientes en interleucina (IL) -3 14. La IL-18 coestimula la producción de IL-4 e IL-13 por basófilos en respuesta tanto a IL-3 como a entrecruzamiento de los FCeRI 15, al igual que la IL-3 aumenta la síntesis de leucotrienos 16. La IL-33 ha mostrado capacidad de aumentar la liberación de mediadores inducida por IgE y sinergia con la IL-3 para producir citoquinas Th2 en basófilos de manera independiente de IgE 17.
Otras formas de activación
El efecto de las enzimas ha sido estudiado, en especial las de tipo proteasas de cisterna, sobre la activación del basófilo 18. Asimismo, se ha descrito que la papaína induce la liberación de IL-4 e IL-6 en basófilos murinos y la migración de estos al ganglio linfático 19. Otro mecanismo de activación no específica descrito en los basófilos es la activación por superantígenos, como la glicoproteína gp120 del virus de la inmunodeficiencia humana que puede unirse a la región VH3 de la IgE promoviendo la liberación de IL-4 e IL-13 20. De igual forma, la proteína L (expresada en Peptostreptococcus magnus) induce la liberación de estas mismas citoquinas, pero por interacción con la cadena κ de la IgE 21.
Mecanismos de secreción
Se ha observado que los basófilos activados pueden presentar dos patrones de secreción regulada del contenido de sus gránulos. Una es la degranulación anafiláctica (DA), en la que se producen cambios morfológicos rápidos y una secreción coordinada de mediadores desde sus gránulos de forma rápida y explosiva que se completa en minutos tras la estimulación; por lo general, esta es observada in vivo en respuestas de hipersensibilidad inmediata IgE-dependientes 22-24. La otra es la degranulación gradual (PMD, por su sigla en inglés) en la que la secreción es gradual o lenta 22,23,25. La PMD es el evento visto con más frecuencia en basófilos analizados que participan en varias condiciones y enfermedades in vivo, tales como rechazos de injertos de piel en humanos, lesiones ampollares penfigoides, leucemia de basófilos, linfoma, síndrome de Sézary, entre otras 22,23,26; esta forma de degranulación también se ha observado en los mastocitos, en situaciones clínicas como alergia por contacto, hipersensibilidad retardada, urticaria pigmentosa, ampollas penfigoides, melanoma, gromerulonefritis crónica, pielonefritis, adenoma renal, colitis ulcerativa, enfermedad de Crohn, enfermedad de Whipple, poliposis familiar del colon, fibrosis intersticial pulmonar, inflamación crónica de la mucosa del seno maxilar, tumores metastásicos primarios, estimulación mecánica o con frio de la piel, heridas de la piel en sanación y angiogénesis 22,23,26.
Aunque por sus características la DA y la PMD pueden ser vistas como fenómenos independientes, en realidad se han propuesto como extremos de un mismo modelo general de degranulación que depende de la tasa de formación de las vesículas; en este modelo, una tasa lo suficientemente baja permite que las vesículas transiten de manera individual transportando el contenido granular. Sin embargo, conforme la tasa aumenta, las vesículas ya no pueden mantener su individualidad y tienden a fusionarse formando canales que pueden interconectar gránulos adyacentes o gránulos con la membrana de la célula, creando así la anatomía característica de la degranulación anafiláctica 25.
Prueba de activación de basófilos y marcadores de activación
La técnica actual de la PAB se basa en la cuantificación de los cambios en la expresión de marcadores de activación tras la estimulación con el alergeno específico y la consecuente degranulación del basófilo 2. Dentro de sus usos se encuentra la evaluación experimental de la alergenicidad y el diagnóstico de sensibilización con fines clínicos. A continuación se describen los marcadores de activación más estudiados y se reseñan algunos otros que han sido propuestos.
CD63
También denominado LAMP-3 (glicoproteina-3 de membrana asociada a lisosoma), es un miembro de la superfamilia transmembrana 4 o tetraspaninas presente en diferentes tipos de células, como basófilos, mastocitos, macrófagos y plaquetas 11. Este es una proteína que en estado de reposo en encuentra anclada a la membrana del granulo, pero que cuando se presenta la degranulación anafiláctica, la fusión del granulo con la membrana plasmática causa su expresión en la superficie celular de un basófilo activado 27,28. Por ser el primero en describirse, ha sido el marcador de activación de basófilos más estudiado 29.
CD203c
Identificado por Buhring et al.30 como marcador adicional de activación de basófilos, es una proteína transmembrana de tipo II, miembro de la familia de fosfatasas/fosfodiesterasas de nucleótidos 31, cuya función en el basófilo es desconocida 28.
Su expresión varía de acuerdo con el estado atópico del individuo: las personas asmáticas con exacerbaciones presentan mayor expresión basal e inducida por anti-IgE que los pacientes con control de la enfermedad; incluso, su expresión es mayor durante la exacerbación que durante el periodo de mejoría clínica 32.
Otros indicadores de la activación de basófilos
La activación del basófilo también se ha evaluado mediante el empleo de otros marcadores, p. ej., midiendo el grado de fosforilación de MAPK p38, un miembro de las cinasas activadas por mitógeno cuya fosforilación aumenta conjuntamente con la regulación al alza de CD63 33. CD13, CD107a y CD164 son otros indicadores de activación que se han identificado 34; no obstante, se requieren más estudios y ensayos de validación que permitan verificar si estos marcadores pueden ser utilizados en la práctica para el diagnóstico de alergias y si su uso mejoraría el desempeño de la PAB y sus resultados.
Estrategias de identificación de basófilos y su activación
Para medir la activación de basófilos es esencial su discriminación del resto de células sanguíneas. Existen varias formas de identificar basófilos humanos por citometría de flujo y de separarlos de otros leucocitos durante los ensayos de activación 35-37. Esta selección debe ser bastante cuidadosa, pues influye en la eficacia diagnóstica de la prueba 38. Dentro de los aspectos que deben tenerse en cuenta para la selección de los mejores marcadores celulares están su especificidad para discriminar basófilos, su patrón de expresión en condiciones de reposo y durante la activación celular, la variabilidad interindividuo y la representatividad del marcador en la población real de basófilos. Otro aspecto conveniente es que con un mínimo de marcadores se puede identificar a la población de manera óptima, lo que ahorra costos y tiempo en el desarrollo de la prueba.
Dentro de las estrategias de selección más conocidas se encuentran:
la combinación de anti-CD123 (subunidad α del receptor de IL-3) con anti HLA-DR para excluir células presentadoras de antígeno y monocitos 13,35,36.
la combinación de anti-CRTH2 (receptor D2), anti-CD3 (exclusión de células T) y anti-CD203c para identificar estas células en la región más baja de "Side Scatter" (SSClow), donde, por sus complejidad, se encuentran las células mononucleares y los basófilos 37.
el uso de anti-CCR3 (receptor 3 de quimiocinas CC, expresado en basófilos, mastocitos y linfocitos Th2), también conocido como CD193 con o sin el empleo de un segundo marcador 35,39.
la detección de IgE en la superficie de los basófilos, aunque esta se complica en pacientes con bajos niveles de este anticuerpo, además, la IgE puede hallarse también en la superficie de otras células (como monocitos y eosinófilos), lo que eleva la cantidad de células contaminantes y reduce la especificidad de la prueba 35,40. A pesar de esto, una selección adecuada permite discriminar los basófilos con este marcador en compañía de algún otro, como CD45 41 o CD203c, por lo que sigue siendo empleado 42.
el marcador CD203c podría usarse como marcador de identificación ya que entre las células sanguíneas se expresa exclusivamente en basófilos y se regula al alza tras su activación por alergeno o anti-IgE en basófilos maduros 30; sin embargo, su baja expresión basal ha obstaculizado en muchos casos su empleo como único marcador para la adquisición de los basófilos en reposo 41.
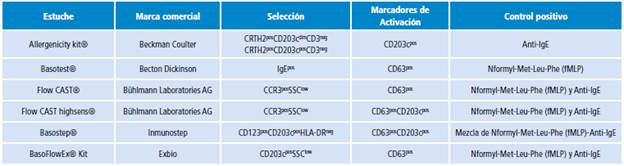
Una técnica bastante utilizada para determinar basófilos y cuantificar su activación se basa en la caracterización de las células por anti-IgE y la evaluación de su estado de activación por anti-CD63 43,44. Esta técnica es empleada por estuches comercialmente disponibles, como Basotest™ (Becton Dickinson, Pont de Claix, France); sin embargo, el hecho de que no se utilice un marcador adicional para diferenciar los basófilos de otras células sanguíneas que también poseen IgE en su superficie, sumado a que este protocolo utiliza como control positivo el péptido inductor de degranulación fMLP (que activa el basófilo por vía FRP-1, diferente a la vía usada por alergenos dependiente de anticuerpos), hacen que el empleo de este producto sea menos recomendable 11,45 en comparación con otros que basan su selección en combinaciones de marcadores que permiten mejor discriminación y utilizan como control positivo anticuerpos anti-IgE (que al igual que los alergenos, activan al basófilo por vía IgE-dependiente). Un ejemplo es el Allergenicity Kit™ (Beckman Coulter, Fullerton, California, Estados Unidos), que identifica los basófilos como una población CD3+ CRTH2+ CD203c+ 44.
De diferentes estudios que han comparado la eficiencia de las estrategias de selección de basófilos para realizar pruebas de activación 46-48, el trabajo de Eberlein et al.46 es el que incluye mayor número de estrategias. Estos autores concluyen que se puede identificar una mayor cantidad de basófilos al seleccionarlos como células anti-CCR3+, anti-IgE+ o anti IgE+/anti-CD203c+ en comparación con la estrategia CRTH2+/CD203c+/CD3- 46. Aunque en en el presente estudio la detección de IgE se recomienda para seleccionar basófilos con una alta pureza, otros autores consideran lo contrario 35,46 y mencionan como desventaja que este es un marcador con alta variabilidad interindividual 35,47 no recomendando su uso como único marcador de selección.
CCR3 es un marcador altamente confiable y con poca variabilidad interindividual que permite obtener gran cantidad relativa de basófilos, con alta pureza, independiente del componente atópico del paciente 35,46, por lo que podría considerársele el mejor marcador individual para identificar basófilos. Por otra parte, para el estudio de la urticaria crónica, mediante la PAB indirecta, se ha comparado el empleo de CCR3 o CD123 y la combinación de ambos, encontrándose que esta última presenta mejores resultados, por lo que se recomienda como método de selección 49.
En la Tabla 1 se describen varias estrategias de selección que usan los estuches de determinación de activación de basófilos disponibles comercialmente.
Aspectos metodológicos de la PAB
Para realizar la PAB se puede emplear sangre total o leucocitos aislados. El empleo de sangre total hace más práctica la manipulación (reduciendo el número pasos de centrifugación), pero se argumenta que puede presentar diferencias relevantes con respecto al empleo de leucocitos aislados; un ejemplo es la posible interferencia de componentes del suero (anticuerpos específicos para el alergeno, entre otros) que, si bien puede representar de manera más cercana lo que ocurre en condiciones fisiológicas, puede también llevar a un descenso en la sensibilidad del ensayo o permitir que componentes del suero causen activación inespecífica en los controles e interferencias debido a agregados de plaquetas (ya que estas también expresan CD63) 50,51. La Figura 2 muestra el esquema general de los pasos a seguir en una PAB sobre sangre total.
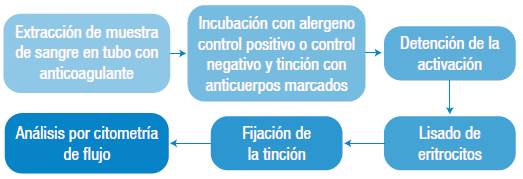
Fuente: Elaboración propia.
Figura 2 Esquema general de la prueba de activación de basófilos en sangre total.
Otro tipo de PAB que se usa principalmente en investigación biomédica se hace de manera indirecta y utiliza basófilos de un donador distinto al paciente evaluado. Por lo general se extraen células mononucleares periféricas y se someten a un procedimiento de lavado con ácido láctico para remover de los basófilos a las inmunoglobulinas unidas a membranas ("stripping"), las cuales se incuban con el suero "sospechoso" y el alergeno a evaluar 52. Este procedimiento es bastante útil cuando no se puede contar con sangre fresca, p. ej., en pacientes que viven lejos de una unidad con citometría de flujo o en la evaluación de pacientes con urticaria crónica 49.
Muestreo de sangre
El procedimiento de la PAB inicia con la extracción de sangre del paciente mediante algún anticoagulante, casi siempre heparina. Hay opciones comerciales, como el Allergenicity kit, para hacer el BAT con muestras tomadas en tubos con ácido etildiaminotetraacético (EDTA) o ácido cítrico-citrato-dextrosa, las cuales incluyen una solución de activación para reponer el calcio que se quela con estos anticoagulantes y es necesario para la degranulación de los basófilos 2. Asimismo, se ha reportado que no hay diferencia significativa entre los resultados de la prueba con el marcador anti-CD63 tras almacenar la sangre a 4°C durante 24 horas empleando EDTA o citrato, pero no con heparina 53. Sin embargo, en otra publicación más reciente, la eficiencia de la prueba no se ve alterada con este anticoagulante bajo las mismas condiciones de tiempo y temperatura 54. El mantenimiento de la muestra a temperatura ambiente por largos periodos reduce de forma significativa la reactividad del basófilo en la prueba de activación 51.
Controles
El control negativo evalúa la expresión basal de los marcadores de activación y, por lo general, se utiliza el mismo diluyente en el que se encuentra el alergeno a evaluar. Tradicionalmente, el control positivo consiste en anticuerpos anti-IgE monoclonales o policlonales. También se pueden emplear anticuerpos monoclonales anti FCeRI, con el que se han encontrado mayores tasas de activación y un mayor número de respondedores 45,50,51. El péptido bacteriano N-formilmetionil-leucil-fenilalanina (fMLP) puede emplearse para evaluar la calidad de los basófilos; sin embargo, se ha recomendado evitar su uso como control positivo 11,45, puesto que activa a los basófilos a través del FPR-1 (receptor acoplado a proteína G que activa vías MAPK y fosfolipasa C) y no por estimulación mediada por IgE- FCeRI. Alrededor del 10-15% de los individuos tienen basófilos "no respondedores" al control positivo de la vía dependiente de IgE; en estos casos, los resultados de la PAB no son confiables 11.
Estimulación con alergeno
Las concentraciones empleadas para la PAB son alergeno-dependientes, haciéndose necesario estandarizar la técnica para cada uno de ellos mediante titulación a distintas concentraciones 2. En general, los alergenos medicamentosos son activos en el rango de los mg/mL y pueden ser diluidos de 5 a 25 veces sin perder su actividad. Por su parte, los alergenos proteicos son empleados a menudo en concentraciones del orden de los μg/mL y pueden ser diluidos hasta ng/mL o pg/mL manteniendo su actividad. El tiempo de incubación es, por lo general, de 15 a 20 minutos y está acorde a la dinámica de expresión de los marcadores de activación (CD203c o CD63), siendo CD203 el de aparición más temprana.
Pretratamiento con IL-3
Aunque la necesidad de preactivación de los basófilos con IL-3 ha sido causa de controversia 11, se ha demostrado que una corta preincubación (de máximo 10 min) con IL-3 (2 ng/mL) no aumenta la expresión de CD63 basal, pero sí induce mayor expresión de mediadores y de CD63 ante estímulos como el alergeno especifico 11, permitiendo aumentar la sensibilidad del ensayo 41,55.
La IL-3 se ha empleado con éxito para normalizar la reactividad de basófilos de donantes sanos usados para el diagnóstico de urticaria espontanea crónica 39. Sin embargo, la estimulación con esta aumenta de forma inespecífica la expresión de CD203c en basófilos en reposo, lo que reduce de manera significativa la diferencia entre basófilos activados y los no activados; por tanto no se recomienda su uso cuando la PAB se realiza con este marcador de activación 13,41.
Empleando CD63
La expresión de CD63 se presenta tras el proceso de degranulación anafiláctica del basófilo 28, tiene un pico máximo de expresión a los 25-30 minutos y coincide con el momento de la liberación de la histamina 27.
Para la evaluación apropiada de los resultados debe tenerse en cuenta el número absoluto de basófilos identificados, que debe ser de al menos 150, y el porcentaje de basófilos activados, que en el control negativo debe ser <5%. Existen dos medidas comunes de activación de basófilos: la reactividad y la sensibilidad, ambas recomendadas por la Academia Europea de Asma, Alergia e Inmunología Clínica (EAACI) para la interpretación de la PAB. La primera equivale al porcentaje de basófilos que responde a determinado estímulo y la segunda a la mínima concentración de alergeno necesaria para que responda el 50% de los basófilos reactivos (EC50). Para el análisis de la reactividad basta con evaluar la activación de basófilos ante una o dos concentraciones de alergeno. Es importante emplear un control positivo que evalúe la reactividad de los basófilos antes de someterlos a la estimulación con el alergeno 2.
Tras determinar la reactividad se puede evaluar la sensibilidad, dado que esta se da en función de la reactividad de los basófilos. Para esto se hacen lecturas de la reactividad de los basófilos a 6-8 concentraciones y la respuesta se gráfica en una curva de respuesta versus concentración de alergeno para determinar la EC50. La sensibilidad puede ser expresada también como "CD-sens" (equivalente el inverso de EC50 multiplicado por 100) 2,56.
La activación de basófilos también puede evaluarse mediante la intensidad de fluorescencia media (MFI, por su sigla en inglés). Para este fin, el incremento en la MFI se presenta como un valor relativo denominado índice de estimulación (SI, por su sigla en inglés), que resulta de la relación entre el MFI tras la estimulación y el MFI del control negativo 57. En general, un SI >2.0 puede ser considerado como una señal confiable de activación de basófilos inducida por la sustancia de ensayo. La dependencia de dosis puede tomarse como una segunda confirmación confiable de reacción específica al alergeno. Asimismo, en general, un porcentaje >15% de basófilos activados tras el reto alergénico podría indicar un estado alérgico; sin embargo, para establecer los puntos de corte para cada alergeno es recomendable construir una curva ROC (del inglés, receiver operating characteristics) que permita seleccionar el punto de mayor sensibilidad con la máxima especificidad 50,57,58. Los puntos de corte empleados con mayor frecuencia en clínica aparecen en la Tabla 2.
Tabla 2 Puntos de corte utilizados para considerar una prueba de activación de basófilos positiva.
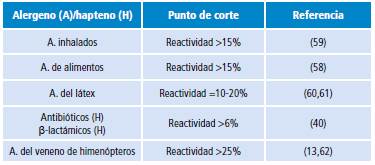
Fuente: Elaboración propia.
Por último, para la correcta evaluación de los resultados siempre debe tenerse en cuenta la situación general del paciente (medicación, estación del año, inmunoterapia, exposición reciente a alergenos y coexistencia de enfermedades).
Empleando CD203c
CD203c es un marcador específico de basófilos y, aunque se expresa de manera constitutiva en la superficie celular, sus niveles aumentan con la activación. En contraste a CD63, el incremento de CD203c en superficie celular por lo general es más rápido y transitorio. Los niveles basales de CD203c expresados por basófilos pueden diferir de forma significativa entre individuos, además, diversos factores pueden afectar su expresión; de hecho, se han encontrado diferencias basales de esta entre las personas con asma e individuos no alérgicos 32.
La expresión de CD203c puede modificarse por los niveles de otras citoquinas. En específico, la IL-3 aumenta su expresión en ausencia de degranulación anafiláctica, por lo cual pueden hallarse niveles mayores de CD203c durante el curso de varios procesos inflamatorios 57. El incremento en la expresión de CD203c se presenta en forma de SI y, aunque también puede presentarse como porcentaje de basófilos activados, esto último no es lo más apropiado pues la expresión basal del marcador y, por lo tanto, la definición del punto de corte son diferentes para cada paciente 41. Al igual que para CD63, un SI >2 puede ser considerado como indicador confiable de activación de basófilos y la dependencia de la dosis se considera un segundo indicador fiable de una reacción especifica al alergeno 57,63.
Un ejemplo del análisis de los resultados se muestra en la Figura 3, donde a partir de células CD3- (Figura 3A), se seleccionaron los basófilos (Figura 3B) teniendo en cuenta las que son CD203c+ CRTH2+. El porcentaje de activación (%Act.) se determinó usando como punto de corte el control negativo que corresponde a las células estimuladas con la solución de dilución del alergeno (Figura 3C). La estimulación con 1 μg/ mL de extracto B. tropicalis (Figura 3D) y anti IgE (Figura 3E) evidencia la sobreexpresión del marcador CD203c. Al interior de los cuadrantes se presenta el índice de estimulación (SI) que indican un resultado positivo para el alergeno y el control de la prueba, >2 en ambos casos.
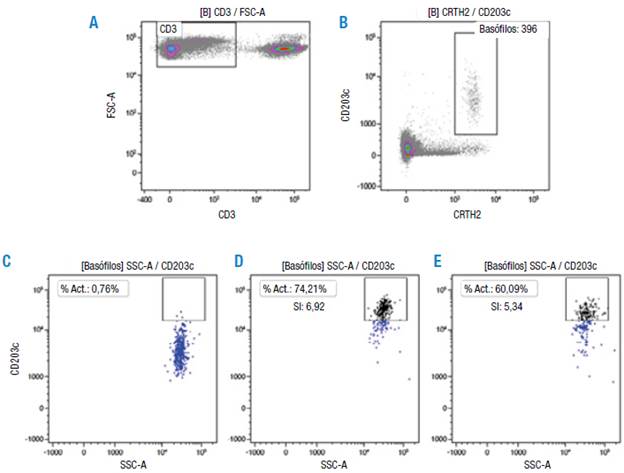
Fuente: Elaboración propia.
Figura 3 Prueba de activación de basófilos de un paciente con rinitis alérgica sensibilizado al ácaro Blomia tropicalis usando el estuche comercial Allergenicity kit™.
Sin embargo, el incremento en la expresión CD203c en basófilos activados es, por lo general, menos prominente que el de CD63; en pacientes con elevada expresión basai de CD203c la regulación positiva puede estar completamente ausente, originando falsos negativos. Por lo tanto, los resultados siempre deben ser interpretados a la luz de la situación general del paciente (medicación, estación del año, inmunoterapia, exposición reciente a alérgenos y coexistencia de enfermedades) 11.
Factores que influyen en la realización de la prueba
El uso de antihistamínicos no afecta la expresión de CD63 o CD203c tras un evento de estimulación. En el caso de los corticoïdes orales, se ha demostrado que a concentraciones muy altas, inusuales en clínica, se interfiere en la expresión de CD63, mas no de CD203c 12,13.
PAB en el diagnóstico de alergias
Comparado con la determinación de IgE específica, la PAB tiene la ventaja que evalúa una respuesta alérgica efectora y, por lo tanto, se espera que tenga una mayor concordancia clínica con los retos orales, prueba de oro para el diagnóstico de alergias 4. Su rendimiento como técnica diagnóstica, en comparación con la prueba cutánea (PC), es variable y depende del alergeno o la molécula inductora de hipersensibilidad. En algunos casos se ha demostrado la superioridad de la PAB sobre la PC 56. Expertos consideran que en casos de falta de concordancia entre la PC y la IgE específica, o en los que hacer una prueba in vivo ponga en peligro la vida del paciente, la PAB tiene un escenario ideal de aplicación. Aunque hay otra pruebas ex vivo, como los ensayos de liberación de histamina, la posición de la EAACI es que de estos no hay revisiones sistemáticas que permitan hacer un juicio apropiado de su aplicabilidad, y que hay limitaciones técnicas, como la reactividad cruzada de la histamina con otros metabolites, que pueden alterar la especificidad cuando se hace su determinación. Por lo tanto, dicha academia considera que la PAB es superior a los otros métodos 2. Además, en comparaciones directas entre estos métodos, la PAB ha mostrado mayor sensibilidad, pero rendimiento diagnóstico parecido 64. La línea celular de rata con leucemia basofílica (RBL, por su sigla en inglés) también es una estrategia prometedora como prueba diagnóstica ex vivo65; no obstante, faltan más estudios que evalúen su comportamiento clínico.
La utilidad de la PAB como prueba diagnóstica ha sido estudiada en distintas clases de alergia y ante un considerable número de alérgenos (Tabla 3), además, ha mostrado ser útil como herramienta complementaria para la evaluación y diagnóstico de alergia severa al maní en adultos. Se ha establecido que la reactividad de los basófilos es significativamente mayor en pacientes con historia de alergia severa al maní en comparación a pacientes sensibilizados 56.
Tabla 3 Utilidad de la prueba de activación de basófilos como prueba diagnóstica de alergia ante distintos alergenos.
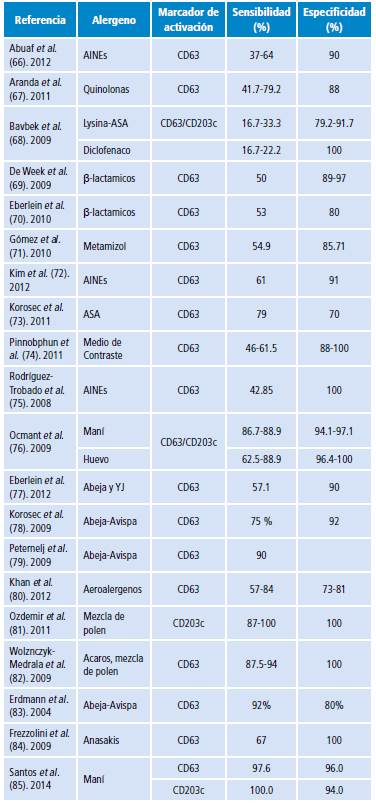
Fuente: Elaboración propia.
La PAB también puede emplearse para revelar alergias severas ocultas a la soya en pacientes con alergia a maní 58. Hace poco, en un estudio en niños de 1 a 13 años, Santos et al.56 identificaron variables en la PAB que permiten predecir los resultados del reto oral.
Utilizando CD63 como marcador de activación, estos investigadores identificaron la reactividad alergeno-específica a través de la PAB como biomarcador de la gravedad de las reacciones alérgicas al maní durante los retos orales. De igual forma, encontraron que la medición de la sensibilidad de los basófilos (medida por CD-sens) puede tener un valor clínico para estimar el umbral de las reacciones alérgicas al maní durante los retos orales. Estos hallazgos indican que la PAB puede funcionar como sustituto in vitro de los retos orales para estimar la severidad y el umbral de las reacciones alérgicas y mejorar el manejo de los pacientes con alergia a maní.
Las limitaciones principales de la PAB en la práctica clínica se relacionan con la accesibilidad, la validación de los reactivos y su alto costo 86. El empleo de citometría de flujo disminuye su uso como prueba de rutina, a diferencia de la PC, que está disponible en el consultorio del especialista. No obstante, se espera que en un futuro la PAB se posicione como prueba diagnóstica de alergia en casos específicos en donde la superioridad es evidente.
CD63 versus CD203c
Como se ha mencionado, para la medición de la activación de los basófilos casi siempre se emplean dos marcadores: CD63 y CD203c (Tabla 4). Diferentes estudios se han desarrollado para evaluar la idoneidad de cada uno en diferentes condiciones alérgicas. Al examinar la respuesta de basófilos ante el estímulo con anti-IgE o ffMLP, se ha encontrado que la totalidad de basófilos que resultan CD63 negativos o "no respondedores" sí muestran activación si esta se mide mediante CD203c. Esto sugiere que en aquellos "no respondedores", la PAB debería emplear ambos marcadores de activación 87.
Tabla 4 Principales características de los marcadores más empleados en test de activación de basófilos.
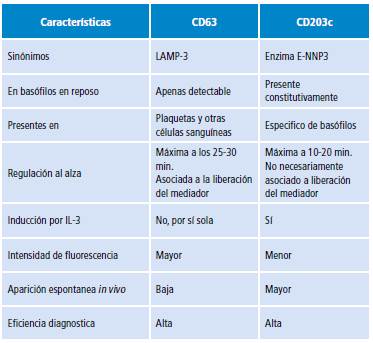
Fuente: Elaboración propia.
Ambos marcadores mostraron ser igual de confiables en el diagnóstico de alergia al gato, siempre y cuando la prueba se desarrolle bajo las condiciones más adecuadas para cada marcador; por ejemplo, la preincubación con IL-3 en caso de que se emplee CD63 y no CD203c 41.
En pacientes con historia clínica de anafilaxia a amoxicilina se ha encontrado que CD203c puede ser mucho más sensible que CD63 (60% para CD203c, contra 20% para CD63) 40. Sin embargo, en este estudio los métodos de selección de los basófilos pudieron afectar en cierta forma los resultados, dado que para la prueba con CD63 los basófilos se identificaron solo como IgE+, sin emplear un segundo marcador para eliminar otras células que también expresan IgE, lo que ocasionó que entre las células seleccionadas para la evaluación de activación se observara, en ocasiones, hasta un 50% de células diferentes a basófilos 40.
Para la identificación de pacientes alérgicos a veneno de avispa y abeja se ha reportado que, aunque la sensibilidad de CD203c es ligeramente mayor que la de CD63 (97% vs. 89%), ambos marcadores resultan confiables para el diagnóstico de pacientes con alergia a las picaduras por estos himenópteros 88.
Conclusiones
La PAB ha mostrado tal confiabilidad clínica que se ha sugerido como sustituto in vitro de los retos orales para estimar la severidad de la alergia a alimentos como el maní, ofreciendo la ventaja que el diagnóstico se hace ex vivo, lo cual evita efectos adversos en el paciente. También se reconoce su utilidad en el diagnóstico de hipersensibilidad a medicamentos.
Dentro de las desventajas actuales del uso de la PAB está la falta de estandarización de la prueba entre laboratorios. Esto puede causar variabilidad en los resultados y dificultar la reproducibilidad de los hallazgos. Otras limitaciones en la práctica clínica son la accesibilidad y su alto costo; no obstante, se espera que en un futuro la PAB se posicione como prueba diagnóstica de alergia en casos específicos en donde la superioridad es evidente.