Introducción
El hipotiroidismo congénito (HC) no reconocido y no tratado de manera adecuada es la primera causa de retraso mental prevenible en todo el mundo 1. Las hormonas tiroideas son imprescindibles para el desarrollo del sistema nervioso central y se requieren especialmente durante la vida fetal y la infancia temprana 2. La prevalencia de HC varía alrededor del mundo, presentándose 1 caso por cada 3 000-4 000 recién nacidos vivos 3,4. El Instituto Nacional de Salud (INS) de Colombia 10 define como un síndrome clínico y bioquímico que resulta de la disminución en la producción de hormonas tiroideas en el periodo crítico del neurodesarrollo; este produce lesiones permanentes en el desarrollo psicomotor por la alteración de migración, diferenciación y mielinización del sistema nervioso central y periférico 3,5, de ahí la importancia de iniciar de forma temprana el tratamiento para evitar las diferentes secuelas neurológicas 1.
La principal causa mundial y ambiental del HC es el déficit endémico de yodo 5,6. En Colombia se declaró la suficiencia de este elemento en el año 1998 por las campañas de yodación en alimentos como la sal, reglamentada por el Ministerio de Salud 5. En países con suplencia de yodo la mayoría de reportes obedece a problemas en la glándula tiroides, (hipotiroidismo primario) y se relaciona en cerca del 85% de los casos a disgenesia tiroidea 7, mientras que el 15% corresponde a alteraciones en la hormonogénesis e hipotiroidismo transitorio 1. Las alteraciones en hipófisis e hipotálamo (hipotiroidismo secundario y terciario) y la resistencia periférica a la hormona tiroidea ocurren con menor frecuencia 8,9.
El 95% de los neonatos afectados no presentan manifestaciones clínicas al nacimiento y solo el 5% restante puede desarrollar en el primer mes de vida fontanela posterior amplia, macroglosia, frialdad de piel, hernia abdominal, ictericia, hipotonia y problemas de alimentación 7,10. Por esta razón, es necesaria la realización del tamizaje neonatal universal con la hormona estimulante de la tiroides (TSH, por su sigla en inglés) como 10 establecen los consensos 1,8.
En Colombia, el tamizaje neonatal de HC 10 establece INS y se realiza en sangre de cordón umbilical teniendo en cuenta todos los aspectos técnicos para una excelente muestra 11. En caso de ser positivo, se realizan exámenes de TSH y T4 libre de sangre periférica para definir si es un caso de HC; cuando el diagnóstico es definitivo se busca su etiología y las alteraciones asociadas. Desde la implementación del tamizaje se han reportado incidencias de 1:536 recién nacidos a 1:3600 recién nacidos 5. Para el año 2012, también el INS estimó una cobertura del programa de tamizaje aproximada del 80.2%, reportándose 612 casos, de los cuales en 22 este no se realizó. Las mayores dificultades radican en no tener unificados centros hospitalarios regionales para el proceso, la no oportuna entrega de los resultados, las deficiencias de la salud pública y el no tener aún tamizaje neonatal universal 6-12.
El objetivo de este trabajo es describir la etiología, las características clínicas y su relación con el tamizaje neonatal, el tratamiento y la posterior discapacidad cognitiva del HC en una serie de casos de niños diagnosticados con este síndrome en Santander, Colombia.
Materiales y métodos
Se recolectó información de las historias clínicas de los pacientes diagnosticados con HC entre 1999 y 2013 y atendidos por el Servicio de Endocrinología Pediátrica del Hospital Universitario de Santander Empresa Social del Estado, institución pública de alta complejidad. El hospital aglutina la mayoría de los casos del departamento de Santander y el oriente colombiano; otros pocos son seguidos por instituciones privadas.
Se tomaron los datos demográficos como el lugar de nacimiento y la zonificación (rural o urbana) y las características clínicas del primer examen físico al momento del diagnóstico; el tamizaje se realizó del cordón umbilical con la TSH medida por método fluorométrico automatizado (Delphia) y se obtuvieron las pruebas confirmatorias de TSH y T4 libre (técnica de quimioluminiscencia para las dos), o los primeros resultados de estas pruebas encontrados. También se tuvo en cuenta la información de la historia perinatal y neonatal, otras enfermedades y malformaciones asociadas y los antecedentes familiares. Del mismo modo, se extrajeron datos sobre los estudios complementarios realizados (ultrasonografía o gammagrafía tiroidea y cálculo de edad ósea) y la fecha de inicio de tratamiento, que fue evaluada por la presencia o ausencia de secuelas neurológicas por la escala de Denver, además se realizó audiometria.
Se excluyeron las historias de pacientes con HC que tuvieran asociados otros síndromes genéticos y prematuros que pudieran sobreponerse o alterar la presentación clínica clásica del HC.
La base de datos se realizó y analizó en el programa Mcrosoft Excel 2013 mediante 16 variables (Figura 1 ). Las variables nominales se presentaron como porcentajes y proporciones; para su análisis se realizaron medias con su respectiva desviación estándar (σ).
Los pacientes se dividieron en tres grupos de acuerdo a la realización del tamizaje de cordón umbilical (tamizaje realizado con valor conocido, tamizaje realizado con valor desconocido y tamizaje no realizado o desconocido) y se compararon con la edad del diagnóstico de HC.
Aspectos éticos
Esta investigación se considera sin riesgo según el artículo 11, Parágrafo A de la resolución 8430 de 1993 para la investigación con seres humanos del Mnisterio de Salud de Colombia, esto dado que es una investigación documental de carácter retrospectivo, basada en la revisión de historias clínicas 13. El tratamiento de los datos personales y de la base de datos se realizó teniendo en cuenta los principios éticos de la Declaración de Helsinki 14. Además, el protocolo de investigación fue sometido a evaluación del Comité de Ética de la Universidad Industrial de Santander (CIENCI-UIS) y obtuvo su aval el día 19 de febrero de 2016 según consta en el acta No. 03.
Resultados
Se identificaron 59 casos de HC, de los cuales 37 (62.7%) eran de sexo femenino, con una relación mujer-hombre de 1.7:1. El 59.3% de los pacientes provenían del área urbana; Santander aportó 51 casos (86.4%), siendo 43 (72.8%) registrados en Bucaramanga. Las disgenesias tiroideas fueron responsables de 45 casos (76.2%) (Tabla 1).
Tabla 1 Clasificación etiológica de los casos de hipotiroidismo congénito.
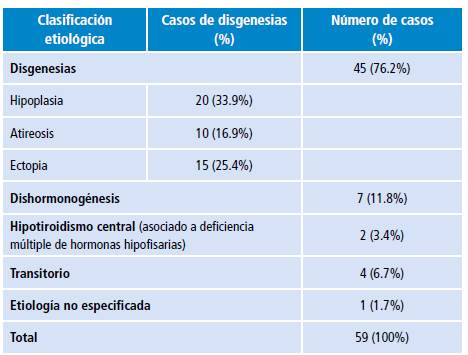
Fuente: Elaboración propia.
Se realizó el tamizaje neonatal en 29 casos (49.2%), en 17 se recuperó el valor y la edad media del diagnóstico fue 0.82 meses, σ: 0.74 (25 días); se diagnosticaron siete pacientes antes de las dos semanas de vida y dos casos tuvieron valores de TSH <15 mUI/mL, los cuales se consideraron falsos negativos; el diagnóstico de HC en estos pacientes se realizó al mes de nacimiento y a los 45 días y correspondían a sujetos con HC por ectopia y atireosis, respectivamente. En los otros 12 casos no se recuperó el valor del tamizaje, pero se obtuvo el primer valor de TSH en sangre total que permitió realizar el diagnóstico y se realizó entre las dos primeras semanas de vida y los 10 años de edad. La edad media de diagnóstico fue 16.2 meses (σ: 34.84).
En los 30 casos restantes (50.84%) no se realizó tamizaje neonatal; el diagnóstico se hizo posterior a las dos semanas de vida antes de los 16 años. La media de la edad del diagnóstico fue de 41.3 meses (σ: 53.02) y se diagnosticaron ocho pacientes entre los 6 y los 16 años.
En los casos de ectopia tiroidea se encontraron cuatro (6.7%) casos de tiroides lingual de forma tardía; el diagnóstico de dishormonogénesis fue hecho por características clínicas como bocio al nacer, consanguinidad y valores bajos de tiroglobulina; para el hipotiroidismo transitorio fue un diagnóstico retrospectivo al no tener posibilidades de medir anticuerpos bloqueantes maternos y por la evolución clínica y de los valores de T4 Libre y TSH después de los tres años.
En cuanto a malformaciones por sistemas, cinco niños (8.47%) nacieron con malformaciones cardíacas y se encontró un caso de riñón poliquístico.
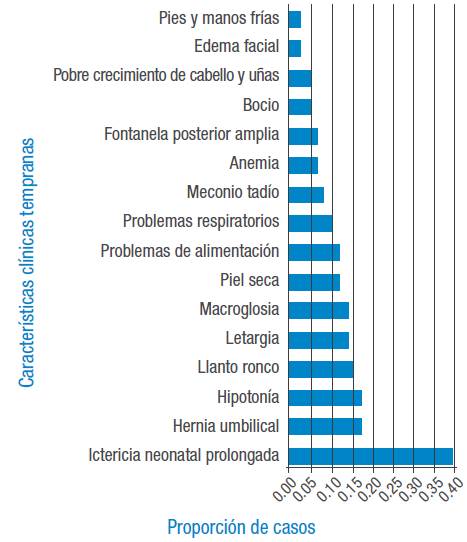
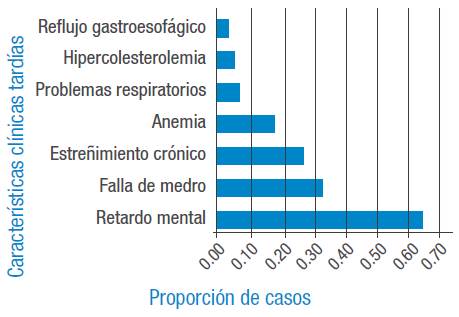
Las principales características clínicas tempranas consideradas antes de tres meses se encuentran en la Figura 1. La relación entre las principales características se encuentra en la Figura 2.
En cuanto a la secuela tardía más importante, 38 pacientes (64.4%) desarrollaron retraso mental o disfunción cognitiva; en estos se realizó tamizaje a nueve casos, pero su valor solo fue conocido en tres. Se registran dos casos de falsos positivos por errores humanos y la etiología del HC era una atireosis y una hipoplasia. En la serie de casos no se encontró ninguno de hipoacusia. La Figura 2 resume los otros signos y síntomas de presentación tardía.
Se realizó ecografía tiroidea a 36 pacientes (67.9%) y gammagrafía tiroidea a 17 (32%), lo que ayudó a clasificar su etiología (Tabla 1).
En 28 pacientes se encontró información de la maduración ósea (en recién nacidos presencia del núcleo distal de fémur y de proximal de la tibia), la cual estaba atrasada en 22 pacientes (78.5%). A los restantes no se les realizó estudio de edad ósea porque el diagnóstico fue muy tardío y por lo tanto el examen perdía utilidad clínica. Fue posible recuperar la edad de inicio del tratamiento en 56 pacientes (94.91%); de ellos, 47 (76.6%) iniciaron tratamiento con medicamentos comerciales.
Discusión
Los niños a quienes no se les realizó tamizaje neonatal, o este fue desconocido, desarrollaron retraso mental en el 64.4% de los casos y el 40% presentó ictericia neonatal prolongada. En la serie, la hipoplasia fue la causa más frecuente de HC.
El inicio del tratamiento, tan pronto como se establezca un diagnóstico de HC, es esencial para el neurodesarrollo del niño, pues la discapacidad mental es costosa para el individuo, la familia y el sistema de salud 8,15,16. Esta situación debe alertar a las autoridades sanitarias coordinadas por el INS para que aumenten la cobertura del programa de tamizaje neonatal y la socialización del mismo y para que revisen las posibles fallas en los protocolos de atención, como la falta de ajuste de caso y la pérdida de información del paciente 12. Las metas de este y de todos los programas de tamizaje de HC deben incluir no solo la detección de los pacientes, sino también el suministro de tratamiento oportuno en las dos primeras semanas de vida, tal como lo reportan Bongers-Schokking et al.17. Este tratamiento debe incluir terapia farmacológica y física y apoyo familiar.
Aun cuando el tamizaje neonatal es confiable, existen falsos negativos en la prueba que en su mayoría se presentan por errores humanos, por lo que a futuro se recomienda hacer tamizaje junto con T4 libre e incluso durante el embarazo 8; otras causas son los partos gemelares, la dishormonogénesis, el hipotiroidismo central y las ectopias de grueso volumen 18,19. También existen ciertas condiciones en que las concentraciones de TSH pueden estar en rango normal o bajo, como el hipotiroidismo central, el déficit de la proteína de unión de tiroxina y la hipotiroxinemia 1,20. En el caso de los recién nacidos pretérmino, los niños con síndrome de Down y aquellos con muy bajo peso al nacer -poblaciones en las que la incidencia de HC es mayor en comparación con la población general 21,22-, la Sociedad Europea de Endocrinología Pediátrica recomienda repetir el tamizaje dos semanas después de su nacimiento o de la toma de la primera prueba 8 por el alto riesgo de falsos negativos
Al nacimiento, la mayoría de los niños afectados no muestran signos ni síntomas llamativos 10 y suelen presentar peso y talla normal 23. En esta serie, la ictericia neonatal prolongada es el signo temprano más frecuente, seguido por la hipotonía y la hernia umbilical. Estos datos difieren con otros estudios: Ohira et al.4 mostraron en Santa Catarina, Brasil, que el HC se asociaba en un 48.9% con hernia umbilical y en un 44.4% con ictericia neonatal; también en Brasil, Palhares et al.23 reportaron ictericia neonatal en el 50%, mientras que el resto de la muestra no presentó signos clínicos; Grob & Martínez-Aguayo 24 citan en Chile la presencia de una fontanela posterior >5 mm, hernia umbilical y piel seca, mientras que en México Sánchez-Pérez et al.25 reportaron fontanela posterior amplia, hernia umbilical e ictericia prolongada como los signos más frecuentes. Por lo tanto, y ante la heterogeneidad de sintomatología o la ausencia de esta, el tamizaje debe ser universal.
En cuanto a la etiología, la mayoría de los casos se debieron a disgenesias tiroideas, pero se encontró que la mayoría correspondía a hipoplasias tiroideas. Estos datos difieren a algunos informes que citan la ectopia tiroidea como el hallazgo más común 6-8, con una incidencia alta de 1 en 5 700 nacimientos 25,26. No está clara la razón, por lo que se requieren más estudios en el país, ya que quizás existen condiciones genéticas asociadas. Cada vez es más importante realizar ecografías doppler de la glándula tiroidea para hallar el diagnóstico etiológico, como lo sugiere el consenso; en la serie descrita el 68% de los casos fueron confirmados por ecografía y gammagrafía.
Las dishormonogénesis se mantienen como la segunda causa de HC, seguida del hipotiroidismo transitorio e hipotiroidismo central. La incidencia de HC transitorio varía a nivel mundial, siendo más común en Europa (1/8000) que en América (1/60000) 7. En una serie de 13 casos en Turquía, seis fueron hipotiroidismos transitorios 27 y cuatro fueron diagnosticados de manera retrospectiva dado que no fue posible realizar la medición de anticuerpos. En cuanto al hipotiroidismo central, 75-80% pueden tener alteraciones en la producción de otras hormonas de la hipófisis anterior 20; en la presente serie de casos la deficiencia de TSH se encontró asociada a deficiencia de prolactina y hormona del crecimiento.
La principal fortaleza de este estudio es el tamaño de muestra, el cuál abarca pacientes nacidos desde 1999 hasta 2013. Sin embargo, al ser retrospectivo y basarse solo en la información contenida en la historia clínica sin unificar la información, se pudo haber incurrido en el subregistro de algunos datos. Se encontró un número importante de malformaciones asociadas (10%), la mayoría de ellas cardíacas, por lo que ante un caso de HC se debe descartar su coexistencia 8.
Dentro de las debilidades de la presente investigación está el no tener todos los casos del departamento centralizados en el hospital para obtener incidencia en la región y no haber obtenido en todos los casos las ayudas de imagen y los tiempos exactos de inicio de tratamiento para asociarlo con el retraso mental. El objetivo de este estudio no fue determinar la sensibilidad ni la especificidad de los signos y síntomas clínicos, por lo que se pueden plantear estudios de cohortes que tengan dicho propósito. A futuro se espera realizar el estudio genético de los casos de dishormonogénesis y determinar porqué en Santander las hipoplasias tiroideas son más comunes que las ectopias tiroideas.
Conclusiones
El tamizaje neonatal universal y con controles periódicos de calidad de la prueba es la herramienta que permite realizar de manera oportuna el diagnóstico de HC y su tratamiento. En Colombia, la ictericia neonatal prolongada debe alertar un posible caso de HC. Se requieren estudios genéticos para determinar porqué en Santander las hipoplasias tiroideas son más comunes que las ectopias tiroideas. Asimismo es importante educar a todos los profesionales de la salud para evaluar de forma temprana el resultado del tamizaje con TSH.