Introducción
La enfermedad de Kawasaki corresponde a una vasculitis sistémica que en la mayoría de los casos afecta el árbol coronario 1-4. Su etiología es desconocida, pero se cree que tiene un origen infeccioso y que afecta a individuos genéticamente susceptibles 5. La enfermedad es más frecuente en el género masculino en relación aproximada de 1.5:1 5 y afecta principalmente a niños entre 6 meses y 5 años de edad, con un pico de incidencia alrededor de los 9-11 meses 6-8. Las formas recurrentes representan cerca del 2% de los casos 5.
La incidencia anual de la enfermedad se ha estimado en 4-5 por cada 100 000 menores de 5 años para Europa y EE. UU., mientras que alcanza los 113-216 por cada 100 000 menores de 5 años en Japón, 113 por cada 100 000 menores de 5 años en Corea, 39-55 por cada 100 000 menores de 5 años en China y 69 por cada 100 000 menores de 5 años en Taiwán 5,8,9. En Latinoamérica su incidencia no está del todo establecida, pero se considera que se encuentra alrededor de 3 por cada 100 000 menores de 5 años 9.
La enfermedad de Kawasaki constituye la segunda causa más frecuente de vasculitis durante la infancia después de la púrpura de Henoch-Schönlein y es la principal causa de cardiopatía adquirida en niños en países desarrollados 10. Un porcentaje importante de los pacientes con esta enfermedad desarrollan aneurismas coronarios, reportándose valores que oscilan entre el 10-25% de los pacientes no tratados y el 2-15% tratados, según las distintas series 11-18.
El tratamiento conjunto con inmunoglobulina más aspirina a dosis relativamente altas resuelve la inflamación y reduce significativamente la incidencia de aneurismas coronarios 19,20. Sin embargo, un porcentaje significativo de los pacientes no responde al tratamiento inicial y tiene un mayor riesgo de formación de aneurismas, a menos que se administre tratamiento adicional 10. En este sentido, el objetivo del presente artículo es responder a la pregunta ¿Cuáles son las opciones de tratamiento farmacológico en paciente con enfermedad de Kawasaki?
Materiales y métodos
A junio de 2018, se realizó una búsqueda estructurada de la literatura en las bases de datos EBSCO, ScienceDirect, PubMed, LILACS, Embase, SciELO y Cochrane Library con los términos "Kawasaki disease AND therapeutics", "Kawasaki disease AND treatment" y "Mucocutaneous Lymph Node Syndrome AND therapeutics", tanto en inglés como en español.
En función de determinar las recomendaciones de tratamiento, se incluyeron guías de manejo, revisiones sistemáticas con o sin metaanálisis y ensayos clínicos publicados en los últimos 10 años (2008-2018). Se desestimaron estudios de cohorte, casos y controles; series y reportes de casos; artículos de revisión narrativa; editoriales, y cartas al editor.
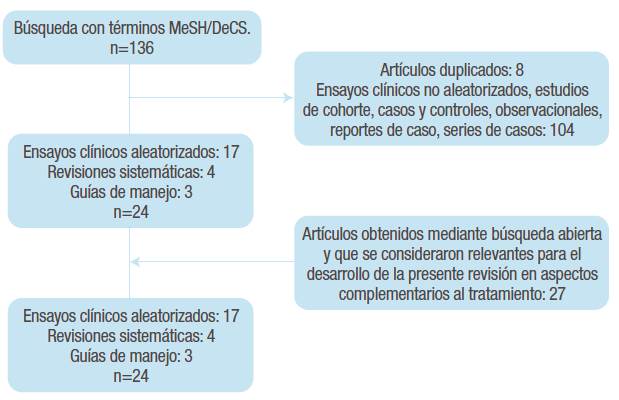
De forma secundaria, se realizó una segunda búsqueda sin limitación cronológica ni del nivel de evidencia para identificar información relevante, diferente a las recomendaciones de tratamiento pero necesaria para el desarrollo de la presente revisión. En cualquier caso, la calidad de la evidencia se valoró de forma independiente por dos coautores mediante la aplicación de un instrumento para lectura crítica: Critical Appraisal Skills Programme Español (CASPe). La inclusión o exclusión de cada una de las referencias en la presente revisión se definió por el consenso de dos coautores, mientras que las decisiones dispares fueron resueltas por un tercer coautor (Figura 1).
Resultados
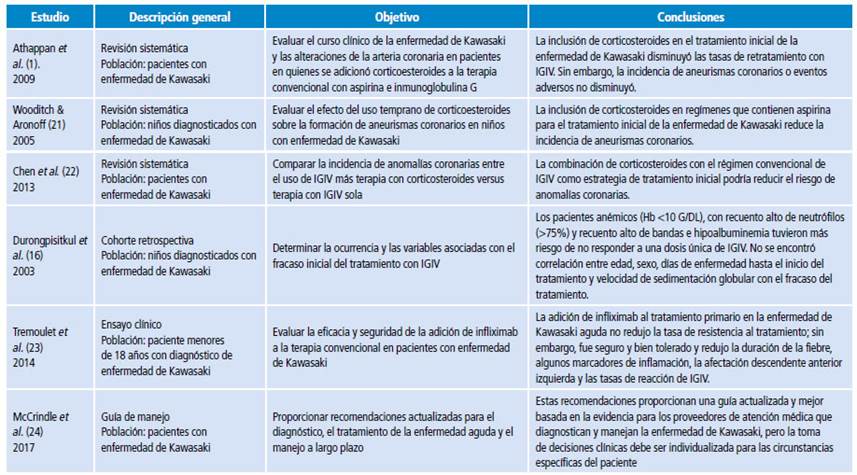
Se encontraron 51 artículos con información relevante para el desarrollo de la presente revisión, 24 referentes al tratamiento que incluyen 4 revisiones sistemáticas, 17 ensayos clínicos y 3 guías de manejo. La Tabla 1 resume las características más relevantes de los principales estudios incluidos.
Discusión
A continuación, se presenta una síntesis de la evidencia respecto al tratamiento farmacológico de la enfermedad de Kawasaki.
Tratamiento de la enfermedad de Kawasaki
El objetivo del tratamiento es reducir la respuesta inflamatoria para prevenir la presentación de anomalías coronarias 23-29.
Ácido acetilsalicílico (ASA)
La administración del ASA debe realizarse de manera conjunta con inmunoglobulina. Se recomienda la administración de 30-50 mg/kg/día, con mejor tolerancia gastrointestinal 10. Un metaanálisis que comparó el uso de ASA a dosis intermedias de 30-50 mg/kg/día con dosis altas de 80-120 mg/kg/día -ambas asociadas al uso conjunto de inmunoglobulina-, no encontró diferencia significativa en la incidencia de aneurisma arterial coronario entre ambos grupos 8,10. Después de la defervescencia la dosis puede reducirse a 2-5 mg/ kg/día en dosis única para mantener el efecto antiagregante. El uso concomitante de ibuprofeno durante el tratamiento con ASA debe evitarse, ya que puede antagonizar la función antiagregante del salicilato 30.
Inmunoglobulina
La administración de la terapia combinada con ASA e inmunoglobulina a dosis altas reduce el riesgo de aparición de aneurisma arterial coronario a 9% por 30 días y 4% por 60 días después de la instauración de la enfermedad. El efecto protector es dependiente de la dosis de gammaglobulina e independiente de la dosis de ASA utilizada 19. La prevalencia de la complicación coronaria es inversamente proporcional a la dosis total de inmunoglobulina utilizada, siendo la dosis óptima de 2 g/kg 31,32. Una única infusión de 2 g/kg endovenosos resuelve el cuadro febril en 85-90% de los casos antes de 26 horas 25,33. La inmunoglobulina debe administrarse preferiblemente entre 5 y 10 días después del inicio de la fiebre, o en cualquier término si persiste la elevación de los reactantes de fase aguda 34.
Enfermedad de Kawasaki resistente a inmunoglobulina
Cerca del 15-25% de los pacientes con enfermedad de Kawasaki no responden al manejo inicial con inmunoglobulina y tienen riesgo aumentado de padecer aneurismas coronarios, a menos que reciban tratamiento adicional 35,36.
Se considera como enfermedad de Kawasaki resistente a inmunoglobulina a la ausencia de respuesta clínica favorable tras la administración del tratamiento con esquema de inmunoglobulina en al menos dos ocasiones 8. Existen varias escalas para la valoración del riesgo de resistencia a este tratamiento que fueron desarrolladas a partir de poblaciones asiáticas. Con distintos criterios y puntos de corte para definir el alto riesgo de resistencia, todas presentan una especificidad cercana al 85-87%, pero tienen baja sensibilidad (<45%) y no han sido validadas en otras poblaciones 37.
Algunos predictores propuestos para la resistencia al tratamiento con inmunoglobulina son valores de sensibilidad y especificidad que varían en función de valores de corte 38. De acuerdo con Xie et al.38, un valor de proteína C reactiva (CRP) tiene una sensibilidad del 65.52% y una especificidad del 62.7% para la predicción de resistencia cuando se alcanzan valores >100 mg/L. De forma similar, valores de albúmina <3.2 g/dL tienen como sensibilidad y especificidad la predicción de resistencia de 72% y 83.19%, respectivamente. También se ha involucrado al propéptido natriurético cerebral (NT-proBNP), el cual ha mostrado una sensibilidad de 73.91% y una especificidad de 76.43% con punto de corte de >1300 pg/mL. Asimismo, niveles de interleucina-6 tienen una sensibilidad de 76.19% y una especificidad de 61.59% con valores >45 pg/mL. La velocidad de sedimentación globular (VSG) ha mostrado una sensibilidad del 53.26% y una especificidad del 64.14% para la predicción de resistencia a inmunoglobulina, con un punto de corte de 75 mm/h 38.
En pacientes con formas no clásicas (o incompletas) de Kawasaki, valores de hemoglobina <11 g/L tienen una sensibilidad y especificidad del 80% y 54.1%, respetivamente, para la predicción de resistencia. De forma similar, un porcentaje de neutrófilos >70% tiene sensibilidad del 68% y especificidad del 66.94%. Los niveles VSG tienen una sensibilidad del 70.83% y una especificidad del 65.81% para predecir la resistencia, con un punto de corte >80 mm/h, mientras que los niveles de NT-proBNP tienen una sensibilidad de 78.57% y una especificidad de 56.67% con un punto de corte >360 pg/mL. Además, valores de interleuquina-6 exhiben una sensibilidad de 70.59% y una especificidad de 66%. Los niveles de interleucina-10 tuvieron una sensibilidad del 64.71% y una especificidad del 74.42% para un valor de corte >8 pg/mL 38.
Corticosteroides
No es claro si el empleo de corticosteroides en la enfermedad de Kawasaki disminuye la duración del proceso febril, mejora los resultados de marcadores inflamatorios y disminuye la estancia hospitalaria 39-43. El metaanálisis de Athappan et al.1 encontró que la utilización combinada de corticosteroides e inmunoglobulina en el tratamiento inicial de la enfermedad de Kawasaki disminuye la tasa de falla en el tratamiento y la necesidad de retratamiento con inmunoglobulina (OR: 0.48, IC95%: 0.24-0.95) 1.
En contraste, el metaanálisis de Wooditch & Aronoff 21 encontró que la terapia combinada disminuye la incidencia de la lesión arterial coronaria (OR: 0.546; IC95%: 0.371-0.803). Este mismo estudio comparó el uso de ASA más inmunoglobulina más corticosteroides con el uso de ASA más inmunoglobulina; sin embargo, la conclusión estuvo limitada por la baja calidad y el diseño del estudio 4.
Por su parte, el metaanálisis de Chen et al.22 encontró que la adición de corticoide a la inmunoglobulina en el tratamiento inicial de la enfermedad tiene ventaja para la reducción de complicaciones coronarias, en comparación con el uso de inmunoglobulina sola (OR: 0.3, IC95%: 0.20-0.46), sin un aumento significativo de la frecuencia de efectos de adversos 22.
Dos ensayos clínicos aleatorizados 19,37 han estudiado la utilidad de los corticosteroides en los pacientes con alto riesgo de resistencia a la inmunoglobulina en enfermedad severa (definida mediante escalas de riesgo), con resultados discrepantes. Kobayashi et al.19, en el estudio RAISE realizado en Japón, encontraron que la terapia primaria con corticosteroides e inmunoglobulina disminuye la incidencia de anomalías coronarias en comparación con inmunoglobulina sola; en contraste, los hallazgos de Sleeper et al.37 plantean que la terapia conjunta inicial no mejoró los resultados coronarios.
Bajo la actual perspectiva, se recomienda el tratamiento con corticosteroides en los siguientes casos: i) enfermedad de Kawasaki que no responde a un primer curso de tratamiento con inmunoglobulina, ii) enfermedad de Kawasaki resistente a inmunoglobulina, iii) enfermedad de Kawasaki severa y iv) enfermedad de Kawasaki con cambios ecocardiográficos tempranos.
No existe consenso acerca de la dosis y el tiempo de tratamiento con corticosteroide. Algunos autores recomiendan una dosis de 30 mg/kg una vez al día por 1-3 días y estudios recientes muestran buenos resultados en los pacientes con enfermedad de Kawasaki con alto riesgo de lesión coronaria cuando se combina inmunoglobulina intravenosa con prednisolona a 2 mg/kg sosteniéndola hasta que la PCR se normaliza 19,44. De cualquier forma, se recomienda vigilar la posible aparición de adversos como hipertensión, infección secundaria, hiperglicemia y necrosis ósea 10.
Antagonistas del factor de necrosis tumoral alfa (FNT-α1)
El infliximab es un anticuerpo monoclonal de la inmunoglobulina G1, específico contra el FNT-α1 45, que produce una rápida resolución del cuadro agudo, pero no se ha demostrado que disminuya la incidencia de la lesión coronaria 46. A pesar de esto, se le considera una alternativa solo o en adición a los corticosteroides en los casos resistentes a inmunoglobulina, en tratamiento conjunto con esta última. La dosis recomendada es de 5 mg/kg 47. El etanercept es otra alternativa dentro de los antagonistas del TNF-α, aunque la evidencia es aún más insuficiente para recomendar su uso; estudios en curso han encontrado una mejoría en las escalas de afectación de las arterias coronarias 48.
Otras terapias
En casos refractarios se ha administrado ciclofosfamida, metotrexate, ciclosporinas, plasmaferesis, ciclofosfamida y abciximab; estos medicamentos se han utilizado como terapia adicional y han logrado disminuir la duración de la fiebre, mejorar los parámetros inflamatorios de los exámenes de laboratorio y disminuir las citoquinas proinflamatorias 49,50. Su administración puede ser considerada como último recurso en pacientes con enfermedad de Kawasaki refractaria al tratamiento con inmunoglobulina, esteroides e infliximab 24.
Complicaciones y pronóstico
La principal complicación de la enfermedad de Kawasaki es la aparición de aneurismas coronarios, aunque cerca del 50% de las lesiones sufren regresión antes de cinco años. En la mayoría de las anomalías leves (3-4mm) la regresión se produce dentro de los dos primeros años, mientras que es muy raro que los aneurismas gigantes (>8mm) resuelvan; algunos de estos últimos pueden desarrollar estenosis con riesgo aumentado de trombosis coronaria, infarto de miocardio y muerte súbita 8.
Entre los factores de riesgo para el desarrollo de lesión arterial coronaria se incluyen la enfermedad de Kawasaki incompleta, la ausencia de respuesta al tratamiento con inmunoglobulina endovenosa, la fiebre persistente y algunas variaciones del gen PELI151. Otros factores de riesgo para el desarrollo de aneurismas coronarios incluyen historia familiar de enfermedad de Kawasaki, edad ≤1 año, género masculino, fiebre ≥14 días, hemoglobina ≤10 g/dL, hematocrito ≤35%, leucocitosis ≥30 000 cel/mm3, recuento plaquetario ≥350 000, eritrosedimentación ≥101 mm/h, sodio sérico ≤135 mEq/L y albúmina sérica ≤3 g/L 27.
En síntesis, la enfermedad de Kawasaki constituye una causa importante de morbilidad cardiovascular, por lo que un diagnóstico y tratamiento oportuno es fundamental para la prevención de sus complicaciones, en especial dilataciones de la vasculatura coronaria, infartos de miocardio subsecuentes y muerte súbita. En todo caso, la mejor evidencia se inclina al tratamiento de primera línea, consistente en la administración de terapia combinada de ASA más inmunoglobulina G, el cual tiene efecto comprobado sobre la disminución de la inflamación y la reducción de la incidencia de aneurismas coronarios 31,32. El mecanismo, se cree, incluye la reducción de la producción de citoquinas inflamatorias, la neutralización de superantígenos bacterianos u otros agentes etiológicos, el aumento de la actividad de las células T supresoras, la reducción de la producción de óxido nítrico por parte de los neutrófilos y el bloqueo de receptores de la fracción cristalizable (Fc), entre otros efectos 21.
Evidencia de primer nivel sugiere que la adición de corticoesteroides al tratamiento convencional parece ser segura, pues disminuye la tasa de fallo y retratamiento con inmunoglobulina G y la incidencia de anomalías coronarias; sin embargo, algunos estudios han mostrado limitaciones metodológicas que impiden generalizar su uso, quedando indicados a criterio clínico en los casos con escasa respuesta o refractarios a inmunoglobulina, en enfermedad severa y ante la presencia de anomalías ecocardiográficas tempranas, sin que exista una pauta de tratamiento bien definida 1,42,43.
Por su parte, el infliximab parece constituir una alternativa de manejo para los casos resistentes a la inmunoglobulina, aunque no se ha comprobado su eficacia y se necesitan más estudios para recomendar su uso 45-48. Asimismo, la evidencia de los demás fármacos inmunosupresores utilizados en otros tipos de vasculitis es insuficiente para recomendar su uso rutinario en la enfermedad de Kawasaki.
Conclusiones
El pilar de tratamiento de la enfermedad de Kawasaki es la administración de ASA más inmunoglobulina G. La evidencia, aunque limitada, parece orientarse en favor de los corticoesteroides para el tratamiento de formas severas, refractarias a inmunoglobulina G y de rápida progresión. Las demás alterativas, incluyendo los antagonistas del factor de necrosis tumoral alfa y otras terapias inmunosupresoras, se reservan para casos sin respuesta a tratamiento convencional, sin que exista evidencia en favor de su uso en términos de seguridad y eficacia.