Introducción
El hígado juega un papel importante en la homeostasis lipídica, en especial en la síntesis de ácidos grasos y triglicéridos (TG) y en la producción de lipoproteínas plasmáticas que aseguran el transporte de lípidos endógenos y exógenos entre los órganos 1,2.
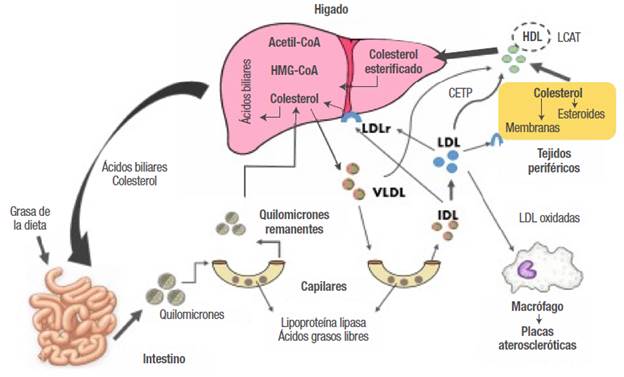
Una de las funciones del hígado es la síntesis de colesterol a través de una amplia serie de reacciones, entre las cuales se generan interacciones con los tejidos periféricos y el intestino; su equilibrio es regulado por mecanismos de retroalimentación entre las vías endógena y exógena 3. La inhibición de absorción de colesterol intestinal aumenta la actividad de la hidroximetilglutaril coenzima A reductasa (HMG-CoAR) intensificando su síntesis en el hígado 4. En cambio, una captación intestinal elevada de colesterol inhibe la HMG-CoAR, reduce la síntesis hepática y produce una regulación negativa de los receptores de las lipoproteínas de baja densidad (LDLr), lo que reduce la captación de lipoproteínas de baja densidad (LDL) 5. Por el contrario, cuando existe una disminución en las concentraciones de colesterol, los LDLr son regulados al alza y dan lugar a un aumento de la eliminación de partículas de LDL de la sangre 3,5 (Figura 1 ).
Los lípidos plasmáticos (TG, ésteres del colesterol, fosfolípidos y colesterol libre) deben ser transportados por lipoproteínas. Los lípidos de la dieta (vía exógena) son absorbidos en el intestino por los quilomicrones; luego, los quilomicrones se someten a lipólisis rápida por parte de la lipoproteína lipasa (LPL), un proceso que elimina algunos de los TG y deja pequeños remanentes de quilomicrones que internalizan el resto de los lípidos de la dieta al hígado. En la vía endógena, el hígado utiliza los remanentes de quilomicrones, lípidos y colesterol endógeno para producir las partículas de VLDL (lipoproteínas de muy baja densidad) (Figura 1). Las VLDL son lipoproteínas ricas en TG que contienen entre 10-15% del colesterol plasmático, fosfolípidos y un conjunto característico de apolipoproteínas: Apo B-100, Apo C-I, Apo C-II, Apo C-III y Apo E. Estas lipoproteínas son transportadas por la sangre desde el hígado hasta el músculo y el tejido adiposo, donde la LPL se activa gracias a la Apo C-II, hidrolizando los TG de las VLDL y liberando ácidos grasos libres que pueden ser almacenados por los adipocitos 6,7. Las LDL que han sido sintetizadas en el hígado tienen una concentración alta de colesterol y moderada de fosfolípidos y no contienen TG. Su apolipoproteína asociada de mayor importancia es Apo B-100, indispensable para unirse al LDLr 3,8. El desequilibrio entre estas vías de síntesis y degradación se encuentra asociado con el desarrollo de diferentes enfermedades cardiovasculares y metabólicas 7,8.
Una amplia variedad de modelos celulares ha sido utilizada para investigar el metabolismo hepático. Estos modelos ofrecen la oportunidad de estudiar detalles específicos de los mecanismos bioquímicos como el metabolismo lipídico y de glucosa, la respuesta toxicológica frente a fármacos, la expresión de proteínas relacionadas con el metabolismo, el mecanismo de invasión viral, las vías de señalización o la inhibición de proteínas a través de ARN de interferencia 9. Sin embargo, las células primarias son inherentemente desafiantes, en particular en su obtención y su aislamiento 10; a pesar de ello, los hepatocitos primarios son considerados como el mejor modelo in vitro para estudiar el metabolismo de lípidos y glucosa 1.
Las metodologías de cultivo de células aisladas de hígado humano han sido mejoradas en los últimos años; en la actualidad, una variedad de estrategias de aislamiento, cultivo y criopreservación se han establecido y evaluado. Sin embargo, la viabilidad de estas células sigue siendo baja en contraste con las líneas celulares inmortalizadas de hepatomas; estas últimas tienen capacidad de biotransformación, una característica crucial en estudios toxicológicos y metabólicos 9,11.
El desarrollo de los modelos celulares hepáticos permite explorar el metabolismo de los lípidos en el hígado humano y, con ello, el desarrollo y progresión de las enfermedades relacionadas 12. Se ha trabajado en varias líneas celulares hepáticas para establecer modelos de acumulación de lípidos usando ácidos grasos saturados e insaturados de forma individual o combinados 11,13. En la mayoría de los estudios, el ácido graso que se ha adicionado al medio de cultivo ha sido el ácido oleico (ácido graso monoinsaturado, de 18 carbonos, que presenta la insaturación en el carbono 9, conocido como omega 9 y presente en alimentos como el aceite de oliva o el aguacate), esencial para la producción de los TG, siendo menos lipotóxico que el ácido palmítico (ácido graso saturado de cadena larga, de 16 carbonos, el principal ácido graso de la dieta y presente en las carnes y en las grasas lácteas) 14.
Las ventajas de los modelos inmortalizados comparados con los cultivos primarios de hepatocitos humanos son: crecen continuamente, tienen vida útil ilimitada y su fenotipo es bastante estable. Además, es fácil disponer de ellos y sus condiciones de cultivo son más simples. Incluso, algunos hepatomas retienen (en parte) un diferenciado fenotipo adulto. De esta forma, los modelos celulares hepáticos poseen un alto potencial para proveer una plataforma de investigación del metabolismo de lípidos, así como de agentes farmacológicos o principios activos que permitan la reducción de la acumulación de TG a nivel intracelular 10.
El objetivo de esta revisión es comparar algunos modelos celulares hepáticos utilizados para el estudio del metabolismo lipídico, sus características y los resultados más relevantes de investigación en ellos, para establecer cuál de ellos ofrece mejores características para posteriores estudios.
Materiales y métodos
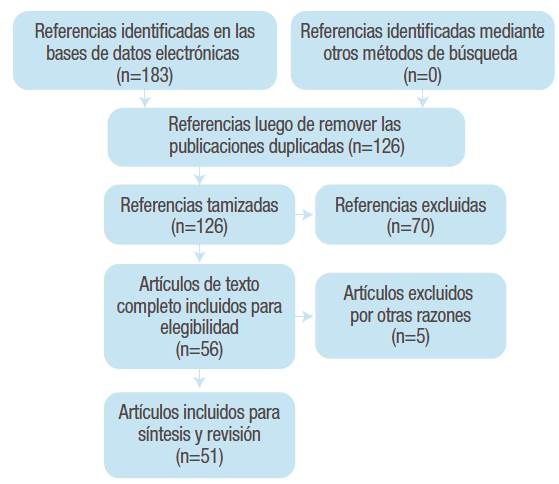
Se realizó una búsqueda de artículos científicos relacionados con modelos celulares y metabolismo de lípidos publicados en las bases de datos PubMed, ScienceDirect, Google Scholar y SciElO. La búsqueda fue realizada entre noviembre de 2016 y abril de 2017 y tuvo en cuenta artículos publicados desde enero de 2006 hasta abril de 2017, excepto para los artículos que trataban sobre el origen del modelo celular. Se incluyeron textos completos de investigaciones originales o revisiones, en idioma inglés y español y que contuvieran las siguientes palabras clave y sus posibles combinaciones: "lipid metabolism" and "modelo celular hepático (HepG2, HepaRG, Huh-7, primary hepatocytes, IHH)" and "tipo de sustrato (oleic acid, palmitic acid)". Los criterios de exclusión para la selección de los artículos fueron: estudios publicados en otros idiomas, estudios que utilizaran otros sustratos de inducción de síntesis de lípidos y estudios donde solo se evaluara la esteatosis hepática. Al final, 51 artículos cumplieron con los requisitos para ser incluidos en la revisión (Figura 2.).
Resultados
Se identificaron 51 referencias, de las cuales 36 correspondieron a artículos originales de texto completo y 15 a revisiones bibliográficas. La mayor proporción de los documentos estaban relacionados con el modelo celular HepG2 (62%) y la menor proporción (6%) con el modelo de hepatocitos primarios. De las referencias seleccionadas, 48 estaban escritas en inglés y 3 en español.
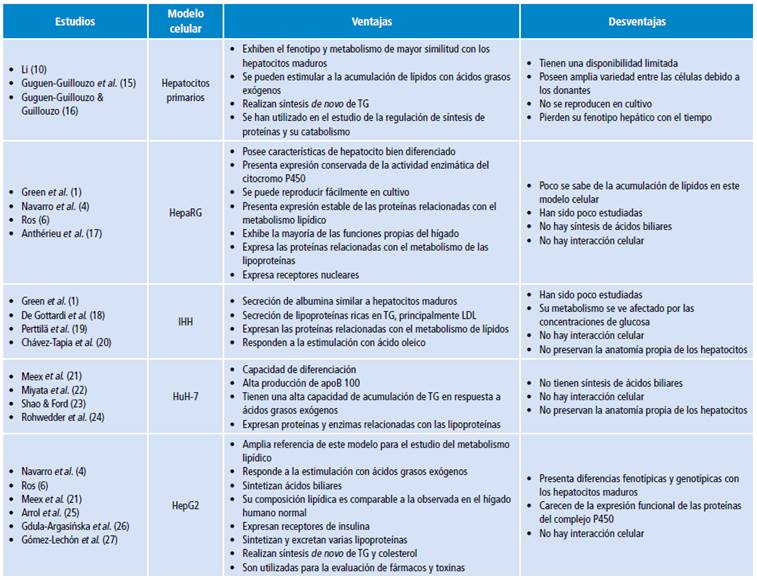
En la Tabla 1 se resumen las ventajas y desventajas de los modelos celulares utilizados para el estudio del metabolismo lipídico, notándose que la selección del modelo celular depende de las necesidades de la investigación y de la condición que se desea evaluar. No obstante, podríamos decir que el modelo celular HepG2 presenta la mejor estabilidad y es el más caracterizado en el estudio del metabolismo de los lípidos.
Discusión
Se evidenció que una considerable variedad de modelos celulares ha sido usada para estudiar el metabolismo de los lípidos a nivel hepático, siendo el metabolismo del colesterol y de las lipoproteínas lo que más ha captado el interés. A pesar de que estos modelos celulares ofrecen la oportunidad de estudiar detalles específicos de un proceso metabólico en particular, no hay que pasar por alto que presentan limitaciones inherentes como la perdida de capacidades reguladoras de división celular, algunas modificaciones genéticas o fenotípicas que alteraran su capacidad de comunicación celular o su propio metabolismo y el estar en un ambiente aislado y controlado, lo que cambia la capacidad de interacción y respuesta celular. A continuación se mencionan las características de los modelos celulares hepáticos más utilizados para elucidar el proceso de síntesis, asimilación y excreción de los lípidos encontrados en esta revisión.
Hepatocitos primarios
Uno de los modelos in vitro para el estudio de los mecanismos que controlan el metabolismo de lípidos y glucosa en humanos es el de hepatocitos primarios 1,28. Desafortunadamente, existe una disponibilidad limitada del tejido de hígado humano para el aislamiento celular, además de una amplia variabilidad entre los donantes de este tejido 15,16,29. A pesar de los esfuerzos en optimizar las condiciones de cultivo, estas células aisladas pierden su fenotipo hepático de forma irreversible y su capacidad proliferativa es bastante limitada 16,30.
Los hepatocitos primarios pueden ser obtenidos de un hígado completo o una porción de este. En la actualidad, los hepatocitos humanos son aislados de hígados no aptos para trasplante y sobre todo de fragmentos de hígados con tumores primarios o con algunas otras enfermedades hepáticas 31. Los hepatocitos aislados frescos exhiben la mayoría de las funciones de los hepatocitos humanos maduros en vivo, pero han perdido los dominios especializados de membrana, tales como los de uniones intercelulares (canalículos biliares), y no sobreviven más de unas pocas horas en suspensión 16.
Los hepatocitos primarios son considerados el modelo celular ideal para el estudio del metabolismo lipídico hepático debido a que muestran un comportamiento similar a las células del hígado in vivo10. Estas células muestran una acumulación intracelular de TG similar a la observada en hígado humano in vivo cuando se exponen a ácidos grasos 10. La acumulación de estos TG a nivel extracelular está directamente relacionada con la entrada y secreción de los mismos, a la vez que tiene una relación directa con la tasa de secreción de las lipoproteínas encargadas de transportar TG. Se ha demostrado que los hepatocitos humanos responden a la suplementación con ácidos grasos, incrementando la síntesis de TG y la secreción de VLDL sin ningún cambio en la abundancia de la apoB 10, indicando que la síntesis de novo es funcionalmente activa en este modelo celular.
Células HepaRG
Estas células son uno de los principales modelos para el estudio del metabolismo lipídico y una línea celular obtenida de tumor de hígado (carcinoma de una paciente femenina quien sufrió de hepatocarcinoma y hepatitis C) 32; además muestran características de un hepatocito bien diferenciado 2. Esta línea se compone de una población celular homogénea con un cariotipo que exhibe pocas alteraciones 17 y tiene la capacidad de proliferación y diferenciación 16. Cuando estas células son sembradas a baja densidad, adquieren una morfología elongada no diferenciada, se dividen activamente y, después de alcanzar la confluencia, forman colonias como las típicas de hepatocitos rodeadas por células epiteliales similares a las biliares 2; además, expresan una mayor cantidad de enzimas P450, varias enzimas de la fase II (que participan en la conjugación de xenobióticos como: acetiltransferasa, metiltransferasa, glutatión transferasa), trasportadores y receptores nucleares importantes. Entre estos últimos se encuentra el receptor adrenostano constitutivo (CAR), el receptor pregano X (PXR) y el receptor activado por el proliferador de perixosoma (PPAR), que muestran un 85% de identidad con los genes expresados por hepatocitos primarios humanos 16, convirtiendo también a las HepaRG en un modelo útil para el estudio de los mecanismos del metabolismo de medicamentos 33.
En este modelo se ha observado una expresión estable de proteínas relacionadas con el metabolismo lipídico, como lo son proteína de unión de elementos reguladores de esteroles 1 (SREBP-1), sintetasa de ácidos grasos (FAS) y acetil-CoA carboxilasa (ACC), sin observar diferencias en la expresión en medios de cultivo con baja o alta concentración de glucosa 1. Por otro lado, no se han apreciado diferencias en la expresión de proteínas relacionadas con el metabolismo de las lipoproteínas como: apolipoproteína A (apoA), apolipoproteína I (apoI), receptor scavenger clase B miembro 1 (SR-BI), LDLr y proteínas relacionadas con el receptor LDL 1 (LRP1) 1.
Las células HepaRG han sido muy utilizadas en estudios de toxicología y metabolismo de medicamentos, pero poco se ha estudiado acerca de la capacidad para acumular TG cuando son expuestas a ácidos grasos exógenos 10. No obstante, se encuentran reportes de estudios donde se evidencia la secreción de TG y lipoproteínas conteniendo apoB en estas células, incluso de la expresión de genes asociados al metabolismo de lípidos 1,12.
Células IHH
Este modelo de hepatocitos humanos inmortalizados es una línea celular hepática reciente que fue obtenida de tejido de hígado sano; se extrajo quirúrgicamente de un hombre de 59 años de edad y fue inmortalizada por transfección con el plásmido SV40 que expresa el antígeno T 29. Estas células secretan albúmina a un nivel comparable con los hepatocitos primarios humanos, así como lipoproteínas ricas en TG, apoB, apoAI 29 y apoCIII 34.
En las células IHH se ha observado una expresión considerable de las proteínas relacionadas con el metabolismo de los lípidos, en particular las proteínas SREBP-1, FAS y ACC, pero no se han visto diferencias en las lipoproteínas como apoA, ApoI, SR-BI, LDLr y LRP1 1. Estas células secretan, en su gran mayoría, lipoproteínas asociadas a LDL 10 y, en presencia de ácido oleico, acumulan TG a nivel intracelular; además, cuando son expuestas a altas concentraciones de glucosa incrementan la secreción de sus lipoproteínas 10,18. En su mayoría aumenta la producción de ApoCIII y de la proteína que contiene el dominio de la fosfolipasa 3 similar a patatina (PNPLA3) 19. Este incremento de los niveles de ApoCIII está correlacionado con una elevada secreción de VLDL y su correspondiente aumento de TG y ApoB.
Bajo condiciones normales de cultivo, la tinción con aceite rojo (del inglés Oil Red) revela que las células IHH contienen muy baja cantidad de lípidos neutros intracelulares; después del tratamiento con ácido oleico, estas células acumulan una gran cantidad de micelas lipídicas en citoplasma 35. En contraste con las células IHH, tanto las HepG2 como las HuH-7 presentan tinción de lípidos intracelulares aún sin inducir la formación de vesículas de lípidos; por esta razón, se considera que este modelo celular tiene un comportamiento muy similar a las células hepáticas maduras de hígado humano 18, además tolera altas concentraciones de ácidos grasos exógenos 20.
Al estudiar la acumulación de lípidos intracelulares a través del método Oil Red, se encontró que las células IHH aumentan 15.8 veces su acumulación de lípidos intracelulares comparado con condiciones basales al ser tratadas con ácido oleico. De Gotarddi et al.18 observaron que las células IHH esteatóticas exhiben una expresión diferencial de 30 genes, 12 de los cuales incrementan su expresión mientras que los 18 restantes la disminuyen. Entre los que aumentan la expresión se encuentran acil-CoA sintetasa, ácido graso denaturasa y acetil-CoA actiltransferasa, mientras que los que la reducen son HMGCR y LDLr. En conclusión, se observa que la inducción de esteatosis en células IHH incrementa de manera considerable la biosíntesis de TG, mientras se inhibe la lipogénesis de ácidos grasos y colesterol 18.
Células HuH-7
En este modelo las células derivan de carcinoma hepatocelular, tienen la capacidad de diferenciarse y han sido bastante utilizadas en estudios relacionados con enfermedades virales del hígado. Meex et al.21 demostraron que este modelo celular es muy similar a las células HepG2 con relación al efecto de los lípidos exógenos y los inhibidores del proteosoma de la secreción, la recuperación y la degradación de la ApoB100; sin embargo, no ofrece ventajas sobre las células HepG2 para estudiar el metabolismo lipídico. Existen reportes que señalan que la adición de suero humano en remplazo del suero fetal bovino podría estimular más funciones específicas de hepatocitos humanos, entre ellas la secreción de VLDL 21.
Estas células secretan en mayor proporción la apoB100 (95%) comparada con la secreción de las células HepG2 (70%). También se ha demostrado que en momentos de relativa deficiencia de lípidos degradan la apoB100. Las células HuH-7 tienen la capacidad de acumular más del doble de los TG que acumulan las células HepG2 cuando son expuestas a ácido palmítico, ácido oleico o una combinación de ambos 20. No obstante, la estimulación con el ácido oleico en ambos tipos celulares presenta una mayor acumulación de TG que cuando son estimuladas con ácido palmítico 36. Asimismo, se ha observado que el ácido palmítico es bastante citotóxico para las células HuH-7; en contraste a esto, el ácido oleico es tolerado hasta concentraciones de 1.32 mmol sin inducir la muerte celular 30.
Miyata et al.37 establecieron una variante que expresa el gen de la luciferasa bajo el control del promotor de la enzima FAS (HuH-7/FAS-Luc) y en la que se puede evaluar el efecto de diferentes sustancias sobre el metabolismo de los lípidos, relacionadas con la SREBP y la inhibición de la síntesis de FAS, HMG-CoA sintetasa, HMG-CoA reductasa y esterol CoA desaturasa. Miyata et al.22, utilizando la misma variante, evaluaron el efecto de alil isotiocianato (AITC) sobre SREBP en otro estudio y encontraron que dicho compuesto tiene la capacidad de inhibir la proteólisis de SREBP en sus diferentes isoformas y afecta el estado maduro de la proteína. Asimismo, observaron una reducción en los niveles de ARNm de las proteínas reguladas por SREBP-1 (ACC, FAS y SCD) y en las reguladas por SREBP-2 (HMG-CoA sintetasa, HMG-CoA reductasa y la escualeno sintetasa); esto indicó que se produce un efecto regulador sobre la lipogénesis, tanto de ácidos grasos como de colesterol 22; Shao & Ford 23 reportaron en 2014 resultados similares.
En este modelo también se realizó seguimiento subcelular del ácido oleico y se observó que la mayoría de este sustrato era utilizado por las células para elaborar ácidos neutros, principalmente fosfolípidos y TG 24.
Células HepG2
Son células derivadas de hepatoblastoma humano que se comportan de forma similar a las células de hígado fetal, lo que las hace inadecuadas para la investigación del metabolismo de medicamentos 10; no obstante, esta línea celular expresa muchas de las funciones atribuidas a los hepatocitos humanos normales 25,38,39. Para algunos investigadores, estas células presentan acumulación de TG cuando se adicionan al medio de cultivo ácidos grasos exógenos 26,40, mientras que otros autores reportan que la acumulación de TG solo ocurre cuando se utiliza ácido oleico 10. A diferencia de las células primarias, cultivar células HepG2 con solo ácido palmítico no promueve la acumulación de TG 41.
Desde su introducción en 1979, un sin número de investigaciones han utilizado este modelo y una alta proporción de las proteínas específicas del hígado han sido identificadas en los estudios iniciales con estas células, lo que generó expectativas con relación a que esta línea celular se convirtiera en un modelo celular de hígado humano bastante consistente para investigación. Entre los procesos metabólicos que han sido estudiados hasta ahora, se destacan estudios del metabolismo de lipoproteínas, síntesis de ácidos biliares, metabolismo del colesterol, metabolismo de medicamentos, enzimas hepáticas, transporte de glucosa, entre otros; estas vías han sido evaluadas procurando mantener el ambiente de los hepatocitos normales y, por lo tanto, favoreciendo incluso aplicaciones más amplias de esta línea celular sobre problemas biológicos, en los cuales está involucrado el funcionamiento hepático 12,38. También se ha demostrado que las células HepG2 tienen la capacidad de sintetizar ácidos biliares a partir de colesterol 5.
La composición de lípidos en cultivo de las células HepG2 es comparable con la encontrada en hígado humano normal 42, en donde a pesar de la reducción de la síntesis de ácidos grasos de novo no se encontraron diferencias significativas entre las células HepG2 con relación a hepatocitos primarios o hepatocitos frescos. Es decir, las células HepG2 tienen una alta capacidad para la síntesis de TG a partir de ácido oleico, resultando en una alta acumulación a nivel intracelular y muy baja secreción al medio 6.
Las células HepG2 tienen la capacidad de expresar los receptores de insulina, transferrina y los LDLr, además se ha documentado la capacidad de sintetizar y excretar lipoproteínas, como VLDL 25, HDL 25 y en mayor proporción LDL 43; por esta razón el modelo celular HepG2 se ha catalogado como un sistema estándar para estudiar el metabolismo y la síntesis de las lipoproteínas. Al estudiar el efecto que puede tener el ácido oleico y la insulina sobre la secreción de lípidos, se ha observado que los TG son los lípidos secretados en mayor proporción seguidos de colesterol esterificado y no esterificado, siendo estas observaciones concordantes con lo encontrado en cultivo primario de hepatocitos 44. La cantidad de colesterol no esterificado no se ve afectada por el ácido oleico o por la insulina; sin embargo, la baja concentración de ésteres de colesterol refleja baja actividad de la lecitin-colesterol aciltransferasa (LCAT) 44.
En varios estudios se ha demostrado que el ácido oleico es un elemento inductor de la lipogénesis en células HepG2, induciendo 1.85 veces la cantidad de lípidos en células expuestas; mientras que los TG aumentan 1.7 veces en células tratadas a nivel intracelular y 3.7 veces a nivel extracelular 25,44,45; también genera el aumento de la acumulación de apoB100 (700%) 21.
La viabilidad de las células HepG2 frente al ácido oleico se mantiene en 95% a concentraciones <1 mmol (concentraciones >1.4 mmol causan muerte celular) 43. Al comparar las células HepG2 con los hepatocitos primarios no se evidencian diferencias significativas en la acumulación de TG cuando son expuestas a ácidos grasos libres exógenos 27.
Kamper et al.46 compararon la producción de apoB y de la proteína microsomal transportadora de triglicéridos (MTP) en células HepG2 y células BeWo (células humanas de placenta originadas de un criocarcinoma), encontrando que las células HepG2 producen tanto apoB como MTP en muy buena proporción, mientras que las células BeWo solo producen pequeñas cantidades de apoB, por este motivo no se consideran modelos viables para el estudio del metabolismo de los lípidos 46.
Por otra parte, cuando se evalúan metabolitos secundarios como los polifenoles, específicamente el oligonol, se observa que reduce de una forma dosis dependiente la acumulación intracelular de TG en células HepG2 cultivadas con ácido palmítico; además este metabolito no afecta la viabilidad celular 41. Esta reducción está explicada por la supresión de la expresión de proteínas ACC, FAS y SREBP-1 y el receptor gamma activado por el proliferador de perixosomas (PPARy); de esta forma inhibe la síntesis de novo de ácidos grasos 41. Similares resultados se observaron cuando se evaluaron los extractos de Moringa olifera47, Zanthoxylum bungeanum48, Sibiraea angustata49, Olea europaea Linn50 y Camellia sinensis51.
Una de las desventajas de las células HepG2 es que carecen de la expresión funcional de casi todas las proteínas relevantes P450 de hígado humano 2,30,37, además tienen una limitada capacidad para cargar de lípidos a la apoB100 y secretarla en forma de VLDL 39.
Conclusiones
Las investigaciones con relación a la acumulación de lípidos a nivel hepático en modelos celulares han permitido elucidar y avanzar en el conocimiento de este proceso desde el punto de vista bioquímico y molecular; es así como ya se han identificado cuáles son las rutas metabólicas involucradas en el desarrollo de la esteatosis hepática. Del mismo modo, se han identificado varios compuestos tanto sintéticos como naturales que pueden tener efectos sobre la función de enzimas esenciales en el metabolismo de lípidos o sobre los factores nucleares que permiten la expresión o inhibición de la síntesis de estas enzimas.
Como se notó a lo largo del texto, cada modelo celular ofrece algunas ventajas sobre los otros, pero también presentan limitantes o factores desfavorables al momento de su utilización que puede incluir amplias diferencias a nivel genético y fenotípico con relación a las células hepáticas maduras, que sería el tipo de célula que se pretende simular, como a nivel bioquímico donde las células sobre expresan el metabolismo lipídico. Es decir, el investigador debe tener en cuenta cuáles son los requerimientos y el proceso que desea evidenciar para poder optar por uno u otro modelo de estudio, sin olvidar que los resultados obtenidos solo serán aproximaciones de lo que realmente podría suceder a nivel del hígado como órgano.