Introducción
El melanoma cutáneo es una neoplasia maligna derivada de la proliferación de melanocitos atípicos del estrato basal de la epidermis 1 y puede presentarse en cualquier tejido al cual hayan migrado células derivadas de la cresta neural 2. Se caracteriza por una gran capacidad de metástasis linfáticas y hemáticas, produciendo una neoformación a nivel cutáneo pigmentada, plana o exofitica.
Se reconocen cuatro subtipos clínico-patológicos de melanoma primario cutáneo: melanoma de propagación superficial (70% de los casos), melanoma nodular (15-30% de los casos), melanoma lentigo maligno (10% de los casos) y melanoma lentiginoso acral (MLA) (5-10% de los casos); se estima que 7% de melanomas cutáneos se ubican en zonas distales. Se describen, además, algunos tipos de presentación inusual como los melanomas amelanotico, neurotropo, desmoplasico, polipoideo, melanocitoma epitelioide pigmentado y verrugoso 3.
El MLA es una variante de rápida progresión, la cual se localiza preferentemente en palmas de las manos, plantas de los pies y lechos ungueales. Se presenta como casos de novo o secundarios a malignización de algún nevus benigno ya existente 1 y son más frecuentes en afrodescendientes (70%), asiáticos (40%) y latinos (15%), siendo su incidencia de 10-20 casos por cada 100 000 individuos en Europa, 20-30 casos por cada 100 000 individuos en EE. UU. y 50-60 casos por cada 100 000 individuos en Australia 4; su prognosis es significativamente más mala que el de otras variantes clínicas de melanoma, esto debido a retrasos en el diagnóstico y al comportamiento agresivo del melanoma 5.
Los melanomas pueden desencadenar metástasis nodal, regional y a distancia en la mayoría de los órganos, con especial predilección por ganglios linfáticos, piel y tejido subcutáneo (42-57%); pulmones (18-36%); hígado (14-29%); cerebro (12-20%); hueso (11-17%), e intestinos (1-7%) 6.
El MLA representa el 4% de las neoplasias malignas de la piel, siendo responsable del 80% de las muertes 7. Asimismo, se puede presentar metástasis a distancia sin compromiso de los ganglios linfáticos regionales, esto se da cuando la diseminación es hematógena. La sintomatología neurológica es la forma más frecuente de las metástasis cerebrales, las cuales se detectan por medio de tomografía axial computarizada (TAC) o resonancia magnética nuclear y suelen debutar con hemorragia en el 50% de los casos 8.
En Perú no se cuenta con datos exactos sobre la incidencia de cáncer de piel; sin embargo, la Dirección General de Epidemiologia (DGE) encuentra que en el periodo 2006-2010 se registraron 5 975 casos de cáncer de piel, lo que representa el 6.6% del total de canceres registrados 9.
El problema radica muchas veces en que el MLA se diagnostica con menor frecuencia en estadios iniciales, en que el comportamiento biológico es agresivo -con respecto a otros tipos de melanoma maligno-, y en que es notoria la falta de conocimiento por parte de la población, ya que se desconoce que los melanomas se pueden presentar en regiones subungueales, palmas de las manos y plantas de los pies; por tanto, las lesiones muchas veces pasan desapercibidas a la vista. Asimismo, los servicios de atención primaria de salud en locaciones alejadas a las ciudades hacen tardío el diagnóstico y tratamiento de las mismas.
El objetivo de este artículo es reportar el caso de un sujeto de 44 años fototipo cutáneo tipo IV que presentó recidiva de MLA con metástasis cerebral.
Presentación de caso
Paciente masculino de 44 años de edad, casado, mecánico de profesión, foto tipo cutáneo tipo IV y con antecedentes previos de lesión pigmentada asintomática de dos años de evolución y crecimiento lento. La lesión estaba localizada en la planta del pie izquierdo (Figura 1), registraba nivel IV de Clark, estaba ulcerada y tenía 2.33mm de espesor de Breslow (Figura 2).
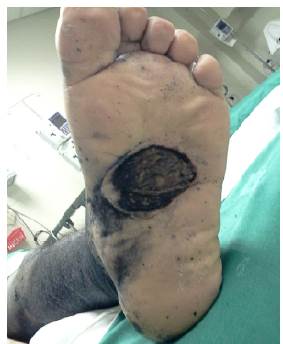
Fuente: Documento obtenido durante la realización del estudio.
Figura 1 Lesión primaria ulcerada de cerca de 3cm, hiperpigmentada y de bordes mal definidos en pie izquierdo.
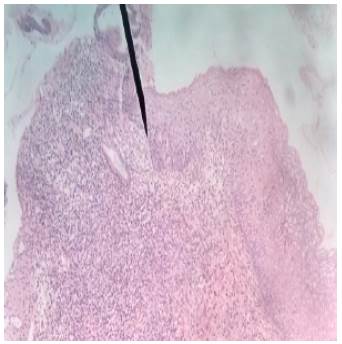
Fuente: Documento obtenido durante la realización del estudio.
Figura 2 Melanoma lentiginoso acral con Breslow de 2.33mm con epidermis atrófica, proliferación de melanocitos en capa basal y presencia de atipia nuclear y mitosis. Tinción: Hematoxilina-Eosina. Vista: 40x.
El paciente había sido sometido a resección quirúrgica de MLA un año atrás en un hospital regional de la zona nororiental del país. Aunque no se cuenta con mayores datos, se registra que no recibió quimioterapia ni radioterapia. Al momento de la realización del presente estudio, presenta una lesión ulcerada de 3cm, además de múltiples neoformaciones en cara lateral de muslo izquierdo (Figuras 3 y 4).
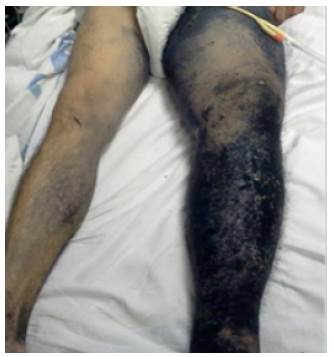
Fuente: Documento obtenido durante la realización del estudio.
Figura 3 Tumefacción de miembro inferior izquierdo, piel negruzca, acartonada y con múltiples formaciones nodulares que recorren la extremidad de forma ascendente (metástasis en tránsito).

Fuente: Documento obtenido durante la realización del estudio.
Figura 4 Formación nodular en cara lateral de muslo izquierdo.
Durante su traslado por vía aérea presenta cefalea intensa asociada a vómitos. El sujeto ingresa por clínica neurológica de seis horas de evolución, caracterizada por hemiparesia derecha, disartria, cefalea, náuseas y vómitos. En la exploración clínica se observa paciente adelgazado, piel y mucosas pálidas, hipoactivo, mal estado general, mal estado de hidratación, llenado capilar >2'', ruidos cardiacos rítmicos de intensidad regular, sin soplos y electrocardiograma con ritmo sinusal. A nivel respiratorio se auscultan crepitos y subcrepitos en ambos campos pulmonares; el abdomen se encuentra blando, depresible, doloroso a la palpación profunda a nivel de cuadrante superior derecho y con ruidos hidroaéreos presentes; a nivel inguinal izquierdo se palpa adenopatía de consistencia pétrea. Se reporta frecuencia cardiaca de 110 x', frecuencia respiratoria de 28x', saturación de oxígeno ambiental de 95% mediante pulsioximetria, temperatura de 37.8°C y presión arterial de 90/65 mmHg. En el examen neurológico se encuentra escala de Glasgow 10 de 11 puntos y disminución en la fuerza en brazo y pierna derecha de 3/5; en el curso de la evaluación el paciente presenta convulsión tónico-clónica.
Se realizó TAC sin contraste, en donde se observó una tumoración temporoparietal izquierda, hiperdensa de 4.1x5cm, con edema perilesional y hemorragia que produce efecto expansivo severo, desviación de la línea media e invasión intraventricular (Figura 5).
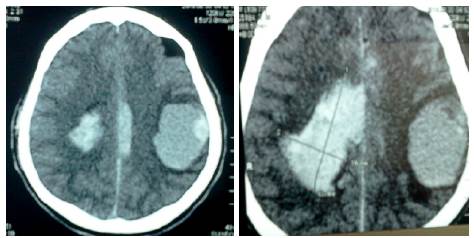
Fuente: Documento obtenido durante la realización del estudio.
Figura 5 Tomografía axial computada, lesión metastásica cerebral.
Asimismo, se realizaron paraclínicos que tuvieron los siguientes resultados: hemoglobina 9 g/dl, leucocitos 11 800 mm/m3, plaquetas 255 000 mm/m3, glucosa 126 mg/dl, urea 20, creatinina 0.97, albumina 3.0, AST 87 U/L, ALT 680 U/L, fosfatasa alcalina 306 IU/L, LDH 585 UI, grupo sanguíneo Rh O positivo, examen de orina no patológico y análisis de gases arteriales con acidosis metabólica. Se solicitó radiografía de tórax anteroposterior, en donde se evidenciaron múltiples lesiones nodulares diseminadas en ambos campos pulmonares sugestivas de metástasis pulmonar y ultrasonido abdominal, en donde se observaron lesiones nodulares <1.5cm en todo el parénquima hepático, de probable origen metastásico; la vesícula biliar, las vías biliares, el páncreas, el bazo y ambos riñones de morfología se encontraron normales. No se observaron adenopatías intraabdominales ni liquido libre.
El paciente se estadificó según la clasificación TNM 11 con estadio IV. Previa estabilización, fue referido a un centro hospitalario de mayor nivel para tratamiento microquirúrgico.
Discusión
En la mayoría de los casos, las metástasis cerebrales se originan de alguno de los siguientes cuatro tumores primarios: cáncer de pulmón (40-50%), cáncer de mama (15-25%), melanoma (5-20%) y cáncer colorectal (4-16%). De estos, el melanoma presenta metástasis cerebrales con mayor frecuencia, apareciendo en el 50% de los pacientes que fallecen por esta neoplasia 12.
Los melanomas se localizan en zonas subcorticales, pero pueden afectar cualquier área de sustancia blanca, supra o infratentorial; el espacio subaracnoideo; la región paraselar, y el sistema ventricular. Por lo general, las metástasis cerebrales secundarias a melanoma se presentan de aspecto quístico y en ocasiones se observa un comportamiento hemorrágico. Hayward 13 reporta que 7 de 20 pacientes de melanoma metastásico debutan clínicamente con hemorragia subaracnoidea.
La sintomatología está relacionada con la localización de la lesión y cerca del 15% de los pacientes presenta convulsiones como primera manifestación de metástasis cerebral, mientras que la hemorragia intratumoral puede producir un trastorno neurológico de inicio súbito. La causa de los síntomas está relacionada al edema producido por las lesiones metastásicas, hidrocefalia o émbolos tumorales.
La cefalea es el síntoma más frecuente (24-53%) que precede a los demás; suele tener localización frontal y se incrementa con maniobras como tos, estornudos o Valsalva. Muchas veces este síntoma va acompañado de nauseas, vómito y clínica neurológica 14; déficit motor focal (16-40%); alteraciones del estado mental (24-31%); crisis epiléptica (15%), y ataxia (9-20%) 15.
Las mutaciones o alteraciones genómicas están presentes en la mayoría de los melanomas. Cerca del 15-20% posee una mutación oncogénica de n-RAS y BRAF que induce la activación no controlada de las cinasas de proteínas activadas por mitógeno, las cuales conllevan a la proliferación y senescencia celular; estos genes se asocian a melanomas por exposición solar y con el melanoma de extensión superficial (16). En los melanomas acrales la mutación más frecuente es la del gen c-KIT (11-15%), pero también se han descrito mutaciones en la CDK4 (cinasa 4 dependiente de Ciclina), la cual se halla mal regulada en el 90% de los melanomas y también está presente en melanomas mucosos y acrales. La activación de la CDK4 por fosforilación da como resultado la inhibición de la proteína del retinoblastoma que conduce a una transición del ciclo celular en la fase G1-S, inhibiendo el envejecimiento celular y la apoptosis 17,18.
En cuanto a su aparición, la radiación ultravioleta probablemente no sea el factor condicionante en esta neoplasia, ya que se presenta en zonas no expuestas como las palmas de las manos y las plantas de los pies 19. La patogénesis del MLA no es clara; la localización de estos en zonas de apoyo sugiere que la presión podría tener algún papel en su etiopatogenia, quizás asociado al calor y a traumatismos 20. Recientemente se ha encontrado sobreexpresión de la quinasa NUAK2 y aberraciones genéticas de otros genes relacionados con el melanoma, asimismo la presencia de nevus melanociticos congénitos o de múltiples nevus adquiridos representarían un factor de riesgo relacionado a su aparición 21.
Conclusiones
El melanoma metastásico se considera una enfermedad incurable; por lo general, a nivel intracraneal se presenta con signos neuropsiquiátricos o síntomas de efecto de masa. El diagnostico precoz y oportuno de lesiones dérmicas accesibles a la inspección y el desarrollo de terapias de mayor efectividad para su tratamiento es prioritario para mejorar el pronóstico de esta enfermedad.
Consideraciones éticas
En cuanto a la confidencialidad y publicación de los datos, la autora del presente artículo declara seguir los protocolos sobre la difusión de datos y reproducción de imágenes 22. Se contó con consentimiento informado por parte de los familiares del paciente.















