Introducción
Los vírus oncolíticos son partículas que infectan y lisan las células cancerosas, pero no las células normales. Se pueden presentar de forma natural (con genoma RNA) o pueden modificarse en el laboratorio (con genoma DNA); asimismo, pueden facilitar la destrucción de las células tumorales cuando se administran solos o junto con quimioterapia o radioterapia. La mayoría de estos virus matan directamente las células tumorales del hospedero dependiendo de la afinidad por el receptor celular, la replicación viral y la respuesta antiviral de la célula y del hospedero. Este tipo de tratamiento permite que se activen las células dendríticas y las células asesinas naturales (NEC, por su sigla en inglés) para promover citotoxicidad en el tumor 1-3.
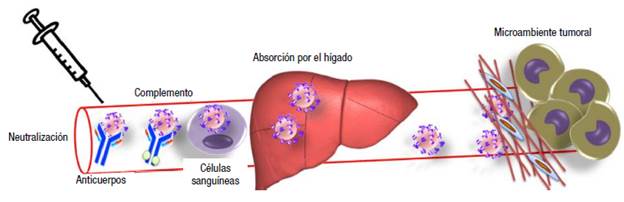
Los virus oncolíticos se estudian primero in vitro, en líneas tumorales, luego in vivo, en modelos animales, y por último en pacientes humanos. Cuando el tumor primario es de fácil acceso o susceptible a la inyección puede utilizarse la administración intratumoral (IT), pero esta aplicación se dificulta en los focos metastásicos. Para alcanzar el tumor primario y las metástasis, la alternativa es aplicar el virus por vía intravenosa (IV). No obstante, su eficiencia podría estar limitada, como se ilustra el la Figura 1, por la presencia de una respuesta inmunológica preexistente en los sujetos tratados debido a infecciones virales previas o por anticuerpos emergentes durante el tratamiento con el virus oncolítico; los virus también pueden ser neutralizados por la unión no especifica a las proteínas del suero y células circulantes del torrente sanguino o por órganos no específicos que eliminan el virus del torrente sanguíneo como el hígado y la matriz pericelular y tumoral que atrapa el virus.
Fuente: Elaboración con base en Roy & Bell 4.
Figura 1 Barreras a las que se enfrenta un virus oncolítico por vía IV.
Debido a 10 anterior, se han desarrollado métodos que faciliten la llegada del virus al tumor, y que, a su vez, permitan que el virus pueda reactivar el sistema inmuno lógico antitumoral mediante la expresión de antígenos virales en las células tumorales o por la liberación de antígenos tumorales luego de la lisis celular.
Los tratamientos convencionales como la radioterapia y la quimioterapia no han mostrado por si solos resultados óptimos en el tratamiento contra el cáncer, por tal motivo han surgido alternativas de tratamiento como los virus oncolíticos. La comunidad médica y la población en general conocen a los virus como agentes causales de enfermedades, pero saben muy poco sobre su potencial uso contra el cáncer. Por esto, es importante conocer los virus oncolíticos existentes y los diferentes métodos que se emplean para evitar su neutralización antes de que lleguen al tumor para determinar los avances y la seguridad del tratamiento. Por 10 tanto, esta revisión busca exponer las técnicas utilizadas para envolver y transportar los virus con el fin de eludir el sistema inmunológico antes de que el virus llegue al tumor. Para entender esto, es necesario hacer un repaso de algunos virus que en la actualidad están siendo utilizados como virus oncolíticos.
Materiales y métodos
Se realizó una búsqueda sistemática de literatura original y de revisión para publicaciones en inglés hechas entre í990y20í7.La búsqueda se hizo en las bases de datos PubMed, JSTOR y EBSCO sobre métodos o técnicas utilizadas para el tratamiento del cáncer mediante el uso de virus oncolíticos utilizando las palabras claves "Oncolytic Viruses", "Oncolytic Virotherapy", "Neoplasms", "application oncolytic virus", "tumour targeting", "viral vector cancer therapy".
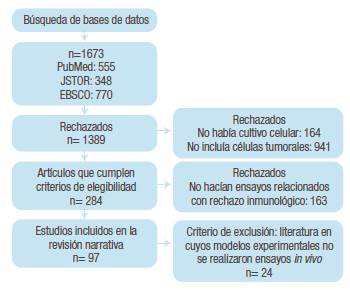
Los criterios de inclusion en la búsqueda de literatura fueron que el aspecto central de la literatura estuviera representado por el uso de virus silvestres o modificados utilizados para el tratamiento del cáncer, que su tema fuera sobre técnicas utilizadas para envolver el virus y eludir de esta manera el sistema inmunológico antes que el virus llegue al tumor y que hicieran mención sobre los métodos utilizados para aplicar el virus al paciente y hacer que este alcance el tumor; también se incluyeron propuestas de modelos para aplicar los virus oncolíticos en el tratamiento del cáncer. Como criterio de exclusión se tuvo en cuenta la literatura en cuyos modelos experimentales no se realizaron ensayos in vivo. La Figura 2 muestra el flujograma de los artículos encontrados en la revisión.
Resultados
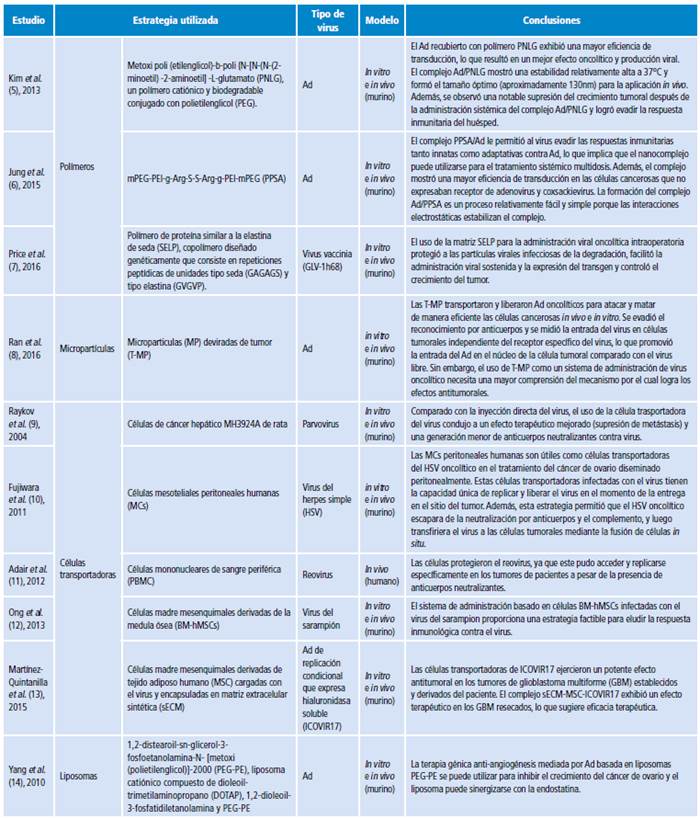
Se encontraron 1 673 artículos, de los cuales se eliminaron 1 576 por no cumplir con los criterios de elegibilidad, 163 porque no estaban relacionados con rechazo inmunológico y 24 porque no incluían experimentos realizados in vivo. Esta revisión narrativa contó con un total de 97 estudios, los cuales fueron artículos originales en inglés, realizados en diversas partes del mundo y que utilizaban estrategias para envolver y transportar virus oncolíticos para eludir la respuesta inmunológica (Tabla 1). El virus más estudiado hasta la fecha fue el adenovirus (Ad).
Discusión
Para desarrollar las distintas estrategias utilizadas para envolver y transportar los virus con el fin de eludir el sistema inmunológico antes de que el virus llegue al tumor, las diferentes investigaciones han conjugado complejos a la superficie de los virus, como anticuerpos, factores de crecimiento y pequeños péptidos. Sin embargo, este tipo de estrategias solo han dado una modesta eficacia antitumoral, en gran parte debido a que no cubren todas las heterogéneas morfologías celulares, fenotipos, propiedades y patrones de expresión de antígeno, propios de los tejidos tumorales. De esta forma, se han generado diferentes estrategias para evitar la neutralización de los virus oncolíticos por el sistema inmunológico. Sin embargo, previo a la descripción de dichas estrategias, es importante conocer los virus oncolíticos estudiados en la actualidad.
Virus oncolíticos
Existen diferentes tipos de virus modificados o no genéticamente que han sido utilizados en la terapia oncolítica (Tabla 2).
Tabla 2 Virus oncolíticos estudiados en la actualidad.
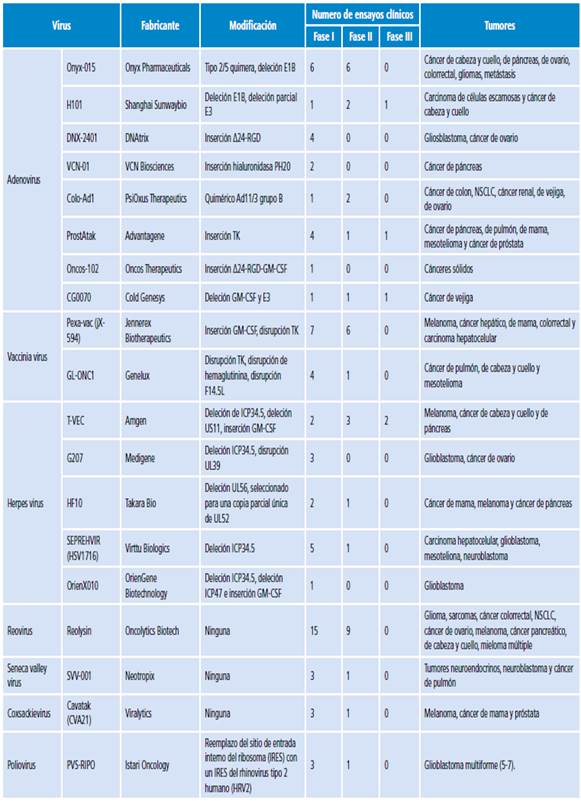
GM-CSF: Factor estimulador de colonias monocito-macrófago; NSCLC: cáncer de pulmón de células no pequeñas; RGD: Arg-Gly-Asp motif; TK: timidina quinasa; US11: glicoproteína corta única 11.
Fuente: Elaboración con base en Kaufman et al.15, Buijs et al.16 y Brown et al.17.
En el Laboratorio de Biología Molecular de Virus de la Facultad de Medicina de la Universidad Nacional de Colombia se han realizado estudios en los cuales se encontró que cepas rotavirales aisladas en el laboratorio infectan y lisan las líneas celulares Sp2/0-Ag14 cells (mieloma de ratón), U-937 (linfoma histiocítico), REH (leucemia linfocítica aguda), Kato III (carcinoma gástrico), MCF-7 (adenocarcinoma de mama), PC-3 (adenocarcinoma grado IV de próstata) y A549 (carcinoma de pulmón humano), lo que sugiere que las cepas estudiadas son potenciales virus oncolíticos 18.
Adicional a los estudios in vitro, se han estudiado los rotavirus en un modelo in vivo en tumores generados inoculando subcutáneamente células SP2/O-Ag14 en ratones Balb/c, en lo denominado tumores alogénicos. En este modelo se ha aplicado el virus en forma directa o intratumoral. Los resultados indican que el rotavirus oncolítico infecta, lisa las células tumorales y detiene el crecimiento tumoral. De igual forma se ha demostrado que el rotavirus oncolítico infecta células tumorales extraídas de tumores procedentes de cáncer gástrico, de ovario y de leucemia linfoblástica aguda. La metodología en general está siendo patentada por la Universidad Nacional de Colombia en la actualidad.
Métodos y técnicas utilizadas para envolver los virus con el fin de eludir el sistema inmunológico
El modelo más utilizado para estudiar los virus oncolíticos es el ratón atímico, que permite implantar células tumorales de origen humano para generar el tumor (xenotrasplante) y luego administrar el virus intratumoral o endovenoso.
Se han propuesto dos mecanismos para evitar la neutralización de los virus oncolíticos, uno modificando genéticamente los epítopes inmunogénicos en los virus y otro creando un escudo o blindaje que permita envolver el virus y ocultarlo del sistema inmunológico.
Dentro de la estrategia de envolver los virus están los denominados nanocomplejos. En este punto es importante recordar que se define como nanopartículas aquellas partículas que están entre 1 y 100 nanómetros de tamaño; los de mayor tamaño, en general, se definen como nanocomplejos. Los virus poseen tamaños que van desde los 20nm hasta los 300nm; la mayoría está en el rango de 100nm y, por lo general, cuando se les incorpora diferentes materiales -ya sean proteínas, polímeros, entre otros- sobrepasan su tamaño promedio.
En términos generales, se puede resumir la estrategia de la siguiente manera:
Formación de nanocomplejos mediante la unión química o mediante la unión a través de interacciones electrostáticas entre biopolímeros y virus oncolíticos, tales como a) complejos conjugados a la superficie de los virus a través de moléculas de polietilenglicol (PEG), como anticuerpos, factores de crecimiento y pequeños péptidos 19-24 y b) unión, mediante interacciones electrostáticas, entre el virus (específicamente Ad) y polímeros cargados positivamente como polyethylenimine (PEI), poly(disulfide amine) (ABP), poly(amidoamine) (PAMAM), chitosan, methoxy poly(ethylene glycol)-b-poly{N-[N-(2-aminoethyl)-2-aminoethyl]-L-glutamate (PNLG), methoxy poly(ethylene glycol)-b-poly(l-histidine)-poly(l-phenylalanine) (PEGbPHF), mPEG-PEI-g-Arg-S-S-Arg-g-PEI-mPEG (Ad/PPSA), N-(2-hydroxypropyl)methacrylamide) (HPMA), N-(2-Hydroxypropyl)-2-methyl-prop-2-enamide (HPMA) 5-6,25-49.
Vesículas subcelulares especializadas, con tamaños entre 0.1μm a 1mm y denominadas micropartículas (MP) 8.
Biopolímeros
Para desarrollar esta estrategia, en términos generales se han conjugado anticuerpos, factores de crecimiento y pequeños péptidos a la superficie de los virus mediante moléculas de PEG 19-24. Sin embargo, este tipo de estrategia no ha sido muy eficiente y un ejemplo de ello fue la unión de un anticuerpo monoclonal (Herceptin) mediante PEG a la superficie del Ad. El Herceptin se une de manera específica al receptor HER2/neu y se utiliza ampliamente para tratar el cáncer de mama tanto temprano como metastásico. Sin embargo, HER2/neu solo se sobreexpresa en el 20-30% de los pacientes con cáncer de mama 19, por lo que la estrategia basada en Herceptin es ineficaz en muchos casos.
La estrategia para modificar la superficie de los virus oncolíticos mediante interacciones electrostáticas entre el virus y polímeros cargados positivamente -tales como ABP 25, polyethylenimine 26, poly(amido amine) 27, chitosan 28 o methoxy poly(ethylene glycol)-b-poly{N-[N-(2-aminoethyl)-2-aminoethyl]-L-glutamate} 5- ha sido descrito para Ad, que posee la superficie viral cargada negativamente. Estos complejos generan cargas positivas dadas por el polímero, que permite interaccionar con las membranas celulares cargadas negativamente mejorando la internalización.
El recubrimiento con el polímero catiónico permite disociar con facilidad el material en los endosomas, liberando de manera efectiva los Ad a través del efecto esponja de protones 29. Por ejemplo, el ABP, que tiene enlaces disulfuro reducibles en la cadena principal y mejora en gran medida la eficacia del ingreso del Ad a la célula, aunque reduce la citotoxicidad del virus 25. Un problema es que los complejos Ad/polímero de carga positiva poseen escasa selectividad por el tumor debido a su absorción inespecífica dada por la interacción con las membranas de células no tumorales también cargadas negativamente 30, limitando la eficacia general de estas terapias.
Morrison et al.72 han utilizado el polímero (Poly-(2-hidroxipropil) methacrylamida (pHPMA) unido al virus, junto con un ligando llamado mEGF (factor de crecimiento epidermal murino) para redirigir el virus a células tumorales que sobre expresan el EGFR, receptor de mEGF. A ratones desnudos le fueron implantadas intraperitonealmente 1x107 células SKOV-luc (línea celular de cáncer de ovario humano) y 96 horas después fueron tratados con partículas virales Ad5WT, pHPMA-Ad5WT (Ad ligado al polímero) o mEGF-pHPMA-Ad5WT (Ad-polímero-factor de crecimiento epidermal) en 3 dosis, cada una con 5x1010 partículas virales, con un intervalo de 72 horas entre dosis. Los resultados mostraron que ratones tratados con Ad5WT presentaron alta frecuencia de adhesiones peritoneales y obstrucciones intestinales subagudas, por lo que se requirió eutanasia en el 20% de los ratones. De otro lado, los tratados con mEGF-pHPMA-Ad5WT presentaron una mejora significativa en eventos como adhesiones peritoneales y obstrucción intestinal; sin embargo, no se observó diferencia en el efecto antitumoral con respecto al Ad5WT 72.
Otro estudio realizado por Kim et al.5 utilizó el polímero metoxipolietilenglicol amino (MPEG-NH2, Mw 5000) unido al Ad; los investigadores aplicaron este virus a un ratón en el cual se había generado un tumor con células humanas, HT1080 y A549 (fibrosarcoma humano y adenocarcinoma de pulmón, respectivamente). Con este sistema se redujo el atrapamiento del virus en el hígado y se localizó más en el tumor, respecto al Ad no envuelto. Los autores afirmaron que el polímero evade al sistema inmunológico y en especial evita que los anticuerpos séricos interfieran con el Ad.
El estudio de Price et al.7 utilizó el virus vaccinia (VV) atenuado (GLV-1h68) envuelto en un polímero de proteína similar a la elastina de seda: "silk-elastin-like protein polymer" (SELP) aplicado en forma IV a un ratón, al cual se le generó un tumor con una línea de carcinoma anaplásico de tiroides humano (línea celular 85505c). Asimismo, los autores inyectaron 5x106 células subcutáneamente en un flanco en ratones atímicos y observaron una mayor expresión viral en el tumor respecto a los ratones que se inyectaron con virus no envueltos 7.
También se han utilizado aptámeros (ácidos nucleicos de cadena sencilla con capacidad de unir anticuerpos) para que unan anticuerpos y eviten que estos bloqueen la infección viral, lo cual conduce a una mayor infección 73.
El ensayo de Garofalo et al.42 utilizó un compuesto que tiene un efecto anti-proliferativo celular, como es la L-carnosina, la cual unieron electrostáticamente con la cápside de un Ad y lo inyectaron vía IT a ratones que le habían generado tumores suministrando 1x106 células de cáncer de pulmón o de colon (A549, HCT-116) en forma subcutánea. Se observó reducción en el crecimiento del tumor por inducción de apoptosis 42.
Otro método para aumentar la eficiencia en la llegada del Ad a los tumores ha sido aprovechar que los tejidos tumorales son a menudo hipóxicos (que carecen de oxígeno adecuado) y están caracterizados por un pH inferior con relación a los tejidos no tumorales 31. La hipoxia se considera un factor que contribuye a la quimio resistencia y la metástasis; así, se han explorado Ad recubiertos con un polímero que contiene methoxy poly(ethylene glycol)-b-poly(L-histidine)-poly(L-phenylalanine) (3.3 K, PHF; H:F = 23:1) (abreviado como PEGbPHF) 32, utilizando las interacciones electrostáticas entre el polímero catiónico cargado positivamente y la superficie cargada negativamente de los Ad. El complejo Ad recubierto de polímero sensible al pH aumenta significativamente la carga neta positiva al exponerse al microambiente tumoral hipóxico, lo que permite la orientación pasiva al tejido tumoral 74-78.
En resumen, el uso de interacciones electrostáticas para unirse a polímeros cargados positivamente, como ha sido descrito para Ad, elude la respuesta inmunológica pero reduce la capacidad citotóxica del virus en el tumor. Además, los complejos Ad/polímero de carga positiva poseen escasa selectividad por el tumor debido a su absorción no específica y la interacción con las membranas de células no tumorales, también cargadas negativamente, limitando la eficacia general de estas terapias. Sin embargo, para evitar daños en células no tumorales, los Ad han sido modificados para que no se repliquen en estas células. A pesar de los avances, se necesitan más estudios respecto a la seguridad de los materiales, puesto que las nanopartículas sintetizadas que contienen componentes no propios del hospedero no tienen estudios concluyentes que descarten toxicidad o provoquen rechazo inmunológico 74-78.
Micropartículas
Esta es una estrategia reciente que se basa en que las células, en respuesta a diversos estímulos, son capaces de generar varias vesículas con diferentes tamaños. Las células cambian su citoesqueleto y encapsulan el contenido citosólico dentro de la membrana celular para formar vesículas y su posterior liberación a los espacios extracelulares. Tales vesículas subcelulares especializadas que tienen tamaños entre 0.1μm y 1mm se denominan micropartículas y estas MP contienen enzimas, RNA e incluso DNA y son capaces de transferir moléculas bioactivas de una célula a otra. También pueden servir para entregar fármacos quimioterapéuticos a células tumorales.
Para utilizar la estrategia de MP, Ran et al.8 infectaron cultivos celulares tumorales con Ad para que se liberaran MP cargadas con Ad al sobrenadante 8. Con estas MP, que tenían incorporados Ad, se pudo infectar otras células tumorales. Aunque se evidenció un éxito en la entrega del Ad a la célula tumoral, evitando el reconocimiento del virus por los anticuerpos, estos autores no excluyeron si también facilitaba la entrada del Ad a células no tumorales, dado que la entrada del Ad a la célula es independiente de su receptor celular. Es decir, los investigadores no aclaran el mecanismo por el cual los Ad cargados en las MP infectan y matan las células tumorales. No se analizó la cantidad de material no viral, propio de la célula tumoral de donde proceden las MP; es decir, qué portan las MP y su efecto en las nuevas células tumorales a donde llegan 8.
De igual forma, la estrategia para transportar virus oncolítico o fármacos quimioterapéuticos a células tumorales, utilizando MP, puede contener enzimas, RNA e incluso DNA y otros componentes citoplasmáticos. No se ha estudiado la repercusión en la célula tumoral o en células no tumorales, puesto que las IMP pueden ingresar a los dos tipos de células. Transfectar mediante electroporación tanto in vitro como in vivo plásmidos que contienen proteínas virales con efecto citopático para las células tumorales tiene la limitante que el método no es eficiente, por ahora, para transfectar el plásmido dentro de tumores sólidos con baja accesibilidad.
Células transportadoras
Las dos anteriores estrategias han sido muy estudiadas para Ad. En cambio, esta estrategia, la de células transportadoras o "carrier cell", en la actualidad es la más estudiada y más aplicada a la gran variedad de virus candidatos a oncolíticos; asimismo ha sido desarrollada y estudiada para infectar cultivos celulares tumorales in vitro en modelos animales y en pacientes 9,50-66. Cumple con los requisitos de evitar que los anticuerpos reconozcan el virus oncolítico, permite la llegada al tumor y la liberación del virus y puede utilizar células del propio paciente para transportar el virus, lo que evita rechazos inmunológicos o efectos colaterales por el material exógeno, como ocurre con otras estrategias.
Otras ventajas de este método incluyen que se protege al virus de la respuesta del sistema inmunológico, lo cual permite que haya una mayor biodisponibilidad del virus, y que según el tipo de célula transportadora puede presentarse replicación viral, lo cual posibilita que haya más partículas virales que la cantidad original incorporada en dichas células transportadoras 59,79.
El tipo de célula transportadora puede variar según la etiología del tumor -epitelial, mesenquimal o células del sistema inmunológico (células T, dendríticas)- y según el tipo de tumor -si es sólido o de tipo hematopoyético-. Para esta estrategia se han utilizado células normales, células tumorales o células madre 55,80-82. Por ejemplo, los macrófagos se han utilizado como células transportadoras: estos fueron infectados con Ad e inyectados a ratones xenotransplantados con tumor de próstata 48 horas después de ser tratados con docetaxel o irradiados. En este caso no se observó proliferación tumoral pero sí mayor sobrevida post tratamiento en los ratones, comparado a los que no se les aplicaron macrófagos infectados pero sí recibieron el fármaco o fueron irradiados 83.
También se han utilizado macrófagos como "transportadores" de Ad para inhibir el crecimiento tumoral prostático y metástasis pulmonar en ratones atímicos xenotransplantados. En este caso se evidencia infiltración en zonas hipóxicas del tumor por parte de los macrófagos con Ad. Se considera que esto ocurre por tres mecanismos: la afinidad propia de los macrófagos a regiones hipóxicas, el constructo insertado en los Ad que utiliza un promotor inducible por hipoxia -lo cual induce la replicación viral en el macrófago- y la afinidad del Ad por las células tumorales prostáticas, también generado por promotores específicos de próstata 84.
Asimismo, se han utilizado células madre neuronales (NSCs), las cuales han sido infectadas con un Ad de replicación condicional (CRAd-S-pk7). Al inyectar estas células intracranealmente a ratones atímicos, con gliomas de origen humano, se presentó disminución en el crecimiento tumoral y mayor sobrevida en comparación al grupo con aplicación de Ad libre 56. El estudio de Raykov et al.9 utilizó ratones con metástasis pulmonares y nodulares generados con una línea celular de hepatocarcinoma de rata. La misma línea celular fue utilizada como célula transportadora de parvovirus H-1. Los resultados mostraron que las ratas tratadas con virus transportados dentro de la célula presentaron menor generación de anticuerpos neutralizantes y supresión de eventos metastásicos con respecto a las tratadas con virus libres 9.
De otro lado, también se ha explorado de forma positiva la generación de anticuerpos contra los virus. Para esto, primero se inoculan virus en el ratón con el propósito de generar anticuerpos, luego se generan tumores en los ratones y por último se administran células que transportan virus. Por ejemplo, se generaron tumores con células de hepatocarcinoma humano a ratones con elevados niveles de anticuerpos contra el virus del sarampión. Luego, se les aplicó células madre mesenquimales derivadas de la medula ósea (BM-hMSCs) de pacientes con hepatocarcinoma, e infectadas con virus del sarampión. Se observó que a pesar de que los ratones tenían anticuerpos neutralizantes antisarampión, presentaron una buena respuesta antitumoral respecto a los ratones con tumores que no tenían anticuerpos y fueron infectados con virus libres. Esto sugiere que los anticuerpos contribuyen de manera positiva a la respuesta antitumoral, pues estimulan el sistema inmunológico al reconocer el virus en la célula tumoral 12.
El ensayo de Fujiwara et al.10 utilizó células mesoteliales humanas como transportadoras del virus del herpes simple (HSV-1) que administraron a ratones con tumores subcutáneos e intraperitoneales, generados con células tumorales de ovario; allí los ratones que con anterioridad tenían anticuerpos anti-HSV-1 presentaron un mayor efecto oncolítico respecto a los ratones que no tenían anticuerpos y fueron infectados con virus libres. Por su parte, Coukos et al.85 en su estudio utilizaron la línea de teratocarcinoma humano (Pa-1) como célula transportadora de HSV-1, presentando mayor infección en regiones tumorales de ovario con respecto al HSV-1 libre 85.
En el estudio clínico de Adair et al. (11) fueron reclutados 10 pacientes que presentaban metástasis hepáticas por cáncer colorectal primario, se administró un único ciclo de monoterapia con reovirus IV a una concentración de 1x1010 TCID50 (concentración mínima con la cual se infecta el 50% de las células de un cultivo: "minimum titre 1010 Tissue culture infective dose at the 50% end point, TCID50 ml- 1"). El virus se aplicó cinco días antes de la resección de la metástasis hepática por cáncer colorectal y como células transportadoras se usaron las mononucleares de sangre periférica (PBMC). Al comparar muestras de sangre, tejido tumoral resecado y tejido normal, se observó la presencia selectiva del reovirus en el tumor, sugiriendo que la célula transportadora brindó protección al reovirus en la circulación 11.
Por su parte, la investigación de Martínez-Quintanilla et al.13 utilizó un Ad de replicación condicional que expresa hialuronidasa soluble (ICOVIR17). Para esto, a los ratones les implantaron, en forma intracraneal, células de glioblastoma multiforme (GBM) nodular humano (U87). Luego, se utilizaron células madre mesenquimales derivadas de tejido adiposo humano (MSC) como células transportadoras del Ad ICOVIR17. A la vez, se encapsularon dichas MSC en matrix extracelular sintética biocompatible (sECM). Los experimentos mostraron una regresión en el crecimiento tumoral y un aumento de la supervivencia en el grupo inyectado con MSC-sECM- ICOVIR17 con respecto a los grupos inyectados solo con MSC-sECM, ICOVIR17 o PBS 13.
Liposomas
Esta estrategia busca que los virus oncolíticos no sean retirados de circulación demasiado rápido, disminuya la interacción con componentes sanguíneos (anticuerpos neutralizantes, complemento, etc.) y se permita mayor biodisponibilidad del virus en tumores. A ratones con tumores generados con la línea celular SKOV-3 (cistocarcinoma de ovario humano) les aplicaron vía endovenosa Ad recombinante (Ad-hEndo, 1x108 p.f.u.) encapsulado en micelas poliméricas hechas de conjugados de polietilenglicol y fosfatidiletanolamina (PEG-PE-micelas). Se observó una disminución en el tamaño tumoral con aumento de eventos apoptóticos y tiempos de sobrevida mayores en los ratones que se les inyectó Ad dentro de liposomas respecto a los grupos control. En este caso, no se indujo una respuesta considerable de anticuerpos 14.
Ultrasonido
El ultrasonido (US) es un método bastante aplicado en imágenología médica para el diagnóstico de patologías. Los agentes de contraste por ultrasonido (UCA) o microburbujas (MB) se utilizan como portadores potenciales de ácidos nucleicos, RNA de interferencia, fármacos, proteínas y, recientemente, virus oncolíticos 67,68.
A la interacción de ondas ultrasónicas con burbujas (esferas de gas generadas en el medio) en una fase líquida o similar se le denomina cavitación. Estas son microesferas llenas de gas con un diámetro de 1-10μΓη encapsuladas por una membrana estabilizada y biocompatible. Para el gas del interior se emplean gases inertes que favorecen la vida media de la microburbuja. El US inicia a una frecuencia mayor a la del rango audible humano, que está entre 20Hz y 20kHz. Las ondas ultrasónicas viajan a mayor velocidad en un medio solido (como el tejido óseo) que en un medio gaseoso. La microburbuja es dirigida hacia la membrana celular de determinada célula por efecto de las ondas de ultrasonido, esto genera un efecto de "empuje y hale" de la microburbuja con la membrana; por cizallamiento se generan poros en la membrana celular y la microburbuja libera su contenido. Existen microburbujas comerciales como SonoVue (SV) y Artison microbubble que están formadas por una suspensión acuosa y en su interior tienen un gas inerte. La dosis de MB aprobada por la Food and Drug Administration para un paciente está entre 109MB y 1010MB y en 1-2mL para inyección en bolo endovenoso 68.
Un estudio empleó US para favorecer la internalización del virus oncolítico HSV-1, deficiente para el gen neurovirulento γ134.5 (HSV-1 RH2), en células de carcinoma escamoso oral (SCC), observándose mayor número de virus cuando se utilizó el US respecto al control 69. De igual forma, se generó un tumor con células de carcinoma escamoso oral (SCC) en un ratón cuando los tumores alcanzaron 5mm de diámetro, se aplicó HSV-1 RH2 en presencia (mezcla de 1x106 PFU+5x106 MB) o ausencia de MB. El US se aplicó por 10 segundos y se observó supresión del crecimiento tumoral en el grupo de ratones tratados con HSV-1 RH2+US+MB respecto a los grupos control 70. Myers et al.71 utilizaron una "copa polimérica (cups)" diseñada como alternativa a las MB comerciales para inducir fenómenos de cavitación entre virus y células tumorales al aplicar US.
Luego de generar el tumor en ratones con líneas celulares de cáncer de ovario humano (SKOV 5x106) o de carcinoma hepático humano (HepG2 5x106), se co-inyectaron "cups" vía IV en la vena de la cola (50 μL a 25 mg/mL) y vaccinia virus (1x105 en 50 μL). Cuando los tumores alcanzaron un volumen de 40-100 mm3, se expusieron a US. Se observó que la expresión de VV en los tumores generados por SKOV-3 y HepG2 aumentó en más de tres órdenes de magnitud y se presentó disminución en el tamaño tumoral en comparación al grupo control no tratado con cups ni US 71.
Plásmidos con proteínas virales
Una estrategia menos desarrollada, diferente a los nanocomplejos, consiste en transfectar mediante electroporación, tanto in vitro como in vivo, plásmidos que contienen proteínas virales con efecto citopático para las células tumorales 86. En este caso, por ahora, la limitante es el método para transfectar el plásmido de manera eficiente dentro del tumor, en especial para tumores sólidos en un modelo animal.
Además de los enfoques antes mencionados, para evitar la neutralización de los virus por el sistema inmunológico han surgido alternativas para mejorar la eficacia del tratamiento y permitir la llegada del virus al sitio del tumor. Dentro de estas alternativas se encuentra la terapia combinada entre virus oncolíticos con radioterapia o quimioterapia y la terapia fotodinámica.
Terapias combinadas con virus oncolíticos
Los virus oncolíticos se han utilizado como coadyuvantes a tratamientos convencionales como cirugía, quimioterapia, inmunoterapia y radioterapia. Igualmente, se han aplicado de forma simultánea con medicamentos inmunomoduladores que disminuyen la respuesta inmunológica; con medicamentos que generan disrupción de la matriz extracelular del tumor, facilitando la entrada del virus; con medicamentos que saturan receptores en el huésped encargados de la internalización del virus 87-90, o con terapia combinada oncolítica viral y antiangiogénica, que sinergizan en la regresión y eliminación del tumor 91. Otro método es el uso de dos tipos de virus que mejoran la actividad oncolítica 92-96.
En ratones C57BL/6 se generó un tumor inyectando intraperitonealmente 3x106 células ID8 (tumor ovárico de origen epitelial murino). Luego, se aplicó el fármaco gemcitabina y se administró reovirus. Se encontró que esta terapia combinada retardaba la aparición de carcinomatosis peritoneal y se prolongaba la supervivencia respecto a los ratones tratados solo con gemcitabina o con reovirus 97.
En otros experimentos en ratas inmunocompetentes se implantaron intracranealmente células de glioma de rata (D74/HveC) para generar gliomas. Luego, un grupo fue tratado con un péptido angiostático cRGD 30μg por cuatro días, antes del tratamiento con virus herpes simple atenuado (1x107 PFU (hrR3)), el cual se realizó siete días postimplantación. En el grupo de tratamiento con cRGD-hrR3 se observó una disminución de la infiltración leucocitaria en la permeabilidad vascular del tumor y un aumento en la sobrevida de las ratas 98.
Francis et al.99 generaron carcinomatosis peritoneal en ratones (células MC38-luc de cáncer de colon murino); luego, los trataron con un coctel modulador de quimioquinas (CKM) 200μL (IFN-a, poli i:c inhibidor de Cox-2), aplicaron el virus atenuado vaccinia (vv) y expresaron la quimioquina CXCL11 (vvDD-CXCL 11). En los ratones tratados con vvDD-CXCL11+CKM observó mayor respuesta inmunológica contra el tumor, disminución de la carcinomatosis peritoneal y aumento en la sobrevida, dada por el aumento en la concentración de células NK (linfocitos T CD8) con respecto a los grupos tratados solo con vvDD-CXCL11, CKM o PBS 99.
Antes de llegar el virus oncolítico a la célula tumoral, se encuentra con la barrera del microambiente del tumor, el cual está compuesto por células estromales, infiltración de leucocitos y matriz extracelular. Dicha matriz suele presentar una densidad aumentada, convirtiéndose en una barrera mecánica para el virus antes de interactuar con la célula tumoral, pues el virus queda atrapado en la matriz.
Se generaron tumores aplicando células de Sarcoma de tejido blando humano (HSTS26T) o de melanoma humano (Mu89) en las patas y en la región dorsal de ratones inmunodeficientes (SCID) o células de adenocarcinoma de páncreas humano (L3.6pl) en el páncreas de ratones SCID. Cuando los tumores alcanzaron 4-6mm de diámetro se aplicó una dosis diaria intraperitoneal del fármaco losartán por 2 semanas (20 mg/kg/día). De manera simultánea se inyectaron por la vena de la cola 10μL (3.6*1013 nanoparticulas/mL) de HSV-1. Se observó reducción en el colágeno estromal tumoral, al igual que menor volumen tumoral y mayor tasa de infección viral en los tumores de los ratones tratados con losartán 100.
Estudios de terapia combinada con diversos virus oncolíticos en ratones a los cuales se les generó tumores con células humanas muestran el aumento de la respuesta antitumoral generada tanto por el virus como por el sistema inmunológico; sin embargo, el efecto dual del sistema inmunológico como barrera para los virus oncolíticos o de sinergia terapéutica depende del tipo de virus utilizado, las modificaciones genéticas realizadas y los coadyuvantes empleados 101,102.
Terapia fotodinámica
La terapia fotodinámica es un tipo de tratamiento antitumoral poco invasivo. Se necesita un fotosensibilizador captado por el tejido tumoral y la aplicación de luz a una determinada longitud de onda; la activación del fotosensibilizador genera la producción de radicales libres de oxígeno (ROS). Esto permite que donde se localice el fotosensibilizador y se active, se generare una considerable producción de ROS que en el caso de encontrarse en una región tumoral puede inducir mecanismos de muerte celular 103,104.
El estudio de Gil et al.105 empleó terapia fotodinámica (PDT) en ratones con tumores generados con la línea celular NXS2 2x106 (neuroblastoma) y carcinoma escamoso de cabeza y cuello (generados con 5x106 células FaDu). Luego, los investigadores aplicaron el virus oncolítico vaccinia (108 PFU). Por su parte, el fotosensibilizador 2-[1-Hexyloxyethyl-]-2-devinyl pyropheophorbide-a (0.45 umol7kg) fue aplicado endovenosamente y a las 24 horas los tumores fueron estimulados con luz a una longitud de onda de 665nm. La combinación de PDT y terapia oncolítica viral evidenció inhibición del crecimiento tumoral, mayor número de partículas virales en el tumor y disminución del flujo vascular al interior del tumor con respecto a los grupos control tratados con monoterapia 105.
Por su parte, Takehara et al.106 utilizaron un Ad (Ad-GFP) y lo modificaron genéticamente para que expresara un fotosensibilizador KillerRed®, el cual es una proteína roja fluorescente que genera radicales libres de oxigeno (ROS) a la irradiación con luz verde, esto utilizando como promotor la transcriptasa reversa de la telomerasa humana (ad+KillerRed=Telomekiller). Los autores evaluaron el efecto w en un ratón con metástasis en nodo linfático, para esto implantaron 3x106 células HCT116 en 25μL de PBS con 25μL de matrigel en la capa submucosa del recto; a los 10 días inyectaron 108pfu/50uL de Telemekiller directamente en los tumores rectales. Tres días después se realizó laparotomía y los nódulos para-aórticos y para-iliares que expresaron GFP (proteína verde fluorescente) fueron irradiados con láser a 300mW/cm2. Se observó una respuesta sinérgica entre los Ad y la producción de ROS para eliminar el tumor. Las micrometástasis en los nódulos fueron eliminadas posterior al tratamiento de irradiación con láser 106.
Ajuicio de los autores de esta revisión, el uso de células transportadoras es la estrategia más aplicada a la gran variedad de virus candidatos a oncolíticos; esta ha sido desarrollada y estudiada para infectar cultivos celulares tumorales in vitro en modelos animales y en pacientes y cumple con los requisitos de evitar que los anticuerpos reconozcan el virus oncolítico, permitiendo su llegada y liberación en el sitio del tumor. Además, pueden utilizarse células del propio paciente para transportar el virus, de esta manera se evitan rechazos inmunológicos o efectos colaterales al paciente, como ocurre con otras estrategias (polímeros) debido al uso de materiales exógenos 9,50-66. Sin embargo, es importante tener en cuenta que el uso de células transportadoras no se limita a un solo tipo de virus o a un solo tipo de célula. Al momento de elegir una célula trasportadora se debe tener en cuenta la susceptibilidad de la célula al virus, la cinética de replicación viral y la facilidad de aislamiento. Estas estrategias, en combinación con los métodos tradicionales de cirugía, quimioterapia y radioterapia, dan esperanzas para lograr mejores condiciones de sobrevida del paciente y una reducción en la cantidad de fármacos o radiación actualmente utilizadas.
Conclusiones
Los sistemas de protección y transporte, tales como biopolímeros, micropartículas, células transportadoras y liposomas, son eficaces para evitar la respuesta inmunológica del huésped contra el virus. Sin embargo, debido a la diversidad de los virus, se debe tener en cuenta que la eficacia de los métodos de protección y transporte depende de las características bioquímicas tanto del biomaterial como del virus. Por otro lado, la combinación de varias metodologías es lo que ha mostrado mayor respuesta terapéutica con virus oncolíticos.