Introducción
El conducto arterioso es una estructura que comunica la aorta con la arteria pulmonar y es de especial importancia en la vida fetal, ya que permite la disminución de presión arterial pulmonar previniendo los efectos deletéreos de esta sobre los pulmones inmaduros 1. En la mayoría de neonatos a término, el conducto arterioso se cierra espontáneamente en la vida extrauterina en las 48-96 horas 2,3. Sin embargo, en los neonatos prematuros este tiende a permanecer abierto con una frecuencia que está inversamente relacionada con la edad gestational y el peso al nacer, afectando al 40% de la población pretérmino; el porcentaje puede alcanzar el 80% en los neonatos con extremo bajo peso al nacer y el 70% de los recién nacidos (RN) antes de las 28 semanas 4.
El cierre del conducto arterioso es un evento crucial para la adaptación circulatoria a la vida extrauterina. En neonatos pretérmino su persistencia está asociada a un aumento de la morbilidad y se puede asociar con enterocolitis necrotizante, displasia broncopulmonar y alteraciones del neurodesarrollo a largo plazo 5,6.
Los dos principales factores que contribuyen al cierre del conducto arterioso son el incremento de la presión arterial de oxígeno y el cierre del flujo placentario. Por el contrario, el óxido nítrico, la hipoxemia, la endotelina I, la bradicinina, la norepinefrina y la prostaglandina Ε contribuyen a que la comunicación permanezca abierta 7-9.
No existe evidencia concreta para recomendar el tratamiento del conducto permeable asintomático 10; sin embargo, el tratamiento del conducto arterioso permeable (CAP) clínicamente significativo es importante para prevenir complicaciones cardiorrespiratorias y cardiovasculares en los neonatos 7. Este incluye el manejo conservador con balance neutro de líquidos, cierre farmacológico y cierre quirúrgico o endovascular en aquellos casos en que el cierre farmacológico falla o se encuentra contraindicado y cuando existen defectos ductales con un diámetro >2.5mm, ya que las tasas de falla terapéutica y complicaciones son altas 1,11-13. El momento óptimo, las dosis y los beneficios del tratamiento médico o de la ligadura quirúrgica no han sido completamente identificados 14, por 10 que, en 10 posible, debe recurrirse al manejo farmacológico, ya que el cierre quirúrgico podría relacionarse con peores desenlaces, en especial debidos a los efectos adversos potenciales de la anestesia sobre el neurodesarrollo 5,15-19.
Los signos del conducto arterioso clínicamente significativo incluyen soplo sistólico o continuo (>3/6 en la escala de Levine), precordio hiperdinámico, pulsos amplios, presión de pulso >20 mmHg, taquicardia en reposo, dificultad respiratoria o necesidad de oxigenoterapia, intolerancia a la alimentación, oliguria, acidosis metabólica en los gases arteriales, aumento en la silueta cardíaca e hiperflujo pulmonar en los rayos X de tórax 10,12,13.
Existen algunos criterios ecocardiográficos aceptados para el diagnóstico de conducto arterioso hemodinámicamente significativo, así como para la predicción de la necesidad de intervención farmacológica o quirúrgica. Estos criterios son: diámetro ductal >1.5mm, presencia de flujo diastólico retrógrado a nivel de la aorta post ductal y relación entre la aurícula izquierda y la raíz aórtica >1.4 2,20-22.
El objetivo del presente artículo es realizar una revisión narrativa de la literatura acerca de las opciones de tratamiento farmacológico del CAP en neonatos prematuros, para responder a la pregunta ¿cuáles son las opciones de tratamiento para el CAP en RN prematuros?
Materiales y métodos
Se realizó una búsqueda estructurada de la literatura en las bases de datos ProQuest, EBSCO, ScienceDirect, PubMed, LILACS, Embase, Trip Database, SciELO y Cochrane Library con los términos: "Ductus Arteriosus, patentAND therapeutics"; "Ductus Arteriosus, patent AND indometacin"; "Ductus Arteriosus, PatentAND ibuprofen", y "Ductus Arteriosus, patentAND acetaminophen". La búsqueda se hizo en inglés con sus equivalentes en español.
La estrategia de búsqueda se subdividió en dos partes. La primera se realizó en función de determinar las recomendaciones actuales de tratamiento y se limitó a revisiones sistemáticas con o sin metaanálisis y ensayos clínicos aleatorizados publicados en los últimos diez años; se incluyeron los resultados que cumplieron los criterios de selección y se descartaron ensayos clínicos no aleatorizados, así como estudios con menor nivel de evidencia y resultados referentes al manejo quirúrgico del conducto. La segunda parte se dirigió a identificar información relevante para el desarrollo de los demás tópicos de la presente revisión y se realizó sin limitación cronológica ni del nivel de evidencia. La calidad de la evidencia se valoró de forma independiente por dos coautores mediante la aplicación del instrumento para lectura crítica Critical Appraisal Skills Programme Español (CASPe) (Home CASPe). La inclusión o exclusión de las referencias en la presente revisión se definió por el consenso de los dos revisores y las decisiones dispares fueron resueltas por un tercer coautor. La Figura 1 muestra el flujograma de selección de los estudios incluidos.
Resultados
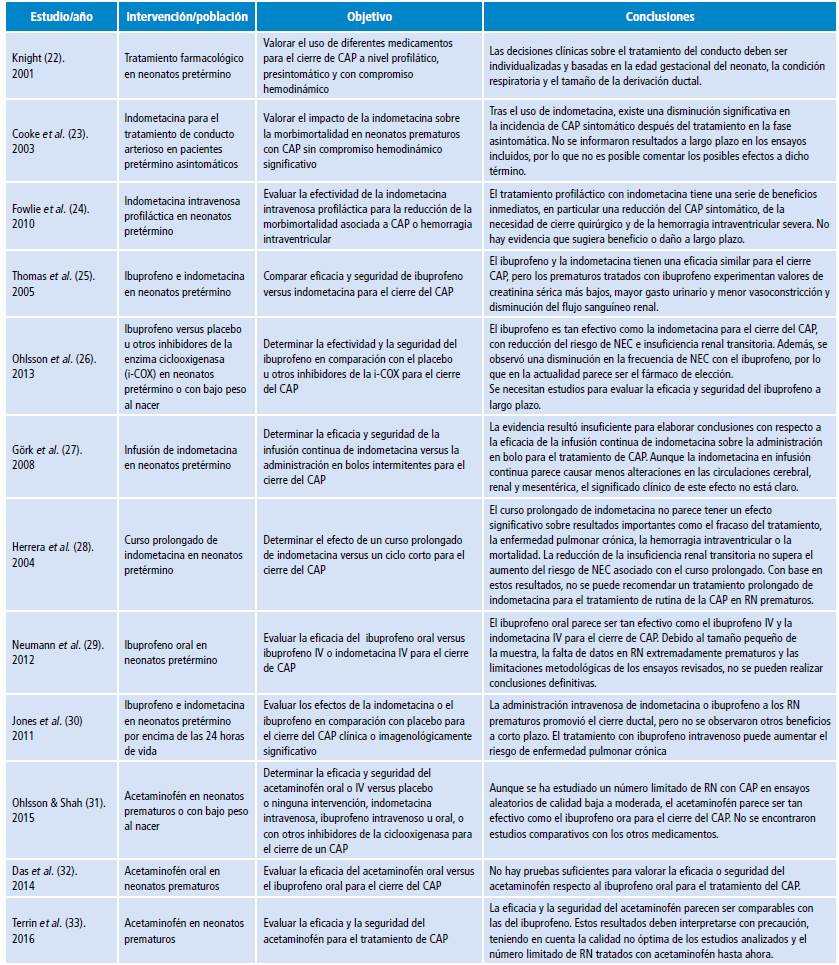
Mediante las búsquedas estructuradas se encontraron 69 artículos con información relevante, entre ellos 34 ensayos clínicos, 12 revisiones sistemáticas y 3 series de caso. Los principales estudios considerados en la presente revisión se describen en la Tabla 1.
Discusión
No existe consenso para realizar recomendaciones definitivas acerca del tratamiento del CAP en neonatos prematuros: la indometacina y el ibuprofeno parecen tener una eficacia similar, con mejores desenlaces renales en favor del ibuprofeno; por su parte, el acetaminofén, al parecer, tiene una eficacia similar al ibuprofeno, pero el tamaño muestral de los estudios es pequeño e insuficiente para realizar conclusiones definitivas al respecto. A continuación se describen los apartes relevantes que corresponden a cada fármaco.
Tratamiento farmacológico del conducto arterioso permeable
En la actualidad, el manejo médico del CAP se basa en inhibidores no selectivos de la enzima ciclooxigenasa (COX) que participa en la síntesis de prostaglandinas, en especial indometacina e ibuprofeno, los cuales promueven el cierre de la comunicación hasta en un 70-93% 13. El efecto neto de estos fármacos es la disminución de las concentraciones de la prostaglandina E2 (Pg E2), que en condiciones fisiológicas tiende a mantener abierta la comunicación. El complejo enzimático prostaglandina sintetasa tiene dos sitios activos: 1) el ciclooxigenasa (COX), el cual convierte el ácido araquidónico en prostaglandina G2 mediante oxidación, y 2) el peroxidasa (POX), que convierte esta última en prostaglandina H2 por peroxidación. La prostaglandina H2 corresponde a un intermediario a partir del cual se obtienen las prostaglandinas F2-α, E2, I2, así como el tromboxano A234.
Se ha sugerido también la utilidad del acetaminofén como alternativa farmacológica para el cierre del CAP. Este ejercería su acción al inhibir el sitio peroxidasa e impidiendo así la síntesis de Pg E2.
La reducción de los niveles de prostaglandinas resulta en la constricción del conducto con profunda hipoxia en los vasa vasorum ductales, promoviendo la angiogénesis, la neoformación de íntima y la apoptosis. Lo anterior, junto con el reclutamiento plaquetario, genera obstrucción, fibrosis y cierre definitivo del conducto arterioso 5.
Indometacina
La indometacina es un inhibidor no selectivo de la enzima ciclooxigenasa al igual que el ibuprofeno, pero no existe consenso acerca del momento en que debe ser administrado como tratamiento. El uso profiláctico de indometacina ha mostrado una reducción en la tasa de hemorragia peri o intraventricular, hemorragia pulmonar, incidencia de CAP sintomático y necesidad de manejo quirúrgico. Sin embargo, no mejora la supervivencia ni los desenlaces neurológicos y tampoco reduce la discapacidad a largo plazo 23,24,35-38.
Algunos estudios muestran que el tratamiento temprano (antes de las 72 horas) reduce el riesgo de enfermedad pulmonar crónica, enterocolitis necrotizante (NEC) y necesidad de intervención quirúrgica. Sin embargo, la indometacina tiende a disminuir el gasto urinario y a elevar los valores séricos de creatinina más significativamente que el ibuprofeno, por lo que el tratamiento temprano con este medicamento también ha mostrado peores desenlaces renales 25,26,39-42.
Tampoco existe consenso acerca del modo de utilización de la indometacina: el uso en bolo, respecto su uso en infusión continua, permanece cuestionado. Algunos estudios sugieren que la infusión mejora el flujo cerebral, mesentérico y renal, por lo que recomiendan la infusión continua sobre el uso de bolos intermitentes. No obstante, la revisión sistemática de Gõrk et al.27 no mostró resultados concluyentes debido a un tamaño muestral insuficiente en los ensayos clínicos realizados hasta ese momento.
Algunos estudios han sugerido que la indometacina puede ser menos eficaz en el cierre del conducto arterioso en RN con pocas semanas de gestación, lo cual aumenta la recurrencia de la comunicación en los lactantes con un peso <1 000g 43,44.
Las recomendaciones respecto al número de dosis necesarias para el tratamiento con indometacina no son del todo claras. Una revisión sistemática que comparó el curso prolongado (4 o más dosis) con el curso corto (3 o menos dosis) de indometacina no encontró diferencias estadísticamente significativas entre los dos regímenes respecto a la tasa de cierre, la necesidad de ligadura quirúrgica, la reintervención o la reapertura. Sin embargo, el curso prolongado se asoció a una mayor incidencia de NEC e injuria renal 28. La calidad de la evidencia de los estudios incluidos en la revisión se catalogó como leve a moderada, por lo que los resultados de la misma deben interpretarse con precaución.
Ibuprofeno
Muchos estudios en la literatura muestran que el ibuprofeno es tan efectivo como la indometacina para el cierre del CAP 45,46. Sin embargo, un metaanálisis no mostró diferencia estadísticamente significativa entre el ibuprofeno y la indometacina respecto a tasa de cierre, mortalidad, reapertura, necesidad de manejo quirúrgico ni aparición de hemorragia intraventricular, enterocolitis necrotizante, enfermedad pulmonar crónica y retinopatía del prematuro 26. No obstante, la indometacina tiene peores desenlaces renales y debe recordarse que no existen estudios con ibuprofeno que consideren el neurodesarrollo a largo plazo 25,26.
En neonatos prematuros el ibuprofeno oral es una alternativa segura y efectiva para el tratamiento del CAP 47,48. Un metaanálisis que estudió la utilidad y seguridad del ibuprofeno oral, respecto a ibuprofeno e indometacina endovenosa, concluyó que el ibuprofeno oral tiene un perfil de eficacia y seguridad similar a las formas endovenosas 29.
El ensayo clínico de Hammerman et al.49 concluyó que la utilización de indometacina o ibuprofeno en infusión continua tienen la misma efectividad y seguridad, pero con menos efectos adversos renales reportados para el ibuprofeno. Por lo tanto, este último puede ser considerado seguro para prematuros con un peso al nacer >1 000g o con una edad gestacional >26 semanas, ya que no causa incrementos sustanciales de los valores de creatinina sérica o nitrógeno ureico en sangre, ni produce disminución en la tasa de filtración glomerular o en el gasto urinario en este grupo de pacientes 4,12. No obstante, tanto la indometacina como el ibuprofeno pueden producir insuficiencia renal transitoria en el 19% y 7% de los casos, respectivamente 4,17.
La dosis recomendada de ibuprofeno para el cierre de la comunicación es de 20 mg/kg/día, dividida en 3 dosis de 10mg, 5mg y 5mg, pudiendo llegar a considerarse una dosis tope de 40 mg/kg/día (dosis de 20mg, 10mg y 10mg). No obstante, el estudio de Dani et al.50, realizado con neonatos pretérmino menores de 29 semanas, concluyó que el tratamiento con ibuprofeno a dosis altas puede ser más efectivo que el régimen tradicional, sin un aumento de la tasa de adversos renales.
Efectos adversos y contraindicaciones de indometacina e ibuprofeno
El espectro de efectos adversos derivados del manejo con antinflamatorios no esteroideos incluye hemorragia intraventricular, NEC y perforación intestinal 49. Además, se ha sugerido que el tratamiento con ibuprofeno puede incrementar el riesgo de enfermedad pulmonar crónica 30.
Algunas contraindicaciones particulares para la administración de indometacina e ibuprofeno son trombocitopenia, sangrado activo, hemorragia intracraneal, diagnóstico o sospecha de enterocolitis necrotizante, creatinina sérica >2 mg/dL, diuresis <0.6 mL/kg/h, recuento plaquetario <50 000, infección activa y no tratada, sospecha de enfermedad cardíaca congénita, anomalía renal o gastrointestinal documentada, coadministración con corticosteroides e hiperbilirrubinemia (ibuprofeno) 51.
El uso conjunto de indometacina con corticoesteroides puede incrementar el riesgo de perforación intestinal 52,53, mientras que el ibuprofeno desplaza la bilirrubina de su unión a proteínas, permitiendo una mayor concentración de bilirrubina libre en el plasma del RN 18.
Acetaminofén
Existen numerosas series de reportes de caso dedicadas a informar la utilidad del acetaminofén, en especial en situaciones en las que el tratamiento con indometacina e ibuprofeno estuvo contraindicado o no fue bien tolerado 54-63.
Yurttutan et al.63 estudiaron la utilidad del acetaminofén oral en comparación con el ibuprofeno oral para el tratamiento del CAP en neonatos pretérmino con bajo peso al nacer, pero no se encontró diferencia estadísticamente significativa entre los dos fármacos respecto a la tasa de falla en el cierre de la comunicación. Asimismo, tampoco existió diferencia estadísticamente significativa en los desenlaces secundarios: muerte durante la estancia hospitalaria debida a cualquier causa, mortalidad durante el periodo neonatal, mortalidad durante el primer año de vida, reapertura del conducto confirmado mediante ecocardiografía, necesidad de cierre quirúrgico, duración del soporte ventilatorio, hemorragia pulmonar, hipertensión pulmonar, incidencia de displasia broncopulmonar, hemorragia intraventricular, leucomalacia periventricular, enterocolitis necrotizante, sangrado gastrointestinal, retinopatía del prematuro, sepsis neonatal, aparición de oliguria y niveles séricos de creatinina 31. Sin embargo, ninguno de los ensayos clínicos que se incluyeron en esa investigación estudió el desarrollo cerebral a largo plazo, por lo que, a pesar de que se sugiere que el acetaminofén puede ser útil en el cierre de la comunicación, no se puede recomendar su uso hasta no tener estudios que evalúen este aspecto. La calidad de la evidencia incluida en dicho metaanálisis se catalogó como leve a moderada según la clasificación GRADE 64,65.
Los metaanálisis de Das et al.32 y Terrin et al.33, realizados a partir de los mismos ensayos clínicos de Yurttutan et al.63, concluyeron que aunque la evidencia sugiere que el acetaminofén es comparable con el ibuprofeno respecto a su seguridad y eficacia, la calidad de la misma es limitada e insuficiente para realizar recomendaciones acerca del tratamiento de RN pretérmino con CAP.
Manejo farmacológico coadyuvante
La restricción hídrica es una práctica generalizada, aunque no existe evidencia fuerte que justifique su uso. También hay poca evidencia para apoyar el uso de diuréticos para prevenir o tratar el desarrollo de la falla cardíaca. En teoría, la furosemida aumenta la producción de prostaglandinas, con lo cual el tratamiento farmacológico podría verse antagonizado 19
Falla del manejo farmacológico inicial y manejo quirúrgico
La necesidad de un segundo curso farmacológico o de manejo quirúrgico depende de la clínica, la respuesta al primer ciclo, las posibles contraindicaciones farmacológicas de los fármacos y la edad post natal. El tratamiento primario debe realizarse mediante un ciclo farmacológico corto de tres dosis de ibuprofeno o indometacina si no existen contraindicaciones para el mismo y la edad post natal no es >2 semanas.
No existen estudios que comparen la necesidad de un segundo curso con inhibidores de COX luego del fallo del cierre o de la reapertura del mismo, pero algunas investigaciones sugieren que la tasa de cierre mediante un segundo ciclo es apenas la mitad de la obtenida con un primer ciclo 66; un segundo curso de ibuprofeno mejora la eficacia de la droga sin complicaciones claras a corto plazo 67. Un estudio encontró que tras un tercer ciclo de indometacina, la tasa acumulada de cierre del conducto alcanza el 90%; sin embargo, en este mismo estudio se encontró un aumento de leucomalacia periventricular, por lo que solo se aconsejan hasta dos ciclos 68.
El cierre quirúrgico se reserva para RN en quienes el tratamiento farmacológico está contraindicado o en los que este falla y para comunicaciones con un diámetro >2.5mm en los que las tasas de falla y complicaciones son altas. Aun así, el metaanálisis de Malviya et al.69 no mostró ventajas del manejo quirúrgico sobre el tratamiento farmacológico respecto al cierre del conducto arterioso, pero con el manejo quirúrgico las tasas de morbimortalidad aumentaron, pudiendo aparecer complicaciones severas como ruptura ductal, hipertensión pulmonar, hemorragia intraventricular, neumotórax, parálisis de cuerdas vocales o quilotórax.
Conclusión
En RN prematuros el tratamiento farmacológico del CAP continúa basándose en los inhibidores no selectivos de la ciclooxigenasa, indometacina e ibuprofeno, sin que hasta el momento exista consenso acerca del momento, dosis y forma de administración más adecuada. La revisión de la literatura sugiere que el acetaminofén es también eficaz para el cierre del CAP; sin embargo, no se puede recomendar su administración de forma rutinaria toda vez que no existen estudios que evalúen su seguridad a largo plazo, en especial en materia de neurodesarrollo.