Introducción
Estudios clínicos han mostrado que ante lesiones articulares o ligamentosas el área de sección transversa (AST) de los músculos disminuye y se producen alteraciones en la fuerza muscular y en el patrón de reclutamiento muscular en actividades estáticas y dinámicas, así como cambios metabólicos e inhibición muscular artrogénica.1-7
Adicionalmente, se han observado alteraciones en la expresión génica de los músculos relacionados con una articulación inflamada: Ramírez et al.8 y Ramírez et al.9 demuestran que la inflamación articular crónica inducida por inyección intraarticular de carragenina en ratas aumentó la expresión de los genes de atrofia (atrogina-1 y MuRF1) y los factores pro-inflamatorios (p38 MAPK, NF kB y TNF-alfa), y redujo la expresión de genes relacionados con la diferenciación y el crecimiento muscular (MyoD), el control de la masa (miostatina) y el AST de las fibras de los músculos tibial anterior (TA) y sóleo. En la investigación de Ramírez et al.9 también se evidencia que el músculo sóleo responde de manera diferente, pues el AST de sus fibras no disminuye a pesar de haberse detectado un aumento significativo en la expresión de genes reguladores de atrofia. En síntesis, estos estudios8,9 destacan el impacto que la inflamación articular puede generar sobre el trofismo muscular.
La atrofia muscular, más allá de ser un trastorno netamente estructural, puede producir alteraciones funcionales en el individuo que la padece, lo que, a su vez, puede limitar el uso del segmento afectado y favorece el círculo vicioso de atrofia-reducción del uso del segmento comprometido-limitación funcional de la persona-atrofia.10 Para mitigar este efecto, es necesario implementar recursos de intervención fisioterapéuticos que ayuden a controlar la inflamación articular desde la fase aguda y favorezcan la homeostasis muscular; esto no solo rompe el círculo vicioso señalado, sino que también beneficia los músculos relacionados funcionalmente con la articulación afectada.
Una de las modalidades usadas en fisioterapia para controlar la respuesta inflamatoria es la crioterapia,11 la cual ha demostrado efectividad al ser aplicada directamente sobre el tejido muscular;12-14 sin embargo, no se conoce su efecto sobre los músculos relacionados funcionalmente con la articulación tratada. Por lo anterior, el objetivo del presente trabajo fue evaluar el efecto de la crioterapia aplicada sobre la articulación tibiotarsiana en el AST de los músculos TA y sóleo de ratas con inflamación articular inducida por I-carragenina.
Materiales y métodos
Se realizó un estudio experimental con 32 ratas Wistar que tenían un peso promedio de 250 gramos. Todos los procedimientos experimentales se realizaron con los animales anestesiados mediante una inyección intraperitoneal de una solución de 12 mg/kg/peso corporal de xilaxina más 95 mg/kg/peso corporal de ketamina, y estos permanecieron en jaulas plásticas con acceso libre a agua y alimento.
Las ratas se distribuyeron aleatoriamente en 4 grupos experimentales: Control (n=8), Inflamación (n=8), Crioterapia protocolo A (Crioterapia-A) (n=8) y Crioterapia protocolo B (Crioterapia-B) (n=8); se mantuvieron en ciclos de 12 horas de luz-oscuridad controlada y bajo una temperatura controlada de 21±2°C y una humedad relativa promedio de 65-75%, y fueron sacrificadas 72 horas después de iniciado el experimento.
Variables del estudio
Variable dependiente
Para establecer el AST se seleccionaron aleatoriamente 100 fibras del vientre de cada músculo (TA y sóleo) y se obtuvo el promedio de estas mediciones, el cual se expresó en micrómetros cuadrados (Mm2).
Variable independiente
A continuación se describen los procedimientos de cada grupo de intervención:
Control: los animales no recibieron intervención. Inflamación: los animales recibieron una inyección de carragenina en la articulación tibiotarsiana derecha y permanecieron agrupados en las jaulas. Crioterapia-A: los animales recibieron una inyección de I-carragenina en la articulación tibiotarsiana derecha e, inmediatamente después, se les inició un tratamiento de crioterapia mediante la aplicación de un paquete de hielo picado durante 20 minutos una sola vez al día sobre la articulación mencionada. La aplicación del hielo se repitió a las 24 y 48 horas. Crioterapia-B: los animales recibieron la misma intervención que el grupo Crioterapia A, pero en lugar de una sola sesión de crioterapia, recibieron tres sesiones con intervalos de 20 minutos entre ellas. La aplicación del hielo se repitió a las 24 y 48 horas.
Covariables
Durante los procedimientos se midió la temperatura de la piel y del paquete de hielo picado con un termómetro infrarrojo marca Raytek STTM PRO®. La temperatura de la piel se midió en la pierna derecha, en el punto medio desde el borde superior de la tibia hasta el maléolo externo, y la del paquete, en el punto medio de la bolsa plástica. Estas mediciones se realizaron antes y después de la aplicación de la crioterapia.
Procedimiento
Inducción de la inflamación articular
A los animales que se les indujo la inflamación se les suministró 0.03mL de I-carragenina al 3% (Sigma Chemical Company - St. Louis, USA) en la articulación tibiotarsiana derecha; este compuesto estaba disuelto en solución salina (NaCl 0.9%) tal como lo establecieron Wang et al.15 y Omote et al.16 en sus protocolos. Luego de esto las ratas permanecieron en sus jaulas sin restricción en su actividad y fueron sacrificadas en cámara de dióxido de carbono a las 72 horas de habérseles inducido la inflamación.
Aplicación de la crioterapia
Los animales a los que se les practicó crioterapia luego de inducirles la inflamación recibieron sesiones de 20 minutos de crioterapia con paquetes de hielo picado siguiendo el protocolo descrito previamente de acuerdo con el grupo al cual fueron asignados. La aplicación se hizo directamente sobre la región lateral y medial de la articulación tibiotarsiana sin involucrar el vientre de los músculos de la pierna de los animales.
Para cada paquete se usaron dos hielos preparados previamente en cubetas estándar que se llenaron con 40mL de agua por cubo; los hielos, que tenían una temperatura promedio de 3°C, se introdujeron en una bolsa plástica de 10m x 3cm que se cerró previo vaciamiento de aire y ligera maceración.
Procesamiento de las muestras
Los músculos TA y sóleo se disecaron con los animales vivos y anestesiados, justo antes de ser sacrificados. Cada músculo se pesó y dividió por la mitad con un corte horizontal en su vientre; ambas porciones se congelaron en nitrógeno líquido y se almacenaron en un congelador a -86°C, pero la porción proximal fue la que se usó para el análisis morfométrico. El peso corporal de los animales se registró al inicio y al final del experimento.
Para el análisis morfométrico se hicieron cortes histológicos transversales y seriados de 10um con un micrótomo criostato (LEICA RM 2125) y manteniendo las porciones a una temperatura de -25°C. Las muestras obtenidas se tiñeron con azul de toluidina y se analizaron en un microscopio de luz equipado con una cámara digital (Sony DSCs75, Tokio, Japón). Del vientre de cada músculo se escogieron aleatoriamente 100 fibras para medir sus respectivas AST usando el software ImageJ®.
Análisis estadístico
Inicialmente se aplicaron los test de Shapiro Wilk y de Levene para evaluar la normalidad y la homogeneidad de los datos, respectivamente. Dado que los resultados de estas pruebas fueron normales, los datos se sometieron a análisis de varianza (ANOVA) one-way para determinar las diferencias entre los grupos; luego se realizó un test de Tukey para identificar la fuente de las diferencias. El nivel de significancia mínima establecido fue de p<0.05 y el análisis se realizó utilizando el programa estadístico STATISTICS versión 5.5.
Consideraciones éticas
El estudio tuvo en cuenta las normas internacionales de ética en experimentación con animales de la Guide for the Care and Use of Laboratory Animals,17 las directrices de la Declaración de Helsinki18 y las disposiciones sobre investigación en salud de la Resolución 8430 de 1993 del Ministerio de Salud y Protección Social de Colombia.19 Además, fue aprobado por el Comité de Ética de la Universidad Industrial de Santander según Acta No. 05 del 23 de agosto de 2013.
Resultados
Temperatura de la piel y del paquete
La temperatura de la piel de la pata derecha antes de iniciar las sesiones de crioterapia para ambos grupos intervenidos estuvo entre 29°C y 30.2°C, y una vez finalizados los procedimientos de intervención diarios, la temperatura de la zona en el grupo Crioterapia-A osciló entre los 18.2°C y los 21.2°C, mientras que la del grupo Crioterapia-B estuvo entre los 13°C y los 15°C. La temperatura del paquete de hielo en los dos grupos se mantuvo entre los 3.2°C y 5°C (Tabla 1).
Tabla 1 Temperatura de la piel de la pata derecha y del paquete de hielo al terminar la aplicación de crioterapia en cada uno de los días del protocolo de intervención.
| Crioterapia protocolo A | Crioterapia protocolo B | |||||
|---|---|---|---|---|---|---|
| Variable | Día 1 x̄ ±σ | Día 2 x̄ ± σ | Día 3 x̄ ± σ | Día 1 | Día 2 x̄ ± σ | Día 3 x̄ ± σ |
| Temperatura de la piel (°C) | 18.2±3.2 | 19.3±4.7 | 21.2±2.5 | 13±3.6 * | 13.6±1.3 t | 15±2.9 * |
| Temperatura del paquete de hielo (°C) | 5±1.8 | 3.9±1.1 | 3.2±0.9 | 4.2±1.7 | 3.2±0.4 | 5±0.5 |
x̄: media; a: desviación estándar.
* p<0.05 comparado con el día 1 del grupo crioterapia protocolo A.
† p<0.05 comparado con el día 2 del grupo crioterapia protocolo A.
‡ p<0.05 comparado con el día 3 del grupo crioterapia protocolo A.
Fuente: Elaboración propia.
Peso corporal, peso muscular y AST de las fibras musculares
No se encontraron diferencias al inicio y al final del experimento entre grupos respecto al peso corporal (Tabla 2) (p<0.05) ni al peso muscular de los animales (p<0.05).
Tabla 2 Peso corporal de los animales al inicio y al final el estudio.
| Variable | Grupo Control x̄ ±σ | Grupo Inflamación x̄ ±σ | Grupo Crioterapia-A X ±σ | Grupo Crioterapia-B x̄ ±σ |
|---|---|---|---|---|
| Peso corporal inicial (g) | 328±9.3 | 318±6.4 | 336±10 | 337±18 |
| Peso corporal final (g) | 344±8.7 | 339±6.7 | 339±2.7 | 343±4.3 |
x̄: media; a: desviación estándar.
Fuente: Elaboración propia.
Los resultados del ANOVA evidenciaron que existen diferencias estadísticamente significativas en el AST de los músculos TA y sóleo (p<0.001) entre los tres grupos estudiados: el test de Tukey registró una reducción significativa de las fibras musculares en el AST del músculo TA en los grupos Inflamación (p=0.02) y Crioterapia-B (p=0.03) en comparación con el grupo Control. Por el contrario, en el grupo Crioterapia-A las fibras musculares no registraron diferencia significativa frente al grupo Control (p=0.10) para este músculo, aunque sí se encontró diferencia significativa en relación con el grupo Inflamación (p=0.03) (Figura 1A). Mediante este mismo test, en el músculo sóleo se encontraron diferencias significativas en las fibras musculares en todos los grupos intervenidos en relación con el grupo control (Figura IB).
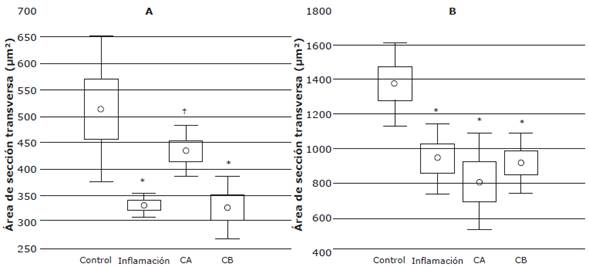
C-A: grupo crioterapia protocolo A; C-B: grupo crioterapia protocolo B; um2: micrometres cuadrados. * Diferencia significativa comparada con el control. † Diferencia significativa comparada con el grupo Inflamación. Fuente: Elaboración propia.
Figura 1 Diagrama de cajas y bigotes: mediana del área de sección transversa de las fibras de los músculos tibial anterior (A) y sóleo (B) para los grupos del estudio.
Discusión
El presente es el primer estudio que explora el efecto de la aplicación de crioterapia sobre la articulación tibiotarsiana inflamada de ratas sobre el AST de los músculos TA y sóleo, y los hallazgos indican que un estímulo como la crioterapia aplicada a nivel articular tiene el potencial de generar un efecto positivo sobre la musculatura relacionada con la articulación intervenida. Estos resultados concuerdan con los obtenidos en estudios similares que analizan el efecto de la crioterapia aplicada directamente sobre el tejido muscular y evidencian que las ratas sometidas a inflamación articular por inyección intraarticular de carragenina presentan cambios plásticos sobre estos músculos.8,9
La reducción en el AST de las fibras musculares después de 72 horas de haber inducido la inflamación articular que se encontró en el presente estudio puede estar relacionada con el aumento en la expresión de las ligasas de ubiquitina encargadas de mediar la degradación de proteína muscular a través de la vía ubiquitina-proteosoma, tales como el MURF-1 y la Atrogina. Estudios previos han demostrado que los genes asociados con atrofia muscular presentan un aumento significativo en su expresión en el músculo TA a partir de las primeras 48 horas de haber aplicado la inyección intraarticular, mientras que en el sóleo solo el MuRFl registra un aumento significativo en su expresión. Sin embargo, dicho aumento en la expresión no se relaciona con la presencia de atrofia muscular, es decir, no se registra reducción del AST de las fibras musculares.8,9
La atrofia muscular en el presente estudio se detectó al tercer día (72 horas) de haber inducido la inflamación articular, lo que sugirió que en este periodo de tiempo la expresión de las ligasas de ubiquitina fue suficientemente alta como para reducir la proteína muscular evidenciable en el AST de las fibras. Al parecer, la inflamación articular afectó por igual los músculos evaluados, a pesar de tratarse de perfiles metabólicos diferentes, pues la reducción en el AST de lasfibras muscularesfue de 32% y 35% para el TA y el sóleo, respectivamente; sin embargo, no se estableció exactamente cuál fue el papel que cumplieron otras vías regulatoriasde la masa muscular, como las vías de las calpaínas y la vía lisosomal, en esta respuesta, ya que no fueron analizazadas.
El mecanismo por el cual la inflamación articular lleva a atrofia muscular aún no está esclarecido; sin embargo, el uso disminuido de la pata debido al dolor generado por la respuesta inflamatoria se considera un factor desencadenante de la respuesta proteolítica del tejido, aunque los estudios de Ramírez et al. y Ramírez et al. ,9 que incluyeron un grupo experimental Inmovilizado, descartan que este sea el único mecanismo responsable de la pérdida de masa muscular en presencia de inflamación articular.
Por otro lado, Sánchez-Martínez et al.20 afirman que el aumento del volumen articular debido al edema y la inflamación de la cápsula articular que se produce en el modelo experimental de carragenina podría mediar la adaptación muscular observada a través de la respuesta muscular artrogénica (RMA). En este caso, la elevada tensión de la cápsula articular puede modificar la magnitud del reflejo H en los músculos relacionados con la articulación afectada y aumentar la actividad de los receptores de adaptación lenta del corpúsculo de Ruffini, los cuales inhiben interneuronas que a su vez disminuyen la activación del pool de motoneuronas (MN) alfa;21,22 entonces, es por esta vía que se disminuiría la síntesis proteica. Sin embargo, son necesarios nuevos estudios que evalúen las vías moleculares que median la atrofia muscular en presencia de inflamación en las articulaciones.
Según los hallazgos, mientras que el estímulo inflamatorio produjo una respuesta similar en el trofismo de los músculos TA y sóleo, la aplicación de la crioterapia articular indujo una repuesta diferenciada sobre los mismos: el músculo TA en el grupo Crioterapia-A mantuvo su trofismo a las 72 horas de haber sido inducida la inflamación, mientras que en el grupo Crioterapia-B no se produjo ningún efecto sobre el AST de las fibras musculares al compararlo con el grupo Inflamación. Estos resultados son diferentes a los de estudios que han mostrado que la aplicación seriada de crioterapia puede ser más benéfica que el uso de una sola aplicación; sin embargo, dichos estudios aplicaron protocolos diferentes al usado en este trabajo y lo hicieron sobre el músculo esquelético lesionado y no sobre la articulación inflamada.23
En el presente estudio la temperatura de la piel de la pata tratada mostró valores significativamente inferiores en el grupo Crioterapia-B (Tabla 1), lo que indicó que un mayor enfriamiento sobre una articulación inflamada no genera efecto benéfico sobre los músculos periariculares y sugirió la existencia de un nivel de enfriamiento óptimo a partir del cual se genera un efecto trófico benéfico sobre el músculo esquelético. Sin embargo, en el análisis de los datos no se incluyó la temperatura de la piel, lo cual constituyó en una limitación de la investigación.
El mecanismo por el cual un recurso físico de enfriamiento aplicado sobre una articulación inflamada genera cambios a nivel muscular no es claro; sin embargo, la RMA podría tener un rol en la génesis de dicho fenómeno, pues se ha planteado que la crioterapia modula esta respuesta "silenciando" parcialmente la actividad aferente elevada provocada por el edema, la inflamación y la laxitud articular.24,25 Esta hipótesis se basa en que la disminución de la temperatura reduce la velocidad de conducción nerviosa y la actividad de los receptores sensoriales sobre el músculo y la articulación, los cuales aumentan su actividad cuando se presenta daño articular.25
Según Palmieri-Smith et al.,26 la aplicación de crioterapia sobre una articulación con efusión articular genera un aumento del reflejo H que podría estar mediado por impulsos sensoriales provenientes de terminaciones cutáneas y por impulsos supraespinales. En este sentido, el enfriamiento de la piel sobre la articulación provocaría un cambio en la excitabilidad o en los umbrales del pool de MN,26,27 lo que potencialmente podría aumentar el reclutamiento de MN y sería por este camino que la crioterapia serviría como estímulo para favorecer el trofismo muscular al crear un ambiente propicio para una mayor actividad contráctil. No obstante, el presente estudio evidencia que la crioterapia genera un efecto trófico únicamente sobre el músculo TA, lo que indica que este podría ser más sensible al estímulo neural debido a que estaría mediado por las diferencias del perfil metabólico y de la composición de la maquinaria contráctil de cada tipo de fibra muscular;28 sin embargo, las variables analizadas no permiten confirmar la participación de dichos mediadores en la respuesta muscular detectada.
Respecto a las diferencias metabólicas y la capacidad de adaptación de cada tipo de fibra muscular, Lieber10 afirma que los músculos de contracción rápida se adaptan de manera diferente, en comparación con los de contracción lenta, frente a estímulos como la suspensión de la pata trasera, la inmovilización y la denervación. Estas diferencias se han atribuido, en parte, a la expresión dependiente del tipo de fibra detectada para citoquinas proinflamatorias como la TNF-alpha, que participa en la vía principal de degradación proteica muscular.29 Asimismo, se ha descrito el rol de los factores de transcripción FOXO y el NF kB en dicha repuesta dependiente del tipo de fibra muscular.30 Adicionalmente, existen reportes en la literatura que han encontrado una respuesta muscular diferenciada frente a la aplicación de la estimulación eléctrica sobre el músculo, según el contenido de miosina pesada.31,32
Conclusiones
La aplicación de crioterapia una vez al día por tres días consecutivos atenuó el efecto atrófico de la inflamación articular aguda sobre el músculo TA, lo que confirma su importancia en el control de los efectos deletéreos que la inflamación articular aguda puede generar sobre músculos de contracción rápida. Sin embargo, es necesario realizar más estudios que permitan comprender los mecanismos moleculares involucrados en esta respuesta.
Estos hallazgos sugieren que al usar la crioterapia sobre una articulación inflamada se produce un efecto trófico únicamente sobre los músculos de contracción rápida y que, por lo tanto, el fisioterapeuta debe tener en cuenta que los músculos de contracción lenta relacionados con la articulación comprometida se tratan mediante otros recursos físicos como la electroterapia.
Estudios futuros que incluyan seres humanos podrían probar estos planteamientos al analizar el efecto de la crioterapia combinada con ejercicios de rango de movimiento asistidos y activos sobre el AST de los músculos relacionados con la articulación comprometida en lesiones articulares agudas como el esguince de cuello de pie.















