Introducción
En la actualidad, se sabe que el delirio puede presentarse en niños con enfermedades críticas y que, aunque es una condición relativamente breve, durante la estancia en la unidad cuidado intensivo (UCI) algunos pacientes pediátricos presentan episodios recurrentes y pueden tener complicaciones con potenciales secuelas en su desarrollo.1,2
Con el avance en el diseño y la validación de herramientas de tamizaje para identificar el delirio en niños, se ha establecido que su prevalencia en esta población es >20% y que su presencia tiene una importante relación con alto riesgo de morir, complicaciones intrahospitalarias, mayor estancia hospitalaria, estrés postraumático y discapacidad a largo plazo.3-5
El delirio en niños críticamente enfermos fue un tema ignorado durante años, pero en 1980 Prugh et al.,6 en un estudio de casos y controles realizado en 33 niños y adolescentes tempranos con trastornos agudos del sistema nervioso central (SNC) de tipo tóxico, metabólico y traumático y en 19 controles (sin ningún trastorno del SNC), reportaron que el delirio se asoció con diferencias significativas respecto al nivel de desarrollo infantil, la aparición de regresión y la persistencia de anomalías perceptivo-motoras leves (que implican posibles dificultades de aprendizaje) durante algunas semanas e incluso después de su recuperación.
A pesar de dicho precedente, no se hicieron más investigaciones al respecto sino hasta 2003, cuando Turkel & Tavaré7 realizaron un estudio retrospectivo para describir la presentación clínica, los síntomas y el resultado del delirio en niños y adolescentes, y encontraron que, de 1 027 consultas psiquiátricas realizadas entre abril de 1991 y diciembre de 1995, 84 pacientes de entre 6 meses y 18 años presentaron delirio. Los autores establecieron que la mortalidad en estos pacientes fue alta (20%); que la principal causa del delirio fue infección (33.33%), seguida por administración de medicamentos (19.04%), y que la evolución y los síntomas de esta condición fueron similares a los de los adultos.
Ante la necesidad de encontrar herramientas prácticas que permitan diagnosticar el delirio, en especial en pacientes graves, se diseñaron escalas de medición de la patología para ser usadas en las UCI. La detección del delirio antes del diseño de estos instrumentos se realizaba mediante una entrevista psiquiátrica clásica que se basaba en los criterios del manual DSM-III-R8 y posteriormente DSM-IV,9 sin tener en cuenta las particularidades de cada paciente. Dada esta situación, en 2001, con base en un instrumento diagnóstico de delirio en pacientes geriátricos llamado CAM (Confusion Assessment Method),10 se adaptaron como criterios de evaluación para pacientes los utilizados en el CAM-ICU (Confusion Assessment Method for the Intensive Care Unit)11 y el ICDSC (Intensive Care Delirium Screening Checklist),12 los cuales lograron mejorar y priorizar el reconocimiento y el tratamiento oportuno de esta patología en adultos.
Posteriormente, en 2003, se publicó la primera escala diagnóstica de delirio para población pediátrica; este instrumento, que se llamó DRS (Delirium Rating Scale)13 y fue diseñado para ser diligenciado por psiquiatras, resultó ser muy laborioso de ejecutar, por lo que las investigaciones en el tema continuaron y el año siguiente se creó la escala PAED (Pediatric Anesthesia Emergency Delirium),14 descrita para niños en posoperatorio (delirio de emergencia). En 2011 se validó el instrumento pCAM-ICU (Pediatric Confusion Assessment Method for the ICU)15 que tuvo algunas desventajas como que requería la cooperación del paciente, estaba restringida a niños mayores de 5 años, entre otras.
En un intento por validar un instrumento ideal que detectara todos los tipos de delirio en pacientes de cualquier edad y nivel de desarrollo, en 2014 se diseñó la escala CAPD (Cornell Assessment of Pediatric Delirium),16 una herramienta unificada de detección estandarizada para población adulta y pediátrica17 bastante utilizada hoy en día y que fue traducida recientemente a español.18
La escala de más reciente aparición es la SOS-PD (Sophia Observation Withdrawal Symptoms-Scale-Pediatric Delirium), que surgió a partir de la hipótesis de que el síndrome de abstinencia causa delirio y que busca, de manera recursiva, que ambas patologías se evalúen simultáneamente.19 En la Tabla 1 se comparan las escalas de mayor uso en población pediátrica.20
Tabla 1 Herramientas diagnósticas para la evaluación de delirio en niños.
| Escala | Edad validada de uso | Método | Ventajas y desventajas |
|---|---|---|---|
| Pediatric Anesthesia Emergence Delirium (PAED) Scale12 | pCAM-ICU: Mayores de 1 año de edad | El médico clasifica al paciente valorando en una escala de 1 (no en absoluto) a 5 (extremadamente) su contacto visual, sus resultados orientados al objetivo, su conciencia del entorno, su inquietud, y si es consolable. | - Es válida y fácil de usar al lado de la cama para detectar el delirio hiperactivo. - Se basa en el comportamiento del paciente. - Tiene buena confiabilidad entre los evaluadores, así como sensibilidad y especificidad favorables para detectar delirio hiperactivo. - No se puede utilizar para detectar delirio hipoactivo, a menudo presente en niños. |
| Pediatric Confusion Assessment Method-Intensive Care Unit (pCAM-ICU)13 | Mayores de 5 años | Se basa en 4 características clave del delirio señaladas en los criterios del Manual diagnóstico y estadístico de los trastornos mentales DSM-IV9: 1) cambio agudo o fluctuación en el estado mental, 2) inatención, 3) nivel de conciencia alterado y 4) pensamiento desorganizado. Si las características 1 y 2 no están presentes, el examen es negativo para delirio. Si además de las características 1 y 2, la 3 o la 4 están presentes, el examen es positivo para delirio. | - Está validada y es confiable para detectar el delirio. - Es eficiente, interactiva y permite una evaluación objetiva del paciente. - Se puede usar tanto en niños que están bajo ventilación mecánica como en niños que no lo están. |
| Cornell Assessment of Pediatric Delirium (CAPD)14 | Todas las edades | El cuidador hace preguntas que evalúan 8 componentes y puntúa cada ítem de 0 (nada) a 4 (extremadamente). Puntuaciones ≥9 indican delirio. | - Es una adaptación de la PAED que identifica mejor los delirios hipoactivo e hiperactivo mediante una escala de comportamiento. - Está validada en niños críticamente enfermos. - La evaluación se completa por el cuidador e incluye múltiples observaciones durante un período de tiempo. - Se puede utilizar para detectar comportamientos sutiles a lo largo del tiempo. - No requiere la participación del paciente, por lo que es bien tolerada y permite que las enfermeras a cargo la apliquen una vez por turno. |
Fuente: Adaptado de Bettencourt & Mullen.20
Según varios autores, el delirio tiene una fuerte relación entre su fisiopatología y la severidad de la enfermedad y el riesgo de morir,3,21,22 por lo que es de suma importancia comprender la patogénesis y los factores de riesgo asociados a su desarrollo, para así implementar métodos diagnósticos prácticos y específicos que permitan su reconocimiento oportuno en niños críticamente enfermos. Esto permitirá avanzar en la comprensión y establecer el impacto del delirio en el curso de la vida de los pacientes.
Fisiopatología
El delirio se define como una alteración aguda en la atención y la conciencia con alteraciones adicionales en la cognición; además, es una condición que no es producto de un trastorno neurocognitivo preexistente, sino que es causada por otra afección médica, siendo las enfermedades críticas las causas más comunes en niños.20 Aunque no se conoce su fisiopatología, clínicamente se describen 3 tipos de delirio en niños: hipoactivo, hiperactivo y mixto (Tabla 2).
Tabla 2 Tipos de delirio en población pediátrica.
Fuente: Adaptado de Bettencourt & Mullen.20
La fisiopatología del delirio es compleja y multifactorial, por lo que su comprensión aún no es completa y apenas se reconocen ciertos efectos a largo plazo de su tratamiento respecto a la recuperación de la función cerebral.20,23 En la Figura 1 se resumen los factores de riesgo asociados al desarrollo de este trastorno.
Por otra parte, varios estudios han abordado posibles factores asociados con la ocurrencia del delirio. Por ejemplo, Hughes et al.,46 en un estudio realizado en 134 adultos (con una mediana de edad de 57 años), reportan que los niveles elevados de marcadores plasmáticos de activación endotelial y barrera hematoencefálica (BHE)/ daño neurológico en pacientes críticamente enfermos se asocian con la presencia prolongada de delirio. Durante la última década, el conocimiento histológico y fisiológico de la BHE ha mejorado significativamente, por ejemplo, se ha encontrado que las alteraciones del desarrollo de esta o su pérdida de funciones inducidas experimentalmente se asocian con disfunción y degeneración de las redes neuronales.47
Gracias a los avances en el estudio microscópico de la BHE se ha establecido que las células endoteliales son el elemento clave que le proporciona sus propiedades de barrera.48 Todos los demás elementos estructurales de la multicapa especializada de la BHE (enzimas, receptores y transportadores) se encargan de regular el paso de sustancias a través de ella para así dar un entorno estable al SNC, el cual es necesario para la correcta función neuronal ya que minimiza el daño celular y cualquier fenómeno inflamatorio que se pueda presentar.49
La permeabilidad de la BHE puede ser o no disruptiva, lo que refleja la presencia o ausencia, respectivamente, de alteraciones físicas en la barrera. La permeabilidad disruptiva se acompaña de cambios estructurales a nivel histológico, tales como daño a las células endoteliales o cambios en las uniones intercelulares, mientras que la no disruptiva ocurre a nivel molecular.49
Se ha reportado que en animales sanos la permeabilidad de la BHE se ve afectada significativamente cuando se utilizan dosis sépticas de lipopolisacáridos.50 Al respecto, se ha demostrado que la sepsis inducida en animales con el método ligadura y punción cecal (LPC) ocasiona edema vasogénico cerebral, lo que sugiere disrupción de la BHE en el círculo de Willis tan solo 6 horas posterior a la inducción; 24 horas después del procedimiento se ha encontrado citotoxicidad aguda, disminución de la utilización de la glucosa y alteración de la perfusión tisular y el flujo sanguíneo. Por tanto, hay una mayor respuesta inflamatoria del SNC y disfunción cognitiva como consecuencia directa de una respuesta inflamatoria sistémica profunda.51
De otro lado, en un estudio en pacientes con y sin delirio asociado a sepsis, Pfister et al.52 evaluaron la perfusión cerebral mediante doppler transcraneal y espectroscopía de infrarrojo cercano, encontrando diferencias significativas en el índice de autorregulación cardiovascular, lo que puede deberse a una inflamación que impide la función endotelial cerebrovascular.
La hipertermia es otro factor con efectos en la autorregulación cerebral, el consumo de energía cerebral y el acoplamiento flujo-metabolismo en cerebros con lesión aguda; esto ha hecho que en modelos animales sin lesión neurológica traumática se estudie si el oxígeno cerebral en reposo y el consumo de glucosa aumentan durante la hipertermia corporal total.51
Se conocen 4 rutas por las cuales la respuesta inflamatoria sistémica puede enviar mensajes al SNC:53
Mediante los órganos circunventriculares, unas estructuras del cerebro que carecen de BHE. En estos órganos, las citoquinas, como la interleucina-1β, la interleucina-6 (IL-6) y el factor de necrosis tumoral-a (TNF-α), se diseminan libremente desde la sangre hacia el parénquima cerebral, donde pueden interactuar con poblaciones de macrófagos.
A través de la BHE intacta las citoquinas activan el endotelio, que a su vez envía señales a los macrófagos perivasculares adyacentes a las células endoteliales; estos macrófagos se comunican con la microglía, es decir, los macrófagos residentes dentro del parénquima cerebral.
Mediante aferencias sensoriales del nervio vago que se comunican con las poblaciones neuronales dentro del tronco cerebral tras la inflamación inducida en la cavidad peritoneal.
Mediante transporte activo directo de citoquinas a través de la BHE.
Estas rutas de comunicación explicarían cómo la inflamación induce alteraciones morfológicas en axones, células nerviosas, células gliales y endotelio vascular como resultado de la permeabilidad, tanto disruptiva como no disruptiva, de la BHE.51-54
El delirio es principalmente ocasionado por cualquier amenaza a la homeostasis (estrés), por lo que esta es una patología que siempre se debe tener en cuenta en pacientes críticos. En este sentido, Maclullich et al.55 sugieren que los sistemas de respuesta al estrés, como la respuesta conductual a la enfermedad, y la actividad del eje límbico-hipotalámico-pituitario-adrenal pueden estar involucrados en la fisiopatología del derlirio.
Los factores de riesgo asociados al desarrollo de delirio en la UCI se pueden clasificar en tres dominios: enfermedad aguda, exposición a medicamentos y efectos ambientales.56 Dentro de las enfermedades agudas hay comorbilidades frecuentes que pueden contribuir a la manifestación del delirio, tales como pérdida de la función renal con reducción en la depuración de medicamentos, metabolitos u otras posibles neurotoxinas,57 y estados posoperatorios cardíacos y no cardíacos.
Para estos últimos se han propuesto varios mecanismos mediante los cuales se desarrollan alteraciones cognitivas secundarias al daño tisular inducido por la cirugía y conocidas como disfunción cognitiva posoperatoria (DCPO); dentro de estas alteraciones se incluyen hipoperfusión, hipoxia, formación de microémbolos,58 activación del sistema inmunitario periférico, neuroinflamación y neurodegeneración.
Por otro lado, algunos estudios sugieren que los fármacos anestésicos pueden facilitar o restringir la aparición de DCPO al suprimir la neurogénesis: Huang et al. 59 sostienen que en cirugía cardíaca los infartos cerebrales pueden contribuir a su desarrollo; Fan et al.60 afirman que en niños ocurren con exposiciones a sevoflurano mayores a 3 horas, relacionándose con altos niveles séricos de caspasa-3, TNF-α, enolasa neuronal específica (NSE) e IL-6, y Jia et al.61 indican que su ocurrencia puede disminuir con el uso de dexmedetomidina en relación con menores niveles de NSE e IL-6.
Asimismo, según Hovens et al.,62 se ha planteado que la disfunción cognitiva posoperatoria está mediada por procesos inflamatorios inducidos por procedimientos quirúrgicos que pueden influir en el funcionamiento neuronal, ya sea directamente o a través de la modulación de vías intraneuronales como el factor neurotrófico derivado del cerebro. Para comprobarlo, estos autores evaluaron la cognición, el comportamiento afectivo y los marcadores de neuroinflamación, factor neurotrófico derivado del cerebro y neurogénesis en ratas Wistar macho de 3 meses sometidas a cirugía abdominal, encontrando que estas presentaron cambios en su actividad exploratoria poco después de la cirugía, los cuales se asociaron con niveles posoperatorios plasmáticos elevados de IL-6. Además, reportaron que el aprendizaje espacial y la memoria de las ratas se vieron afectados durante las primeras 2 semanas posterior a la cirugía, mas no sus capacidades cognitivas no espaciales, lo que sugiere que la cognición dependiente del hipocampo es especialmente vulnerable al deterioro inducido por la cirugía.
En la última década, según Leroy & Schieveld,31 varios grupos de investigación han demostrado una importante prevalencia de delirio en niños sometidos a cirugía cardíaca bajo circulación extracorpórea y han establecido que su ocurrencia está asociada con resultados menos favorables del procedimiento, por lo que existen preocupaciones en relación con los resultados neuro-cognitivos y neuropsicológicos a futuro.
En una evaluación prospectiva de pacientes pediátricos (0-21 años) admitidos a una unidad de cuidado intensivo pediátrica cardiotorácica después de haber sido sometidos a cirugía de bypass de la arteria coronaria, la incidencia de delirio fue del 49%, desarrollándose dentro de los primeros 3 días del posoperatorio, con una duración, en la mayoría de los casos, de entre 1 y 2 días. En dicho estudio también se encontró que la edad menor a 2 años, el retraso en el desarrollo en general, un puntaje ≥2 en el RASCH-1 (Risk Adjustment for Congenital Heart Surgery), la presencia de enfermedad cardíaca cianótica y el registro de niveles de albúmina <3 g/dL se asociaron de forma independiente con el desarrollo de delirio, el cual fue un predictor de estancia hospitalaria prolongada, con un aumento del 60% de días en la unidad de cuidado intensivo pediátrica (UCIP).32
Estudios en adultos han evaluado algunos fármacos de uso frecuente en UCI que podrían predisponer la presencia de delirio. Esta lista incluye medicamentos de uso frecuente en UCIP como diuréticos, opioides, antihipertensivos, broncodilatadores, inotrópicos, anticoagulantes y otros de uso infrecuente en niños. En específico, se ha documentado que el uso de inotrópicos (por más de 12 horas), inhibidores de colinesterasa, anti-colinérgicos, anti-psicóticos, antidepresivos y fentanyl en dosis >10 mcg/kg aumenta 3.4 veces el riesgo de presentar delirio.63 Asimismo, se ha establecido que las benzodiacepinas, especialmente en infusión, provocan un aumento en el riesgo de delirio según la dosis.64-66 Y finalmente, el delirio se ha asociado con el uso de corticosteroides, aunque este hallazgo ha sido inconsistente.56
La falta de luz del día, las alteraciones del ritmo circadiano, el nivel del sonido ambiente en la UCI y las interrupciones del sueño son factores de riesgo asociados al desarrollo de delirio.22,24,39-43,67
En el único estudio que compara la fenomenología del delirio en niños con la de adultos y ancianos, Boesen et al.43 afirman que el delirio infantil se caracteriza por un inicio más agudo pero menos diurno, por una mayor variabilidad de los síntomas y por menos alteraciones del ciclo sueño-vigilia. Aunque la gama de síntomas parece ser similar entre los grupos de edad, el delirio pediátrico (niños de 0 a 17 años) se caracteriza por alteraciones perceptuales más intensas, alucinaciones más graves, ilusiones profundas, mayor agitación y labilidad emocional más severa, así como deficiencias cognitivas aparentemente más leves.68
Complicaciones
El delirio en sí mismo es una complicación grave y frecuente en pacientes críticamente enfermos; sin embargo, no se le ha dado la relevancia que requiere, pues se le considera un desenlace supuesto e intrascendente de cualquier enfermedad crítica.
Es frecuente que los pacientes se hagan daño a sí mismos al retirar sus dispositivos (tubos, catéteres, sondas, drenes, etc.), al caer o al rechazar la atención cuando presentan un episodio de delirio, por lo que es una obligación del personal de salud prevenir, reconocer, intervenir y tratar esta condición médica, que además puede ser un indicador de empeoramiento clínico en niños de cualquier edad.69
Los conocimientos acerca de las secuelas del delirio en los pacientes pediátricos respecto a su potencial desarrollo cognitivo son limitados, pues resulta difícil atribuir la presencia de algún grado y tipo de discapacidad como consecuencia exclusiva a la presencia de esta condición, y no a un conjunto de factores asociados a la gravedad de la enfermedad crítica y su evolución. De este modo, se han descrito múltiples escalas pediátricas para cuantificar la morbilidad o la discapacidad que pueden presentar los niños después de superar una enfermedad grave (Pediatric Overall Performance Category, Pediatric Cerebral Performance Category, Stanford-Binet Intelligence Scale (4a edición), Bayley Scales of Infant Development (2a edición) y Vineland Adaptive Behavior Scales), pero ninguna relaciona de manera específica el antecedente de delirio.70
Las principales complicaciones del delirio en niños se han encontrado en los estados posoperatorios,71-73 ya que los efectos se pueden presentar luego del período de recuperación.
Desde la primera descripción del delirio de emergencia hecha por Levy71 en 1945, se han establecido como posibles consecuencias los problemas de comportamiento (ansiedad, trastornos alimentarios, agresión y apatía). De igual forma, los niveles de ansiedad preoperatoria del paciente se han asociado con una mayor incidencia en esta clase de delirio27 y en niños sometidos a anestesia profunda con sevoflurano se han documentado eventos de supresión electroencefalográfica, lo que en adultos se ha asociado con delirio posoperatorio y secuelas neurocognitivas. Infortunadamente, las consecuencias neurológicas inmediatas y a largo plazo de los eventos de discontinuidad electroencefalográfica (amplitud <25 uV, con una duración de ≥2 segundos) durante la anestesia general en niños siguen siendo desconocidas, al igual que el comportamiento homeostático del cerebro durante la anestesia general.74
Ninguna investigación hasta la fecha ha explorado qué impacto tiene el delirio en la morbilidad de los pacientes que sobreviven luego de haber ingresado a la UCIP, así que es pertinente que futuras investigaciones exploren el papel de esta condición médica como un factor modificable que relacione el ingreso a la UCIP con los resultados negativos después del alta.
Es importante mencionar que, según Paterson et al.,2 los padres y cuidadores han sido negligentes al desconocer el impacto que tiene el delirio en el núcleo familiar, por lo que es necesario realizar nuevos estudios que examinen esta relación con el fin de informar y mejorar la práctica centrada en la familia.
Diversas investigaciones, tanto en adultos como en niños, han analizado la asociación entre delirio y mortalidad y han tenido resultados contradictorios. Por ejemplo, el estudio de Traube et al.3 demostró que el delirio es un importante predictor de mortalidad en niños (OR=4.4) según la puntuación del Pediatric Index of Mortality-3. No obstante, Klein-Klouwenberg et al.75concluyeron en su estudio, realizado en 1 112 pacientes adultos, que, en general, el delirio prolonga el ingreso en la unidad de cuidados intensivos, pero no causa la muerte en pacientes críticamente enfermos.
Tratamiento farmacológico y no farmacológico
Serafim et al. ,76 en una revisión sistemática de la literatura, recopilaron los estudios publicados entre 1980 y 2014 que evaluaron las intervenciones farmacológicas para tratar o prevenir el delirio en pacientes de UCI y concluyeron que ninguno de los agentes utilizados mejoraba los principales resultados clínicos, incluyendo la mortalidad. Los investigadores también encontraron que el uso de antipsicóticos era la principal estrategia para disminuir la prevalência de delirio en pacientes quirúrgicos de UCI y que el suministro de dexmedetomidina para ventilación mecánica era una posible estrategia preventiva para esta condición médica.76
A continuación, se describe el uso de algunos fármacos que, aunque requieren mayor investigación en niños, han demostrado disminuir la prevalência del delirio en adultos:
Las estatinas se han utilizado para reducir la neuroinflamación inducida por sepsis que afecta la permeabilidad de la BHE y provoca daño neuronal y edema vasogénico y citotóxico.77 Su papel en la prevención del daño endotelial de la vasculatura cerebral y en la reducción del daño oxidativo con el consecuente efecto neuroprotector ha sido controvertido, pues, como lo sugieren Vallabhajosyula et al.,78 no hay ningún benefício en la incidencia de delirio con el suministro de este medicamento.
El ácido valproico, conocido antiepiléptico y estabilizador del estado de ánimo, fue usado en un estudio retrospectivo de Gangnon et al.79 como una nueva opción de tratamiento para manejarei delirio. Los autores se basaron en los únicos 4 reportes de su uso y concluyeron que la dosis recomendada es de 23 mg/kg/día para reducir la agitación y el delirio, además aconsejaron usarlo concomitante con psicofármacos dentro de las primeras 48 horas luego de la presentación del evento.
Otros fármacos utilizados son los antipsicóticos y la clonidina: en un reporte de caso publicado en 2016, Shin etal.50 recomendaron el uso de fármacos antipsicóticos como el haloperidol y la risperidona cuando el delirio no se controla mediante tratamientos clásicos; asimismo, Wang et al.,81 en una revisión sistemática, indicaron que la clonidina puede actuar como un agente de ahorro de narcóticos, aunque también puede aumentar el riesgo de hipotensión significativa, por lo cual su uso rutinario como sedante en la población crítica requiere que se realicen más estudios controlados debido a que los datos siguen siendo insuficientes para apoyar su uso.
Respecto a la melatonina, Martínez et al.82 realizaron un estudio que se basó en que las perturbaciones del sueño y del ciclo día-noche juegan un papel importante en la aparición del delirio, por lo que la melatonina, al ser una hormona natural, segura y barata, se puede administrar para mejorar el sueño y de esta forma constituir un recurso terapéutico efectivo para el delirio.
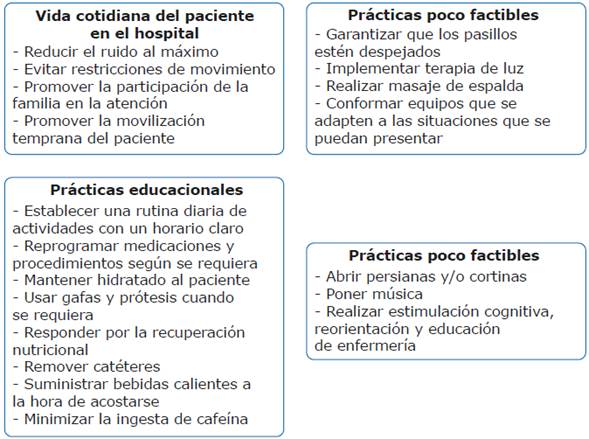
Considerando los limitados recursos farmacológicos, la implementación de protocolos no farmacológicos en la prevención del delirio es una estrategia que ha demostrado disminuir el porcentaje de tiempo delirante en la UCI, al mismo tiempo que reduce el riesgo de desarrollo del mismo. Estos protocolos se encaminan, principalmente, a establecer guías apropiadas de sedoanalgesia y movilidad que incluyan las prácticas que se presentan en la Figura 2.83 Un punto importante a tener en cuenta en las UCIP para prevenirei delirio en los pacientes es la utilidad de la música, ya que se cree que ayuda con la reducción de esta condición en adultos no críticos, aunque hasta el momento no hay ningún estudio que evalúe el efecto de la música en niños críticamente enfermos y con delirio.
Prevención
El enfoque preventivo del delirio se centra en la identificación, modificación y, cuando sea posible, corrección de las condiciones médicas subyacentes que pueden contribuir a su presentación, para lo cual resulta útil la nemotecnia BRAIN MAPS (Tabla 3).20 Es importante mencionar que ante la ausencia de evidencia en cuanto a intervenciones de manejo del delirio, la prevención resulta una herramienta primordial a tener en cuenta en pacientes críticamente enfermos que puedan padecerlo.
Tabla 3 Proceso de evaluación de factores modificables que pueden contribuir al desarrollo de delirio en niños.
Fuente: Adaptado de Bettencourt & Mullen.20
En la actualidad, y a pesar de los avances en las investigaciones en el tema, muchos niños hospitalizados experimentan delirio debido a que no se ha implementado un programa integral de evaluación y prevención del mismo,20 por lo que existe una necesidad crítica de educación y compromiso sobre esta condición y sus factores de riesgo en población pediátrica entre el personal de las UCIP,84 fundamentalmente en aspectos como la interrupción del ritmo circadiano,40-44 que es considerado un desencadenante de delirio y cuyos principales factores de riesgo se presentan en la Figura 3.
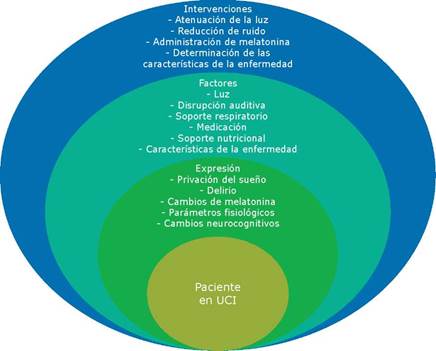
Fuente: Adaptado de Korompeli et al.40
Figura 3 Disrupción del ciclo circadiano en los pacientes de UCI: resumen conceptual de factores, expresión e intervenciones.
En este sentido, dado el impacto que la alteración de los ritmos circadianos en las UCI tiene en el desarrollo del delirio, Fan et al.67 indican que una forma efectiva de regular estos ritmos es suplementar la luz diurna, y que esto funciona incluso mejor que reducir la luz nocturna. Sobre la movilización temprana y la realización de actividad física en horas de la mañana se entiende claramente que es segura, factible y eficaz, aun en población pediátrica.33-36
Las medidas no farmacológicas, la implementación de protocolos preventivos y el diagnóstico temprano son tareas fundamentales para el inicio oportuno e integral del tratamiento para el delirio. Cuando estas medidas son ineficaces se pueden usar medicamentos. Además, el reconocimiento y el tratamiento del delirio en la UCIP sin duda mejoran los resultados en los niños críticamente enfermos a corto y largo plazo.85
Conclusión
Es indispensable que durante la estancia en UCIP se empleen herramientas preventivas que permitan evitar el desarrollo de delirio. Esto debe realizarse de manera simultánea con evaluaciones diagnósticas diarias, de tal manera que esta condición se detecte en etapas iniciales, en las cuales sea posible implementar un tratamiento oportuno orientado a evitar resultados deletéreos como alto riesgo de muerte, larga estancia hospitalaria, deterioro neurocognitivo y/o neurocomportamental, problemas perceptuales y motores, desarrollo de estrés postraumático y costos económicos elevados. En este sentido, la investigación futura del delirio en niños críticamente enfermos debe adoptar un enfoque de «volver a lo básico», y centrarse en aspectos como la fisiopatología, los biomarcadores, las perspectivas de tratamiento y el pronóstico.